9.4: Ligação em sólidos cristalinos
- Page ID
- 182847
Ao final desta seção, você poderá:
- Descreva as estruturas de empacotamento de sólidos comuns
- Explicar a diferença entre a ligação em um sólido e em uma molécula
- Determine a distância de separação de equilíbrio dadas as propriedades do cristal
- Determine a energia de dissociação de um sal dadas as propriedades do cristal
Começando nesta seção, estudamos sólidos cristalinos, que consistem em átomos dispostos em um padrão regular estendido chamado de rede. Os sólidos que não formam ou são incapazes de formar cristais são classificados como sólidos amorfos. Embora os sólidos amorfos (como o vidro) tenham uma variedade de aplicações tecnológicas interessantes, o foco deste capítulo será nos sólidos cristalinos.
Os átomos se organizam em uma rede para formar um cristal por causa de uma força atrativa líquida entre seus elétrons constituintes e os núcleos atômicos. Os cristais formados pela ligação dos átomos pertencem a uma das três categorias, classificadas por sua ligação: iônica, covalente e metálica. As moléculas também podem se unir para formar cristais; essas ligações, não discutidas aqui, são classificadas como moleculares. No início do século XX, o modelo atômico de um sólido era especulativo. Agora temos evidências diretas de átomos em sólidos (Figura\(\PageIndex{1}\)).
Ligação iônica em sólidos
Muitos sólidos se formam por ligação iônica. Um exemplo prototípico é o cristal de cloreto de sódio, como discutimos anteriormente. Os elétrons são transferidos dos átomos de sódio para os átomos de cloro adjacentes, uma vez que os elétrons de valência no sódio estão frouxamente ligados e o cloro tem uma grande afinidade eletrônica. Os íons de sódio carregados positivamente e os íons de cloro (cloreto) carregados negativamente se organizam em uma matriz regular estendida de átomos (Figura\(\PageIndex{2}\)).
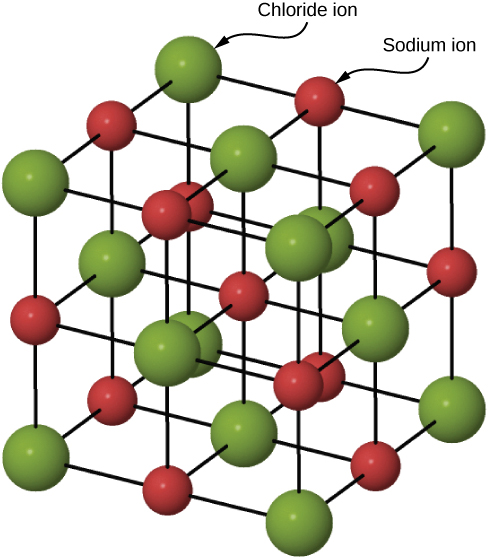
As distribuições de carga dos íons sódio e cloreto são esfericamente simétricas, e o íon cloreto tem cerca de duas vezes o diâmetro do íon sódio. O arranjo de menor energia desses íons é chamado de estrutura cúbica centrada na face (FCC). Nessa estrutura, cada íon está mais próximo de seis íons da outra espécie. A célula unitária é um cubo — um átomo ocupa o centro e os cantos de cada “face” do cubo. A energia potencial atraente do\(Na^+\) íon devido aos campos desses seis\(Cl^-\) íons é escrita
\[U_1 = -6\frac{e^2}{4\pi \epsilon_0 r} \nonumber \]
onde o sinal de menos designa um potencial atraente (e nós identificamos\(k = 1/4 \pi \epsilon_0\)). À distância\(\sqrt{2r}\) estão seus vizinhos mais próximos: doze\(Na^+\) íons da mesma carga. A energia potencial repulsiva total associada a esses íons é
\[U_2 = 12\frac{e^2}{4\pi \epsilon_0\sqrt{2}r}. \nonumber \]
Os próximos são oito\(Cl^-\) íons a uma distância de 3√r3r do\(Na^+\) íon. A energia potencial do\(Na^+\) íon no campo desses oito íons é
\[U_3 = -8\frac{e^2}{4\pi \epsilon_0 \sqrt{3}r}. \nonumber \]
Continuando da mesma maneira com conjuntos alternativos de\(Na^+\) íons\(Cl^-\) e, descobrimos que a energia potencial atraente líquida\(U_A\) do\(Na^+\) íon único pode ser escrita como
\[U_{coul} = - \alpha \frac{e^2}{4\pi \epsilon_0 r} \nonumber \]
onde\(\alpha\) está a constante de Madelung, introduzida anteriormente. A partir dessa análise, podemos ver que essa constante é a soma convergente infinita
\[\alpha = 6 - \frac{12}{sqrt{2}} + \frac{8}{\sqrt{3}} + . . . \nonumber \]
Os íons distantes contribuem significativamente para essa soma, então ela converge lentamente, e muitos termos devem ser usados para calcular αα com precisão. Para todos os sólidos iônicos da FCC, αα é aproximadamente 1,75.
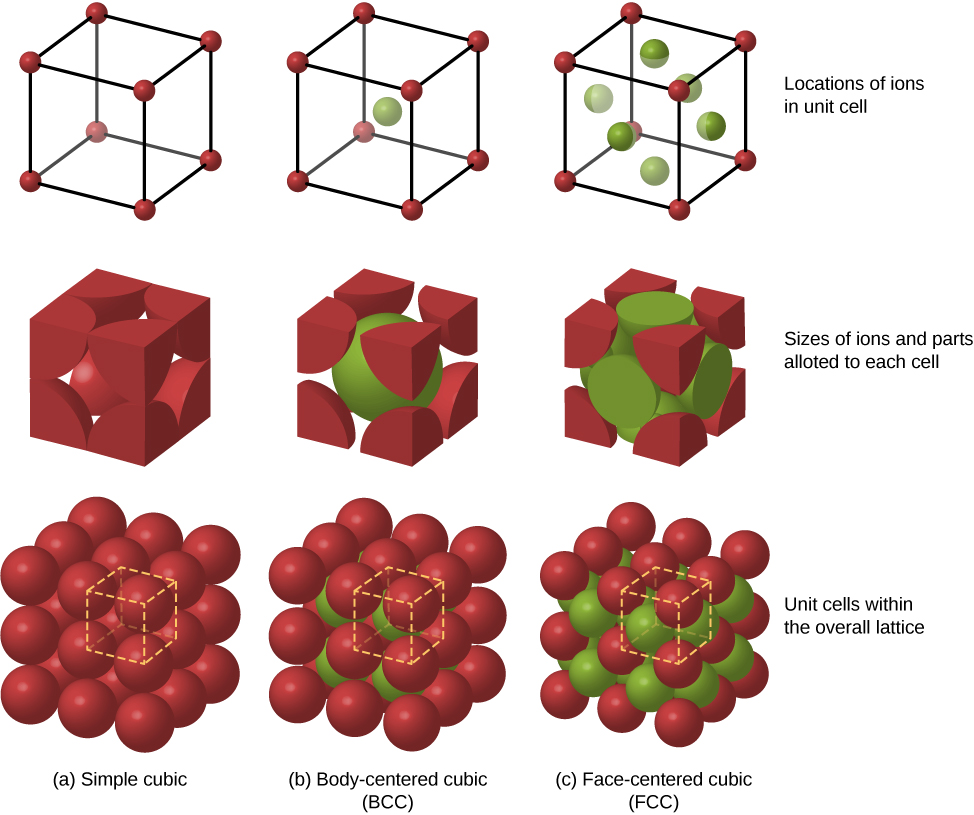
Outros arranjos de empacotamento possíveis de átomos em sólidos incluem cúbico simples e cúbico centrado no corpo (BCC). Essas três estruturas de empacotamento diferentes de sólidos são comparadas na Figura\(\PageIndex{3}\). A primeira linha representa a localização, mas não o tamanho, dos íons; a segunda linha indica as células unitárias de cada estrutura ou rede; e a terceira linha representa a localização e o tamanho dos íons. A estrutura do BCC tem oito vizinhos mais próximos, com uma constante de Madelung de cerca de 1,76 — apenas ligeiramente diferente daquela da estrutura da FCC. Determinar a constante de Madelung para sólidos específicos é um trabalho difícil e objeto de pesquisas atuais.
A energia dos íons de sódio não é inteiramente devida às forças de atração entre íons de carga oposta. Se os íons forem comprados muito próximos, as funções de onda dos elétrons centrais dos íons se sobrepõem e os elétrons se repelem devido ao princípio de exclusão. A energia potencial total do\(Na^+\) íon é, portanto, a soma do potencial atraente de Coulomb (\(U_{coul}\)) e do potencial repulsivo associado ao princípio de exclusão (\(U_{ex}\)). O cálculo desse potencial repulsivo requer computadores poderosos. Felizmente, no entanto, essa energia pode ser descrita com precisão por uma fórmula simples que contém parâmetros ajustáveis:
\[U_{ex} = \frac{A}{r^n} \nonumber \]
onde os parâmetros A e n são escolhidos para fornecer previsões consistentes com dados experimentais. Para o problema no final deste capítulo, o parâmetro n é chamado de constante de repulsão. A energia potencial total do\(Na^+\) íon é, portanto,
\[U = -\alpha\frac{e^2}{4\pi \epsilon_0 r} + \frac{A}{r^n}. \nonumber \]
No equilíbrio, não há força líquida no íon, então a distância entre o vizinho\(Na^+\) e os\(Cl^-\) íons deve ser o valor mínimo\(r_0\) para o qual U é mínimo. Configuração\(\frac{dU}{dr} = 0\), temos
\[0 = \frac{\alpha e^2}{4\pi \epsilon_0 r_0^2} - \frac{nA}{r_0^{n+1}}. \nonumber \]
Assim,
\[A = \frac{\alpha e^2 r_0^{n-1}}{4\pi \epsilon_0 n}. \nonumber \]
Inserindo essa expressão na expressão da energia potencial total, temos
\[U = - \frac{\alpha e^2}{4\pi \epsilon_0 r_0} \left[\frac{r_0}{r} - \frac{1}{n}\left(\frac{r_0}{r}\right)^n \right]. \nonumber \]Observe que a energia potencial total agora tem apenas um parâmetro ajustável, n. O parâmetro A foi substituído por uma função envolvendo r0r0, a distância de separação de equilíbrio, que pode ser medida por um experimento de difração (você aprendeu sobre difração em um capítulo anterior). A energia potencial total é plotada na Figura\(\PageIndex{4}\) for\(n = 0\), o valor aproximado de n para NaCl.
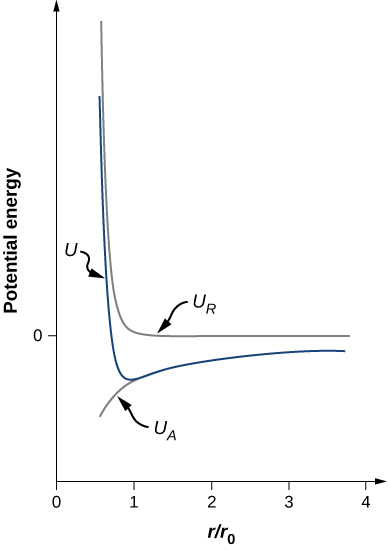
Desde que\(n > 1\), a curva para U tenha a mesma forma geral: U se aproxima do infinito\(r \rightarrow 0\) e U se aproxima de zero como\(r \rightarrow \infty\). O valor mínimo da energia potencial é dado por
\[U_{min} (r = r_0) = -\alpha \frac{fe^2}{r_0}\left( 1 - \frac{1}{n}\right). \nonumber \]
A energia por par de íons necessária para separar o cristal em íons é, portanto,
\[U_{diss} = \alpha \frac{ke^2}{r_0}\left(1 - \frac{1}{n}\right). \nonumber \]
Essa é a energia de dissociação do sólido. A energia de dissociação também pode ser usada para descrever a energia total necessária para quebrar um mol de um sólido em seus íons constituintes, geralmente expressa em kJ/mole. A energia de dissociação pode ser determinada experimentalmente usando o calor latente da vaporização. Os valores da amostra são fornecidos na tabela a seguir.
| \(F^-\) | \(Cl^-\) | \(Br^-\) | \(I^-\) | |
|---|---|---|---|---|
| \(Li^+\) | \ (F^-\)” style="text-align:center;” class="lt-phys-4543">1036 | \ (Cl^-\)” style="text-align:center;” class="lt-phys-4543">853 | \ (Br^-\)” style="text-align:center;” class="lt-phys-4543">807 | \ (I^-\)” style="text-align:center;” class="lt-phys-4543">757 |
| \(Na^+\) | \ (F^-\)” style="text-align:center;” class="lt-phys-4543">923 | \ (Cl^-\)” style="text-align:center;” class="lt-phys-4543">787 | \ (Br^-\)” style="text-align:center;” class="lt-phys-4543">747 | \ (I^-\)” style="text-align:center;” class="lt-phys-4543">704 |
| \(K^+\) | \ (F^-\)” style="text-align:center;” class="lt-phys-4543">821 | \ (Cl^-\)” style="text-align:center;” class="lt-phys-4543">715 | \ (Br^-\)” style="text-align:center;” class="lt-phys-4543">682 | \ (I^-\)” style="text-align:center;” class="lt-phys-4543">649 |
| \(Rb^+\) | \ (F^-\)” style="text-align:center;” class="lt-phys-4543">785 | \ (Cl^-\)” style="text-align:center;” class="lt-phys-4543">689 | \ (Br^-\)” style="text-align:center;” class="lt-phys-4543">660 | \ (I^-\)” style="text-align:center;” class="lt-phys-4543">630 |
| \(Cs^+\) | \ (F^-\)” style="text-align:center;” class="lt-phys-4543">740 | \ (Cl^-\)” style="text-align:center;” class="lt-phys-4543">659 | \ (Br^-\)” style="text-align:center;” class="lt-phys-4543">631 | \ (I^-\)” style="text-align:center;” class="lt-phys-4543">604 |
Assim, podemos determinar a constante de Madelung a partir da estrutura cristalina e n da energia da rede. Para NaCl\(r_0 = 2.81 A\), temos\(n \approx 8\),\(U_{diss} = 7.84 \, eV/ion \, pair\) e. Essa energia de dissociação é relativamente grande. O fóton mais energético do espectro visível, por exemplo, tem uma energia de aproximadamente
\[hf = (4.14 \times 10^{-15} eV \cdot s)(7.5 \times 10^{14} Hz) = 3.1 \, eV. \nonumber \]
Como os íons nos cristais estão tão fortemente ligados, os cristais iônicos têm as seguintes características gerais:
- Eles são bastante duros e estáveis.
- Eles vaporizam em temperaturas relativamente altas (1000 a 2000 K).
- Eles são transparentes à radiação visível, porque os fótons na parte visível do espectro não são energéticos o suficiente para excitar um elétron de seu estado fundamental para um estado excitado.
- Eles são maus condutores elétricos, porque efetivamente não contêm elétrons livres.
- Eles geralmente são solúveis em água, porque a molécula de água tem um grande momento de dipolo cujo campo elétrico é forte o suficiente para romper as ligações eletrostáticas entre os íons.
Determine a energia de dissociação do cloreto de sódio (NaCl) em kJ/mol. (Dica: A constante de repulsão n do NaCl é aproximadamente 8.)
Estratégia
Um cristal de cloreto de sódio tem uma separação de equilíbrio de 0,282 nm. (Compare esse valor com 0,236 nm para uma unidade diatômica livre de NaCl.) A energia de dissociação depende da distância de separação, constante de repulsão e constante de Madelung para uma estrutura FCC. A distância de separação depende, por sua vez, da massa molar e da densidade medida. Podemos determinar a distância de separação e, em seguida, usar esse valor para determinar a energia de dissociação para um mol do sólido.
Solução
As massas atômicas de Na e Cl são 23,0 u e 58,4 u, então a massa molar de NaCl é 58,4 g/mol. A densidade do NaCl é\(2.16 \, g/cm^3\). A relação entre essas quantidades é
\[\rho = \frac{M}{V} = \frac{M}{2N_A r_0^3}, \nonumber \]
onde M é a massa de um mol de sal, NANA é o número de Avogadro e r0r0 é a distância de separação de equilíbrio. O fator 2 é necessário, pois os íons sódio e cloreto representam um volume cúbico\(r_0^3\). Resolvendo a distância, obtemos
\[r_0^3 = \frac{M}{2N_A \rho} = \frac{58.4 \, g/mol}{2(6.03 \times 10^{23})(2.160 \, g/cm^3)} = 2.23 \times 10^{-23} \, cm^3, \nonumber \]ou
\[r_0 = 2.80 \times 10^{-8} cm = 0.280 \, nm. \nonumber \]
A energia potencial de um par de íons (\(Na^+ Cl^-\)) é
\[U = -\alpha \frac{ke^2}{r_0} \left(1 - \frac{1}{n}\right), \nonumber \]
onde\(\alpha\) é a constante de Madelung,\(r_0\) é a distância de separação de equilíbrio e n é a constante de repulsão. NaCl é FCC, então a constante de Madelung é\(\alpha = 1.7476\). Substituindo esses valores, obtemos
\[U = -1.75 \frac{1.44 \, eV \cdot nm}{0.280 \, nm} \left(1 - \frac{1}{8}\right) = - 7.88 \frac{eV}{ion \, pair}. \nonumber \]
A energia de dissociação de um mol de cloreto de sódio é, portanto,
\[D = \left(\frac{7.88 \, eV}{ion \, pair}\right)\left( \frac{\frac{23.052 \, kcal}{1 \, mol}}{\frac{1 \, eV}{ion \, pair}}\right) = 182 \, kcal/mol = 760 \, kJ/mol. \nonumber \]
Significância
Esse valor teórico da energia de dissociação de 766 kJ/mol é próximo ao valor experimental aceito de 787 kJ/mol. Observe que, para uma densidade maior, a distância de separação de equilíbrio entre os pares de íons é menor, conforme esperado. Essa pequena distância de separação aumenta a força entre os íons e, portanto, a energia de dissociação. A conversão no final da equação aproveitou o fator de conversão\(1 \, kJ = 0.239 \, kcal\).
Se a energia de dissociação fosse maior, isso tornaria mais fácil ou mais difícil separar o sólido?
- Resposta
-
mais difícil
Ligação covalente em sólidos
Os cristais também podem ser formados por ligação covalente. Por exemplo, ligações covalentes são responsáveis por manter os átomos de carbono juntos nos cristais de diamante. A configuração eletrônica do átomo de carbono é\(1s^22s^22p^2\) - um núcleo He mais quatro elétrons de valência. Essa configuração eletrônica tem quatro elétrons a menos de uma camada completa, então, ao compartilhar esses quatro elétrons com outros átomos de carbono em uma ligação covalente, as camadas de todos os átomos de carbono são preenchidas. O diamante tem uma estrutura mais complicada do que a maioria dos cristais iônicos (Figura\(\PageIndex{5}\)). Cada átomo de carbono é o centro de um tetraedro regular e o ângulo entre as ligações é 110°.110°. Esse ângulo é uma consequência direta da direcionalidade dos orbitais p dos átomos de carbono.
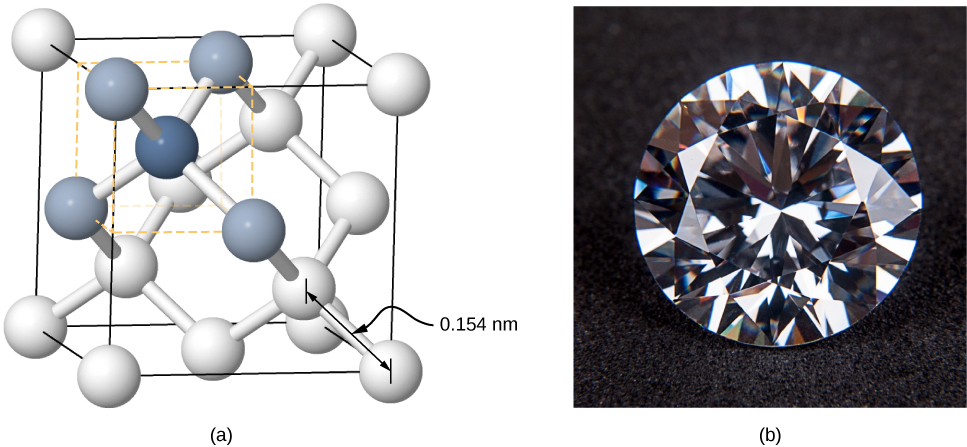
Os cristais ligados covalentemente não são tão uniformes quanto os cristais iônicos, mas são razoavelmente duros, difíceis de derreter e são insolúveis em água. Por exemplo, o diamante tem uma temperatura de fusão extremamente alta (4000 K) e é transparente à luz visível. Em comparação, o estanho ligado covalentemente (também conhecido como alfa-estanho, que não é metálico) é relativamente macio, derrete a 600 K e reflete a luz visível. Dois outros exemplos importantes de cristais ligados covalentemente são o silício e o germânio. Ambos os sólidos são usados extensivamente na fabricação de diodos, transistores e circuitos integrados. Voltaremos a esses materiais posteriormente em nossa discussão sobre semicondutores.
Ligação metálica em sólidos
Como o nome indica, a ligação metálica é responsável pela formação de cristais metálicos. Os elétrons de valência são essencialmente livres dos átomos e são capazes de se mover com relativa facilidade pelo cristal metálico. A ligação se deve às forças de atração entre os íons positivos e os elétrons de condução. As ligações metálicas são mais fracas do que as ligações iônicas ou covalentes, com energias de dissociação na faixa\(1 - 3 \, eV\).


