30.2: Descoberta das partes do átomo - elétrons e núcleos
- Page ID
- 194157
Objetivos de
Ao final desta seção, você poderá:
- Descreva como os elétrons foram descobertos.
- Explique o experimento da gota de óleo Millikan.
- Descreva o experimento de folha de ouro de Rutherford.
- Descreva o modelo planetário do átomo de Rutherford.
Assim como os átomos são uma subestrutura da matéria, elétrons e núcleos são subestruturas do átomo. Os experimentos que foram usados para descobrir elétrons e núcleos revelam algumas das propriedades básicas dos átomos e podem ser facilmente compreendidos usando ideias como força eletrostática e magnética, já abordadas nos capítulos anteriores.
CARGAS E FORÇA ELETROMAGNÉTICA
Em discussões anteriores, observamos que a carga positiva está associada aos núcleos e a carga negativa aos elétrons. Também abordamos muitos aspectos das forças elétricas e magnéticas que afetam as cargas. Agora vamos explorar a descoberta do elétron e do núcleo como subestruturas do átomo e examinar suas contribuições para as propriedades dos átomos.
O elétron
Os tubos de descarga de gás, como os mostrados na Figura\(\PageIndex{1}\), consistem em um tubo de vidro evacuado contendo dois eletrodos de metal e um gás rarefeito. Quando uma alta voltagem é aplicada aos eletrodos, o gás brilha. Esses tubos foram os precursores das luzes de néon atuais. Eles foram estudados seriamente pela primeira vez por Heinrich Geissler, um inventor e soprador de vidro alemão, a partir da década de 1860. O cientista inglês William Crookes, entre outros, continuou estudando o que por algum tempo foram chamados de tubos de Crookes, em que elétrons são liberados de átomos e moléculas no gás rarefeito dentro do tubo e são acelerados do cátodo (negativo) para o ânodo (positivo) pelo alto potencial. Esses “raios catódicos” colidem com os átomos e moléculas do gás e os excitam, resultando na emissão de radiação eletromagnética (EM) que torna o caminho dos elétrons visível como um raio que se espalha e desaparece à medida que se afasta do cátodo.
Hoje, os tubos de descarga de gás são mais comumente chamados de tubos catódicos, porque os raios se originam no cátodo. Crookes mostrou que os elétrons carregam impulso (eles podem fazer uma pequena roda girar). Ele também descobriu que seu caminho normalmente reto é dobrado por um ímã na direção esperada para uma carga negativa se afastando do cátodo. Essas foram as primeiras indicações diretas de elétrons e sua carga.
O físico inglês J. J. Thomson (1856-1940) aprimorou e expandiu o escopo dos experimentos com tubos de descarga de gás. (Figuras\(\PageIndex{2}\) e\(\PageIndex{3}\)) Ele verificou a carga negativa dos raios catódicos com campos magnéticos e elétricos. Além disso, ele coletou os raios em um copo de metal e encontrou um excesso de carga negativa. Thomson também foi capaz de medir a razão entre a carga do elétron e sua massa,\(q_{e}/m_{e}\) - um passo importante para encontrar os valores reais de ambos\(q_{e}\)\(m_{e}\) e.

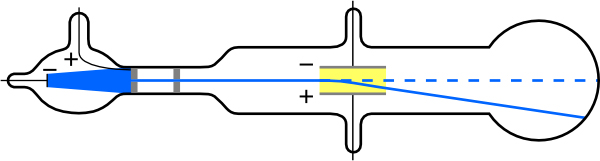
\(\PageIndex{4}\)A figura mostra um tubo de raios catódicos, que produz um feixe estreito de elétrons que passa por placas de carregamento conectadas a uma fonte de alimentação de alta tensão. Um campo elétrico\(E\) é produzido entre as placas de carregamento e o tubo de raios catódicos é colocado entre os pólos de um ímã de forma que o campo\(E\) elétrico fique perpendicular ao campo magnético\(B\) do ímã. Esses campos, sendo perpendiculares entre si, produzem forças opostas nos elétrons. Conforme discutido para espectrômetros de massa em “Mais aplicações do magnetismo”, se a força líquida devido aos campos desaparecer, a velocidade da partícula carregada será\(v = E/B\). Dessa forma, Thomson determinou a velocidade dos elétrons e, em seguida, moveu o feixe para cima e para baixo ajustando o campo elétrico.
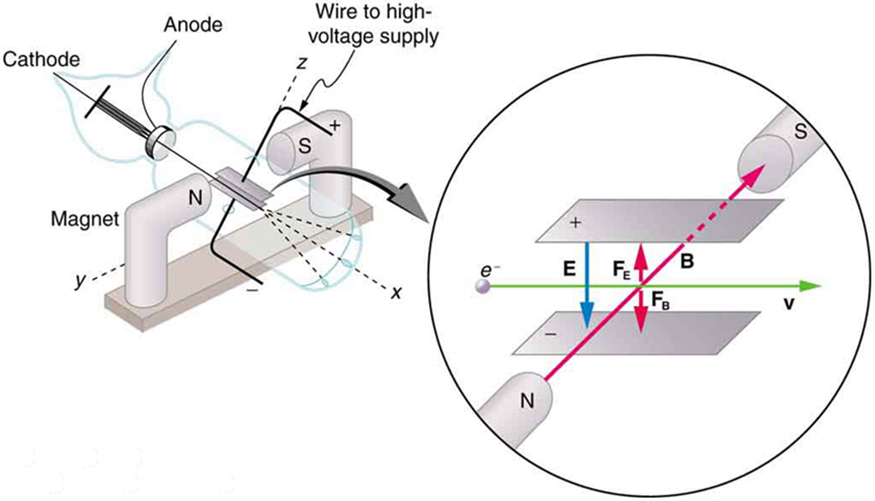
Para ver como a quantidade de deflexão é usada para calcular\(q_{e}/m_{e}\), observe que a deflexão é proporcional à força elétrica no elétron:\[F = q_{e}E.\label{30.3.1}\] Mas a deflexão vertical também está relacionada à massa do elétron, já que a aceleração do elétron é
\[a = \frac{F}{m_{e}}.\label{30.3.2}\]
O valor de não\(F\) é conhecido, pois ainda não\(q_{e}\) era conhecido. Substituindo a expressão de força elétrica na expressão de rendimentos de aceleração
\[a = \frac{F}{m_{e}} = \frac{q_{e}E}{m_{e}}.\label{30.3.3}\]
Reunindo termos, temos
\[\frac{q_{e}}{m_{e}} = \frac{a}{E}.\label{30.3.5}\]
A deflexão é analisada para obter\(a\) e\(E\) é determinada a partir da tensão aplicada e da distância entre as placas; portanto,\(\frac{q_{e}}{m_{e}}\) pode ser determinada. Com a velocidade conhecida, outra medida de\(\frac{q_{e}}{m_{e}}\) pode ser obtida dobrando o feixe de elétrons com o campo magnético. Desde
\[F_{mag} = q_{e}vB = m_{e}a,\label{30.3.6}\]
nós temos
\[\frac{q_{e}}{m_{e}} = \frac{a}{vB}.\label{30.3.7}\]
Resultados consistentes são obtidos usando deflexão magnética.
O que é tão importante sobre\(q_{e}/m_{e}\) a razão entre a carga do elétron e sua massa? O valor obtido é
\[\frac{q_{e}}{m_{e}} = -1.76 \times 10^{11} C/kg \left(electron\right).\]
Esse é um número enorme, como percebeu Thomson, e isso implica que o elétron tem uma massa muito pequena. Sabia-se pela galvanoplastia que cerca de\(10^{8} C/kg\) é necessário para revestir um material, um fator de cerca de 1000 a menos que a carga por quilograma de elétrons. Thomson fez o mesmo experimento para íons de hidrogênio carregados positivamente (agora conhecidos por serem prótons nus) e descobriu uma carga por quilograma cerca de 1000 vezes menor do que a do elétron, o que implica que o próton é cerca de 1000 vezes mais massivo que o elétron. Hoje, sabemos com mais precisão que
\[\frac{q_{p}}{m_{p}} = 9.58 \times 10^{7} C/kg \left(proton\right), \label{30.3.8}\]
onde\(q_{p}\) está a carga do próton e\(m_{p}\) sua massa. Essa proporção (para quatro números significativos) é 1836 vezes menos carga por quilograma do que para o elétron. Como as cargas de elétrons e prótons são iguais em magnitude, isso implica\(m_{p} = 1836 m_{e}\).
Thomson realizou uma variedade de experimentos usando diferentes gases em tubos de descarga e empregando outros métodos, como o efeito fotoelétrico, para liberar elétrons dos átomos. Ele sempre encontrou as mesmas propriedades para o elétron, provando que ele é uma partícula independente. Por seu trabalho, cujas importantes peças começou a publicar em 1897, Thomson recebeu o Prêmio Nobel de Física de 1906. Em retrospectiva, é difícil perceber o quão surpreendente foi descobrir que o átomo tem uma subestrutura. O próprio Thomson disse: “Foi somente quando me convenci de que o experimento não deixava escapar dele que publiquei minha crença na existência de corpos menores que átomos”.
Thomson tentou medir a carga de elétrons individuais, mas seu método conseguiu determinar sua carga apenas na ordem de magnitude esperada.
Desde os experimentos de Faraday com galvanoplastia na década de 1830, sabia-se que cerca de 100.000° C por mol eram necessários para colocar íons ionizados isoladamente. Dividindo isso pelo número de íons por mol (ou seja, pelo número de Avogadro), que era aproximadamente conhecido, a carga por íon foi calculada em cerca de\(1.6 \times 10^{-19} C\), próxima ao valor real.
Um físico americano, Robert Millikan (1868—1953) (Figura\(\PageIndex{5}\)), decidiu aprimorar o experimento de medição de Thomson\(q_{e}\) e acabou sendo forçado a tentar outra abordagem, que agora é um experimento clássico realizado por estudantes. O experimento de gota de óleo Millikan é mostrado na Figura\(\PageIndex{6}\).

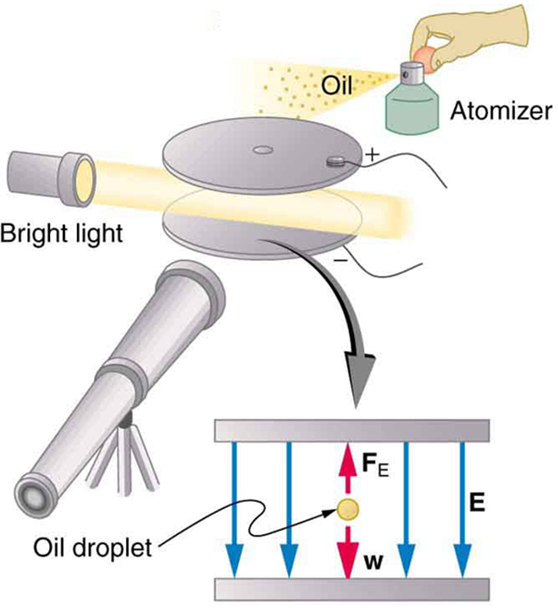
No experimento de gota de óleo Millikan, gotas finas de óleo são pulverizadas a partir de um atomizador. Alguns deles são carregados pelo processo e podem então ser suspensos entre placas de metal por uma tensão entre as placas. Nessa situação, o peso da queda é equilibrado pela força elétrica:\[m_{drop}g = q_{e}E.\label{30.3.9}\]
O campo elétrico é produzido pela tensão aplicada, portanto,
\[E = \frac{V}{d},\label{30.3.10}\]
e\(V\) é ajustado apenas para equilibrar o peso da gota. As gotas podem ser vistas como pontos de luz refletida usando um microscópio, mas são muito pequenas para medir diretamente seu tamanho e massa. A massa da gota é determinada pela observação da rapidez com que ela cai quando a tensão é desligada. Como a resistência do ar é muito significativa para essas gotas submicroscópicas, as gotas mais massivas caem mais rápido do que as menos massivas, e cálculos sofisticados de sedimentação podem revelar sua massa. O óleo é usado em vez de água, porque não evapora facilmente e, portanto, a massa é quase constante. Uma vez conhecida a massa da gota, a carga do elétron é dada pela reorganização da equação anterior:
\[q = \frac{m_{drop}g}{E} = \frac{m_{drop}gd}{V}, \label{30.3.11}\]
onde\(d\) está a separação das placas e\(V\) é a tensão que mantém a queda imóvel. (A mesma queda pode ser observada por várias horas para ver se ela realmente está imóvel.) Em 1913, Millikan havia medido a carga do elétron\(q_{e}\) com uma precisão de 1%, e ele melhorou isso em um fator de 10 em poucos anos para um valor de\(-1.60 \times 10^{-19} C\). Ele também observou que todas as cargas eram múltiplas da carga eletrônica básica e que mudanças repentinas poderiam ocorrer nas quais elétrons eram adicionados ou removidos das gotas. Por essa medição direta fundamental\(q_{e}\) e por seus estudos do efeito fotoelétrico, Millikan recebeu o Prêmio Nobel de Física de 1923.
Com a carga do elétron conhecida e a relação carga/massa conhecida, a massa do elétron pode ser calculada. É
\[m = \frac{q_{e}}{\left(\frac{q_{e}}{m_{e}}\right)}.\label{30.3.12}\]
A substituição de valores conhecidos resulta em\[m_e = \dfrac{-1.60 \times 10^{-19} \, C}{-1.76 \times 10^{11} \, C/kg}\] ou\[m_e = 9.11 \times 10^{-31} \, kg \, (electron's \, mass),\] onde os erros de arredondamento foram corrigidos. A massa do elétron foi verificada em muitos experimentos subsequentes e agora é conhecida com uma precisão de mais de uma parte em um milhão. É uma massa incrivelmente pequena e continua sendo a menor massa conhecida de qualquer partícula que tenha massa. (Algumas partículas, como fótons, não têm massa e não podem ser colocadas em repouso, mas viajam à velocidade da luz.) Um cálculo semelhante fornece as massas de outras partículas, incluindo o próton. Com três dígitos, agora se sabe que a massa do próton é
\[m_p = 1.67 \times 10^{-27} \, kg \, (proton's \, mass),\]
que é quase idêntico à massa de um átomo de hidrogênio. O que Thomson e Millikan fizeram foi provar a existência de uma subestrutura de átomos, o elétron, e ainda mostrar que ele tinha apenas uma pequena fração da massa de um átomo. O núcleo de um átomo contém a maior parte de sua massa, e a natureza do núcleo era completamente imprevista.
Outra característica importante da mecânica quântica também estava começando a surgir. Todos os elétrons são idênticos um ao outro. A carga e a massa dos elétrons não são valores médios; ao contrário, são valores únicos que todos os elétrons têm. Isso é verdade para outras entidades fundamentais no nível submicroscópico. Todos os prótons são idênticos um ao outro, e assim por diante.
O Núcleo
Aqui, examinamos a primeira evidência direta do tamanho e da massa do núcleo. Nos capítulos posteriores, examinaremos muitos outros aspectos da física nuclear, mas as informações básicas sobre tamanho e massa nuclear são tão importantes para entender o átomo que o consideramos aqui.
A radioatividade nuclear foi descoberta em 1896 e logo foi objeto de intenso estudo por vários dos melhores cientistas do mundo. Entre eles estava o neozelandês Lord Ernest Rutherford, que fez inúmeras descobertas fundamentais e ganhou o título de “pai da física nuclear”. Nascido em Nelson, Rutherford fez sua pós-graduação nos Laboratórios Cavendish, na Inglaterra, antes de assumir uma posição na Universidade McGill, no Canadá, onde fez o trabalho que lhe rendeu o Prêmio Nobel de Química em 1908. Na área de física atômica e nuclear, há muita sobreposição entre química e física, com a física fornecendo as teorias facilitadoras fundamentais. Ele retornou à Inglaterra nos últimos anos e teve seis futuros ganhadores do Prêmio Nobel como estudantes. Rutherford usou radiação nuclear para examinar diretamente o tamanho e a massa do núcleo atômico. O experimento que ele planejou é mostrado na Figura\(\PageIndex{7}\). Uma fonte radioativa que emite radiação alfa foi colocada em um recipiente de chumbo com um orifício em um dos lados para produzir um feixe de partículas alfa, que são um tipo de radiação ionizante ejetada pelos núcleos de uma fonte radioativa. Uma fina folha de ouro foi colocada na viga, e a dispersão das partículas alfa foi observada pelo brilho que elas causaram quando atingiram uma tela de fósforo.
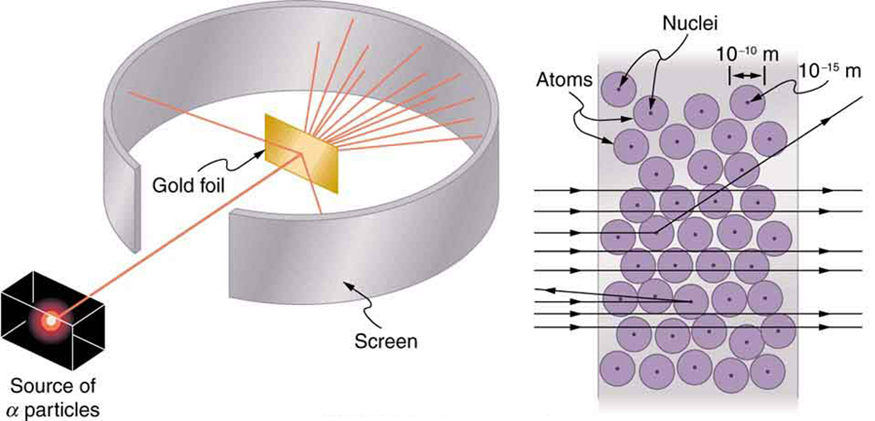
As partículas alfa eram conhecidas por serem núcleos positivos de dupla carga de átomos de hélio que tinham energias cinéticas na ordem de\(5 \, MeV\) quando emitidos em decaimento nuclear, que é a desintegração do núcleo de um nuclídeo instável pela emissão espontânea de partículas carregadas. Essas partículas interagem com a matéria principalmente por meio da força de Coulomb, e a maneira pela qual elas se dispersam dos núcleos pode revelar o tamanho e a massa nucleares. Isso é semelhante a observar como uma bola de boliche é espalhada por um objeto que você não pode ver diretamente. Como a energia da partícula alfa é muito grande em comparação com as energias típicas associadas aos átomos\((MeV\) versus\(eV)\), você esperaria que as partículas alfa simplesmente passassem por uma folha fina, da mesma forma que uma bola de boliche supersônica colidiria com algumas dezenas de fileiras de pinos de boliche. Thomson imaginou que o átomo fosse uma pequena esfera na qual quantidades iguais de carga positiva e negativa eram distribuídas uniformemente. As partículas alfa massivas incidentes sofreriam apenas pequenas deflexões em tal modelo. Em vez disso, Rutherford e seus colaboradores descobriram que partículas alfa ocasionalmente estavam espalhadas em grandes ângulos, algumas até voltando na direção de onde vieram! Uma análise detalhada usando a conservação do momento e da energia — particularmente do pequeno número que veio diretamente de volta — implica que os núcleos de ouro são muito pequenos em comparação com o tamanho de um átomo de ouro, contêm quase toda a massa do átomo e estão fortemente ligados. Como o núcleo dourado é várias vezes mais massivo que a partícula alfa, uma colisão frontal espalharia a partícula alfa diretamente de volta para a fonte. Além disso, quanto menor o núcleo, menos partículas alfa atingiriam uma cabeça.
Embora os resultados do experimento tenham sido publicados por seus colegas em 1909, Rutherford levou dois anos para se convencer de seu significado. Como Thomson antes dele, Rutherford estava relutante em aceitar resultados tão radicais. A natureza em pequena escala é tão diferente do nosso mundo clássico que até mesmo aqueles que estão na vanguarda da descoberta às vezes se surpreendem. Rutherford escreveu mais tarde: “Foi quase tão incrível como se você tivesse disparado um projétil de 15 polegadas contra um pedaço de papel de seda e ele voltasse e batesse em você. Considerando tudo, percebi que essa dispersão para trás... [significava]... a maior parte da massa do átomo estava concentrada em um núcleo minúsculo.” Em 1911, Rutherford publicou sua análise junto com um modelo proposto do átomo. O tamanho do núcleo foi determinado como sendo cerca\(10^{-15} \, m\) de 100.000 vezes menor que o átomo. Isso implica uma densidade enorme, na ordem de\(10^{15} \, g/cm^3\) muito diferente de qualquer matéria macroscópica. Também está implícita a existência de forças nucleares até então desconhecidas para neutralizar as enormes forças repulsivas de Coulomb entre as cargas positivas no núcleo. Forças enormes também seriam consistentes com as grandes energias emitidas na radiação nuclear.
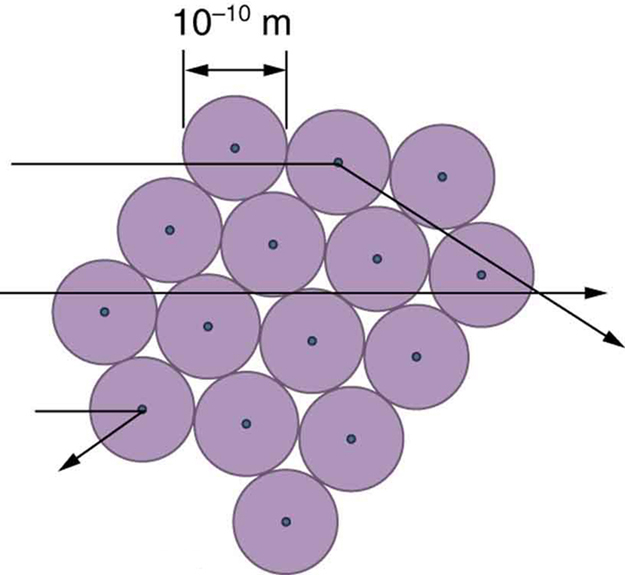
O pequeno tamanho do núcleo também implica que o átomo está quase vazio por dentro. De fato, no experimento de Rutherford, a maioria dos alfas passou direto pela folha de ouro com muito pouca dispersão, já que os elétrons têm massas tão pequenas e porque o átomo estava quase vazio, sem nada para o alfa atingir. Já havia indícios disso na época em que Rutherford realizou seus experimentos, já que foi observado que elétrons energéticos penetram em películas finas com mais facilidade do que o esperado. A figura\(\PageIndex{7}\) mostra um esquema dos átomos em uma folha fina com círculos representando o tamanho dos átomos (aproximadamente\(10^{-10} \, m\)) e pontos representando os núcleos. (Os pontos não estão em escala — se estivessem, você precisaria de um microscópio para vê-los.) A maioria das partículas alfa perde os pequenos núcleos e é apenas ligeiramente dispersa por elétrons. Ocasionalmente (cerca de uma vez em 8000 vezes no experimento de Rutherford), um alfa atinge um núcleo de frente e é espalhado diretamente para trás.
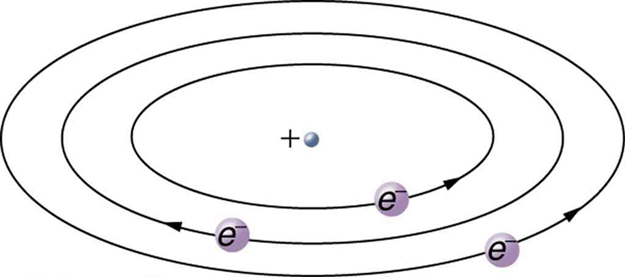
Com base no tamanho e na massa do núcleo revelados por seu experimento, bem como na massa dos elétrons, Rutherford propôs o modelo planetário do átomo. O modelo planetário do átomo mostra elétrons de baixa massa orbitando um núcleo de grande massa. Os tamanhos das órbitas dos elétrons são grandes em comparação com o tamanho do núcleo, com principalmente vácuo dentro do átomo. Esta imagem é análoga a como os planetas de baixa massa em nosso sistema solar orbitam o Sol de grande massa a grandes distâncias em comparação com o tamanho do sol. No átomo, a atrativa força de Coulomb é análoga à gravitação no sistema planetário (Figura\(\PageIndex{9}\)). Observe que um modelo ou imagem mental é necessário para explicar os resultados experimentais, já que o átomo é muito pequeno para ser observado diretamente com a luz visível.
O modelo planetário do átomo de Rutherford foi crucial para entender as características dos átomos e suas interações e energias, como veremos nas próximas seções. Além disso, era uma indicação de quão diferente a natureza é do mundo clássico familiar na pequena escala da mecânica quântica. A descoberta de uma subestrutura de toda a matéria na forma de átomos e moléculas agora estava sendo levada um passo adiante para revelar uma subestrutura de átomos que era mais simples do que os 92 elementos então conhecidos. Continuamos buscando subestruturas mais profundas, como as que estão dentro do núcleo, com algum sucesso. Nos capítulos posteriores, seguiremos essa missão na discussão sobre quarks e outras partículas elementares e veremos a direção em que a busca parece estar indo agora.
EXPLORAÇÕES DE PHET: DISPERSÃO DE RUTHERFORD
Como Rutherford descobriu a estrutura do átomo sem ser capaz de vê-la? Simule o famoso experimento no qual ele refutou o modelo do átomo de pudim de ameixa observando partículas alfa ricocheteando nos átomos e determinando que elas devem ter um núcleo pequeno.
Resumo
- Os átomos são compostos por elétrons carregados negativamente, que provaram existir pela primeira vez em experimentos com tubos de raios catódicos e um núcleo com carga positiva.
- Todos os elétrons são idênticos e têm uma relação carga/massa de\[\dfrac{q_e}{m_e} = -1.76 \times 10^{11} \, C/kg. \nonumber\]
- A carga positiva nos núcleos é transportada por partículas chamadas prótons, que têm uma relação carga/massa de\[\dfrac{q_p}{m_p} = 9.57 \times 10^7 \, C/kg.\nonumber\]
- Massa do elétron,\[m_e = 9.11 \times 10^{-31} \, kg.\nonumber\]
- Massa de próton,\[m_p = 1.67 \times 10^{-27} \, kg.\nonumber\]
- O modelo planetário do átomo mostra elétrons orbitando o núcleo da mesma forma que os planetas orbitam o sol.
Glossário
- tubo de raios catódicos
- um tubo de vácuo contendo uma fonte de elétrons e uma tela para visualizar imagens
- modelo planetário do átomo
- o modelo ou ilustração mais familiar da estrutura do átomo


