30.1: Descoberta do Átomo
- Page ID
- 194144
Objetivos de
Ao final desta seção, você poderá:
- Descreva a estrutura básica do átomo, a subestrutura de toda a matéria.
Como sabemos que os átomos realmente existem se não podemos vê-los com nossos olhos? Segue um breve relato da progressão da proposta de átomos pelos gregos para a primeira evidência direta de sua existência.
As pessoas há muito especulam sobre a estrutura da matéria e a existência de átomos. As primeiras ideias significativas que sobreviveram são devidas aos antigos gregos no século V aC, especialmente as dos filósofos Leucipo e Demócrito. (Há algumas evidências de que filósofos na Índia e na China fizeram especulações semelhantes, mais ou menos na mesma época.) Eles consideraram a questão de saber se uma substância pode ser dividida sem limite em pedaços cada vez menores. Existem apenas algumas respostas possíveis para essa pergunta. Uma é que uma subdivisão infinitesimalmente pequena é possível. Outra é a crença de Demócrito em particular: que existe uma unidade menor que não pode ser subdividida. Demócrito chamou isso de átomo. Agora sabemos que os próprios átomos podem ser subdivididos, mas sua identidade é destruída no processo, então os gregos estavam corretos a respeito. Os gregos também sentiram que os átomos estavam em constante movimento, outra noção correta.
Os gregos e outros especularam sobre as propriedades dos átomos, propondo que existiam apenas alguns tipos e que toda a matéria era formada como várias combinações desses tipos. A famosa proposta de que os elementos básicos eram terra, ar, fogo e água era brilhante, mas incorreta. Os gregos identificaram os exemplos mais comuns dos quatro estados da matéria (sólido, gás, plasma e líquido), em vez dos elementos básicos. Mais de 2000 anos se passaram antes que as observações pudessem ser feitas com equipamentos capazes de revelar a verdadeira natureza dos átomos.
Ao longo dos séculos, foram feitas descobertas sobre as propriedades das substâncias e suas reações químicas. Certas características sistemáticas foram reconhecidas, mas semelhanças entre elementos comuns e raros resultaram em esforços para transmutá-los (chumbo em ouro, em particular) para obter ganhos financeiros. O sigilo era endêmico. Os alquimistas descobriram e redescobriram muitos fatos, mas não os disponibilizaram amplamente. Com o fim da Idade Média, a alquimia gradualmente desapareceu e a ciência da química surgiu. Não era mais possível, nem considerado desejável, manter as descobertas em segredo. O conhecimento coletivo cresceu e, no início do século XIX, um fato importante estava bem estabelecido: as massas de reagentes em reações químicas específicas sempre têm uma proporção de massa específica. Essa é uma evidência indireta muito forte de que existem unidades básicas (átomos e moléculas) que têm essas mesmas proporções de massa. O químico inglês John Dalton (1766-1844) fez grande parte desse trabalho, com contribuições significativas do físico italiano Amedeo Avogadro (1776-1856). Foi Avogadro quem desenvolveu a ideia de um número fixo de átomos e moléculas em uma toupeira, e esse número especial é chamado de número de Avogadro em sua homenagem. O físico austríaco Johann Josef Loschmidt foi o primeiro a medir o valor da constante em 1865 usando a teoria cinética dos gases.
PADRÕES E SISTEMÁTICA
O reconhecimento e a apreciação dos padrões nos permitiram fazer muitas descobertas. A tabela periódica dos elementos foi proposta como um resumo organizado dos elementos conhecidos muito antes de todos os elementos serem descobertos e levou a muitas outras descobertas. Veremos nos capítulos posteriores que os padrões nas propriedades das partículas subatômicas levaram à proposta dos quarks como sua estrutura subjacente, uma ideia que ainda está dando frutos.
O conhecimento das propriedades dos elementos e compostos cresceu, culminando no desenvolvimento da tabela periódica dos elementos em meados do século XIX por Dmitri Mendeleev (1834—1907), o grande químico russo. Mendeleev propôs uma matriz engenhosa que destacou a natureza periódica das propriedades dos elementos. Acreditando na sistemática da tabela periódica, ele também previu a existência de elementos então desconhecidos para completá-la. Uma vez que esses elementos foram descobertos e determinados como tendo propriedades previstas por Mendeleev, sua tabela periódica tornou-se universalmente aceita.
Também durante o século XIX, a teoria cinética dos gases foi desenvolvida. A teoria cinética é baseada na existência de átomos e moléculas em movimento térmico aleatório e fornece uma explicação microscópica das leis dos gases, transferência de calor e termodinâmica. A teoria cinética funciona tão bem que é outra forte indicação da existência de átomos. Mas ainda é uma evidência indireta: átomos e moléculas individuais não foram observados. Houve debates acalorados sobre a validade da teoria cinética até que a evidência direta dos átomos fosse obtida.
A primeira evidência verdadeiramente direta de átomos é creditada a Robert Brown, um botânico escocês. Em 1827, ele percebeu que pequenos grãos de pólen suspensos em água parada se moviam em caminhos complexos. Isso pode ser observado com um microscópio para qualquer partícula pequena em um fluido. O movimento é causado pelos movimentos térmicos aleatórios de moléculas de fluido colidindo com partículas no fluido e agora é chamado de movimento browniano (Figura\(\PageIndex{1}\)). Flutuações estatísticas no número de moléculas que atingem os lados de uma partícula visível fazem com que ela se mova primeiro dessa maneira, depois daquela. Embora as moléculas não possam ser observadas diretamente, seus efeitos na partícula podem ser. Ao examinar o movimento browniano, o tamanho das moléculas pode ser calculado. Quanto menores e mais numerosas forem, menores serão as flutuações nos números que atingem lados diferentes.
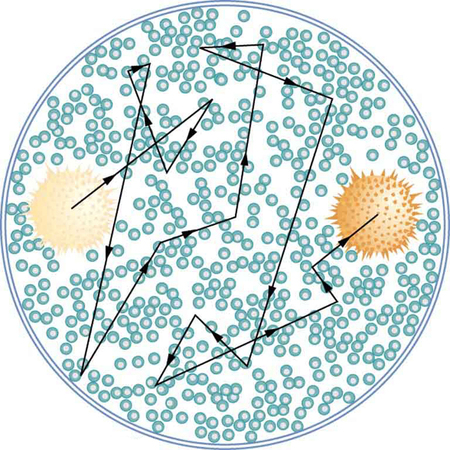
Foi Albert Einstein quem, a partir de seu ano de época de 1905, publicou vários artigos que explicavam com precisão como o movimento browniano poderia ser usado para medir o tamanho de átomos e moléculas. (Em 1905, Einstein criou a relatividade especial, propôs fótons como quanta da radiação EM e produziu uma teoria do movimento browniano que permitiu determinar o tamanho dos átomos. Tudo isso foi feito em seu tempo livre, já que ele trabalhou dias como examinador de patentes. Qualquer um desses trabalhos muito básicos poderia ter sido a maior conquista de uma carreira inteira, mas Einstein fez ainda mais nos últimos anos.) Seus tamanhos eram conhecidos apenas aproximadamente\(10^{-10} \, m\), com base em uma comparação do calor latente de vaporização e da tensão superficial feita por volta de 1805 por Thomas Young, famoso por dupla fenda, e pelo famoso astrônomo e matemático Simon Laplace.
Usando as ideias de Einstein, o físico francês Jean-Baptiste Perrin (1870—1942) observou cuidadosamente o movimento browniano; além de confirmar a teoria de Einstein, ele também produziu tamanhos precisos para átomos e moléculas. Como os pesos moleculares e as densidades dos materiais estavam bem estabelecidos, conhecer os tamanhos atômicos e moleculares permitiu obter um valor preciso para o número de Avogadro. (Se soubermos o tamanho de um átomo, sabemos quantos cabem em um determinado volume.) Perrin também usou essas ideias para explicar os efeitos da agitação atômica e molecular na sedimentação e recebeu o Prêmio Nobel de 1926 por suas conquistas. A maioria dos cientistas já estava convencida da existência de átomos, mas a observação e análise precisas do movimento browniano foram conclusivas — foi a primeira evidência verdadeiramente direta.

Agora existe uma grande variedade de evidências diretas e indiretas da existência de átomos. Por exemplo, tornou-se possível acelerar íons (assim como os elétrons são acelerados em tubos de raios catódicos) e detectá-los individualmente, bem como medir suas massas (veja Mais Aplicações do Magnetismo para uma discussão sobre espectrômetros de massa). Outros dispositivos que observam átomos individuais, como o microscópio eletrônico de tunelamento de varredura, serão discutidos em outro lugar (Figura\(\PageIndex{2}\)). Toda a nossa compreensão das propriedades da matéria é baseada e consistente com o átomo. As subestruturas do átomo, como camadas de elétrons e o núcleo, são interessantes e importantes. O núcleo, por sua vez, tem uma subestrutura, assim como as partículas das quais ele é composto. Esses tópicos, e a questão de saber se existe uma estrutura básica mais pequena que importa, serão explorados em partes posteriores do texto.
Resumo
- Os átomos são a menor unidade de elementos; os átomos se combinam para formar moléculas, a menor unidade de compostos.
- A primeira observação direta dos átomos foi em movimento browniano.
- A análise do movimento browniano forneceu tamanhos precisos para átomos (\(10^{-10} \, m\)em média) e um valor preciso para o número de Avogadro.
Glossário
- átomo
- unidade básica de matéria, que consiste em um núcleo central com carga positiva cercado por elétrons carregados negativamente
- Movimento browniano
- o movimento aleatório contínuo de partículas de matéria suspensas em um líquido ou gás


