14.2: Mudança de temperatura e capacidade de aquecimento
- Page ID
- 194688
objetivos de aprendizagem
Ao final desta seção, você poderá:
- Observe a transferência de calor e a mudança de temperatura e massa.
- Calcule a temperatura final após a transferência de calor entre dois objetos.
Um dos principais efeitos da transferência de calor é a mudança de temperatura: o aquecimento aumenta a temperatura enquanto o resfriamento a diminui. Assumimos que não há mudança de fase e que nenhum trabalho é feito no ou pelo sistema. Experimentos mostram que o calor transferido depende de três fatores: a mudança na temperatura, a massa do sistema e a substância e a fase da substância.
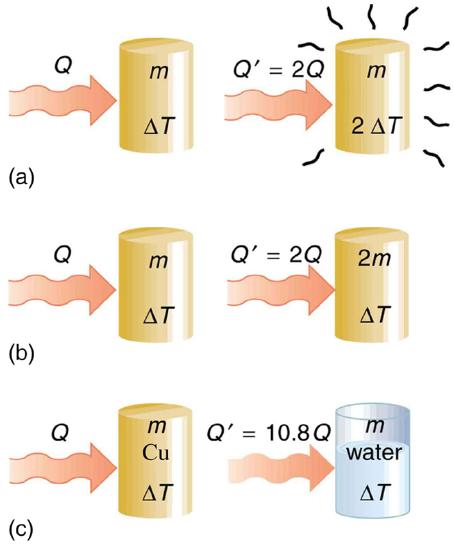
A dependência da mudança de temperatura e da massa é facilmente compreendida. Devido ao fato de que a energia cinética (média) de um átomo ou molécula é proporcional à temperatura absoluta, a energia interna de um sistema é proporcional à temperatura absoluta e ao número de átomos ou moléculas. Devido ao fato de que o calor transferido é igual à mudança na energia interna, o calor é proporcional à massa da substância e à mudança de temperatura. O calor transferido também depende da substância, de modo que, por exemplo, o calor necessário para elevar a temperatura seja menor para o álcool do que para a água. Para a mesma substância, o calor transferido também depende da fase (gás, líquido ou sólido).
Transferência de calor e mudança de temperatura
A relação quantitativa entre transferência de calor e mudança de temperatura contém todos os três fatores:\[Q = mc\Delta T,\] onde\(Q\) está o símbolo da transferência de calor,\(m\) é a massa da substância e\(\Delta T\) é a mudança na temperatura. O símbolo\(c\) representa calor específico e depende do material e da fase. O calor específico é a quantidade de calor necessária para alterar a temperatura de 1,00 kg de massa em\(1.00^oC\). O calor específico\(c\) é uma propriedade da substância; sua unidade SI é\(J/(kg \cdot K)\) ou\(J/(kg \cdot ^oC)\). Lembre-se de que a mudança de temperatura\((\Delta T)\) é a mesma em unidades de kelvin e graus Celsius. Se a transferência de calor for medida em quilocalorias, a unidade de calor específico será\(kcal/(kg \cdot ^oC)\).
Os valores de calor específico geralmente devem ser consultados nas tabelas, porque não há uma maneira simples de calculá-los. Em geral, o calor específico também depende da temperatura. A tabela\(\PageIndex{1}\) lista valores representativos de calor específico para várias substâncias. Com exceção dos gases, a dependência de temperatura e volume do calor específico da maioria das substâncias é fraca. Vemos nesta tabela que o calor específico da água é cinco vezes maior que o do vidro e dez vezes o do ferro, o que significa que é preciso cinco vezes mais calor para elevar a temperatura da água na mesma quantidade que no vidro e dez vezes mais calor para elevar a temperatura da água do que no ferro. Na verdade, a água tem um dos maiores calores específicos de qualquer material, o que é importante para sustentar a vida na Terra.
Exemplo\(\PageIndex{1}\): Calculating the Required Heat: Heating Water in an Aluminum Pan
Uma panela de alumínio de 0,500 kg em um fogão é usada para aquecer 0,250 litros de água\(20.0^oC\) de\(80.0^oC\) a.
(a) Quanto calor é necessário? Qual porcentagem do calor é usada para elevar a temperatura (b) da panela e (c) da água?
Estratégia
A panela e a água estão sempre na mesma temperatura. Quando você coloca a panela no fogão, a temperatura da água e da panela é
aumentado na mesma quantidade. Usamos a equação para a transferência de calor para a determinada mudança de temperatura e massa de água e alumínio. Os valores específicos de calor para água e alumínio são apresentados na Tabela\(\PageIndex{1}\).
Solução
Como a água está em contato térmico com o alumínio, a panela e a água estão na mesma temperatura.
- Calcule a diferença de temperatura:\[\Delta T = T_f - T_i = 60.0^oC.\]
- Calcule a massa da água. Como a densidade da água é\(1000 \, kg/m^3\), um litro de água tem uma massa de 1 kg e a massa de 0,250 litros de água é\(m_w = 0.250 \, kg\).
- Calcule o calor transferido para a água. Use o calor específico da água na tabela\(\PageIndex{1}\)\[Q_w = m_wc_w\Delta T = (0.250 \, kg)(4186 \, J/kg ^oC)(60.0^oC) = 62.8 \, kJ.\]
- Calcule o calor transferido para o alumínio. Use o calor específico para alumínio na Tabela\ (\ PageIndex {1}\:\[Q_{Al} = m_{Al}c_{Al}\Delta T = (0.500 \, kg)(900 \, J/kg^oC)(60.0^oC) = 27.0 kJ.\]
- Compare a porcentagem de calor que entra na panela com a que entra na água. Primeiro, encontre o calor total transferido:\[Q_{Total} = Q_W + Q_{Al} = 62.8 \, kJ + 27.0 \, kJ = 89.8 \, kJ.\]
- Assim, a quantidade de calor que entra no aquecimento da panela é\[\dfrac{62.8 \, kJ}{89.8 \, kJ} \times 100\% = 69.9\%\]
Discussão
Neste exemplo, o calor transferido para o recipiente é uma fração significativa do calor total transferido. Embora a massa da panela seja o dobro da água, o calor específico da água é quatro vezes maior que o do alumínio. Portanto, é necessário um pouco mais do que o dobro do calor para atingir a variação de temperatura da água em comparação com a panela de alumínio.

Exemplo\(\PageIndex{2}\): Calculating the Temperature Increase from the Work Done on a Substance: Truck Brakes Overheat on Downhill Runs
Os freios de caminhão usados para controlar a velocidade em uma corrida em declive funcionam, convertendo a energia potencial gravitacional em maior energia interna (temperatura mais alta) do material de freio. Essa conversão evita que a energia potencial gravitacional seja convertida em energia cinética do caminhão. O problema é que a massa do caminhão é grande em comparação com a do material de freio que absorve a energia, e o aumento da temperatura pode ocorrer muito rápido para que o calor suficiente seja transferido dos freios para o meio ambiente.
Calcule o aumento de temperatura de 100 kg de material de freio com um calor específico médio de\(800.0 \, J/kg \cdot ^oC\) se o material retiver 10% da energia de um caminhão de 10.000 kg descendo 75,0 m (em deslocamento vertical) a uma velocidade constante.
Estratégia
Se os freios não forem acionados, a energia potencial gravitacional é convertida em energia cinética. Quando os freios são aplicados, a energia potencial gravitacional é convertida em energia interna do material do freio. Primeiro calculamos a energia potencial gravitacional\((Mgh)\) que todo o caminhão perde em sua descida e, em seguida, encontramos o aumento de temperatura produzido apenas no material de freio.
Solução
- Calcule a mudança na energia potencial gravitacional à medida que o caminhão desce a ladeira\[Mgh = (10,000 \, kg)(9.80 \, m/s^2)(75.0 \, m) = 7.35 \times 10^6 \, J.\]
- Calcule a temperatura do calor transferido usando\(Q = Mgh\) e\[\Delta T = \dfrac{Q}{mc},\] onde\(m\) está a massa do material de freio. Insira os valores\(m = 100 \, kg\) e\(c = 800 \, J/kg \cdot ^oC\) encontre\[\Delta T = \dfrac{(7.35v \times 10^6 \, J)}{(100 \, kg)(800 \, J/kg^oC)} = 92^oC.\]
Discussão
Essa temperatura está próxima do ponto de ebulição da água. Se o caminhão estivesse viajando há algum tempo, pouco antes da descida, a temperatura do freio provavelmente seria maior do que a temperatura ambiente. O aumento da temperatura na descida provavelmente elevaria a temperatura do material de freio acima do ponto de ebulição da água, portanto, essa técnica não é prática. No entanto, a mesma ideia está subjacente à recente tecnologia híbrida de carros, onde a energia mecânica (energia potencial gravitacional) é convertida pelos freios em energia elétrica (bateria).
| Substâncias | Calor específico (c) | |
|---|---|---|
| Sólidos | \(J/kg\cdot^oC\) | \(kcal/kg\cdot^oC\) |
| Alumínio | 900 | 0,215 |
| Amianto | 800 | 0,19 |
| Concreto, granito (médio) | 840 | 0,20 |
| Cobre | 387 | 0,0924 |
| Vidro | 840 | 0,20 |
| Ouro | 129 | 0,0308 |
| Corpo humano (média a 37 °C) | 3500 | 0,83 |
| Gelo (média, -50°C a 0°C) | 2090 | 0,50 |
| Ferro, aço | 452 | 0,108 |
| Liderar | 128 | 0,0305 |
| Prata | 235 | 0,0562 |
| Madeira | 1700 | 0,4 |
| Líquidos | ||
| Benzeno | 1740 | 0,415 |
| Etanol | 2450 | 0,586 |
| Glicerina | 2410 | 0,576 |
| Mercúrio | 139 | 0,033 |
| Água (15,0 °C) | 4186 | 1.000 |
| Gases 3 | ||
| Ar (seco) | 721 (1015) | 0,172 (0,242) |
| Amônia | 1670 (2190) | 0,399 (0,523) |
| Dióxido de carbono | 638 (833) | 0,152 (0,199) |
| Azoto | 739 (1040) | 0,177 (0,248) |
| Oxigênio | 651 (913) | 0,156 (0,218) |
| Vapor (100°C) | 1520 (2020) | 0,363 (0,482) |
Observe que o Exemplo\(\PageIndex{2}\) é uma ilustração do equivalente mecânico do calor. Como alternativa, o aumento da temperatura pode ser produzido por um maçarico em vez de mecanicamente.
Exemplo\(\PageIndex{3}\): Calculating the Final Temperature When Heat Is Transferred Between Two Bodies: Pouring Cold Water in a Hot Pan
Suponha que você despeje 0,250 kg de\(20.0^oC\) água (cerca de uma xícara) em uma panela de alumínio de 0,500 kg do fogão com uma temperatura de\(150^oC\). Suponha que a panela seja colocada em uma almofada isolada e que uma quantidade insignificante de água ferva. Qual é a temperatura quando a água e a panela atingem o equilíbrio térmico pouco tempo depois?
Estratégia
A panela é colocada em uma almofada isolada para que ocorra pouca transferência de calor com o ambiente. Originalmente, a panela e a água não estão em equilíbrio térmico: a panela está em uma temperatura mais alta do que a água. A transferência de calor então restaura o equilíbrio térmico quando a água e a panela estão em contato. Como a transferência de calor entre a panela e a água ocorre rapidamente, a massa de água evaporada é insignificante e a magnitude do calor perdido pela panela é igual ao calor obtido pela água. A troca de calor é interrompida quando o equilíbrio térmico entre a panela e a água é alcançado. A troca de calor pode ser escrita como\(|Q_{hot}| = Q_{cold}.\)
Solução
- Use a equação da transferência de calor\(Q = mc\Delta T\) para expressar o calor perdido pela panela de alumínio em termos da massa da panela, do calor específico do alumínio, da temperatura inicial da panela e da temperatura final:\[Q_{hot} = m_{Al}c_{Al}(T_f - 150^oC).\]
- Expresse o calor obtido pela água em termos da massa da água, do calor específico da água, da temperatura inicial da água e da temperatura final:\[Q_{cold} = m_wc_w(T_f - 20.0^oC).\]
- Observe que\(Q_{hot}<0\) e\(Q_{cold} >0\) e que eles devem somar zero porque o calor perdido pela panela quente deve ser o mesmo que o calor ganho pela água fria:\[Q_{cold} + Q_{hot} = 0,\]\[Q_{cold} = -Q_{hot},\]\[m_wc_w(T_f - 20.0^oC) = -m_{Al}c_{Al}(T_f - 150.0^oC).\]
- Traga todos os termos envolvidos\(T_f\) no lado esquerdo e todos os outros termos no lado direito. Resolva para\(T_f\),
\(T_f=\dfrac{m_{Al}c_{Al}(150ºC)+m_Wc_W(20.0ºC)}{m_{Al}c_{Al}+m_Wc_W}\),
e insira os valores numéricos:
\(T_f=\dfrac{(0.500 kg)(900 J/kgºC)(150ºC)+(0.250 kg)(4186 J/kgºC)(20.0ºC)}{(0.500 kg)(900 J/kgºC)+(0.250 kg)(4186 J/kgºC)}=\dfrac{88430 J}{1496.5 J/ºC}=59.1ºC.\)
Discussão
Esse é um problema típico de calorimetria: dois corpos em temperaturas diferentes entram em contato um com o outro e trocam calor até que uma temperatura comum seja atingida. Por que a temperatura final está muito mais próxima de 20,0ºC do que 150ºC? O motivo é que a água tem um calor específico maior do que a maioria das substâncias comuns e, portanto, sofre uma pequena mudança de temperatura para uma determinada transferência de calor. Um grande corpo de água, como um lago, requer uma grande quantidade de calor para aumentar consideravelmente sua temperatura. Isso explica por que a temperatura de um lago permanece relativamente constante durante um dia, mesmo quando a mudança de temperatura do ar é grande. No entanto, a temperatura da água muda por períodos mais longos (por exemplo, do verão ao inverno).
EXPERIÊNCIA PARA LEVAR PARA CASA: MUDANÇA DE TEMPERATURA DA TERRA E DA ÁGUA
O que aquece mais rápido, terra ou água?
Para estudar as diferenças na capacidade térmica:
- Coloque massas iguais de areia seca (ou terra) e água à mesma temperatura em dois pequenos potes. (A densidade média do solo ou da areia é cerca de 1,6 vezes a da água, então você pode obter massas aproximadamente iguais usando\(50%\) mais água por volume.)
- Aqueça os dois (usando um forno ou uma lâmpada de calor) pelo mesmo período de tempo.
- Registre a temperatura final das duas massas.
- Agora leve os dois frascos à mesma temperatura aquecendo por um longo período de tempo.
- Retire os frascos da fonte de calor e meça a temperatura a cada 5 minutos por cerca de 30 minutos.
Qual amostra esfria mais rápido? Essa atividade replica os fenômenos responsáveis pela brisa terrestre e marítima.
Exercício\(\PageIndex{1}\)
Se 25 kJ são necessários para elevar a temperatura de um bloco de 25ºC para 30ºC, quanto calor é necessário para aquecer o bloco de 45ºC para 50ºC?
- Resposta
-
A transferência de calor depende apenas da diferença de temperatura. Como as diferenças de temperatura são as mesmas nos dois casos, os mesmos 25 kJ são necessários no segundo caso.
Resumo
- A transferência de calor\(Q\) que leva a uma mudança\(ΔT\) na temperatura de um corpo com massa\(m\) é\(Q=mcΔT\), onde\(c\) está o calor específico do material. Essa relação também pode ser considerada como a definição de calor específico.
Notas de pé
1 Os valores para sólidos e líquidos estão em volume constante e em 25ºC, exceto conforme indicado.
2 Esses valores são idênticos em unidades de Cal/g⋅ºC.
3 cv em volume constante e a 20,0ºC, exceto conforme indicado, e a 1,00 atm de pressão média. Os valores entre parênteses estão\(c_p\) em uma pressão constante de 1,00 atm.
Glossário
calor específico
a quantidade de calor necessária para alterar a temperatura de 1,00 kg de uma substância em 1,00 ºC


