14.1: Calor
- Page ID
- 194671
Objetivos de
Ao final desta seção, você poderá:
- Defina calor como transferência de energia.
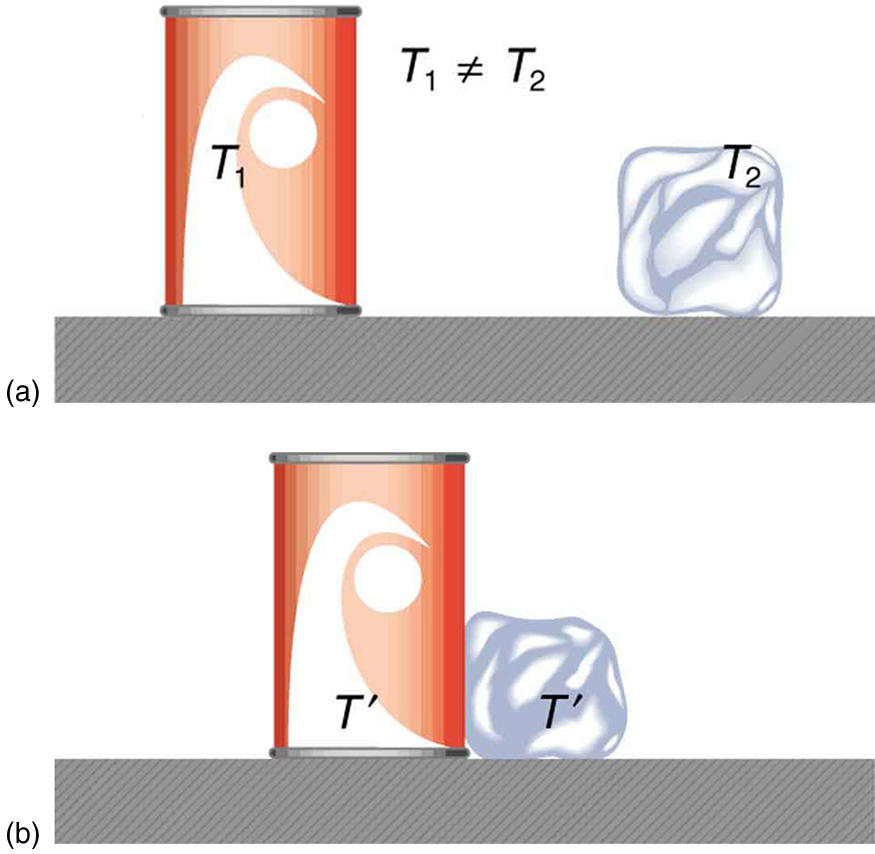
Em Trabalho, Energia e Recursos Energéticos, definimos trabalho como força vezes distância e aprendemos que o trabalho realizado em um objeto muda sua energia cinética. Também vimos em Temperatura, Teoria Cinética e Leis dos Gases que a temperatura é proporcional à energia cinética (média) dos átomos e moléculas. Dizemos que um sistema térmico tem uma certa energia interna: sua energia interna é maior se a temperatura for maior. Se dois objetos em temperaturas diferentes entrarem em contato um com o outro, a energia é transferida do objeto mais quente para o mais frio até que o equilíbrio seja alcançado e os corpos atinjam o equilíbrio térmico (ou seja, eles estão na mesma temperatura). Nenhum trabalho é feito por nenhum dos objetos, porque nenhuma força atua à distância. A transferência de energia é causada pela diferença de temperatura e cessa quando as temperaturas são iguais. Essas observações levam à seguinte definição de calor: O calor é a transferência espontânea de energia devido a uma diferença de temperatura.
Conforme observado em Temperatura, Teoria Cinética e Leis dos Gases, o calor é frequentemente confundido com a temperatura. Por exemplo, podemos dizer que o calor era insuportável, quando na verdade queremos dizer que a temperatura estava alta. O calor é uma forma de energia, enquanto a temperatura não é. O equívoco surge porque somos sensíveis ao fluxo de calor, e não à temperatura.
Devido ao fato de que o calor é uma forma de energia, ele tem a unidade SI de joule (J). A caloria (cal) é uma unidade comum de energia, definida como a energia necessária para alterar a temperatura de 1,00 g de água\(1.00^oC\) —especificamente, entre\(14.5^oC\) e\(15.5^oC\), uma vez que há uma ligeira dependência da temperatura. Talvez a unidade de calor mais comum seja a quilocaloria (kcal), que é a energia necessária para alterar a temperatura de 1,00 kg de água\(1.00^oC\). Como a massa é mais frequentemente especificada em quilogramas, a quilocaloria é comumente usada. As calorias dos alimentos (dada a notação Cal e às vezes chamadas de “grande caloria”) são, na verdade, quilocalorias\((1 \, kilocalorie = 1000 \, calories)\), um fato que não é facilmente determinado na rotulagem da embalagem.
Equivalente mecânico de calor
Também é possível alterar a temperatura de uma substância trabalhando. O trabalho pode transferir energia para dentro ou para fora de um sistema. Essa constatação ajudou a estabelecer o fato de que o calor é uma forma de energia. James Prescott Joule (1818—1889) realizou muitos experimentos para estabelecer o equivalente mecânico do calor — o trabalho necessário para produzir os mesmos efeitos da transferência de calor. Em termos das unidades usadas para esses dois termos, o melhor valor moderno para essa equivalência é
\[ 1.000 \, kcal = 4186 \, J.\]
Consideramos essa equação como a conversão entre duas unidades diferentes de energia.
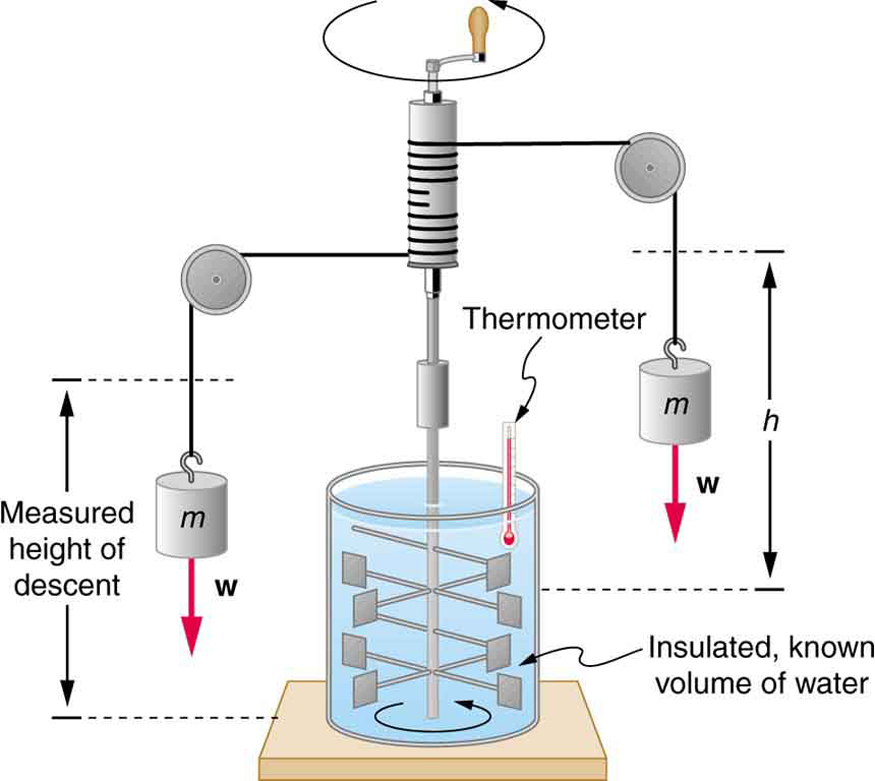
\(\PageIndex{2}\)A figura mostra uma das configurações experimentais mais famosas de Joule para demonstrar o equivalente mecânico do calor. Demonstrou que o trabalho e o calor podem produzir os mesmos efeitos e ajudou a estabelecer o princípio da conservação de energia. A energia potencial gravitacional (PE) (trabalho realizado pela força gravitacional) é convertida em energia cinética (KE) e, em seguida, randomizada por viscosidade e turbulência em energia cinética média aumentada de átomos e moléculas no sistema, produzindo um aumento de temperatura. Suas contribuições para o campo da termodinâmica foram tão significativas que a unidade de energia SI recebeu o nome dele.
O calor adicionado ou removido de um sistema altera sua energia interna e, portanto, sua temperatura. Esse aumento de temperatura é observado durante o cozimento. No entanto, adicionar calor não aumenta necessariamente a temperatura. Um exemplo é o derretimento do gelo; isto é, quando uma substância muda de uma fase para outra. O trabalho realizado no sistema ou pelo sistema também pode alterar a energia interna do sistema. Joule demonstrou que a temperatura de um sistema pode ser aumentada por agitação. Se um cubo de gelo for esfregado contra uma superfície áspera, o trabalho é feito pela força de atrito. Um sistema tem uma energia interna bem definida, mas não podemos dizer que ele tenha um certo “conteúdo de calor” ou “conteúdo de trabalho”. Usamos a frase “transferência de calor” para enfatizar sua natureza.
Exercício\(\PageIndex{1}\)
Duas amostras (A e B) da mesma substância são mantidas em um laboratório. Alguém adiciona 10 quilojoules (kJ) de calor a uma amostra, enquanto 10 kJ de trabalho são feitos na outra amostra. Como você pode saber a qual amostra o calor foi adicionado?
- Resposta
-
O calor e o trabalho alteram a energia interna da substância. No entanto, as propriedades da amostra dependem apenas da energia interna, de modo que é impossível dizer se o calor foi adicionado à amostra A ou B.
Resumo
- Calor e trabalho são os dois métodos distintos de transferência de energia.
- O calor é energia transferida apenas devido a uma diferença de temperatura.
- Qualquer unidade de energia pode ser usada para transferência de calor, e as mais comuns são quilocaloria (kcal) e joule (J).
- A quilocaloria é definida como a energia necessária para alterar a temperatura de 1,00 kg de água entre\(14.5^oC\)\(15.5^oC\) e.
- O equivalente mecânico dessa transferência de calor é\(1.00 \, kcal = 4186 \, J.\)
Glossário
- calor
- a transferência espontânea de energia devido a uma diferença de temperatura
- quilocaloria
- 1 quilocaloria = 1000 calorias tamanho 12 {1`"quilocalorie=1000"`"calorias "} {}
- equivalente mecânico de calor
- o trabalho necessário para produzir os mesmos efeitos da transferência de calor


