14.3: Mudança de fase e calor latente
- Page ID
- 194656
Objetivos de
Ao final desta seção, você poderá:
- Examine a transferência de calor.
- Calcule a temperatura final da transferência de calor.
Até agora, discutimos a mudança de temperatura devido à transferência de calor. Nenhuma mudança de temperatura ocorre devido à transferência de calor se o gelo derreter e se tornar água líquida (ou seja, durante uma mudança de fase). Por exemplo, considere a água pingando do gelo derretendo em um telhado aquecido pelo sol. Por outro lado, a água congela em uma bandeja de gelo resfriada por ambientes de baixa temperatura.

A energia é necessária para derreter um sólido porque as ligações coesivas entre as moléculas no sólido devem ser separadas de forma que, no líquido, as moléculas possam se mover com energias cinéticas comparáveis; portanto, não há aumento na temperatura. Da mesma forma, a energia é necessária para vaporizar um líquido, porque as moléculas em um líquido interagem umas com as outras por meio de forças atrativas. Não há mudança de temperatura até que uma mudança de fase seja concluída. A temperatura de uma xícara de refrigerante inicialmente\(0^oC\) permanece em\(0^oC\) até que todo o gelo derreta. Por outro lado, a energia é liberada durante o congelamento e a condensação, geralmente na forma de energia térmica. O trabalho é feito por forças coesivas quando as moléculas são reunidas. A energia correspondente deve ser emitida (dissipada) para permitir que eles permaneçam juntos (veja a Figura\(\PageIndex{2}\))
A energia envolvida em uma mudança de fase depende de dois fatores principais: o número e a força das ligações ou pares de forças. O número de ligações é proporcional ao número de moléculas e, portanto, à massa da amostra. A força das forças depende do tipo de molécula. O calor\(Q\) necessário para mudar a fase de uma amostra de massa\(m\) é dado pelo\[ Q = mL_f (melting/freezing),\]\[Q = mL_v (vaporization/condensation),\] ponto em que o calor latente de fusão e o calor latente de vaporização são constantes do material que são determinadas experimentalmente.\(L_f\)\(L_v\) Veja (Tabela\(\PageIndex{1}\)).
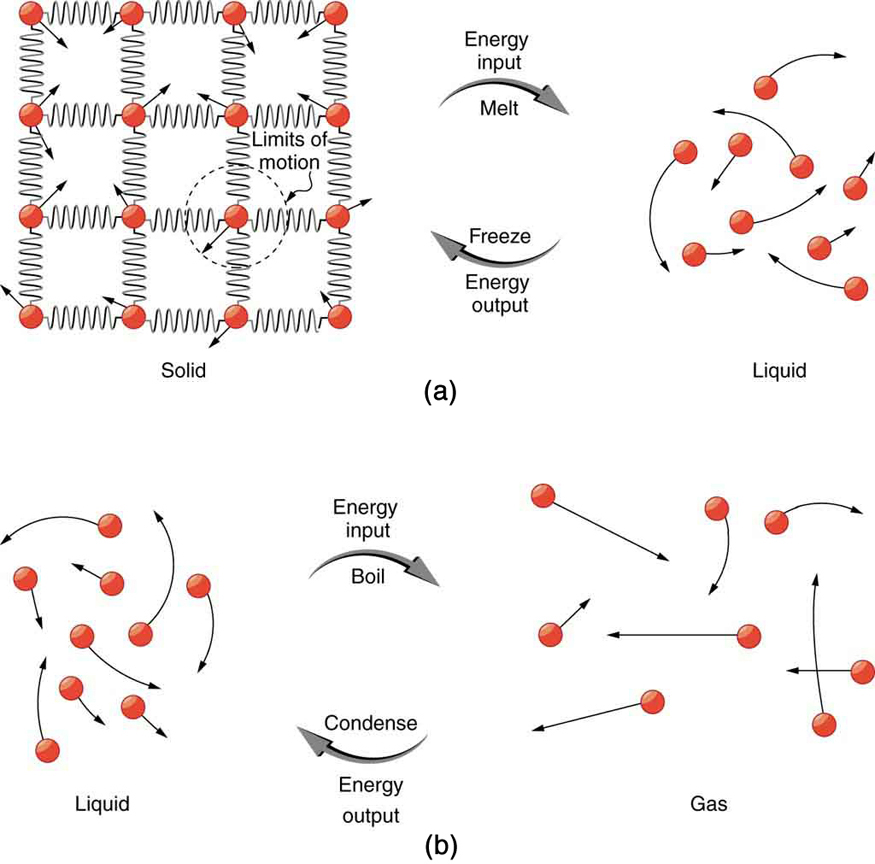
O calor latente é medido em unidades de J/kg. Ambos\(L_f\)\(L_v\) dependem da substância, particularmente da força de suas forças moleculares, conforme observado anteriormente. \(L_f\)e\(L_v\) são chamados coletivamente de coeficientes de calor latente. Eles estão latentes ou ocultos, porque nas mudanças de fase, a energia entra ou sai de um sistema sem causar uma mudança de temperatura no sistema; então, na verdade, a energia está oculta. A tabela\(\PageIndex{1}\) lista os valores representativos de\(L_f\) e\(L_v\), junto com os pontos de fusão e ebulição.
A tabela mostra que quantidades significativas de energia estão envolvidas nas mudanças de fase. Vejamos, por exemplo, quanta energia é necessária para derreter um quilo de gelo\(0^oC\) para produzir um quilo de água\(0^oC\). Usando a equação para uma mudança na temperatura e o valor da água da Tabela\(\PageIndex{1}\), descobrimos que\[Q = mL_f = (1.0 \, kg)(334 \, kJ/kg) = 334 \, kJ\] é a energia para derreter um quilo de gelo. Isso é muita energia, pois representa a mesma quantidade de energia necessária para elevar a temperatura de 1 kg de água líquida de\(0^oC\) para\(79.8^oC\). É necessária ainda mais energia para vaporizar a água; seriam necessários 2256 kJ para trocar 1 kg de água líquida (\((100^oC\)no ponto de ebulição normal (à pressão atmosférica) por vapor (vapor de água). Este exemplo mostra que a energia para uma mudança de fase é enorme em comparação com a energia associada às mudanças de temperatura sem mudança de fase.
| \(L_f\) | \(L_v\) | |||||
|---|---|---|---|---|---|---|
| Substância | Ponto de fusão (ºC) | \ (L_f\)” style="text-align:center; "> kJ/kg | kcal/kg | Ponto de ebulição (°C) | \ (l_V\)” style="text-align:center; "> kJ/kg | kcal/kg |
| Hélio | −269,7 | \ (l_f\)” style="alinhamento de texto: centro; ">5.23 | 1,25 | −268,9 | \ (l_V\)” style="text-align:center; ">20.9 | 4,99 |
| Hidrogênio | −259,3 | \ (l_f\)” style="alinhamento do texto: centro; ">58,6 | 14,0 | −252,9 | \ (l_V\)” style="alinhamento de texto: centro; ">452 | 108 |
| Azoto | −210,0 | \ (l_f\)” style="alinhamento de texto: centro; ">25,5 | 6.09 | −195,8 | \ (l_V\)” style="alinhamento de texto: centro; ">201 | 48,0 |
| Oxigênio | −218,8 | \ (l_f\)” style="alinhamento de texto: centro; ">13,8 | 3,30 | −183,0 | \ (l_V\)” style="alinhamento de texto: centro; ">213 | 50,9 |
| Etanol | −114 | \ (l_f\)” style="alinhamento do texto: centro; ">104 | 24,9 | 78,3 | \ (l_V\)” style="alinhamento de texto: centro; ">854 | 204 |
| Amônia | −75 | \ (l_f\)” style="alinhamento de texto: centro; "> | 108 | −33,4 | \ (l_V\)” style="alinhamento de texto: centro; ">1370 | 327 |
| Mercúrio | −38,9 | \ (l_f\)” style="alinhamento de texto: centro; ">11.8 | 2,82 | 357 | \ (l_V\)” style="alinhamento de texto: centro; ">272 | 65,0 |
| Água | 0,00 | \ (l_f\)” style="alinhamento do texto: centro; ">334 | 79,8 | 100,0 | \ (l_V\)” style="text-align:center; ">2256 2 | 539 3 |
| Enxofre | 119 | \ (l_f\)” style="alinhamento do texto: centro; ">38,1 | 9,10 | 444,6 | \ (l_V\)” style="text-align:center; ">326 | 77,9 |
| Liderar | 327 | \ (l_f\)” style="alinhamento de texto: centro; ">24,5 | 5,85 | 1750 | \ (l_V\)” style="alinhamento de texto: centro; ">871 | 208 |
| Antimônio | 631 | \ (l_f\)” style="alinhamento de texto: centro; ">165 | 39,4 | 1440 | \ (l_V\)” style="alinhamento de texto: centro; ">561 | 134 |
| Alumínio | 660 | \ (l_f\)” style="alinhamento do texto: centro; ">380 | 90 | 2450 | \ (l_V\)” style="alinhamento de texto: centro; ">11400 | 2720 |
| Prata | 961 | \ (l_f\)” style="alinhamento de texto: centro; ">88,3 | 21.1 | 2193 | \ (l_V\)” style="alinhamento de texto: centro; ">2336 | 558 |
| Ouro | 1063 | \ (l_f\)” style="alinhamento do texto: centro; ">64,5 | 15,4 | 2660 | \ (l_V\)” style="alinhamento de texto: centro; ">1578 | 377 |
| Cobre | 1083 | \ (l_f\)” style="alinhamento de texto: centro; ">134 | 32,0 | 2595 | \ (l_V\)” style="alinhamento de texto: centro; ">5069 | 1211 |
| Urânio | 1133 | \ (l_f\)” style="alinhamento do texto: centro; ">84 | 20 | 3900 | \ (l_V\)” style="alinhamento de texto: centro; ">1900 | 454 |
| Tungstênio | 3410 | \ (l_f\)” style="alinhamento do texto: centro; ">184 | 44 | 5900 | \ (l_V\)” style="alinhamento de texto: centro; ">4810 | 1150 |
As mudanças de fase podem ter um tremendo efeito estabilizador mesmo em temperaturas que não estão próximas dos pontos de fusão e ebulição, porque a evaporação e a condensação (conversão de um gás em estado líquido) ocorrem mesmo em temperaturas abaixo do ponto de ebulição. Tomemos, por exemplo, o fato de que a temperatura do ar está úmida os climas raramente ultrapassam\(35.0^oC\),
porque a maior parte da transferência de calor vai para a evaporação da água para o ar. Da mesma forma, as temperaturas em clima úmido raramente caem abaixo do ponto de orvalho porque um calor enorme é liberado quando o vapor de água se condensa.
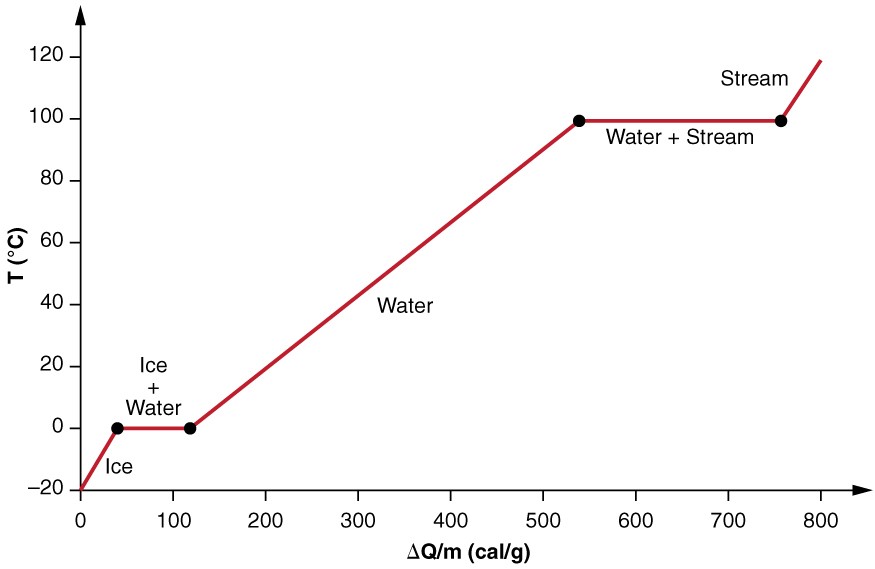
Examinamos os efeitos da mudança de fase com mais precisão, considerando a adição de calor a uma amostra de gelo em\(-20^oC\) (Figura\(\PageIndex{3}\)). A temperatura do gelo aumenta linearmente, absorvendo calor a uma taxa constante de\(0.50 \, cal/g \cdot ^oC\) até atingir\(0^oC\). Uma vez nessa temperatura, o gelo começa a derreter até que todo o gelo derreta, absorvendo 79,8 cal/g de calor. A temperatura permanece constante\(0^oC\) durante essa mudança de fase. Depois que todo o gelo derrete, a temperatura da água líquida aumenta, absorvendo calor a uma nova taxa constante de\(1.00 \, cal/g \cdot ^oC\). Em\(100^oC\), a água começa a ferver e a temperatura permanece novamente constante enquanto a água absorve 539 cal/g de calor durante essa mudança de fase. Quando todo o líquido se torna vapor de vapor, a temperatura sobe novamente, absorvendo o calor a uma taxa de\(0.482 \, cal/g \cdot ^oC\).
A água pode evaporar em temperaturas abaixo do ponto de ebulição. É necessária mais energia do que no ponto de ebulição, porque a energia cinética das moléculas de água em temperaturas abaixo\(100^oC\) é menor do que a energia em\(100^oC\), portanto, menos energia está disponível em movimentos térmicos aleatórios. Tomemos, por exemplo, o fato de que, à temperatura corporal, a transpiração da pele requer uma entrada de calor de 2428 kJ/kg, que é cerca de 10% maior do que o calor latente de vaporização\(100^oC\). Esse calor vem da pele e, portanto, fornece um mecanismo de resfriamento eficaz em climas quentes. A alta umidade inibe a evaporação, de modo que a temperatura corporal pode aumentar, deixando suor não evaporado na testa.
Exemplo\(\PageIndex{1}\): Calculate Final Temperature from Phase Change: Cooling Soda with Ice Cubes
Três cubos de gelo são usados para resfriar um refrigerante\(20^oC\) com massa\(m_{soda} = 0.25 \, kg\). O gelo está pronto\(0^oC\) e cada cubo de gelo tem uma massa de 6,0 g. Suponha que o refrigerante seja mantido em um recipiente de espuma para que a perda de calor possa ser ignorada. Suponha que o refrigerante tenha a mesma capacidade calorífica da água. Encontre a temperatura final quando todo o gelo derreter.
Estratégia
Os cubos de gelo estão na temperatura de fusão de\(0^oC\). O calor é transferido do refrigerante para o gelo para derreter. O derretimento do gelo ocorre em duas etapas: primeiro a mudança de fase ocorre e o sólido (gelo) se transforma em água líquida na temperatura de fusão, depois a temperatura dessa água aumenta. O derretimento produz água em\(0^oC\), então mais calor é transferido do refrigerante para essa água até que o sistema de água mais refrigerante atinja o equilíbrio térmico.\[Q_{ice} = -Q_{soda}.\] O calor transferido para o gelo é\(Q_{ice} = m_{ice}L_f + m_{ice} c_w (T_f - 0^oC).\). O calor liberado pelo refrigerante é\(Q_{soda} = m_{soda}c_w (T_f - 20^oC).\) Como nenhum calor é perdido\(Q_{ice} = -Q_{soda}\),, de modo que\[m_{ice}Lf + m_{ice} c_w (T_f - 0^oC) = -m_{soda} c_w (T_f - 20^oC).\] Traga todos os termos envolvidos\(T_f\) no lado esquerdo e todos os outros termos no lado direito. Resolva para a quantidade desconhecida\(T_f\):\[T_f = \dfrac{m_{soda} c_w (20^oC) - m_{ice} L_f}{(m_{soda} + m_{ice}) c_w}.\]
Solução
- Identifique as quantidades conhecidas. A massa de gelo é\(m_{ice} = 3 \times 6.0 \, g = 0.018 \, kg \) e a massa de refrigerante é\(m_{soda} = 0.25 \, kg\).
- Calcule os termos no numerador:\[m_{soda} c_w (20^oC) = (0.25 \, kg) (4186 \, J/kg \cdot ^oC) (20^oC) = 20,930 \, J\] e\[m_{ice}L_f = (0.018 \, kg)(334,000 \, J/kg) = 6012 \, J.\]
- Calcule o denominador:\[(m_{soda} + m_{ice})c_w = (0.25 \, kg + 0.018 \, kg)(4186 \, J/kg \cdot ^oC)= 1122 \, J/^oC\]
- Calcule a temperatura final:\[T_f = \dfrac{20,930 \, J - 6012 \, J}{1122 \, J/^oC} = 13^oC.\]
Discussão
Este exemplo ilustra as enormes energias envolvidas durante uma mudança de fase. A massa de gelo é cerca de 7% da massa de água, mas leva a uma mudança perceptível na temperatura do refrigerante. Embora tenhamos assumido que o gelo estava na temperatura de congelamento, isso está incorreto: a temperatura típica é\(-6^oC\). No entanto, essa correção fornece uma temperatura final que é essencialmente idêntica ao resultado que encontramos. Você pode explicar o porquê?
Vimos que a vaporização requer transferência de calor para um líquido do ambiente, para que a energia seja liberada pelo ambiente. A condensação é o processo inverso, aumentando a temperatura do ambiente. Esse aumento pode parecer surpreendente, já que associamos a condensação a objetos frios — o vidro na figura, por exemplo. No entanto, a energia deve ser removida das moléculas de condensação para que o vapor se condense. A energia é exatamente a mesma necessária para fazer a mudança de fase na outra direção, de líquido para vapor, e assim ela pode ser calculada a partir de\(Q = mL_v\).

Aplicação no mundo real
A energia também é liberada quando um líquido congela. Esse fenômeno é usado pelos fruticultores da Flórida para proteger as laranjas quando a temperatura está próxima do ponto de congelamento\((0^oC)\). Os produtores pulverizam água nas plantas dos pomares para que a água congele e o calor seja liberado para as laranjas em crescimento nas árvores. Isso evita que a temperatura dentro da laranja caia abaixo de zero, o que danificaria a fruta.

A sublimação é a transição da fase sólida para a fase de vapor. Você deve ter notado que a neve pode desaparecer no ar sem deixar vestígios de água líquida ou o desaparecimento de cubos de gelo em um freezer. O inverso também é verdadeiro: o gelo pode se formar em janelas muito frias sem passar pelo estágio líquido. Um efeito popular é a produção de “fumaça” a partir do gelo seco, que é dióxido de carbono sólido. A sublimação ocorre porque a pressão de vapor de equilíbrio dos sólidos não é zero. Certos purificadores de ar usam a sublimação de um sólido para injetar um perfume na sala. As bolas de mariposa são um exemplo levemente tóxico de fenol (um composto orgânico) que sublima, enquanto alguns sólidos, como o tetróxido de ósmio, são tão tóxicos que devem ser mantidos em recipientes selados para evitar a exposição humana aos vapores produzidos pela sublimação.

Todas as transições de fase envolvem calor. No caso de transições diretas de vapor sólido, a energia necessária é dada pela equação\(Q = mL_s\), onde\(L_s\) é o calor da sublimação, que é a energia necessária para trocar 1,00 kg de uma substância da fase sólida para a fase de vapor. \(L_s\)é análogo a\(L_f\) e\(L_v\), e seu valor depende da substância. A sublimação requer entrada de energia, para que o gelo seco seja um refrigerante eficaz, enquanto o processo inverso (ou seja, congelamento) libera energia. A quantidade de energia necessária para a sublimação é da mesma ordem de magnitude que para outras transições de fase.
O material apresentado nesta seção e na seção anterior nos permite calcular qualquer número de efeitos relacionados à temperatura e à mudança de fase. Em cada caso, é necessário identificar quais mudanças de temperatura e fase estão ocorrendo e, em seguida, aplicar a equação apropriada. Lembre-se de que a transferência de calor e o trabalho podem causar mudanças de temperatura e de fase.
Estratégias de resolução de problemas para os efeitos da transferência de calor
- Examine a situação para determinar se há uma mudança na temperatura ou na fase. Há transferência de calor para dentro ou para fora do sistema? Quando a presença ou ausência de uma mudança de fase não é óbvia, convém primeiro resolver o problema como se não houvesse mudanças de fase e examinar a mudança de temperatura obtida. Se for suficiente para ultrapassar o ponto de ebulição ou fusão, você deve voltar e resolver o problema em etapas: mudança de temperatura, mudança de fase, mudança de temperatura subsequente e assim por diante.
- Identifique e liste todos os objetos que alteram a temperatura e a fase.
- Identifique exatamente o que precisa ser determinado no problema (identifique as incógnitas). Uma lista escrita é útil.
- Faça uma lista do que é dado ou do que pode ser inferido do problema conforme declarado (identifique os conhecidos).
- Resolva a equação apropriada para a quantidade a ser determinada (a desconhecida). Se houver uma mudança de temperatura, o calor transferido depende do calor específico (consulte Mudança de temperatura e Capacidade de Calor), enquanto que, para uma mudança de fase, o calor transferido depende do calor latente. Veja a tabela\(\PageIndex{1}\).
- Substitua os conhecidos junto com suas unidades na equação apropriada e obtenha soluções numéricas completas com unidades. Você precisará fazer isso em etapas se houver mais de um estágio no processo (como uma mudança de temperatura seguida por uma mudança de fase).
- Verifique a resposta para ver se é razoável: Faz sentido? Por exemplo, certifique-se de que a mudança de temperatura também não cause uma mudança de fase que você não tenha levado em consideração.
Exercício\(\PageIndex{1}\)
Por que a neve permanece nas encostas das montanhas mesmo quando as temperaturas diurnas são mais altas do que a temperatura de congelamento?
- Responda
-
A neve é formada por cristais de gelo e, portanto, é a fase sólida da água. Como é necessário um calor enorme para mudanças de fase, leva um certo tempo para que esse calor seja acumulado do ar, mesmo que o ar esteja acima\(0^oC\). Quanto mais quente o ar, mais rápida ocorre essa troca de calor e mais rápido a neve derrete.
Resumo
- A maioria das substâncias pode existir nas formas sólida, líquida e gasosa, chamadas de “fases”.
- As mudanças de fase ocorrem em temperaturas fixas para uma determinada substância a uma determinada pressão, e essas temperaturas são chamadas de pontos de ebulição e congelamento (ou fusão).
- Durante as mudanças de fase, o calor absorvido ou liberado é dado por\(Q = mL,\) onde\(L\) está o coeficiente de calor latente.
Notas de pé
1 Valores cotados nas temperaturas normais de fusão e ebulição à pressão atmosférica padrão (1 atm).
2 A 37,0ºC (temperatura corporal), o calor de vaporização\(L_v\) da água é de 2430 kJ/kg ou 580 kcal/kg
3 A 37,0ºC (temperatura corporal), o calor de vaporização\(L_v\) da água é de 2430 kJ/kg ou 580 kcal/kg
Glossário
- calor de sublimação
- a energia necessária para mudar uma substância da fase sólida para a fase de vapor
- coeficiente de calor latente
- uma constante física igual à quantidade de calor transferida para cada 1 kg de uma substância durante a mudança de fase da substância
- sublimação
- a transição da fase sólida para a fase de vapor


