14.2 : Fluides, densité et pression (partie 1)
- Page ID
- 191707
- Indiquer les différentes phases de la matière
- Décrire les caractéristiques des phases de la matière au niveau moléculaire ou atomique
- Distinguer les matériaux compressibles et incompressibles
- Définir la densité et ses unités SI associées
- Comparer et contraster les densités de différentes substances
- Définir la pression et ses unités SI associées
- Expliquer la relation entre la pression et la force
- Calculer la force selon la pression et la surface
La matière existe le plus souvent sous forme solide, liquide ou gazeuse ; ces états sont connus sous le nom de trois phases communes de la matière. Nous examinerons chacune de ces phases en détail dans cette section.
Caractéristiques des solides
Les solides sont rigides et ont des formes spécifiques et des volumes définis. Les atomes ou les molécules d'un solide sont très proches les uns des autres et il existe une force significative entre ces molécules. Les solides prendront une forme déterminée par la nature de ces forces entre les molécules. Bien que les solides véritables ne soient pas incompressibles, ils nécessitent néanmoins une force importante pour modifier la forme d'un solide. Dans certains cas, la force entre les molécules peut amener les molécules à s'organiser en un réseau, comme le montre la figure\(\PageIndex{1}\). La structure de ce réseau tridimensionnel est représentée par des molécules reliées par des liaisons rigides (modélisées sous forme de ressorts rigides), qui permettent une liberté de mouvement limitée. Même une force importante ne produit que de petits déplacements dans les atomes ou les molécules du réseau, et le solide conserve sa forme. Les solides résistent également aux forces de cisaillement. (Les forces de cisaillement sont des forces appliquées tangentiellement à une surface, comme décrit dans Équilibre statique et élasticité.)
Caractéristiques des fluides
Les liquides et les gaz sont considérés comme des fluides parce qu'ils cèdent aux forces de cisaillement, alors que les solides y résistent. Comme les solides, les molécules d'un liquide sont liées aux molécules voisines, mais possèdent beaucoup moins de ces liaisons. Les molécules d'un liquide ne sont pas bloquées en place et peuvent se déplacer les unes par rapport aux autres. La distance entre les molécules est similaire à celle d'un solide, de sorte que les liquides ont des volumes définis, mais la forme d'un liquide change en fonction de la forme de son contenant. Les gaz ne sont pas liés aux atomes voisins et peuvent présenter de grandes séparations entre les molécules. Les gaz n'ont ni formes ni volumes spécifiques, car leurs molécules se déplacent pour remplir le récipient dans lequel ils sont contenus (Figure\(\PageIndex{1}\)).
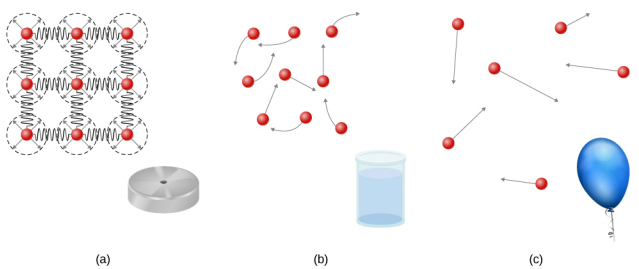
Les liquides se déforment facilement lorsqu'ils sont sollicités et ne reprennent pas leur forme initiale une fois qu'une force est supprimée. Cela se produit parce que les atomes ou les molécules d'un liquide sont libres de glisser et de changer de voisins. C'est-à-dire que les liquides s'écoulent (ils constituent donc un type de fluide), les molécules étant maintenues ensemble par attraction mutuelle. Lorsqu'un liquide est placé dans un récipient sans couvercle, il reste dans le récipient. Comme les atomes sont serrés, les liquides, comme les solides, résistent à la compression ; une force extrêmement importante est nécessaire pour modifier le volume d'un liquide.
En revanche, les atomes des gaz sont séparés par de grandes distances et les forces entre les atomes d'un gaz sont donc très faibles, sauf lorsque les atomes entrent en collision les uns avec les autres. Cela rend les gaz relativement faciles à comprimer et leur permet de s'écouler (ce qui en fait des fluides). Lorsqu'ils sont placés dans un récipient ouvert, les gaz, contrairement aux liquides, s'échappent.
Dans ce chapitre, nous désignons généralement les gaz et les liquides simplement comme des fluides, en les distinguant uniquement lorsqu'ils se comportent différemment. Il existe une autre phase de la matière, le plasma, qui existe à des températures très élevées. À des températures élevées, les molécules peuvent se dissocier en atomes, et les atomes se dissocient en électrons (avec des charges négatives) et en protons (avec des charges positives), formant ainsi un plasma. Le plasma ne sera pas abordé en profondeur dans ce chapitre car le plasma possède des propriétés très différentes de celles des trois autres phases courantes de la matière, abordées dans ce chapitre, en raison des fortes forces électriques entre les charges.
Densité
Supposons qu'un bloc de laiton et un bloc de bois aient exactement la même masse. Si les deux blocs tombent dans un réservoir d'eau, pourquoi le bois flotte-t-il et le laiton s'enfonce-t-il (Figure\(\PageIndex{2}\)) ? Cela se produit parce que le laiton a une densité supérieure à celle de l'eau, alors que le bois a une densité inférieure à celle de l'eau.

La densité est une caractéristique importante des substances. Il est crucial, par exemple, pour déterminer si un objet coule ou flotte dans un fluide.
La densité moyenne d'une substance ou d'un objet est définie comme sa masse par unité de volume,
\[\rho = \frac{m}{V} \label{14.1}\]
où la lettre grecque\(\rho\) (rho) est le symbole de la densité, m est la masse et V est le volume.
L'unité de densité SI est le kg/m 3. Le tableau 14.1 présente certaines valeurs représentatives. L'unité de densité cgs est le gramme par centimètre cube, g/cm 3, où
\[1\; g/cm^{3} = 1000\; kg/m^{3} \ldotp\]
Le système métrique a été initialement conçu pour que l'eau ait une densité de 1 g/cm 3, soit 103 kg/m 3. Ainsi, l'unité de masse de base, le kilogramme, a d'abord été conçue pour être la masse de 1 000 ml d'eau, qui a un volume de 1 000 cm 3.
Tableau 14.1 - Densités de certaines substances courantes
| Solides | (0.0 °C) | liquides | (0.0 °C) | Gaz | (0.0 °C, 101.3 kPa) |
|---|---|---|---|---|---|
| Substance | \(\rho\)(kg/m 3) | Substance | \(\rho\)(kg/m 3) | Substance | \(\rho\)(kg/m 3) |
| Aluminium | 2,70 x 10 3 | Benzène | 8,79 x 10 2 | Air | 1,29 x 10 0 |
| Os | 1,90 x 10 3 | Du sang | 1,05 x 10 3 | Dioxyde de carbone | 1,98 x 10 0 |
| Laiton | 8,44 x 10 3 | Alcool éthylique | 8,06 x 10 2 | Monoxyde de carbone | 1,25 x 10 0 |
| béton | 2,40 x 10 3 | Essence | 6,80 x 10 2 | Hélium | 1,80 x 10 -1 |
| Cuivre | 8,92 x 10 3 | Glycérine | 1,26 x 10 3 | Hydrogène | 9,00 x 10 -2 |
| Liège | 2,40 x 10 2 | Mercure | 1,36 x 10 4 | Du méthane | 7,20 x 10 -2 |
| Croûte terrestre | 3,30 x 10 3 | Huile d'olive | 9,20 x 10 2 | azote | 1,25 x 10 0 |
| Verre | 2,60 x 10 3 | Oxyde d'azote | 1,98 x 10 0 | ||
| Granit | 2,70 x 10 3 | L'oxygène | 1,43 x 10 0 | ||
| Fer | 7,86 x 10 3 | ||||
| plomb | 1,13 x 10 4 | ||||
| Chêne | 7,10 x 10 2 | ||||
| Pin | 3,73 x 10 2 | ||||
| Platine | 2,14 x 10 4 | ||||
| Polystyrène | 1,00 x 10 2 | ||||
| Tung | 1,93 x 10 4 | ||||
| L'uranium | 1,87 x 10 3 |
Comme vous pouvez le constater en examinant le tableau 14.1, la densité d'un objet peut aider à identifier sa composition. La densité de l'or, par exemple, est environ 2,5 fois la densité du fer, soit environ 2,5 fois la densité de l'aluminium. La densité révèle également quelque chose sur la phase de la matière et sa sous-structure. Notez que les densités des liquides et des solides sont à peu près comparables, ce qui indique que leurs atomes sont en contact étroit. Les densités des gaz sont bien inférieures à celles des liquides et des solides, car les atomes des gaz sont séparés par de grandes quantités d'espace vide. Les gaz sont affichés à une température standard de 0,0 °C et à une pression standard de 101,3 kPa, et les densités dépendent fortement de la température et de la pression. Les densités des solides et des liquides affichées sont données pour la température standard de 0,0 °C et les densités des solides et des liquides dépendent de la température. La densité des solides et des liquides augmente normalement avec la baisse de la température.
Le tableau 14.2 montre la densité de l'eau dans différentes phases et à différentes températures. La densité de l'eau augmente avec la baisse de la température, atteignant un maximum à 4,0 °C, puis diminue lorsque la température descend en dessous de 4,0 °C. Ce comportement de la densité de l'eau explique pourquoi la glace se forme au sommet d'un plan d'eau.
Tableau 14.2 - Densités de l'eau
| Substance | \(\rho\)(kg/m 3) |
|---|---|
| Glace (0 °C) | \ (\ rho \) (kg/m3) » style="text-align:center ; » class="lt-phys-4055">9,17 x 10 2 |
| Eau (0 °C) | \ (\ rho \) (kg/m3) » style="text-align:center ; » class="lt-phys-4055">9,998 x 10 2 |
| Eau (4 °C) | \ (\ rho \) (kg/m3) » style="text-align:center ; » class="lt-phys-4055">1 000 x 10 3 |
| Eau (20 °C) | \ (\ rho \) (kg/m3) » style="text-align:center ; » class="lt-phys-4055">9,982 x 10 2 |
| Eau (100 °C) | \ (\ rho \) (kg/m3) » style="text-align:center ; » class="lt-phys-4055">9,584 x 10 2 |
| Vapeur (100 °C, 101,3 kPa) | \ (\ rho \) (kg/m3) » style="text-align:center ; » class="lt-phys-4055">1,670 x 10 2 |
| Eau de mer (0°C) | \ (\ rho \) (kg/m3) » style="text-align:center ; » class="lt-phys-4055">1,030 x 10 3 |
La densité d'une substance n'est pas nécessairement constante dans tout le volume d'une substance. Si la densité est constante dans l'ensemble d'une substance, on dit que la substance est une substance homogène. Une barre de fer solide est un exemple de substance homogène. La densité est constante partout et la densité de tout échantillon de la substance est identique à sa densité moyenne. Si la densité d'une substance n'est pas constante, on dit que la substance est une substance hétérogène. Un morceau de fromage suisse est un exemple de matière hétérogène contenant à la fois du fromage solide et des vides remplis de gaz. La densité à un emplacement spécifique au sein d'un matériau hétérogène est appelée densité locale et est donnée en fonction de l'emplacement,\(\rho\) =\(\rho\) (x, y, z) (Figure\(\PageIndex{3}\)).
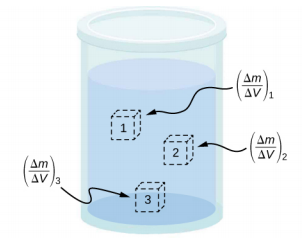
La densité locale peut être obtenue par un procédé de limitation, sur la base de la densité moyenne dans un petit volume autour du point en question, en prenant la limite où la taille du volume approche de zéro,
\[\rho = \lim_{\Delta V \rightarrow 0} \frac{\Delta m}{\Delta V} \label{14.2}\]
où\(\rho\) est la densité, m est la masse et V est le volume.
Comme les gaz sont libres de se dilater et de se contracter, leurs densités varient considérablement avec la température, tandis que les densités des liquides varient peu avec la température. Par conséquent, les densités des liquides sont souvent considérées comme constantes, la densité étant égale à la densité moyenne.
La densité est une propriété dimensionnelle ; par conséquent, lors de la comparaison des densités de deux substances, les unités doivent être prises en compte. Pour cette raison, une quantité sans dimension plus pratique, appelée gravité spécifique, est souvent utilisée pour comparer les densités. La gravité spécifique est définie comme le rapport entre la densité du matériau et la densité de l'eau à 4,0 °C et une atmosphère de pression, soit 1 000 kg/m 3 :
\[Specific\; gravity = \frac{Density\; of\; material}{Density\; of\; water} \ldotp\]
La comparaison utilise de l'eau car la densité de l'eau est de 1 g/cm 3, qui était initialement utilisée pour définir le kilogramme. La gravité spécifique, étant sans dimension, permet une comparaison facile entre les matériaux sans avoir à se soucier de l'unité de densité. Par exemple, la densité de l'aluminium est de 2,7 en g/cm 3 (2 700 en kg/m 3), mais sa densité est de 2,7, quelle que soit l'unité de densité. La gravité spécifique est une quantité particulièrement utile en ce qui concerne la flottabilité, dont nous parlerons plus loin dans ce chapitre.
Pression
Vous avez sans doute entendu le mot « pression » utilisé en relation avec le sang (pression artérielle élevée ou basse) et en relation avec les conditions météorologiques (systèmes météorologiques à haute et basse pression). Ce ne sont là que deux exemples parmi tant d'autres de pression dans les fluides. (Rappelons que nous avons introduit l'idée de pression dans l'équilibre statique et l'élasticité, dans le contexte des contraintes et des déformations globales.)
La pression (p) est définie comme la force normale F par unité de surface A sur laquelle la force est appliquée, ou
\[p = \frac{F}{A} \ldotp \label{14.3}\]
Pour définir la pression en un point spécifique, la pression est définie comme la force dF exercée par un fluide sur un élément infinitésimal de la zone dA contenant le point, résultant en p =\(\frac{dF}{dA}\).
Une force donnée peut avoir un effet très différent, en fonction de la zone sur laquelle elle est exercée. Par exemple, une force appliquée sur une zone de 1 mm 2 a une pression 100 fois supérieure à la même force appliquée sur une zone de 1 cm 2. C'est pourquoi une aiguille pointue peut percer la peau lorsqu'une petite force est exercée, mais appliquer la même force avec un doigt ne perfore pas la peau (Figure\(\PageIndex{4}\)).
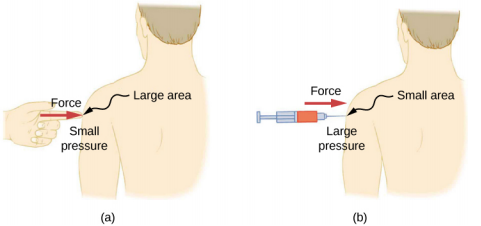
Notez que bien que la force soit un vecteur, la pression est un scalaire. La pression est une quantité scalaire car elle est définie comme étant proportionnelle à l'amplitude de la force agissant perpendiculairement à la surface. L'unité SI pour la pression est le pascal (Pa), du nom du mathématicien et physicien français Blaise Pascal (1623—1662), où
\[1\; Pa = 1\; N/m^{2} \ldotp\]
Plusieurs autres unités sont utilisées pour la pression, dont nous parlerons plus loin dans le chapitre.


