4.6 : Le cycle de Carnot
- Page ID
- 191130
À la fin de cette section, vous serez en mesure de :
- Décrire le cycle de Carnot avec les rôles des quatre processus impliqués
- Décrire le principe Carnot et ses implications
- Démontrer l'équivalence entre le principe de Carnot et la deuxième loi de la thermodynamique
Au début des années 1820, Sadi Carnot (1786-1832), ingénieur français, s'est intéressé à l'amélioration de l'efficacité des moteurs thermiques pratiques. En 1824, ses études l'ont amené à proposer un cycle de travail hypothétique avec la plus grande efficacité possible entre les deux mêmes réservoirs, connu aujourd'hui sous le nom de cycle de Carnot. Un moteur fonctionnant dans ce cycle est appelé moteur Carnot. Le cycle de Carnot revêt une importance particulière pour diverses raisons. Sur le plan pratique, ce cycle représente un modèle réversible pour la centrale à vapeur et le réfrigérateur ou la pompe à chaleur. Cependant, elle est également très importante théoriquement, car elle joue un rôle majeur dans le développement d'un autre énoncé important de la deuxième loi de la thermodynamique. Enfin, comme seuls deux réservoirs sont impliqués dans son fonctionnement, il peut être utilisé avec la deuxième loi de la thermodynamique pour définir une échelle de température absolue réellement indépendante de toute substance utilisée pour la mesure de la température.
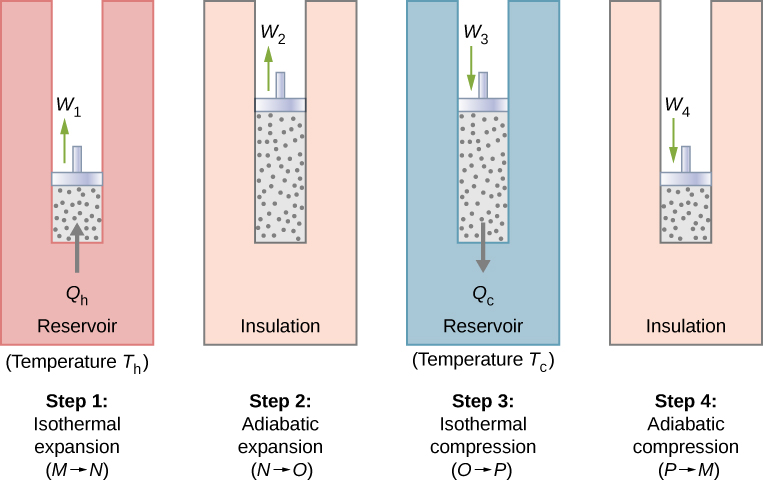
Avec un gaz idéal comme substance active, les étapes du cycle de Carnot, telles que représentées par la figure\(\PageIndex{1}\), sont les suivantes.
- Expansion isotherme. Le gaz est mis en contact thermique avec un réservoir de chaleur à une certaine température\(T_h\). Le gaz absorbe la chaleur\(Q_h\) du réservoir de chaleur et peut se dilater de manière isotherme pendant le travail\(W_1\). Comme l'énergie interne\(E_{int}\) d'un gaz idéal est fonction de la température uniquement, la variation de l'énergie interne est nulle, c'est-à-dire\(\Delta E_{int} = 0\) lors de cette expansion isotherme. Avec la première loi de la thermodynamique\(\Delta E_{int} = Q - W\), nous trouvons que la chaleur absorbée par le gaz est\[Q_h = W_1 = nRT_h \ln \dfrac{V_N}{V_M}.\]
- Expansion adiabatique. Le gaz est isolé thermiquement et on le laisse se dilater davantage en travaillant\(W_2\). Comme cette dilatation est adiabatique, la température du gaz baisse, dans ce cas, de\(T_h\) à\(T_c\). À partir de\(pV^{\gamma} = constant\) et de l'équation d'état pour un gaz idéal\(pV = nRT\), nous avons fait en\[TV^{\gamma - 1} = constant,\] sorte que\[T_hV_N^{\gamma - 1} = T_cV_O^{\gamma - 1}.\]
- Compression isotherme Le gaz est mis en contact thermique avec un réservoir froid à température\(T_c\) et comprimé de manière isotherme. Au cours de ce processus,\(W_3\) on travaille sur le gaz qui cède de la chaleur\(Q_c\) au réservoir froid. Le raisonnement utilisé à l'étape 1 permet maintenant de\[Q_c = nRT_c \ln \dfrac{V_O}{V_p},\] savoir où\(Q_c\) se trouve la chaleur déversée dans le réservoir froid par le gaz.
- Compression adiabatique. Le gaz est isolé thermiquement et ramené à son état initial par compression. Dans ce processus, on\(W_4\) travaille sur le gaz. Comme la compression est adiabatique, la température du gaz augmente, de\(T_c\) à\(T_h\) dans ce cas précis. Le raisonnement de l'étape 2 donne maintenant :\[T_cV_p^{\gamma - 1} = T_hV_M^{\gamma - 1}.\] Le travail total effectué par le gaz dans le cycle de Carnot est donné par\[W = W_1 + W_2 - W_3 - W_4.\]
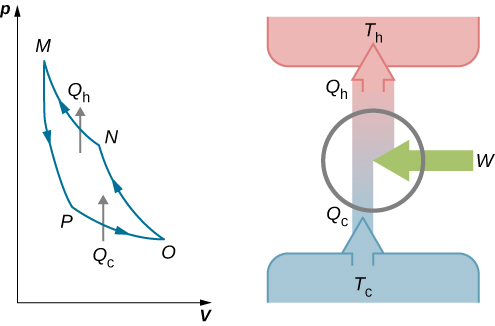
Ce travail est égal à la surface délimitée par la boucle illustrée sur le diagramme pV de la figure\(\PageIndex{2}\). Comme les états initial et final du système sont les mêmes, la variation de l'énergie interne du gaz dans le cycle doit être nulle, c'est-à-dire\(\Delta E_{int} = 0\). La première loi de la thermodynamique donne alors\[W = Q - \Delta E_{int} = (Q_h - Q_c) - 0,\] et\[W = Q_h - Q_c\].
Pour connaître l'efficacité de ce moteur, on divise d'abord\(Q_c\) par\(Q_h\) :
\[\dfrac{Q_c}{Q_h} = \dfrac{T_c}{T_h} \dfrac{\ln V_O/V_P}{\ln V_N?V_M}.\]
Lorsque la constante adiabatique de l'étape 2 est divisée par celle de l'étape 4, on trouve
\[\dfrac{V_O}{V_P} = \dfrac{V_N}{V_M}.\]
En remplaçant cela dans l'équation par\(Q_c/Q_h\), nous obtenons
\[\dfrac{Q_c}{Q_h} = \dfrac{T_c}{T_h}.\]
Enfin, avec l'équation 4.3.6, nous constatons que l'efficacité de ce moteur Carnot à essence idéal est donnée par
\[e = 1 - \dfrac{T_c}{T_h}.\]
Un moteur ne doit pas nécessairement suivre un cycle moteur Carnot. Tous les moteurs ont cependant le même effet net, à savoir l'absorption de la chaleur d'un réservoir chaud, la production de travail et l'évacuation de la chaleur vers un réservoir froid. Cela nous amène à nous poser la question suivante : est-ce que tous les cycles réversibles fonctionnant entre les deux mêmes réservoirs ont la même efficacité ? La réponse à cette question provient de la deuxième loi de la thermodynamique évoquée précédemment : tous les cycles de moteurs réversibles produisent exactement le même rendement. De plus, comme on peut s'y attendre, tous les moteurs réels fonctionnant entre deux réservoirs sont moins efficaces que les moteurs réversibles fonctionnant entre les deux mêmes réservoirs. Ceci est également une conséquence de la deuxième loi de la thermodynamique présentée précédemment.
Le cycle d'un réfrigérateur Carnot à gaz idéal est représenté par le diagramme pV de la Figure\(\PageIndex{3}\). Il s'agit d'un moteur Carnot fonctionnant en sens inverse. Le réfrigérateur extrait la chaleur\(Q_c\) d'un réservoir à température froide\(T_c\) lorsque le gaz idéal se détend de manière isotherme. Le gaz est ensuite comprimé adiabatiquement jusqu'à ce que sa température atteigne\(T_h\), après quoi une compression isotherme du gaz entraîne le\(Q_h\) rejet de la chaleur vers un réservoir à haute température à\(T_h\). Enfin, le cycle est complété par une détente adiabatique du gaz, faisant chuter sa température à\(T_c\).

Le travail effectué sur le gaz idéal est égal à la surface délimitée par le trajet du diagramme pV. Dès la première loi, cette œuvre est donnée par
\[W = Q_h - Q_c.\]
Une analyse, comme celle réalisée pour le moteur Carnot, donne
\[\dfrac{Q_c}{T_c} = \dfrac{Q_h}{T_h}.\]
Combiné à l'équation 4.4.1, cela donne
\[K_R = \dfrac{T_c}{T_h - T_c}\]
pour le coefficient de performance du réfrigérateur Carnot au gaz idéal. De même, nous pouvons calculer le coefficient de performance d'une pompe à chaleur Carnot comme
\[K_P = \dfrac{Q_h}{Q_h - Q_c} = \dfrac{T_h}{T_h - T_c}.\]
Nous venons de trouver des équations représentant l'efficacité d'un moteur Carnot et le coefficient de performance d'un réfrigérateur Carnot ou d'une pompe à chaleur Carnot, en supposant un gaz idéal pour la substance active des deux appareils. Cependant, ces équations sont plus générales que ne le laissent entendre leurs dérivations. Nous allons bientôt montrer qu'ils sont tous deux valides, quelle que soit la substance active.
Carnot a résumé son étude du moteur Carnot et du cycle de Carnot dans ce que l'on appelle aujourd'hui le principe de Carnot :
Aucun moteur fonctionnant entre deux réservoirs à température constante ne peut avoir un rendement supérieur à celui d'un moteur réversible.
Ce principe peut être considéré comme un autre énoncé de la deuxième loi de la thermodynamique et il peut être démontré qu'il est équivalent à l'énoncé de Kelvin et à l'énoncé de Clausius.
Un moteur Carnot a un rendement de 0,60 et la température de son réservoir froid est de 300 K. (a) Quelle est la température du réservoir chaud ? b) Si le moteur effectue 300 J de travail par cycle, quelle quantité de chaleur est évacuée du réservoir à haute température par cycle ? c) Quelle quantité de chaleur est évacuée vers le réservoir à basse température par cycle ?
Stratégie
À partir de la dépendance à la température de l'efficacité thermique du moteur Carnot, nous pouvons déterminer la température du réservoir chaud. Ensuite, à partir de la définition du rendement, nous pouvons trouver la chaleur évacuée lorsque le travail effectué par le moteur est donné. Enfin, les économies d'énergie détermineront la quantité de chaleur qui doit être déversée dans le réservoir froid.
Solution
- \(e = 1 - T_c/T_h\)Nous avons fait en\[0.60 = 1 - \dfrac{300 \, K}{T_h},\] sorte que la température du réservoir chaud soit\[T_h = \dfrac{300 \, K}{1 - 0.60} = 750 \, K.\]
- Par définition, l'efficacité du moteur est\(e = W/Q\) telle que la chaleur retirée du réservoir à haute température par cycle est\[Q_h = \dfrac{W}{e} = \dfrac{300 \, J}{0.60} = 500 \, J.\]
- Selon la première loi, la chaleur évacuée vers le réservoir à basse température par cycle par le moteur est\[Q_c = Q_h - W = 500 \, J - 300 \, J = 200 \, J.\]
L'importance
Un moteur Carnot a l'efficacité maximale possible pour convertir la chaleur en travail entre deux réservoirs, mais cela ne signifie pas nécessairement qu'il est\(100\%\) efficace. À mesure que la différence de température entre le réservoir chaud et le réservoir froid augmente, l'efficacité d'un moteur Carnot augmente.
Imaginez qu'une pompe à chaleur Carnot fonctionne entre une température extérieure\(0^oC\) et une température intérieure de\(20.0^oC\). Quels sont les travaux nécessaires si la chaleur délivrée à l'intérieur de la maison est de 30,0 kJ ?
Stratégie
Comme la pompe à chaleur est supposée être une pompe Carnot, son coefficient de performance est donné par\(K_P = Q_h/W = T_h/(T_h - T_c)\). Ainsi, on peut trouver le travail W à partir de la chaleur délivrée\(Q_h\).
Solution
Le travail nécessaire est obtenu auprès de
\[W = Q_h/K_P = Q_h(T_h - T_c)/T_h = 30 \, kJ \times (293 \, K - 273 \, K)/293 \, K = 2 \, kJ. \nonumber\]
L'importance
Nous notons que ces travaux dépendent non seulement de la chaleur fournie à la maison mais également des températures extérieures et intérieures. La dépendance à la température extérieure rend leur utilisation peu pratique dans des zones où la température extérieure est beaucoup plus froide que la température ambiante.
En termes de coûts énergétiques, la pompe à chaleur est un moyen très économique pour chauffer les bâtiments (Figure\(\PageIndex{4}\)). Comparez cette méthode à la transformation directe de l'énergie électrique en chaleur à l'aide d'éléments chauffants résistifs. Dans ce cas, une unité d'énergie électrique fournit au plus une seule unité de chaleur. Malheureusement, les pompes à chaleur présentent des problèmes qui limitent leur utilité. Ils sont assez chers à l'achat par rapport aux éléments chauffants résistifs et, comme le montre le coefficient de performance d'une pompe à chaleur Carnot, ils perdent en efficacité à mesure que la température extérieure baisse. En effet, en dessous d'environ\(-10^oC\), la chaleur qu'ils fournissent est inférieure à l'énergie utilisée pour les faire fonctionner.

Un moteur Carnot fonctionne entre des réservoirs à\(400^oC\) et\(30^oC\).
- Quelle est l'efficacité du moteur ?
- Si le moteur effectue 5,0 J de travail par cycle, quelle quantité de chaleur par cycle absorbe-t-il par le réservoir à haute température ?
- Quelle quantité de chaleur par cycle est évacuée vers le réservoir à température froide ?
- Quelles températures au réservoir de froid donneraient l'efficacité minimale et maximale ?
- Répondez à une
-
\(e = 1 - T_c/T_h = 0.55\)
- Réponse b
-
\(Q_h = eW = 9.1 \, J\)
- Réponse c
-
\(Q_c = Q_h - W = 4.1 \, J\)
- Réponse d
-
\(-273^oC\)et\(400^oC\)
Un réfrigérateur Carnot fonctionne entre deux réservoirs de chaleur dont les températures sont\(0^oC\) et\(25^oC\).
- Quel est le coefficient de performance du réfrigérateur ?
- Si 200 J de travail sont effectués sur la substance active par cycle, quelle quantité de chaleur par cycle est extraite du réservoir de froid ?
- Quelle quantité de chaleur par cycle est rejetée dans le réservoir d'eau chaude ?
- Répondez à une
-
\(K_R = T_c/(T_h - T_c) = 10.9\)
- Réponse b
-
\(Q_c = K_RW = 2.18 \, kJ\)
- Réponse c
-
\(Q_h = Q_c + W = 2.38 \, kJ\)


