9.6 : Théorie des bandes pour les solides
- Page ID
- 189511
À la fin de cette section, vous serez en mesure de :
- Décrire deux approches principales pour déterminer les niveaux d'énergie d'un électron dans un cristal
- Expliquer la présence de bandes et de lacunes énergétiques dans la structure énergétique d'un cristal
- Expliquez pourquoi certains matériaux sont de bons conducteurs et d'autres sont de bons isolants
- Différencier un isolant d'un semi-conducteur
Le modèle à électrons libres explique de nombreuses propriétés importantes des conducteurs, mais il est faible dans au moins deux domaines. Tout d'abord, il suppose une énergie potentielle constante à l'intérieur du solide. (Rappelez-vous qu'une énergie potentielle constante est associée à l'absence de forces.) La figure\(\PageIndex{1}\) compare l'hypothèse d'une énergie potentielle constante (ligne pointillée) avec le potentiel de Coulomb périodique, qui diminue\(-1/r\) à chaque point du réseau, où r est la distance depuis le noyau ionique (ligne continue). Deuxièmement, le modèle à électrons libres suppose une barrière impénétrable à la surface. Cette hypothèse n'est pas valide, car dans certaines conditions, les électrons peuvent s'échapper de la surface, par exemple lors de l'effet photoélectrique. Outre ces hypothèses, le modèle à électrons libres n'explique pas les différences spectaculaires entre les propriétés électroniques des conducteurs, des semi-conducteurs et des isolants. Par conséquent, un modèle plus complet est nécessaire.
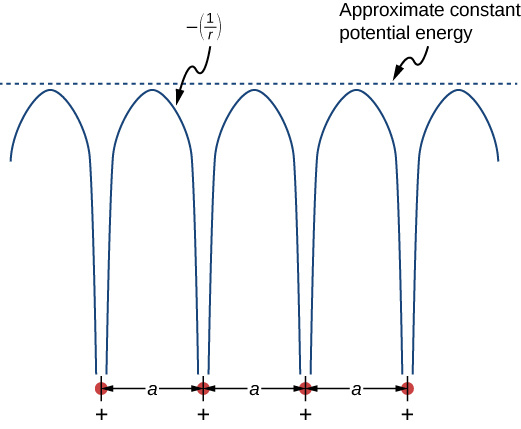
Nous pouvons produire un modèle amélioré en résolvant l'équation de Schrödinger pour le potentiel périodique illustré à la Figure\(\PageIndex{1}\). Cependant, la solution nécessite des mathématiques techniques bien au-delà de notre portée. Nous cherchons à nouveau un argument qualitatif basé sur la mécanique quantique pour trouver une voie à suivre.
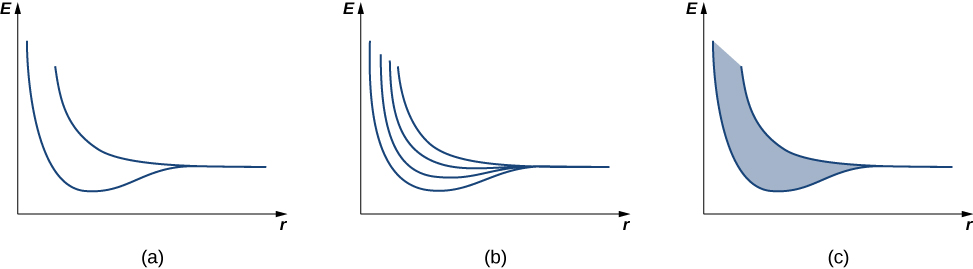
Nous passons d'abord en revue l'argument utilisé pour expliquer la structure énergétique d'une liaison covalente. Considérez deux atomes d'hydrogène identiques si éloignés qu'il n'y a aucune interaction entre eux. Supposons en outre que l'électron de chaque atome se trouve dans le même état fondamental : un électron de 1 s avec une énergie de\(-13.6 \, eV\) (ignorer le spin). Lorsque les atomes d'hydrogène sont rapprochés, les fonctions d'onde individuelles des électrons se chevauchent et, selon le principe d'exclusion, ne peuvent plus être dans le même état quantique, ce qui divise les niveaux d'énergie équivalents d'origine en deux niveaux d'énergie différents. Les énergies de ces niveaux dépendent de la distance interatomique\(a\) (Figure\(\PageIndex{2a}\)).
Si quatre atomes d'hydrogène sont réunis, quatre niveaux se forment à partir des quatre symétries possibles : une seule « bosse » sinusoïdale dans chaque puits, alternant de haut en bas, et ainsi de suite. Dans la limite d'un très grand nombre N d'atomes, nous nous attendons à un étalement de bandes presque continues de niveaux d'énergie électronique dans un solide (Figure\(\PageIndex{2c}\)). Chacune de ces bandes est connue sous le nom de bande énergétique. (Les états d'énergie et de nombre d'ondes autorisés sont encore techniquement quantifiés, mais pour un grand nombre d'atomes, ces états sont si proches les uns des autres qu'ils sont considérés comme continus ou « dans le continuum ».)
Les bandes d'énergie diffèrent quant au nombre d'électrons qu'elles contiennent. Dans les bandes d'énergie de 1 s et 2 s, chaque niveau d'énergie contient jusqu'à deux électrons (spin up et spin down), de sorte que cette bande a une occupation maximale de 2 N électrons. Dans la bande d'énergie 2 p, chaque niveau d'énergie contient jusqu'à six électrons, de sorte que cette bande a une occupation maximale de 6 électrons N (Figure\(\PageIndex{3}\)).

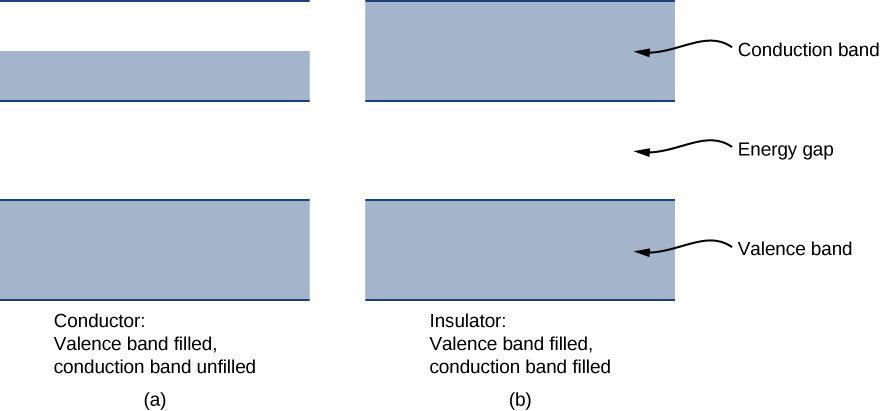
Chaque bande d'énergie est séparée de l'autre par un espace d'énergie. Les propriétés électriques des conducteurs et des isolants peuvent être comprises en termes de bandes d'énergie et de lacunes. La bande d'énergie la plus élevée qui est remplie est connue sous le nom de bande de valence. La bande disponible suivante dans la structure énergétique est connue sous le nom de bande de conduction. Dans un conducteur, la bande d'énergie la plus élevée contenant des électrons est partiellement remplie, tandis que dans un isolant, la bande d'énergie la plus élevée contenant des électrons est complètement remplie. La différence entre un conducteur et un isolant est illustrée sur la figure\(\PageIndex{4}\).
Un conducteur diffère d'un isolant par la façon dont ses électrons réagissent à un champ électrique appliqué. Si un nombre important d'électrons sont mis en mouvement par le champ, le matériau est conducteur. En termes de modèle de bande, les électrons de la bande de conduction partiellement remplie gagnent de l'énergie cinétique à partir du champ électrique en remplissant des états d'énergie plus élevés dans la bande de conduction. Par contre, dans un isolant, les électrons appartiennent à des bandes complètement remplies. Lorsque le champ est appliqué, les électrons ne peuvent pas effectuer de telles transitions (acquérir de l'énergie cinétique à partir du champ électrique) en raison du principe d'exclusion. Par conséquent, le matériau ne conduit pas l'électricité.
Visitez cette simulation pour en savoir plus sur l'origine des bandes d'énergie dans les cristaux d'atomes et sur la façon dont la structure des bandes détermine la façon dont un matériau conduit l'électricité. Découvrez comment la structure en bandes crée un réseau de nombreux puits.
Un semi-conducteur possède une structure énergétique similaire à celle d'un isolant, sauf qu'il présente un écart énergétique relativement faible entre la bande complètement remplie la plus basse et la bande vide disponible suivante. Ce type de matériau constitue la base de l'électronique moderne. At\(T = 0 \, K\), le semi-conducteur et l'isolant ont tous deux des bandes complètement remplies. La seule différence réside dans la taille de l'écart énergétique (ou bande interdite) E g entre la bande d'énergie la plus élevée qui est remplie (la bande de valence) et la bande vide supérieure suivante (la bande de conduction). Dans un semi-conducteur, cet espace est suffisamment petit pour qu'un nombre important d'électrons de la bande de valence soient excités thermiquement dans la bande de conduction à température ambiante. Ces électrons se trouvent alors dans une bande presque vide et peuvent répondre à un champ appliqué. En règle générale, la bande interdite d'un semi-conducteur est d'environ 1 eV. (Tableau\(\PageIndex{1}\) pour le silicium.) Une bande interdite supérieure à environ 1 eV est considérée comme un isolant. À titre de comparaison, l'écart énergétique du diamant (un isolant) est de plusieurs électronvolts.
| Matériau | Déficit énergétique\(E_g(eV)\) |
|---|---|
| Monsieur | \ (E_g (eV) \) » style="text-align:center ; » class="lt-phys-4545">1,14 |
| Ge | \ (E_g (eV) \) » style="text-align:center ; » class="lt-phys-4545">0,67 |
| GaAs | \ (E_g (eV) \) » style="text-align:center ; » class="lt-phys-4545">1,43 |
| GAP | \ (E_g (eV) \) » style="text-align:center ; » class="lt-phys-4545">2,26 |
| Gaz B | \ (E_g (eV) \) » style="text-align:center ; » class="lt-phys-4545">0,69 |
| InAS | \ (E_g (eV) \) » style="text-align:center ; » class="lt-phys-4545">0,35 |
| InP | \ (E_g (eV) \) » style="text-align:center ; » class="lt-phys-4545">1,35 |
| En SB | \ (E_g (eV) \) » style="text-align:center ; » class="lt-phys-4545">0,16 |
| C (diamant) | \ (E_g (eV) \) » style="text-align:center ; » class="lt-phys-4545">5,48 |


