9.4 : Liaison dans des solides cristallins
- Page ID
- 189562
À la fin de cette section, vous serez en mesure de :
- Décrire les structures d'emballage des solides courants
- Expliquer la différence entre la liaison dans un solide et dans une molécule
- Déterminer la distance de séparation d'équilibre en fonction des propriétés des cristaux
- Déterminer l'énergie de dissociation d'un sel en fonction de ses propriétés cristallines
À partir de cette section, nous étudions les solides cristallins, qui sont constitués d'atomes disposés selon un schéma régulier étendu appelé réseau. Les solides qui ne forment pas ou ne peuvent pas former de cristaux sont classés comme solides amorphes. Bien que les solides amorphes (comme le verre) aient diverses applications technologiques intéressantes, ce chapitre se concentrera sur les solides cristallins.
Les atomes s'organisent en réseau pour former un cristal en raison d'une force d'attraction nette entre leurs électrons constitutifs et les noyaux atomiques. Les cristaux formés par la liaison d'atomes appartiennent à l'une des trois catégories suivantes, classées selon leur liaison : ioniques, covalents et métalliques. Les molécules peuvent également se lier entre elles pour former des cristaux ; ces liaisons, qui ne sont pas abordées ici, sont classées comme moléculaires. Au début du XXe siècle, le modèle atomique d'un solide était spéculatif. Nous avons maintenant des preuves directes de la présence d'atomes dans les solides (Figure\(\PageIndex{1}\)).
Liaison ionique dans les solides
De nombreux solides se forment par liaison ionique. Un exemple prototypique est le cristal de chlorure de sodium, comme nous l'avons vu précédemment. Les électrons passent des atomes de sodium aux atomes de chlore adjacents, car les électrons de valence du sodium sont faiblement liés et le chlore possède une grande affinité électronique. Les ions sodium chargés positivement et les ions chlore (chlorure) chargés négativement s'organisent en un réseau régulier étendu d'atomes (Figure\(\PageIndex{2}\)).
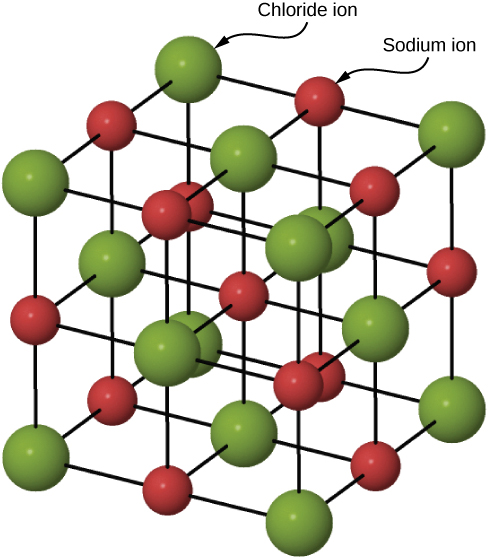
Les distributions de charge des ions sodium et chlorure sont sphériquement symétriques, et l'ion chlorure a environ deux fois le diamètre de l'ion sodium. L'arrangement énergétique le plus faible de ces ions est appelé structure cubique à face centrée (FCC). Dans cette structure, chaque ion est le plus proche de six ions des autres espèces. La cellule unitaire est un cube : un atome occupe le centre et les coins de chaque « face » du cube. L'énergie potentielle d'attraction de l'\(Na^+\)ion due aux champs de ces six\(Cl^-\) ions est écrite
\[U_1 = -6\frac{e^2}{4\pi \epsilon_0 r} \nonumber \]
où le signe moins désigne un potentiel attractif (et on l'identifie\(k = 1/4 \pi \epsilon_0\)). À une certaine distance\(\sqrt{2r}\) se trouvent ses voisins les plus proches : douze\(Na^+\) ions de même charge. L'énergie potentielle de répulsion totale associée à ces ions est
\[U_2 = 12\frac{e^2}{4\pi \epsilon_0\sqrt{2}r}. \nonumber \]
Les huit\(Cl^-\) ions les plus proches sont situés à une distance de 3√ r3r de l'\(Na^+\)ion. L'énergie potentielle de l'\(Na^+\)ion dans le champ de ces huit ions est
\[U_3 = -8\frac{e^2}{4\pi \epsilon_0 \sqrt{3}r}. \nonumber \]
En continuant de la même manière avec des ensembles alternatifs d'\(Na^+\)ions\(Cl^-\) et, nous constatons que l'énergie potentielle d'attraction nette\(U_A\) de l'\(Na^+\)ion unique peut être écrite comme
\[U_{coul} = - \alpha \frac{e^2}{4\pi \epsilon_0 r} \nonumber \]
où\(\alpha\) est la constante de Madelung, introduite plus tôt. À partir de cette analyse, nous pouvons voir que cette constante est la somme convergente infinie
\[\alpha = 6 - \frac{12}{sqrt{2}} + \frac{8}{\sqrt{3}} + . . . \nonumber \]
Les ions distants contribuent de manière significative à cette somme, de sorte que celle-ci converge lentement, et de nombreux termes doivent être utilisés pour calculer αα avec précision. Pour tous les solides ioniques FCC, αα est d'environ 1,75.
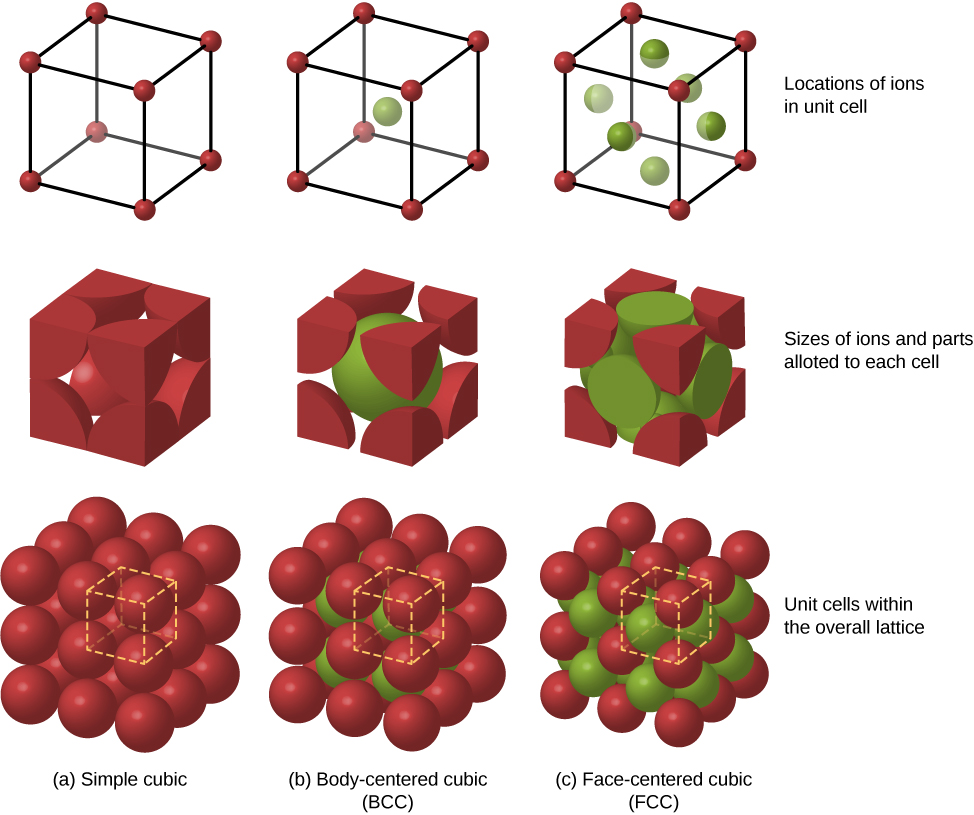
Parmi les autres arrangements d'emballage possibles des atomes dans les solides, citons le cubique simple et le cubique centré sur le corps (BCC). Ces trois structures d'emballage différentes pour les solides sont comparées dans la figure\(\PageIndex{3}\). La première ligne représente l'emplacement, mais pas la taille, des ions ; la deuxième ligne indique les cellules unitaires de chaque structure ou réseau ; et la troisième ligne représente l'emplacement et la taille des ions. La structure BCC possède huit voisins les plus proches, avec une constante de Madelung d'environ 1,76, légèrement différente de celle de la structure FCC. La détermination de la constante de Madelung pour des solides spécifiques est un travail difficile qui fait actuellement l'objet de recherches.
L'énergie des ions sodium n'est pas entièrement due aux forces d'attraction entre des ions de charge opposée. Si les ions sont achetés trop près les uns des autres, les fonctions d'onde des électrons centraux des ions se chevauchent et les électrons se repoussent en raison du principe d'exclusion. L'énergie potentielle totale de l'\(Na^+\)ion est donc la somme du potentiel de Coulomb attractif (\(U_{coul}\)) et du potentiel de répulsion associé au principe d'exclusion (\(U_{ex}\)). Le calcul de ce potentiel répugnant nécessite des ordinateurs puissants. Heureusement, cette énergie peut être décrite avec précision par une formule simple qui contient des paramètres ajustables :
\[U_{ex} = \frac{A}{r^n} \nonumber \]
où les paramètres A et n sont choisis pour donner des prédictions cohérentes avec les données expérimentales. Pour le problème posé à la fin de ce chapitre, le paramètre n est appelé constante de répulsion. L'énergie potentielle totale de l'\(Na^+\)ion est donc
\[U = -\alpha\frac{e^2}{4\pi \epsilon_0 r} + \frac{A}{r^n}. \nonumber \]
À l'équilibre, il n'y a pas de force nette sur l'ion, de sorte que la distance entre les\(Cl^-\) ions voisins\(Na^+\) et les ions doit être la valeur\(r_0\) pour laquelle U est le minimum. Réglage\(\frac{dU}{dr} = 0\), nous avons
\[0 = \frac{\alpha e^2}{4\pi \epsilon_0 r_0^2} - \frac{nA}{r_0^{n+1}}. \nonumber \]
Ainsi,
\[A = \frac{\alpha e^2 r_0^{n-1}}{4\pi \epsilon_0 n}. \nonumber \]
En insérant cette expression dans l'expression de l'énergie potentielle totale, nous avons
\[U = - \frac{\alpha e^2}{4\pi \epsilon_0 r_0} \left[\frac{r_0}{r} - \frac{1}{n}\left(\frac{r_0}{r}\right)^n \right]. \nonumber \]Notez que l'énergie potentielle totale n'a désormais qu'un seul paramètre ajustable, n. Le paramètre A a été remplacé par une fonction impliquant r0r0, la distance de séparation d'équilibre, qui peut être mesurée par une expérience de diffraction (vous avez découvert la diffraction dans un chapitre précédent). L'énergie potentielle totale est tracée dans la figure\(\PageIndex{4}\) for\(n = 0\), la valeur approximative de n pour le NaCl.
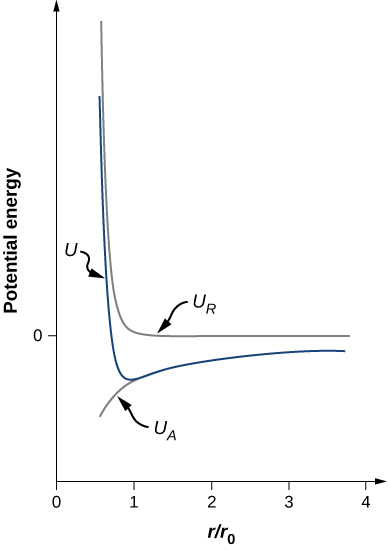
Tant que\(n > 1\), la courbe de U a la même forme générale : U s'approche de l'infini comme\(r \rightarrow 0\) et U s'approche de zéro comme\(r \rightarrow \infty\). La valeur minimale de l'énergie potentielle est donnée par
\[U_{min} (r = r_0) = -\alpha \frac{fe^2}{r_0}\left( 1 - \frac{1}{n}\right). \nonumber \]
L'énergie par paire d'ions nécessaire pour séparer le cristal en ions est donc
\[U_{diss} = \alpha \frac{ke^2}{r_0}\left(1 - \frac{1}{n}\right). \nonumber \]
Il s'agit de l'énergie de dissociation du solide. L'énergie de dissociation peut également être utilisée pour décrire l'énergie totale nécessaire pour décomposer une mole d'un solide en ions constitutifs, souvent exprimée en kJ/mole. L'énergie de dissociation peut être déterminée expérimentalement en utilisant la chaleur latente de vaporisation. Les valeurs d'échantillon sont données dans le tableau suivant.
| \(F^-\) | \(Cl^-\) | \(Br^-\) | \(I^-\) | |
|---|---|---|---|---|
| \(Li^+\) | \ (F^- \) » style="text-align:center ; » class="lt-phys-4543">1036 | \ (Cl^- \) » style="text-align:center ; » class="lt-phys-4543">853 | \ (Br^- \) » style="text-align:center ; » class="lt-phys-4543">807 | \ (I^- \) » style="text-align:center ; » class="lt-phys-4543">757 |
| \(Na^+\) | \ (F^- \) » style="text-align:center ; » class="lt-phys-4543">923 | \ (Cl^- \) » style="text-align:center ; » class="lt-phys-4543">787 | \ (Br^- \) » style="text-align:center ; » class="lt-phys-4543">747 | \ (I^- \) » style="text-align:center ; » class="lt-phys-4543">704 |
| \(K^+\) | \ (F^- \) » style="text-align:center ; » class="lt-phys-4543">821 | \ (Cl^- \) » style="text-align:center ; » class="lt-phys-4543">715 | \ (Br^- \) » style="text-align:center ; » class="lt-phys-4543">682 | \ (I^- \) » style="text-align:center ; » class="lt-phys-4543">649 |
| \(Rb^+\) | \ (F^- \) » style="text-align:center ; » class="lt-phys-4543">785 | \ (Cl^- \) » style="text-align:center ; » class="lt-phys-4543">689 | \ (Br^- \) » style="text-align:center ; » class="lt-phys-4543">660 | \ (I^- \) » style="text-align:center ; » class="lt-phys-4543">630 |
| \(Cs^+\) | \ (F^- \) » style="text-align:center ; » class="lt-phys-4543">740 | \ (Cl^- \) » style="text-align:center ; » class="lt-phys-4543">659 | \ (Br^- \) » style="text-align:center ; » class="lt-phys-4543">631 | \ (I^- \) » style="text-align:center ; » class="lt-phys-4543">604 |
Ainsi, nous pouvons déterminer la constante de Madelung à partir de la structure cristalline et n à partir de l'énergie du réseau. Pour le NaCl, nous avons\(r_0 = 2.81 A\)\(n \approx 8\), et\(U_{diss} = 7.84 \, eV/ion \, pair\). Cette énergie de dissociation est relativement importante. Le photon le plus énergétique du spectre visible, par exemple, a une énergie d'environ
\[hf = (4.14 \times 10^{-15} eV \cdot s)(7.5 \times 10^{14} Hz) = 3.1 \, eV. \nonumber \]
Les ions contenus dans les cristaux étant étroitement liés, les cristaux ioniques présentent les caractéristiques générales suivantes :
- Ils sont assez durs et stables.
- Ils se vaporisent à des températures relativement élevées (1000 à 2000 K).
- Ils sont transparents au rayonnement visible, car les photons de la partie visible du spectre ne sont pas suffisamment énergétiques pour exciter un électron de son état fondamental à un état excité.
- Ce sont de mauvais conducteurs électriques, car ils ne contiennent effectivement aucun électron libre.
- Ils sont généralement solubles dans l'eau, car la molécule d'eau possède un grand moment dipolaire dont le champ électrique est suffisamment puissant pour rompre les liaisons électrostatiques entre les ions.
Déterminer l'énergie de dissociation du chlorure de sodium (NaCl) en kJ/mol. (Conseil : La constante de répulsion n du NaCl est d'environ 8.)
Stratégie
Un cristal de chlorure de sodium présente une séparation d'équilibre de 0,282 nm. (Comparez cette valeur à 0,236 nm pour une unité diatomique libre de NaCl.) L'énergie de dissociation dépend de la distance de séparation, de la constante de répulsion et de la constante de Madelung pour une structure FCC. La distance de séparation dépend à son tour de la masse molaire et de la densité mesurée. Nous pouvons déterminer la distance de séparation, puis utiliser cette valeur pour déterminer l'énergie de dissociation pour une mole du solide.
Solution
Les masses atomiques de Na et de Cl sont de 23,0 u et 58,4 u, donc la masse molaire du NaCl est de 58,4 g/mol. La densité du NaCl est de\(2.16 \, g/cm^3\). La relation entre ces quantités est
\[\rho = \frac{M}{V} = \frac{M}{2N_A r_0^3}, \nonumber \]
où M est la masse d'une mole de sel, NANA est le nombre d'Avogadro et r0r0 est la distance de séparation d'équilibre. Le facteur 2 est nécessaire car les ions sodium et chlorure représentent tous deux un volume cubique\(r_0^3\). En résolvant la distance, nous obtenons
\[r_0^3 = \frac{M}{2N_A \rho} = \frac{58.4 \, g/mol}{2(6.03 \times 10^{23})(2.160 \, g/cm^3)} = 2.23 \times 10^{-23} \, cm^3, \nonumber \]ou
\[r_0 = 2.80 \times 10^{-8} cm = 0.280 \, nm. \nonumber \]
L'énergie potentielle d'une paire d'ions (\(Na^+ Cl^-\)) est
\[U = -\alpha \frac{ke^2}{r_0} \left(1 - \frac{1}{n}\right), \nonumber \]
où\(\alpha\) est la constante de Madelung,\(r_0\) la distance de séparation d'équilibre et n est la constante de répulsion. NaCl est FCC, donc la constante de Madelung l'est\(\alpha = 1.7476\). En substituant ces valeurs, nous obtenons
\[U = -1.75 \frac{1.44 \, eV \cdot nm}{0.280 \, nm} \left(1 - \frac{1}{8}\right) = - 7.88 \frac{eV}{ion \, pair}. \nonumber \]
L'énergie de dissociation d'une mole de chlorure de sodium est donc
\[D = \left(\frac{7.88 \, eV}{ion \, pair}\right)\left( \frac{\frac{23.052 \, kcal}{1 \, mol}}{\frac{1 \, eV}{ion \, pair}}\right) = 182 \, kcal/mol = 760 \, kJ/mol. \nonumber \]
L'importance
Cette valeur théorique de l'énergie de dissociation de 766 kJ/mol est proche de la valeur expérimentale acceptée de 787 kJ/mol. Notez que pour une densité plus grande, la distance de séparation d'équilibre entre les paires d'ions est plus petite, comme prévu. Cette faible distance de séparation augmente la force entre les ions et donc l'énergie de dissociation. La conversion à la fin de l'équation a tiré parti du facteur de conversion\(1 \, kJ = 0.239 \, kcal\).
Si l'énergie de dissociation était plus grande, est-ce que cela rendrait plus facile ou plus difficile la séparation du solide ?
- Réponse
-
plus difficile
Liaison covalente dans les solides
Des cristaux peuvent également être formés par liaison covalente. Par exemple, les liaisons covalentes sont responsables de la cohésion des atomes de carbone dans les cristaux de diamant. La configuration électronique de l'atome de carbone est la suivante\(1s^22s^22p^2\) : un noyau He plus quatre électrons de valence. Cette configuration électronique est inférieure de quatre électrons à une couche complète. Ainsi, en partageant ces quatre électrons avec d'autres atomes de carbone dans une liaison covalente, les couches de tous les atomes de carbone sont remplies. Le diamant a une structure plus complexe que la plupart des cristaux ioniques (Figure\(\PageIndex{5}\)). Chaque atome de carbone est le centre d'un tétraèdre régulier, et l'angle entre les liaisons est de 110°.110°. Cet angle est une conséquence directe de la directionnalité des orbitales p des atomes de carbone.
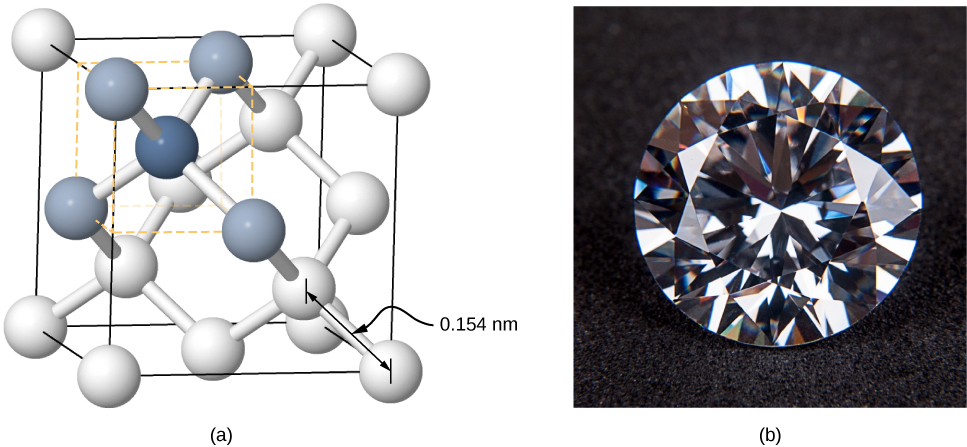
Les cristaux liés par covalence ne sont pas aussi uniformes que les cristaux ioniques, mais ils sont relativement durs, difficiles à fondre et insolubles dans l'eau. Par exemple, le diamant a une température de fusion extrêmement élevée (4 000 K) et est transparent à la lumière visible. En comparaison, l'étain lié par covalence (également connu sous le nom d'alpha-étain, qui n'est pas métallique) est relativement mou, fond à 600 K et réfléchit la lumière visible. Deux autres exemples importants de cristaux liés par covalence sont le silicium et le germanium. Ces deux solides sont largement utilisés dans la fabrication de diodes, de transistors et de circuits intégrés. Nous reviendrons sur ces matériaux plus tard dans notre discussion sur les semi-conducteurs.
Liaison métallique dans les solides
Comme son nom l'indique, la liaison métallique est responsable de la formation de cristaux métalliques. Les électrons de valence sont essentiellement exempts d'atomes et peuvent se déplacer relativement facilement à travers le cristal métallique. La liaison est due aux forces d'attraction entre les ions positifs et les électrons de conduction. Les liaisons métalliques sont plus faibles que les liaisons ioniques ou covalentes, avec des énergies de dissociation comprises dans la plage\(1 - 3 \, eV\).


