20.5 : Techniques d'auto-anticorps fluorescents
- Page ID
- 187801
Objectifs d'apprentissage
- Décrire les avantages des tests d'anticorps immunofluorescents par rapport aux tests non fluorescents
- Comparez les tests d'anticorps fluorescents directs et indirects
- Expliquer comment un cytomètre en flux peut être utilisé pour quantifier des sous-ensembles spécifiques de cellules présentes dans un mélange complexe de types de cellules
- Expliquer comment un trieur de cellules activé par fluorescence peut être utilisé pour séparer des types uniques de cellules
La visualisation rapide des bactéries à partir d'un échantillon clinique, tel qu'un prélèvement de gorge ou des expectorations, peut être réalisée grâce à des techniques d'anticorps fluorescents (FA) qui fixent un marqueur fluorescent (fluorogène) à la région constante d'un anticorps, ce qui permet d'obtenir une molécule rapporteuse rapide à utiliser, facile à voir ou à mesurer, et capable de se lier à des marqueurs cibles avec une grande spécificité. Nous pouvons également étiqueter des cellules, ce qui nous permet de quantifier avec précision des sous-ensembles particuliers de cellules ou même de purifier ces sous-ensembles pour des recherches plus approfondies.
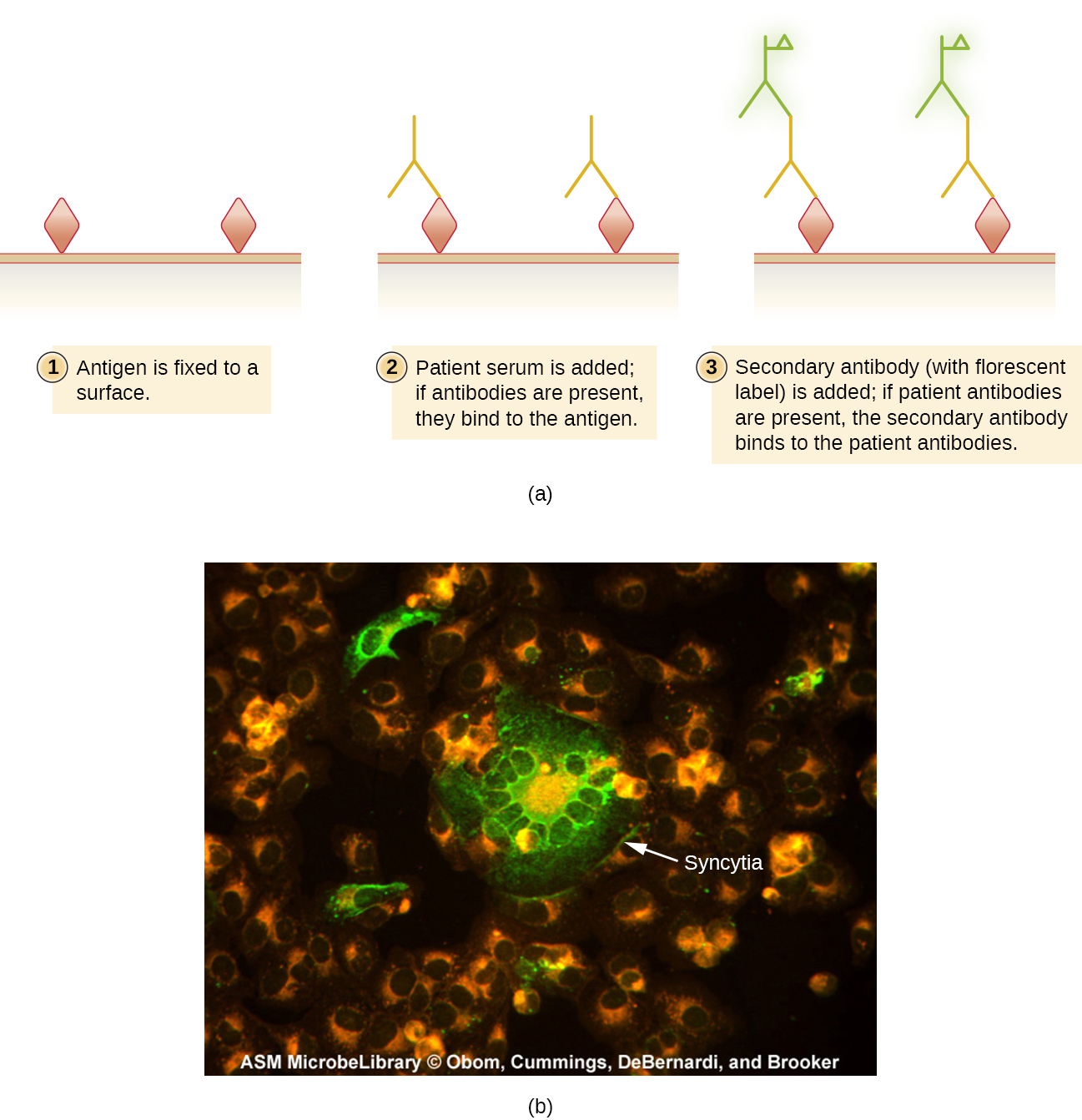
Comme pour les dosages enzymatiques, les méthodes d'amplification par fluorescence peuvent être directes, dans lesquelles un mAb marqué lie un antigène, ou indirectes, dans lesquelles des anticorps polyclonaux secondaires se lient aux anticorps des patients qui réagissent à un antigène préparé. Les applications de ces deux méthodes ont été démontrées dans la Figure 2.3.8. Les méthodes FA sont également utilisées dans les systèmes automatisés de comptage et de tri des cellules pour dénombrer ou séparer les sous-populations de cellules étiquetées d'un échantillon.
Techniques d'anticorps fluorescents directs
Les tests d'anticorps à fluorescence directe (DFA) utilisent un mAb marqué par fluorescence pour lier et éclairer un antigène cible. Les tests DFA sont particulièrement utiles pour le diagnostic rapide des maladies bactériennes. Par exemple, des anticorps marqués par fluorescence contre Streptococcus pyogenes (streptocoque du groupe A) peuvent être utilisés pour diagnostiquer l'angine streptococcique à partir d'un écouvillon de gorge. Le diagnostic est prêt en quelques minutes et le patient peut commencer à prendre des antibiotiques avant même de quitter la clinique. Les techniques DFA peuvent également être utilisées pour diagnostiquer une pneumonie causée par Mycoplasma pneumoniae ou Legionella pneumophila à partir d'échantillons de crachats (Figure\(\PageIndex{1}\)). Les anticorps fluorescents se lient aux bactéries sur une lame de microscope, ce qui permet de détecter facilement les bactéries à l'aide d'un microscope à fluorescence. Ainsi, la technique DFA est utile pour visualiser certaines bactéries difficiles à isoler ou à cultiver à partir d'échantillons de patients.
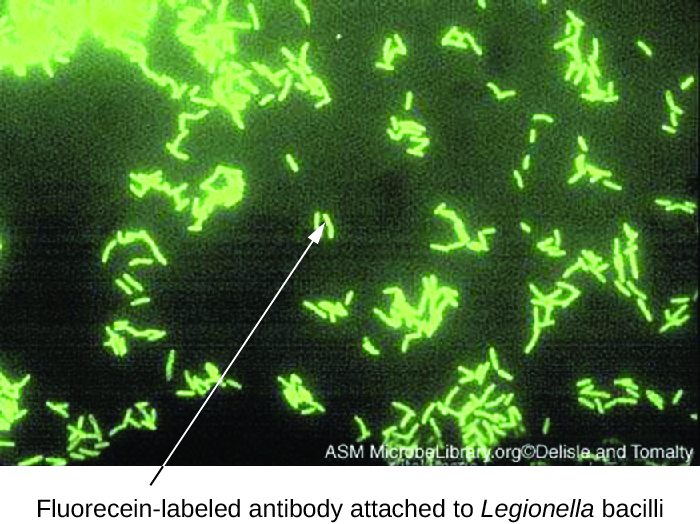
Exercice\(\PageIndex{1}\)
Lors d'un test d'anticorps fluorescents directs, à quoi se lie l'anticorps fluorescent ?
Techniques d'anticorps fluorescents indirects
Les tests d'anticorps fluorescents indirects (IFA) (Figure\(\PageIndex{2}\)) sont utilisés pour rechercher des anticorps dans le sérum des patients. Par exemple, un test IFA pour le diagnostic de la syphilis utilise des cellules de T. pallidum isolées d'un animal de laboratoire (la bactérie ne peut pas être cultivée en laboratoire) et un frottis préparé sur une lame de verre. Le sérum du patient est étalé sur le frottis et les anticorps antitréponémiques, s'ils sont présents, peuvent se lier. Le sérum est lavé et un anticorps secondaire est ajouté. L'anticorps secondaire est une immunoglobuline antihumaine conjuguée à un fluorogène. À l'examen, les bactéries T. pallidum ne seront visibles que si elles ont été liées par les anticorps présents dans le sérum du patient.
Le test IFA pour la syphilis constitue un complément important au test VDRL discuté dans la section Détection des complexes antigène-anticorps. Le VDRL est plus susceptible de générer des réactions faussement positives que le test IFA ; toutefois, le VDRL est un meilleur test pour déterminer si une infection est actuellement active.
Les tests IFA sont également utiles pour le diagnostic des maladies auto-immunes. Par exemple, le lupus érythémateux disséminé (LED) (voir Maladies auto-immunes) se caractérise par des niveaux d'expression élevés d'anticorps antinucléaires (ANA). Ces auto-anticorps peuvent être exprimés contre diverses protéines liant l'ADN et même contre l'ADN lui-même. Comme l'auto-immunité est souvent difficile à diagnostiquer, en particulier au début de la progression de la maladie, le dépistage de l'ANA peut être un indice précieux pour établir un diagnostic et commencer un traitement approprié.
L'IFA pour l'ANA commence par fixer les cellules cultivées en culture sur une lame de verre et les rendre perméables aux anticorps. Les lames sont ensuite incubées avec des dilutions en série de sérum provenant du patient. Après incubation, la lame est lavée pour éliminer les protéines non liées, et l'anticorps fluorescent (IgG antihumaine conjuguée à un fluorogène) est ajouté. Après une incubation et un lavage, les cellules peuvent être examinées pour détecter la fluorescence visible autour du noyau (Figure\(\PageIndex{3}\)). Le titre d'ANA dans le sérum est déterminé par la dilution la plus élevée présentant une fluorescence. Étant donné que de nombreuses personnes en bonne santé expriment l'ANA, l'American College of Rheumatology recommande que le titre soit d'au moins 1:40 en présence de symptômes impliquant deux ou plusieurs systèmes organiques pour être considéré comme révélateur d'un LED. 1
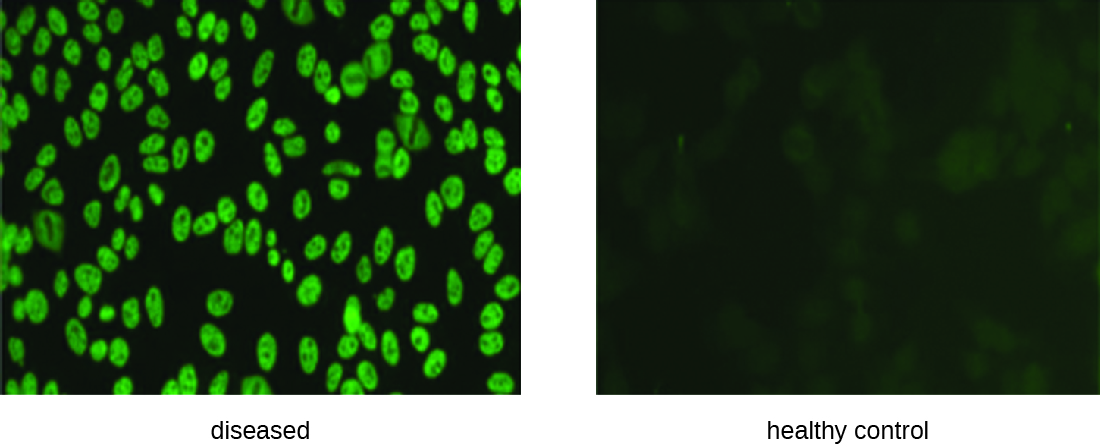
Exercice\(\PageIndex{2}\)
- Lors d'un test d'anticorps fluorescent indirect, à quoi se lie l'anticorps fluorescent ?
- Que recherche le test ANA ?
Cytométrie en flux
Les anticorps marqués par fluorescence peuvent être utilisés pour quantifier des cellules d'un type spécifique dans un mélange complexe à l'aide de la cytométrie en flux (Figure\(\PageIndex{4}\)), un système de comptage cellulaire automatisé qui détecte les cellules fluorescentes lorsqu'elles traversent un tube étroit, une cellule à la fois. Par exemple, en cas d'infection au VIH, il est important de connaître le taux de lymphocytes T CD4 dans le sang du patient ; si le nombre tombe en dessous de 500 par μL de sang, le patient est plus susceptible de contracter des infections opportunistes ; en dessous de 200 par μL, le patient ne peut plus du tout développer une réponse immunitaire adaptative utile. L'analyse commence par l'incubation d'une population de cellules mixtes (par exemple, des globules blancs provenant d'un donneur) avec un mAb marqué par fluorescence spécifique à une sous-population de cellules (par exemple, anti-CD4). Certaines expériences examinent deux marqueurs cellulaires simultanément en ajoutant un fluorogène différent au mAb approprié. Les cellules sont ensuite introduites dans le cytomètre en flux par un capillaire étroit qui force les cellules à passer en file indienne. Un laser est utilisé pour activer le fluorogène. La lumière fluorescente rayonne dans toutes les directions, de sorte que le détecteur de fluorescence peut être positionné à un angle par rapport à la lumière laser incidente.
La figure\(\PageIndex{4}\) montre la barre d'obscurcissement devant le détecteur à diffusion directe qui empêche la lumière laser de toucher le détecteur. Lorsqu'une cellule traverse la barre laser, le détecteur à diffusion directe détecte la lumière diffusée autour de la barre d'obscurcissement. La lumière diffusée est transformée en impulsion de tension et le cytomètre compte une cellule. La fluorescence d'une cellule marquée est détectée par les détecteurs à diffusion latérale. La lumière passe à travers différents miroirs dichroïques de telle sorte que la lumière émise par le fluorophore est reçue par le détecteur approprié.
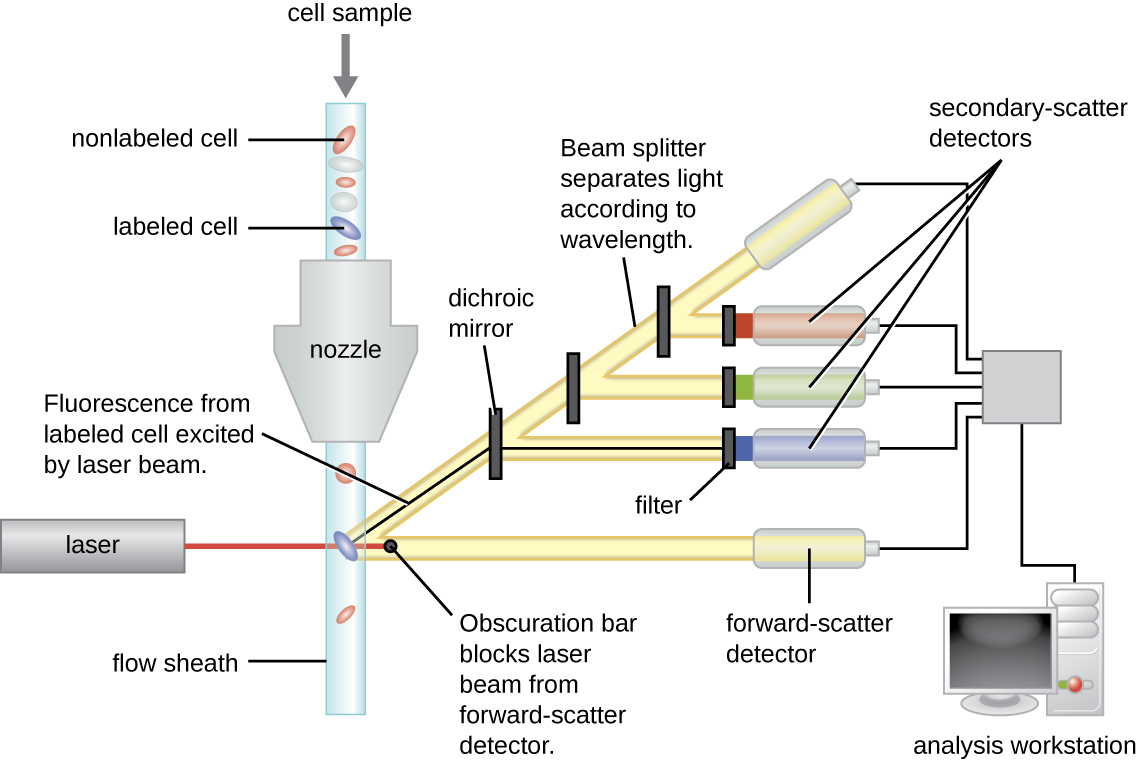
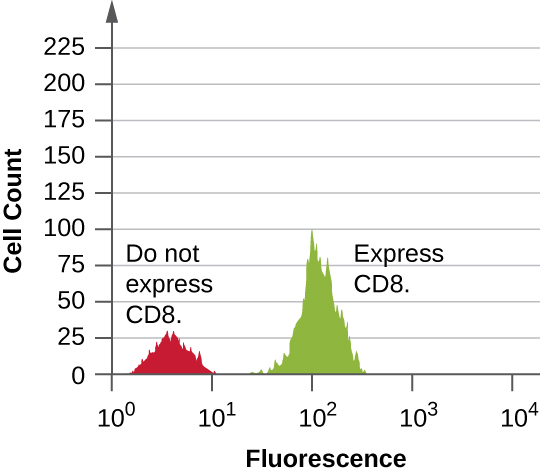
Les données sont collectées à la fois par les détecteurs à diffusion directe et latérale. Ces données peuvent notamment être présentées sous la forme d'un histogramme. La diffusion directe est placée sur l'axe y (pour représenter le nombre de cellules) et la diffusion latérale est placée sur l'axe x (pour représenter la fluorescence de chaque cellule). L'échelle pour l'axe x est logarithmique, de sorte que l'intensité de fluorescence augmente d'un facteur 10 à mesure que chaque unité augmente le long de l'axe. La figure\(\PageIndex{5}\) montre un exemple dans lequel une culture de cellules est combinée à un anticorps fixé à un fluorophore pour détecter les cellules CD8, puis analysée par cytométrie en flux. L'histogramme comporte deux pics. Le pic de gauche présente des valeurs de fluorescence plus faibles, représentant le sous-ensemble de la population cellulaire (environ 30 cellules) qui ne sont pas fluorescentes ; par conséquent, elles ne sont pas liées par des anticorps et n'expriment donc pas le CD8. Le pic de droite présente des valeurs de fluorescence plus élevées, représentant le sous-ensemble de la population cellulaire (environ 100 cellules) qui présente une fluorescence ; elles sont donc liées par l'anticorps et expriment donc le CD8.
Exercice\(\PageIndex{3}\)
- À quoi sert le laser dans un cytomètre en flux ?
- Dans la sortie d'un cytomètre en flux, la zone sous l'histogramme est équivalente à quoi ?
Orientation clinique : résolution
Après avoir informé les 1 300 patients, l'hôpital commence à planifier le dépistage du VIH. Les rendez-vous étaient fixés au moins 3 semaines après la dernière visite à l'hôpital du patient afin de minimiser le risque de faux négatifs. Comme certains faux positifs étaient anticipés, le médecin de santé publique a mis en place un protocole de conseil pour tout patient dont l'ELISA indirect s'est révélé positif.
Sur les 1 300 patients, huit se sont révélés positifs à l'aide du test ELISA. Cinq de ces tests ont été invalidés par des tests Western blot négatifs, mais un test Western Blot s'est révélé positif, confirmant que le patient avait bel et bien contracté le VIH. Les deux western blots restants sont revenus indéterminés. Ces personnes ont dû se soumettre à un troisième test, une PCR, pour confirmer la présence ou l'absence de séquences du VIH. Heureusement, les deux patients ont donné des résultats négatifs.
En ce qui concerne le seul patient dont la séropositivité a été confirmée, les tests ne peuvent ni prouver ni infirmer l'existence d'un lien avec les seringues compromises par l'ancien employé de l'hôpital. Malgré cela, l'assurance de l'hôpital couvrira entièrement le traitement du patient, qui a débuté immédiatement.
Bien que nous disposions aujourd'hui de médicaments généralement efficaces pour contrôler la progression du VIH et du sida, il n'existe toujours aucun remède. En l'absence de traitement ou en cas d'échec du traitement médicamenteux, le patient subira une diminution progressive du nombre de lymphocytes T auxiliaires CD4, entraînant une altération grave de toutes les fonctions immunitaires adaptatives. Même une baisse modérée du nombre de lymphocytes T auxiliaires peut entraîner une immunodéficience, rendant le patient vulnérable aux infections opportunistes. Pour surveiller l'état des lymphocytes T auxiliaires du patient, l'hôpital utilisera la cytométrie en flux. Ce test sensible permet aux médecins de déterminer avec précision le nombre de lymphocytes T auxiliaires afin d'ajuster le traitement si ce nombre tombe en dessous de 500 cellules/µL.
Tri des cellules par immunofluorescence
Le cytomètre en flux et l'immunofluorescence peuvent également être modifiés pour trier les cellules d'un seul échantillon en sous-populations de cellules purifiées à des fins de recherche. Cette modification du cytomètre de flux est appelée trieur de cellules activé par fluorescence (FACS). Dans un FACS, la fluorescence d'une cellule amène le dispositif à appliquer une charge sur une gouttelette du fluide de transport contenant cette cellule. La charge est spécifique à la longueur d'onde de la lumière fluorescente, ce qui permet un tri différentiel en fonction de ces différentes charges. Le tri est effectué par un déflecteur électrostatique qui déplace la gouttelette chargée contenant la cellule dans un récipient collecteur ou un autre. Le processus produit des sous-populations de cellules hautement purifiées.
L'une des limites d'un FACS est qu'il ne fonctionne que sur des cellules isolées. Ainsi, la méthode fonctionnerait pour trier les globules blancs, puisqu'ils existent sous forme de cellules isolées. Mais pour les cellules d'un tissu, la cytométrie en flux ne peut être appliquée que si nous pouvons exciser le tissu et le séparer en cellules individuelles (en utilisant des protéases pour cliver les molécules d'adhésion entre les cellules) sans perturber l'intégrité cellulaire. Cette méthode peut être utilisée sur les tumeurs, mais le plus souvent, l'immunohistochimie et l'immunocytochimie sont utilisées pour étudier les cellules des tissus.
Regardez des vidéos pour en savoir plus sur le fonctionnement de la cytométrie en flux et d'un FACS.
Exercice\(\PageIndex{4}\)
Lors du tri des cellules activées par fluorescence, quelle caractéristique des cellules cibles permet de les séparer ?
Le tableau\(\PageIndex{1}\) compare les mécanismes des techniques d'anticorps fluorescents abordées dans cette section.
| Type de test | Mécanisme | Exemples |
|---|---|---|
| Anticorps à fluorescence directe (DFA) | Utilise des conjugués fluorogène-anticorps pour marquer les bactéries des échantillons de patients | Visualisation de Legionella pneumophila à partir d'un prélèvement de gorge |
| Anticorps fluorescent indirect (IFA) | Détecte les anticorps spécifiques à la maladie dans le sérum du patient | Diagnostic de la syphilis ; détection des anticorps antinucléaires (ANA) contre le lupus et d'autres maladies auto-immunes |
| Cytométrie en flux | Marque les membranes cellulaires avec des marqueurs conjugués fluorogène-anticorps excités par un laser ; la machine compte les cellules et enregistre la fluorescence relative | Compter le nombre de cellules CD4 ou CD8 marquées par fluorescence dans un échantillon |
| Trieur de cellules activées par fluorescence (FACS) | Forme de cytométrie en flux qui compte les cellules et les sépare physiquement en groupes de cellules à fluorescence élevée et faible | Tri des cellules cancéreuses |
Concepts clés et résumé
- Les tests d'immunofluorescence utilisent des conjugués anticorps-fluorogène pour éclairer les antigènes afin de les détecter facilement et rapidement.
- L'immunofluorescence directe peut être utilisée pour détecter la présence de bactéries dans des échantillons cliniques tels que les expectorations.
- L'immunofluorescence indirecte détecte la présence d'anticorps spécifiques à l'antigène dans le sérum des patients. L'anticorps fluorescent se lie à l'anticorps spécifique à l'antigène plutôt qu'à l'antigène.
- L'utilisation de tests d'immunofluorescence indirecte pour détecter les anticorps antinucléaires est un outil important pour le diagnostic de plusieurs maladies auto-immunes.
- La cytométrie en flux utilise des mAbs fluorescents contre des protéines membranaires cellulaires afin de quantifier des sous-ensembles spécifiques de cellules dans des mélanges complexes.
- Les trieurs cellulaires activés par fluorescence sont une extension de la cytométrie en flux dans laquelle l'intensité de fluorescence est utilisée pour séparer physiquement les cellules en populations à fluorescence élevée et faible.
Notes
- 1 Gill, James M., ANNA M. Quisel, PETER V. Rocca et DENE T. Walters. « Diagnostic du lupus érythémateux disséminé. » Médecin de famille américain 68, n° 11 (2003) : 2179-2186.


