20.4 : Essais immuno-enzymatiques (EIA) et tests immunoenzymatiques (ELISA)
- Page ID
- 187800
Objectifs d'apprentissage
- Expliquer les différences et les similitudes entre l'EIA, la FEIA et l'ELISA
- Décrire la différence et les similitudes entre l'immunohistochimie et l'immunocytochimie
- Décrire les différents objectifs de l'ELISA directe et indirecte
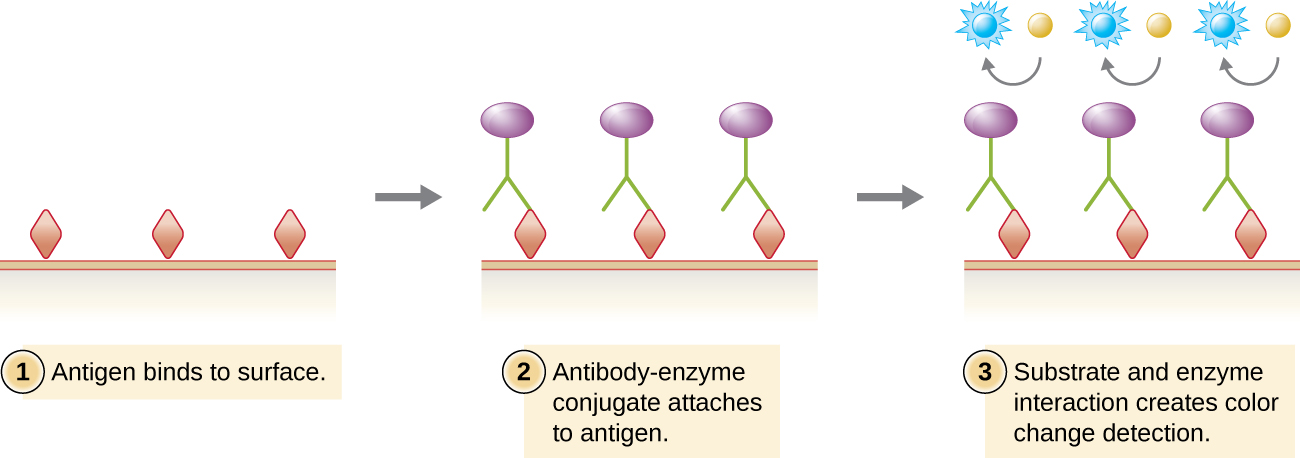
À l'instar du Western Blot, les immunoessais enzymatiques (EIA) utilisent des anticorps pour détecter la présence d'antigènes. Cependant, les EIE se distinguent des Western blots en ce sens que les essais sont réalisés sur des plaques de microtitrage ou in vivo plutôt que sur une membrane absorbante. Il existe de nombreux types d'EIE, mais ils impliquent tous une molécule d'anticorps dont la région constante se lie à une enzyme, laissant la région variable libre de se lier à son antigène spécifique. L'ajout d'un substrat pour l'enzyme permet de visualiser ou de quantifier l'antigène (Figure\(\PageIndex{1}\)).
Dans les EIA, le substrat de l'enzyme est le plus souvent un chromogène, une molécule incolore qui est convertie en un produit final coloré. Les enzymes les plus utilisées sont la phosphatase alcaline et la peroxydase de raifort pour lesquelles des substrats appropriés sont facilement disponibles. Dans certains EIE, le substrat est un fluorogène, une molécule non fluorescente que l'enzyme convertit en une forme fluorescente. Les EIE qui utilisent un fluorogène sont appelés immunoessais enzymatiques fluorescents (FEIA). La fluorescence peut être détectée au moyen d'un microscope à fluorescence ou d'un spectrophotomètre.
Le titre MMR
Le vaccin ROR est un vaccin combiné qui protège contre la rougeole, les oreillons et la rubéole (rougeole allemande). La plupart des personnes reçoivent le vaccin ROR lorsqu'elles sont enfants et possèdent donc des anticorps contre ces maladies. Cependant, pour diverses raisons, même les personnes vaccinées peuvent redevenir vulnérables à ces maladies plus tard dans leur vie. Par exemple, certains enfants peuvent ne recevoir qu'un seul cycle du vaccin ROR au lieu des deux recommandés. De plus, le titre des anticorps protecteurs dans l'organisme d'une personne peut commencer à diminuer avec l'âge ou en raison de certaines affections médicales.
Pour déterminer si le titre d'anticorps dans le sang d'un individu est suffisant pour fournir une protection, un test de titre ROR peut être effectué. Le test est un immunoessai simple qui peut être effectué rapidement à l'aide d'un échantillon de sang. Les résultats du test indiqueront si la personne est toujours immunisée ou a besoin d'une autre dose du vaccin ROR.
La soumission à un titre ROR est souvent une exigence préalable à l'emploi pour les professionnels de santé, en particulier ceux qui seront fréquemment en contact avec de jeunes enfants ou des patients immunodéprimés. Si un agent de santé était infecté par la rougeole, les oreillons ou la rubéole, il pourrait facilement transmettre ces maladies à des patients sensibles, ce qui provoquerait une épidémie. En fonction des résultats du titre ROR, les professionnels de santé peuvent avoir besoin d'être revaccinés avant de commencer à travailler.
Immunocoloration
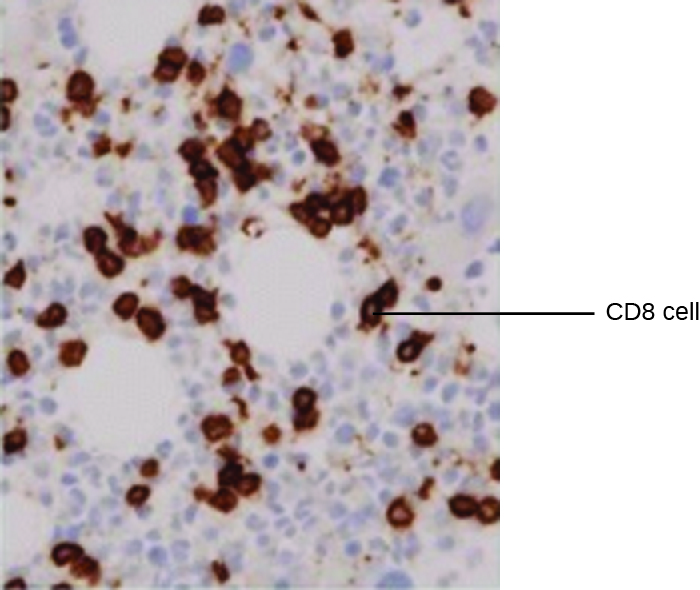
L'une des principales utilisations de l'EIA est l'immunocoloration, dans laquelle les conjugués anticorps-enzyme améliorent la microscopie. L'immunohistochimie (IHC) est utilisée pour examiner des tissus entiers. Comme le montre la figure\(\PageIndex{2}\), une section de tissu peut être colorée pour visualiser les différents types de cellules. Dans cet exemple, un mAb contre le CD8 a été utilisé pour colorer les cellules CD8 dans une section du tissu amygdalien. Il est maintenant possible de compter le nombre de cellules CD8, de déterminer leur nombre relatif par rapport aux autres types de cellules présents et de déterminer la localisation de ces cellules dans ce tissu. Ces données seraient utiles pour étudier des maladies telles que le SIDA, dans lesquelles le fonctionnement normal des cellules CD8 est crucial pour ralentir la progression de la maladie.
L'immunocytochimie (ICC) est une autre forme précieuse d'immunocoloration. Tout comme pour l'IHC, dans l'ICC, le matériau de la matrice extracellulaire est retiré et la membrane cellulaire est gravée avec de l'alcool pour la rendre perméable aux anticorps. Cela permet aux anticorps de traverser la membrane cellulaire et de se lier à des cibles spécifiques à l'intérieur de la cellule. Les organites, les composants du cytosquelette et d'autres structures intracellulaires peuvent être visualisés de cette manière. Bien que certaines techniques ICC utilisent l'EIA, l'enzyme peut être remplacée par une molécule fluorescente, ce qui en fait un immunoessai fluorescent.
Exercice\(\PageIndex{1}\)
- Quelle est la différence entre l'immunohistochimie et l'immunocytochimie ?
- Que doit-il être vrai du produit de la réaction enzymatique utilisé en immunohistochimie ?
Tests immunoenzymatiques (ELISA)
Les tests immunoenzymatiques (ELISA) sont des EIE largement utilisés. Lors de l'ELISA directe, les antigènes sont immobilisés dans le puits d'une plaque de microtitrage. Un anticorps spécifique à un antigène particulier et conjugué à une enzyme est ajouté à chaque puits. Si l'antigène est présent, l'anticorps se liera. Après lavage pour éliminer les anticorps non liés, un substrat incolore (chromogène) est ajouté. La présence de l'enzyme transforme le substrat en un produit final coloré (Figure\(\PageIndex{1}\)). Bien que cette technique soit plus rapide car elle ne nécessite l'utilisation que d'un seul anticorps, elle présente l'inconvénient que le signal issu d'une ELISA directe est plus faible (sensibilité plus faible).
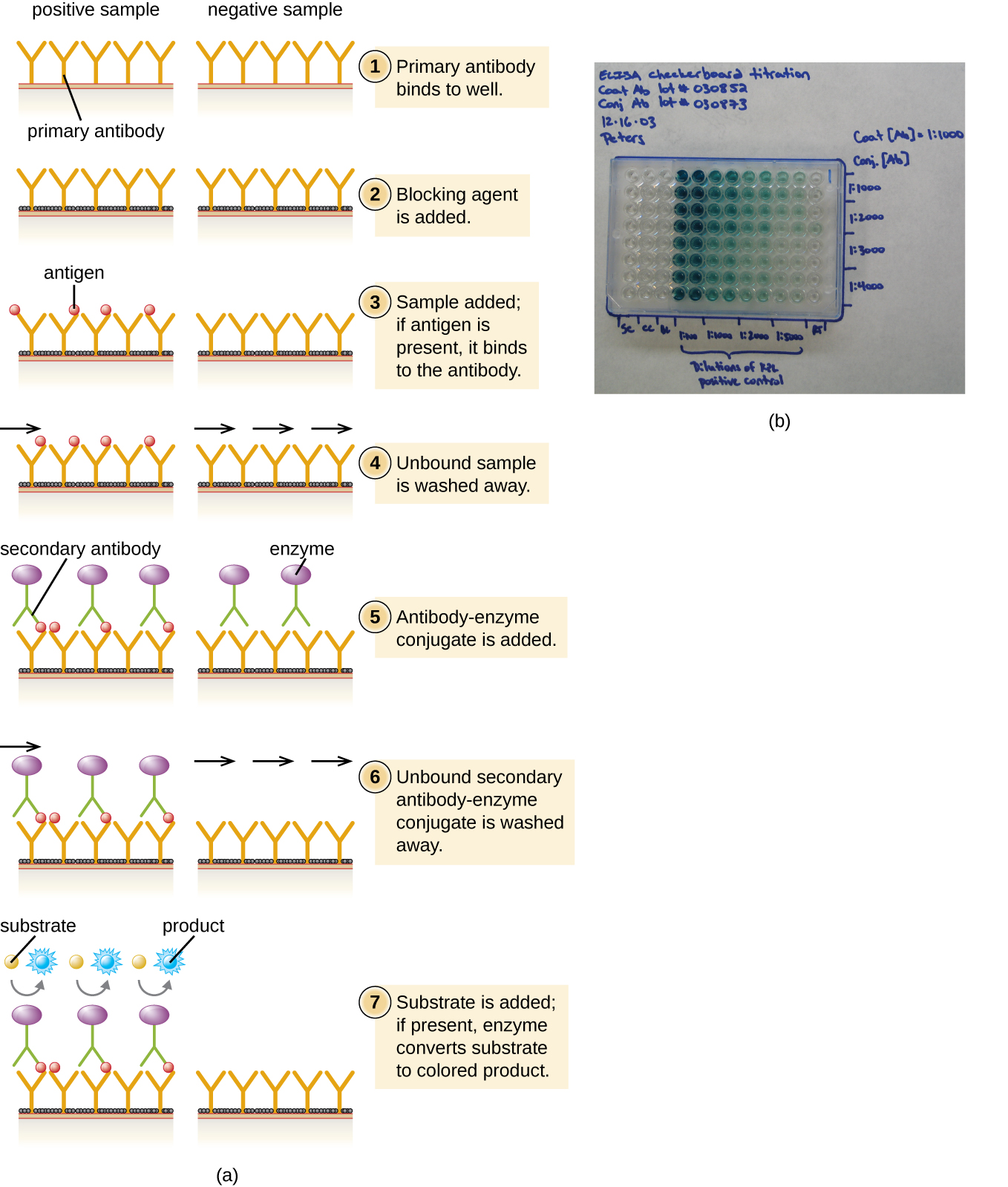
Dans le cadre d'une ELISA en sandwich, l'objectif est d'utiliser des anticorps pour quantifier avec précision un antigène spécifique présent dans une solution, tel que l'antigène d'un agent pathogène, une protéine sérique ou une hormone du sang ou de l'urine pour ne citer que quelques exemples. La première étape d'un test ELISA en sandwich consiste à ajouter l'anticorps primaire dans tous les puits d'une plaque de microtitrage (Figure\(\PageIndex{3}\)). L'anticorps adhère au plastique par des interactions hydrophobes. Après un temps d'incubation approprié, tout anticorps non lié est éliminé. Des lavages comparables sont utilisés entre chacune des étapes suivantes afin de s'assurer que seules les molécules spécifiquement liées restent fixées à la plaque. Une protéine bloquante est ensuite ajoutée (par exemple, de l'albumine ou de la caséine protéique du lait) pour lier les sites de liaison aux protéines non spécifiques restants dans le puits. Certains puits recevront des quantités connues d'antigène pour permettre la construction d'une courbe standard, et des solutions d'antigènes inconnues seront ajoutées aux autres puits. L'anticorps primaire capture l'antigène et, après un lavage, l'anticorps secondaire est ajouté, qui est un anticorps polyclonal conjugué à une enzyme. Après un dernier lavage, un substrat incolore (chromogène) est ajouté et l'enzyme le convertit en un produit final coloré. L'intensité de couleur de l'échantillon provoquée par le produit final est mesurée à l'aide d'un spectrophotomètre. La quantité de couleur produite (mesurée en tant qu'absorbance) est directement proportionnelle à la quantité d'enzyme, qui à son tour est directement proportionnelle à l'antigène capturé. Les ELISA sont extrêmement sensibles, ce qui permet de quantifier l'antigène en nanogrammes (10 à 9 g) par ml.
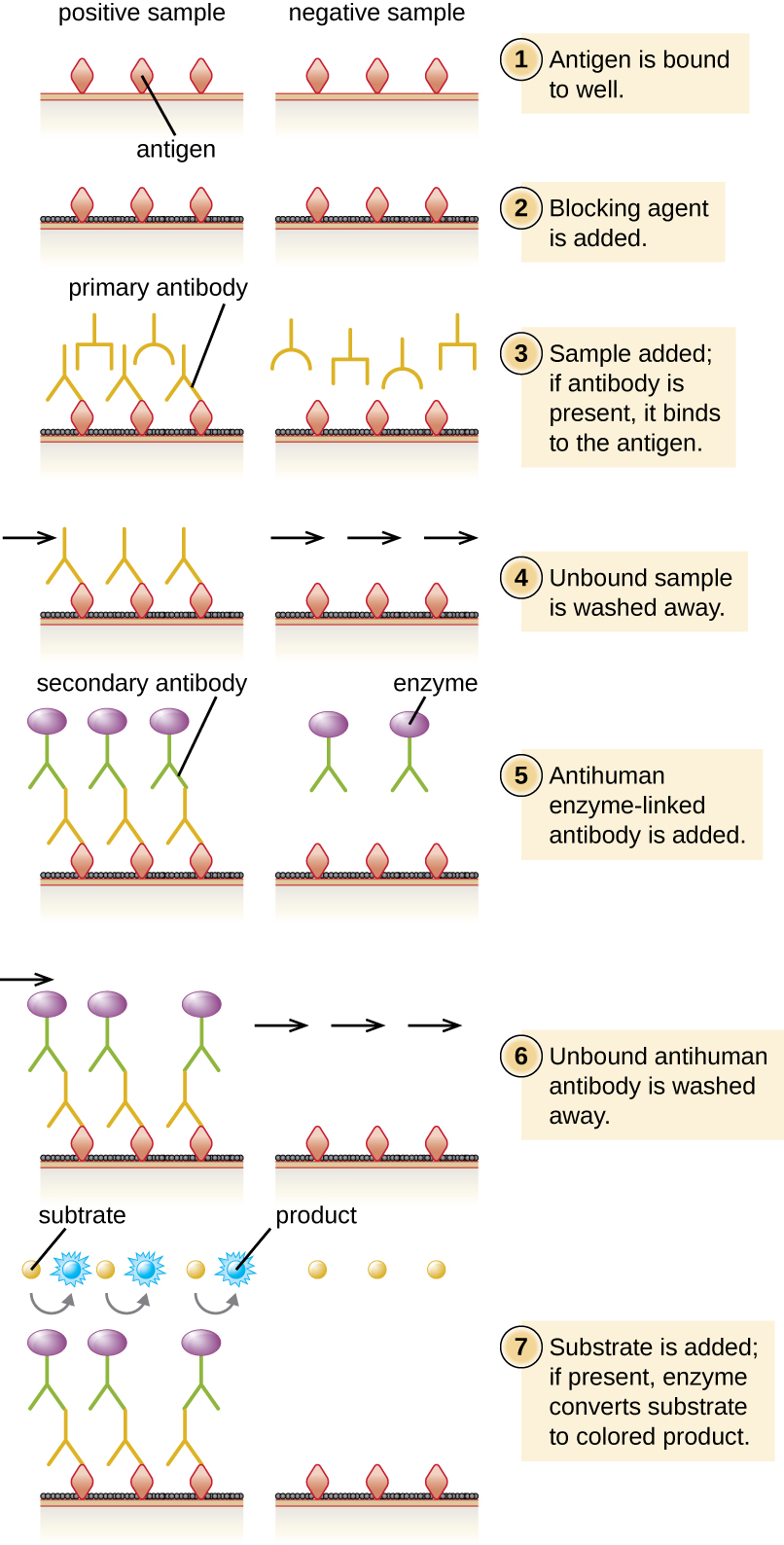
Lors d'une ELISA indirecte, nous quantifions les anticorps spécifiques à l'antigène plutôt que l'antigène. Nous pouvons utiliser l'ELISA indirect pour détecter des anticorps contre de nombreux types d'agents pathogènes, notamment Borrelia burgdorferi (maladie de Lyme) et le VIH. Il existe trois différences importantes entre les ELISA indirects et directs, comme le montre la figure\(\PageIndex{4}\). Plutôt que d'utiliser des anticorps pour capturer l'antigène, l'ELISA indirecte commence par fixer un antigène connu (par exemple, des peptides du VIH) au fond des puits de la plaque de microtitrage. Après avoir bloqué les sites non liés sur la plaque, du sérum du patient est ajouté ; si des anticorps sont présents (anticorps primaire), ils se lieront à l'antigène. Après élimination de toute protéine non liée, l'anticorps secondaire avec son enzyme conjuguée est dirigé contre l'anticorps principal (par exemple, immunoglobuline antihumaine). L'anticorps secondaire nous permet de quantifier la quantité d'anticorps spécifiques à l'antigène présente dans le sérum du patient par l'intensité de la couleur produite par la réaction enzyme-chromogène conjuguée.
Comme c'est le cas pour plusieurs autres tests visant à détecter les anticorps abordés dans ce chapitre, on s'inquiète toujours de la réactivité croisée avec des anticorps dirigés contre un autre antigène, ce qui peut donner des résultats faussement positifs. Ainsi, nous ne pouvons pas diagnostiquer définitivement une infection par le VIH (ou tout autre type d'infection) sur la base d'un seul test ELISA indirect. Nous devons confirmer tout test suspect positif, ce qui est le plus souvent effectué à l'aide d'un immunoblot qui identifie réellement la présence de peptides spécifiques du pathogène ou d'un test visant à identifier les acides nucléiques associés au pathogène, tel que la PCR par transcriptase inverse (RT-PCR) ou un antigène d'acide nucléique test.
Exercice\(\PageIndex{2}\)
- À quoi sert l'anticorps secondaire lors d'une ELISA directe ?
- Que quantifient les ELISA directs et indirects ?
Orientation clinique : partie 2
Bien que contacter et tester les 1 300 patients pour le VIH soit long et coûteux, les administrateurs espéraient minimiser la responsabilité de l'hôpital en recherchant et en traitant de manière proactive les victimes potentielles du crime commis par l'employé malhonnête. La détection précoce du VIH est importante, et un traitement rapide peut ralentir la progression de la maladie.
Il existe divers tests de dépistage du VIH, mais le plus largement utilisé est le test ELISA indirect. Comme les autres tests ELISA indirects, le test fonctionne en fixant un antigène (dans ce cas, des peptides du VIH) à un puits situé dans une plaque de 96 puits. Si le patient est séropositif, les anticorps anti-VIH se lieront à l'antigène et seront identifiés par le deuxième conjugué anticorps-enzyme.
Exercice\(\PageIndex{3}\)
- Quel est le degré de précision d'un test ELISA indirect pour le VIH et quels facteurs peuvent avoir une incidence sur la précision du test ?
- L'hôpital devrait-il utiliser d'autres tests pour confirmer les résultats de l'ELISA indirect ?
Essais d'immunofiltration et d'immunochromatographie
Dans certaines situations, il peut être nécessaire de détecter ou de quantifier des antigènes ou des anticorps présents à de très faibles concentrations en solution. Des techniques d'immunofiltration ont été développées pour rendre cela possible. Lors de l'immunofiltration, un grand volume de liquide passe à travers une membrane poreuse pour atteindre un tampon absorbant. Un antigène fixé à la membrane poreuse capturera l'anticorps lors de son passage ; nous pouvons également fixer un anticorps à la membrane pour capturer l'antigène.
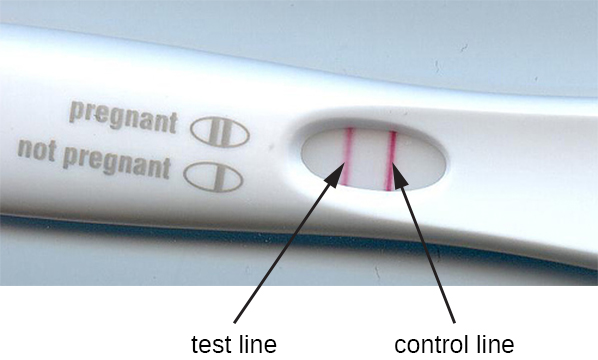
La méthode d'immunofiltration a été adaptée au développement de tests immunochromatographiques, communément appelés tests à flux latéral ou tests sur bandelettes. Ces tests sont rapides et faciles à réaliser, ce qui les rend populaires pour une utilisation sur le site des soins (c'est-à-dire chez le médecin) ou à domicile. Le test TORCH en est un exemple. Il permet aux médecins de dépister chez les femmes enceintes ou les nouveau-nés la présence de toute une gamme de virus et d'autres agents pathogènes (toxoplasme, autres virus, rubéole, cytomégalovirus, herpès simplex). Les tests de grossesse à domicile sont un autre exemple largement utilisé de test de débit latéral (Figure\(\PageIndex{5}\)). Les tests d'immunofiltration sont également populaires dans les pays en développement, car ils sont peu coûteux et ne nécessitent pas de réfrigération constante des réactifs séchés. Cependant, la technologie est également intégrée à certains équipements de laboratoire sophistiqués.
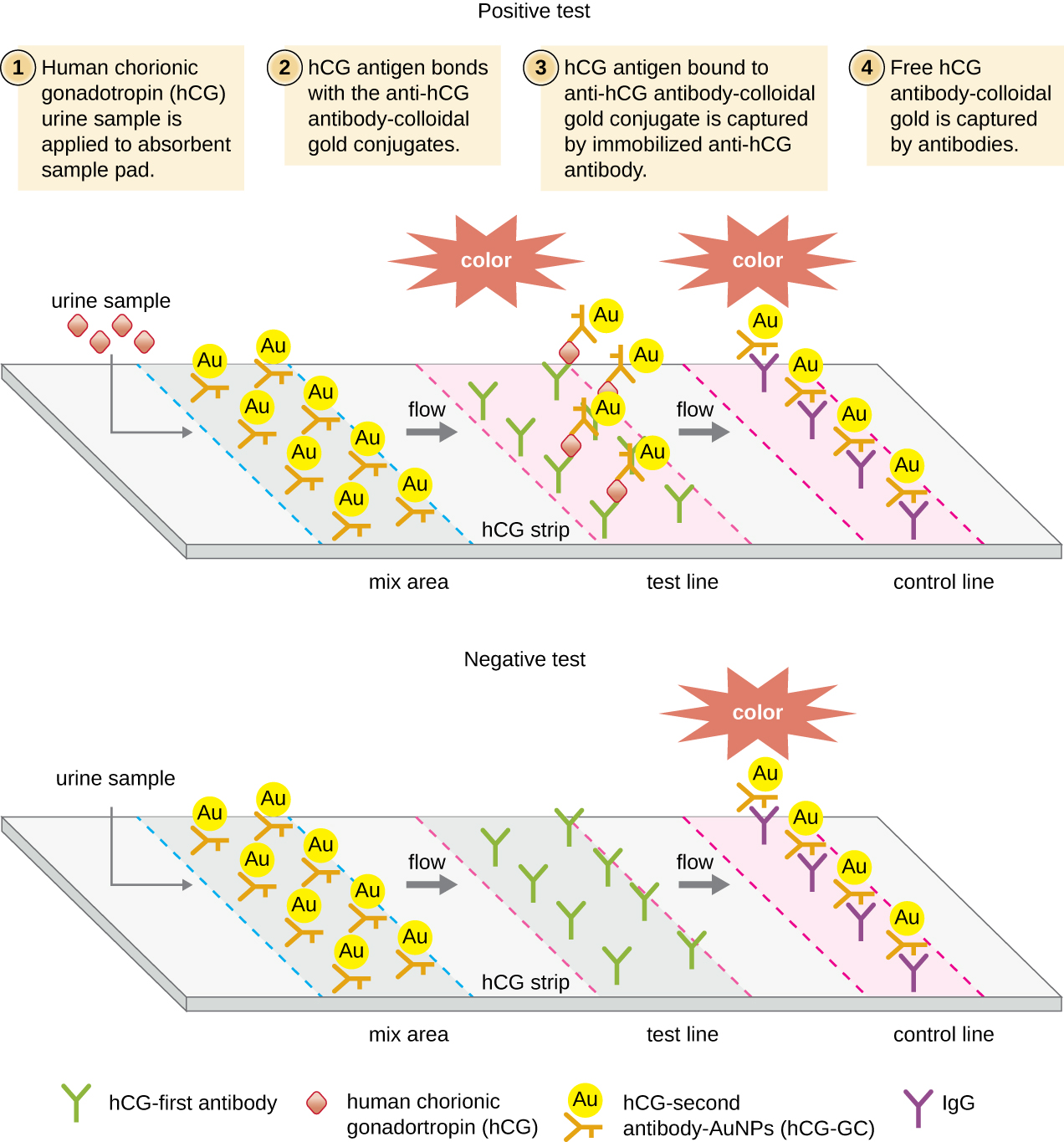
Lors des tests de flux latéral (Figure\(\PageIndex{6}\)), des liquides tels que l'urine sont appliqués sur un tampon absorbant situé sur la bandelette réactive. Le liquide s'écoule par capillarité et se déplace à travers une bande de billes avec des anticorps attachés à leurs surfaces. Le liquide contenu dans l'échantillon hydrate en fait les réactifs, qui sont présents à l'état sec dans la bande. Des billes recouvertes d'anticorps faites de latex ou de minuscules particules d'or lieront les antigènes dans le liquide d'essai. Les complexes anticorps-antigène s'écoulent ensuite sur une seconde bande dans laquelle est immobilisé l'anticorps dirigé contre l'antigène ; cette bande retiendra les billes qui ont lié l'antigène. Une troisième bande de contrôle permet de relier les perles. Une couleur rouge (provenant de particules d'or) ou bleue (provenant de billes de latex) apparaissant sur la ligne d'essai indique un test positif. Si la couleur ne se développe que sur la ligne de contrôle, le test est négatif.
À l'instar des techniques ELISA, les tests à flux latéral tirent parti des sandwichs d'anticorps, apportant ainsi sensibilité et spécificité. Bien qu'ils ne soient pas aussi quantitatifs que l'ELISA, ces tests ont l'avantage d'être rapides, peu coûteux et de ne pas dépendre d'un équipement spécial. Ainsi, ils peuvent être exécutés n'importe où par n'importe qui. Certains craignent de confier des tests diagnostiques aussi puissants à des personnes qui ne comprennent peut-être pas les limites des tests, telles que la possibilité de résultats faussement positifs. Alors que les tests de grossesse à domicile sont désormais largement acceptés, les tests de détection d'anticorps à domicile pour des maladies telles que le VIH ont suscité certaines préoccupations au sein de la communauté médicale. Certains se demandent si l'auto-administration de tels tests devrait être autorisée en l'absence de personnel médical capable d'expliquer les résultats des tests et de prescrire des tests de confirmation appropriés. Toutefois, compte tenu du nombre croissant de tests à flux latéral qui deviennent disponibles et du développement rapide de la technologie de laboratoire sur puce (Figure 20.1), les tests médicaux à domicile devraient devenir encore plus courants à l'avenir.
Exercice\(\PageIndex{4}\)
- Quel est le processus physique requis pour que la méthode d'écoulement latéral fonctionne ?
- Expliquer l'utilité de la troisième bandelette lors d'un essai à écoulement latéral.
Le tableau\(\PageIndex{1}\) compare certains des principaux mécanismes et des exemples de certains des EIE abordés dans cette section, ainsi que des immunoblots, qui ont été abordés dans la section Détection de complexes antigène-anticorps.
| Type de test | Mécanisme | Procédures spécifiques | Exemples |
|---|---|---|---|
| Immunoblots | Utilise des conjugués enzyme-anticorps pour identifier des protéines spécifiques qui ont été transférées vers une membrane absorbante | Western blot : détecte la présence d'une protéine particulière | Détection de la présence de peptides du VIH (ou de peptides provenant d'autres agents infectieux) dans le sérum des patients |
| Immunocoloration | Utilise des conjugués enzyme-anticorps pour colorer des molécules spécifiques sur ou dans les cellules | Immunohistochimie : utilisée pour colorer des cellules spécifiques d'un tissu | Colorant pour détecter la présence de cellules CD8 dans le tissu de l'hôte |
| Test immunoenzymatique (ELISA) | Utilise des conjugués enzyme-anticorps pour quantifier les molécules cibles | ELISA direct : utilise un seul anticorps pour détecter la présence d'un antigène | Détection de l'antigène p24 du VIH jusqu'à un mois après l'infection |
| ELISA indirect : mesure la quantité d'anticorps produits contre un antigène | Détection d'anticorps anti-VIH dans le sérum | ||
| Essais immunochromatographiques (flux latéral) | Les techniques utilisent la capture de complexes antigène-anticorps fluides et marqués par couleur par un anticorps fixe pour le diagnostic de maladies | ELISA en sandwich : mesure la quantité d'antigène lié par l'anticorps | Détection d'anticorps contre divers agents pathogènes dans le sérum des patients (par exemple, streptocoque rapide, bandelette antipaludique) |
| Test de grossesse détectant la gonadotrophine chorionique humaine dans les urines |
Orientation clinique : 3e partie
Bien que le test ELISA indirect pour le VIH soit un test sensible, plusieurs considérations se compliquent. Tout d'abord, si une personne infectée est testée trop tôt après avoir été infectée, le test peut donner des résultats faussement négatifs. La fenêtre de séroconversion est généralement d'environ trois semaines, mais dans certains cas, elle peut être supérieure à deux mois.
Outre les faux négatifs, des faux positifs peuvent également survenir, généralement en raison d'infections antérieures par d'autres virus qui induisent des anticorps à réaction croisée. Le taux de faux positifs dépend de la marque de test utilisée, mais 0,5 % n'est pas inhabituel. 1 En raison de la possibilité d'un faux positif, tous les tests positifs sont suivis d'un test de confirmation. Ce test de confirmation est souvent un immunoblot (western blot) dans lequel les peptides du VIH présents dans le sang du patient sont identifiés à l'aide d'un conjugué d'enzyme MAB spécifique au VIH. Un Western blot positif confirmerait une infection par le VIH et un blot négatif confirmerait l'absence du VIH malgré le résultat positif du test ELISA.
Malheureusement, les tests Western pour les antigènes du VIH donnent souvent des résultats indéterminés, auquel cas ils ne confirment ni n'invalident les résultats de l'ELISA indirect. En fait, le taux d'indéterminants peut être de 10 à 49 % (c'est pourquoi, combiné à leur coût, les Western blots ne sont pas utilisés pour le dépistage). À l'instar de l'ELISA indirect, un Western blot indéterminé peut survenir en raison d'une réactivité croisée ou d'infections virales, de vaccinations ou de maladies auto-immunes antérieures.
Exercice\(\PageIndex{5}\)
- Sur les 1 300 patients testés, combien de tests ELISA faussement positifs devrait-on s'attendre ?
- Parmi les faux positifs, combien de western blots indéterminés pourrait-on s'attendre ?
- Comment l'hôpital traiterait-il les cas où le Western blot d'un patient était indéterminé ?
Concepts clés et résumé
- Les immunoessais enzymatiques (EIA) sont utilisés pour visualiser et quantifier les antigènes. Ils utilisent un anticorps conjugué à une enzyme pour se lier à l'antigène, et l'enzyme convertit un substrat en un produit final observable. Le substrat peut être un chromogène ou un fluorogène.
- L'immunocoloration est une technique d'EIA qui permet de visualiser les cellules d'un tissu (immunohistochimie) ou d'examiner les structures intracellulaires (immunocytochimie).
- L'ELISA directe est utilisée pour quantifier un antigène en solution. L'anticorps primaire capture l'antigène et l'anticorps secondaire délivre une enzyme. La production du produit final à partir du substrat chromogène est directement proportionnelle à la quantité d'antigène capturé.
- L'ELISA indirecte est utilisée pour détecter les anticorps dans le sérum d'un patient en fixant l'antigène au puits d'une plaque de microtitrage, ce qui permet à l'anticorps (primaire) du patient de se lier à l'antigène et à un anticorps secondaire conjugué à une enzyme de détecter l'anticorps primaire.
- Les tests d'immunofiltration et d'immunochromatographie sont utilisés dans les tests à flux latéral, qui peuvent être utilisés pour diagnostiquer la grossesse et diverses maladies en détectant des complexes antigène-anticorps marqués en couleur dans l'urine ou d'autres échantillons de liquide.
Notes
- 1 Thomas, Justin G., Victor Jaffe, Judith Shaffer et Jose Abreu, « Le dépistage du VIH : recommandations américaines 2014 », Médecin de famille ostéopathique 6, n° 6 (2014).


