20.3 : Essais d'agglutination
- Page ID
- 187786
Objectifs d'apprentissage
- Comparez l'agglutination directe et indirecte
- Identifier les différentes utilisations de l'hémagglutination dans le diagnostic de la maladie
- Expliquer comment les groupes sanguins sont déterminés
- Expliquer les étapes utilisées pour croiser le sang destiné à une transfusion
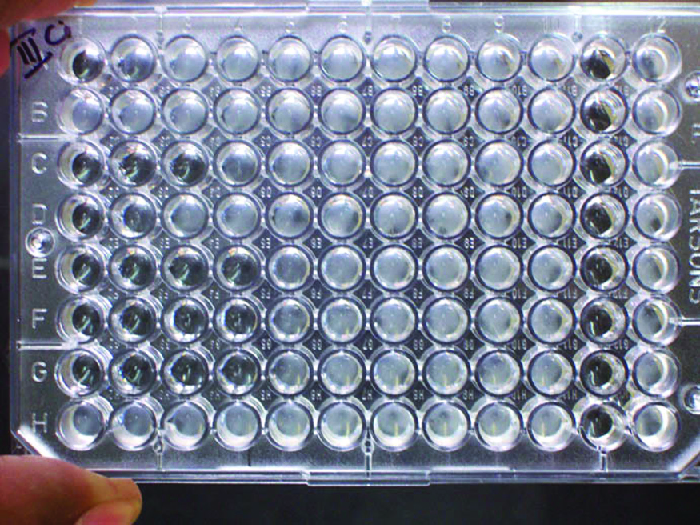
En plus de provoquer la précipitation des molécules solubles et la floculation des molécules en suspension, les anticorps peuvent également agglomérer des cellules ou des particules (par exemple, des billes de latex recouvertes d'antigène) dans le cadre d'un processus appelé agglutination (Figure 18.1.8). L'agglutination peut être utilisée comme indicateur de la présence d'anticorps dirigés contre des bactéries ou des globules rouges. Les tests d'agglutination sont généralement rapides et faciles à réaliser sur une lame de verre ou une plaque de microtitrage (Figure\(\PageIndex{1}\)). Les plaques de microtitrage sont dotées d'un réseau de puits destinés à contenir de petits volumes de réactifs et à observer les réactions (par exemple, l'agglutination) soit visuellement, soit à l'aide d'un spectrophotomètre spécialement conçu. Les puits sont de différentes tailles pour les essais impliquant différents volumes de réactifs.
Agglutination de bactéries et de virus
L'utilisation de tests d'agglutination pour identifier les bactéries streptococciques a été développée dans les années 1920 par Rebecca Lancefield en collaboration avec ses collègues A.R. Dochez et Oswald Avery. 1 Elle a utilisé des anticorps pour identifier la protéine M, un facteur de virulence sur les streptocoques qui est nécessaire à la capacité de la bactérie à provoquer l'angine streptococcique. La production d'anticorps contre la protéine M est essentielle à la mise en place d'une réponse protectrice contre la bactérie.
Lancefield a utilisé des antisérums pour montrer que différentes souches de la même espèce de streptocoques expriment différentes versions de la protéine M, ce qui explique pourquoi les enfants peuvent contracter une angine streptococcique à plusieurs reprises. Lancefield a classé les streptocoques bêta-hémolytiques en de nombreux groupes en fonction des différences antigéniques entre les polysaccharides spécifiques au groupe situés dans la paroi cellulaire bactérienne. Les souches sont appelées sérotypes parce qu'elles sont différenciées à l'aide d'antisérums. Il est important d'identifier les sérotypes présents lors d'une épidémie, car certains sérotypes peuvent provoquer une maladie plus grave que d'autres.
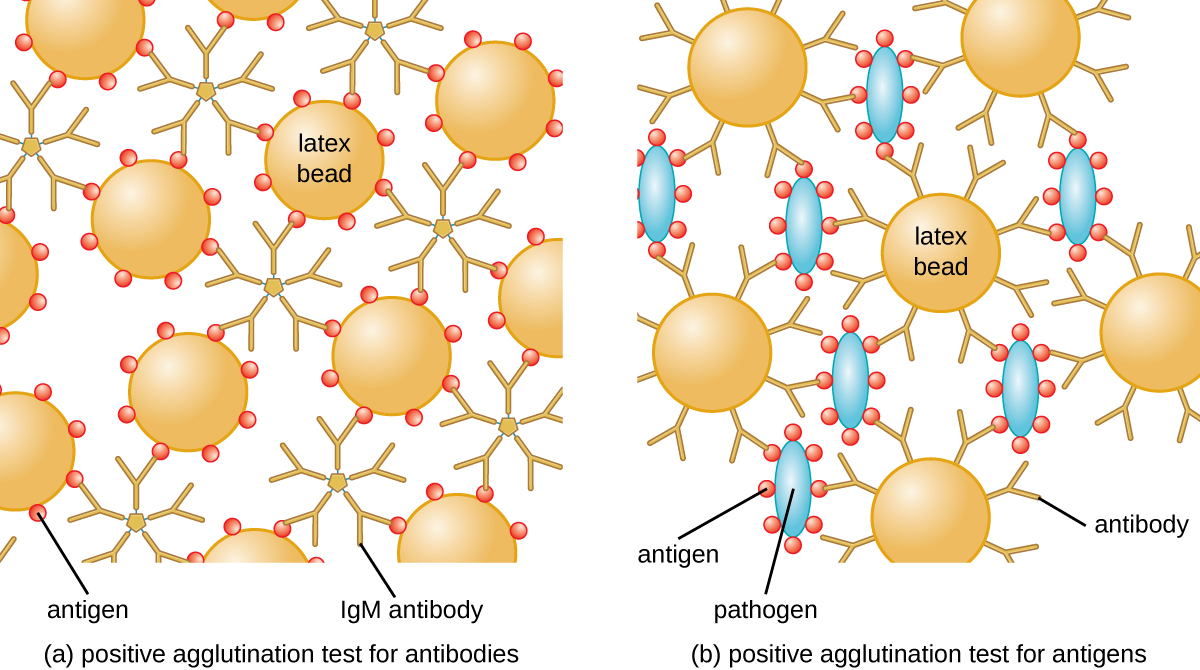
La méthode développée par Lancefield est un test d'agglutination directe, car les cellules bactériennes elles-mêmes s'agglutinent. Une stratégie similaire est plus couramment utilisée aujourd'hui pour identifier les sérovars de bactéries et de virus ; toutefois, pour améliorer la visualisation de l'agglutination, les anticorps peuvent être attachés à des billes de latex inertes. Cette technique est appelée test d'agglutination indirecte (ou test de fixation au latex), car l'agglutination des billes est un marqueur de la liaison des anticorps à un autre antigène (Figure\(\PageIndex{2}\)). Des tests indirects peuvent être utilisés pour détecter la présence d'anticorps ou d'antigènes spécifiques.
Pour identifier les anticorps dans le sérum d'un patient, l'antigène d'intérêt est fixé à des billes de latex. Lorsqu'ils sont mélangés au sérum du patient, les anticorps se lient à l'antigène, réticulant les billes de latex et provoquant une agglutination indirecte des billes ; cela indique la présence de l'anticorps (Figure\(\PageIndex{3}\)). Cette technique est le plus souvent utilisée lors de la recherche d'anticorps IgM, car leur structure permet une réticulation maximale. Un exemple largement utilisé de ce test est le test du facteur rhumatoïde (RF) pour confirmer un diagnostic de polyarthrite rhumatoïde. La RF est, en fait, la présence d'anticorps IgM qui se lient aux propres IgG du patient. RF agglutinera les billes de latex recouvertes d'IgG.
Dans le test inverse, des antigènes solubles peuvent être détectés dans le sérum d'un patient en attachant des anticorps spécifiques (généralement des mAbs) aux billes de latex et en mélangeant ce complexe au sérum (Figure\(\PageIndex{3}\)).
Les tests d'agglutination sont largement utilisés dans les pays sous-développés qui peuvent ne pas disposer d'installations appropriées pour la culture des bactéries. Par exemple, le test de Widal, utilisé pour le diagnostic de la fièvre typhoïde, permet de détecter l'agglutination de la sous-espèce typhi de Salmonella enterica dans le sérum des patients. Le test Widal est rapide, peu coûteux et utile pour surveiller l'étendue d'une épidémie ; cependant, il n'est pas aussi précis que les tests impliquant la culture de la bactérie. Le test de Widal produit fréquemment des faux positifs chez les patients ayant déjà été infectés par d'autres sous-espèces de Salmonella, ainsi que des faux négatifs chez les patients présentant une hyperprotéinémie ou un déficit immunitaire.
De plus, les tests d'agglutination sont limités par le fait que les patients ne produisent généralement pas de taux détectables d'anticorps au cours de la première semaine (ou plus) d'une infection. On dit qu'un patient a subi une séroconversion lorsque les taux d'anticorps atteignent le seuil de détection. En général, la séroconversion coïncide avec l'apparition des signes et des symptômes de la maladie. Cependant, dans le cas d'une infection au VIH, par exemple, la séroconversion prend généralement 3 semaines et, dans certains cas, elle peut prendre beaucoup plus de temps.
À l'instar des techniques utilisées pour le test en anneau de la précipitine et les tests sur plaque, il est courant de préparer des dilutions en série de deux fois du sérum du patient et de déterminer le titre de l'anticorps agglutinant présent. Étant donné que les taux d'anticorps changent au fil du temps dans les réponses immunitaires primaires et secondaires, il est possible de détecter des modifications du titre des anticorps en analysant les échantillons au fil du temps. Par exemple, une comparaison du titre pendant la phase aiguë d'une infection par rapport au titre de la phase de convalescence permet de déterminer si une infection est actuelle ou s'il s'est produit dans le passé. Il est également possible de contrôler dans quelle mesure le système immunitaire du patient répond à l'agent pathogène.
Regardez cette vidéo qui montre les réactions d'agglutination avec des billes de latex.
Exercice\(\PageIndex{1}\)
- Comment utilise-t-on l'agglutination pour distinguer les sérotypes les uns des autres ?
- Lors d'un test avec des billes de latex visant à détecter la présence d'anticorps dans le sérum d'un patient, avec quoi sont recouvertes les billes ?
- Que s'est-il passé lorsqu'un patient a subi une séroconversion ?
Hémagglutination
L'agglutination des globules rouges est appelée hémagglutination. Un test courant qui utilise l'hémagglutination est le test direct de Coombs, également appelé test direct des globulines antihumaines (DAT), qui recherche généralement des anticorps non agglutinants. Le test permet également de détecter le complément attaché aux globules rouges.
Le test de Coombs est souvent utilisé lorsqu'un nouveau-né présente un ictère, un jaunissement de la peau causé par des concentrations sanguines élevées de bilirubine, un produit de la dégradation de l'hémoglobine dans le sang. Le test de Coombs permet de déterminer si les globules rouges de l'enfant ont été liés par les anticorps de la mère. Ces anticorps activeraient le complément, entraînant la lyse des globules rouges et la jaunisse subséquente. Parmi les autres affections pouvant entraîner des tests directs de Coombs positifs, citons les réactions transfusionnelles hémolytiques, l'anémie hémolytique auto-immune, la mononucléose infectieuse (causée par le virus d'Epstein-Barr), la syphilis et la pneumonie à mycoplasmes. Un test de Coombs direct positif peut également être observé pour certains cancers et en tant que réaction allergique à certains médicaments (par exemple, la pénicilline).
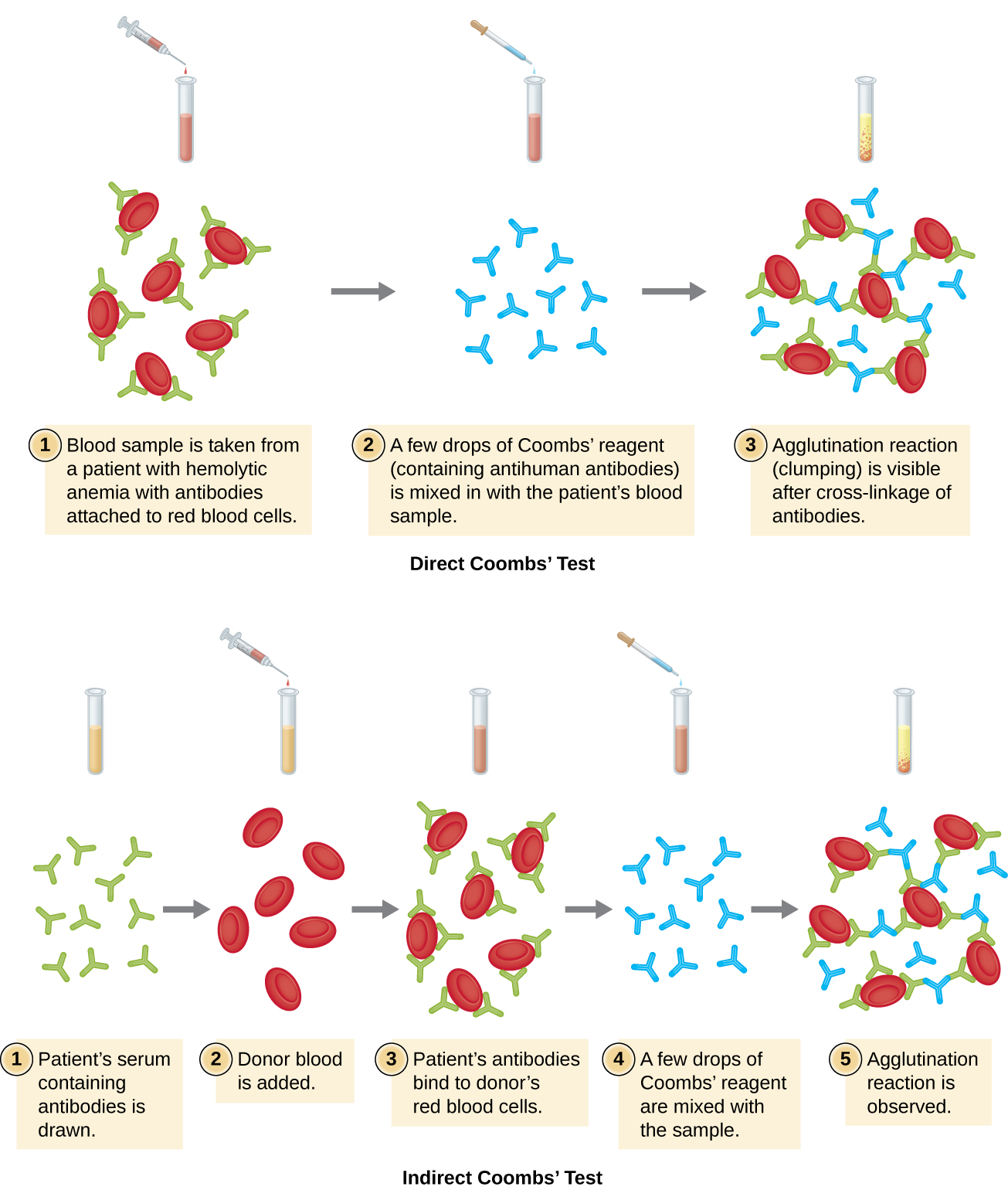
Les anticorps liés aux globules rouges dans ces conditions sont le plus souvent des IgG et, en raison de l'orientation des sites de liaison à l'antigène sur les IgG et de la taille relativement importante des globules rouges, il est peu probable qu'une agglutination visible se produise. Cependant, la présence d'IgG liées aux globules rouges peut être détectée en ajoutant le réactif de Coombs, un antisérum contenant des anticorps anti-IgG humains (qui peuvent être associés à un anticomplément) (Figure\(\PageIndex{4}\)). Le réactif de Coombs lie les IgG fixées aux globules rouges voisins et favorise ainsi l'agglutination.
Il existe également un test de Coombs indirect connu sous le nom de test à l'antiglobuline indirecte (IAT). Cela permet de dépister chez un individu les anticorps dirigés contre les antigènes des globules rouges (autres que les antigènes A et B) qui ne sont pas liés dans le sérum du patient (Figure\(\PageIndex{4}\)). L'IAT peut être utilisé pour dépister les femmes enceintes à la recherche d'anticorps susceptibles de provoquer une maladie hémolytique du nouveau-né. Il peut également être utilisé avant les transfusions sanguines. Vous trouverez plus de détails sur la manière dont l'IAT est effectué ci-dessous.
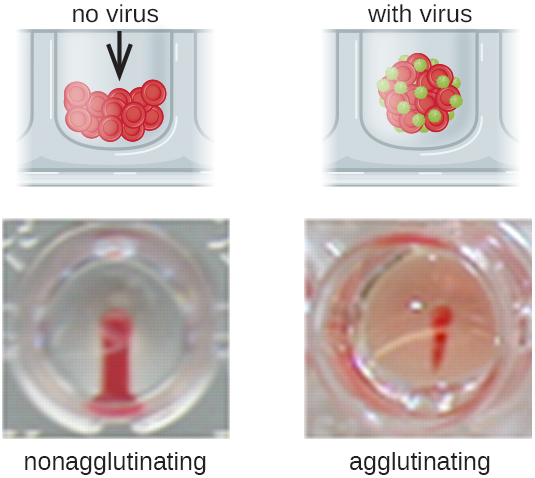
Les anticorps qui se lient aux globules rouges ne sont pas la seule cause de l'hémagglutination. Certains virus se lient également aux globules rouges, ce qui peut provoquer une agglutination lorsque les virus relient les globules rouges. Par exemple, les virus de la grippe présentent deux types de pics viraux différents appelés neuraminidase (N) et hémagglutinine (H), cette dernière étant nommée pour sa capacité à agglutiner les globules rouges (voir Virus). Ainsi, nous pouvons utiliser les globules rouges pour détecter la présence du virus de la grippe par des tests d'hémagglutination directe (HA), dans lesquels le virus provoque une agglutination visible des globules rouges. Les virus des oreillons et de la rubéole peuvent également être détectés à l'aide d'HA.
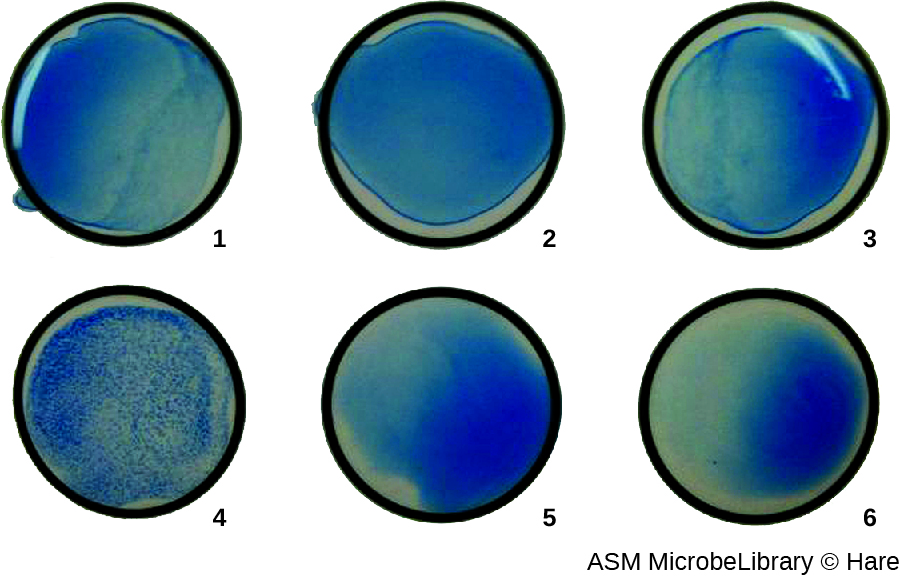
Le plus souvent, un test d'agglutination virale par dilution en série est utilisé pour mesurer le titre ou estimer la quantité de virus produite par culture cellulaire ou pour la production de vaccins. Un titre viral peut être déterminé à l'aide d'un HA direct en procédant à une dilution en série de l'échantillon contenant le virus, en commençant par une concentration élevée d'échantillon qui est ensuite diluée dans une série de puits. La dilution la plus élevée produisant une agglutination visible est le titre. Le test est réalisé dans une plaque de microtitrage avec des puits à fond en V ou rond. En présence de virus agglutinants, les globules rouges et le virus s'agglutinent et forment un tapis diffus au fond du puits. En l'absence de virus, les globules rouges roulent ou se sédimentent au fond du puits et forment une pastille dense, raison pour laquelle les puits à fond plat ne peuvent pas être utilisés (Figure\(\PageIndex{5}\)).
Une modification du test HA peut être utilisée pour déterminer le titre des anticorps antiviraux. La présence de ces anticorps dans le sérum d'un patient ou dans un antisérum produit en laboratoire neutralisera le virus et empêchera celui-ci d'agglutiner les globules rouges, ce qui en fait un test d'inhibition de l'hémagglutination virale (HIA). Dans ce test, le sérum du patient est mélangé à une quantité normalisée de virus. Après une courte incubation, une quantité standardisée de globules rouges est ajoutée et une hémagglutination est observée. Le titre du sérum du patient est la dilution la plus élevée qui bloque l'agglutination (Figure\(\PageIndex{6}\)).

Exercice\(\PageIndex{2}\)
- Quel est le mécanisme par lequel les virus sont détectés lors d'un test d'hémagglutination ?
- Quel résultat d'hémagglutination nous indique le titre du virus dans un échantillon ?
Animaux de laboratoire
Une grande partie de ce que nous savons aujourd'hui sur le système immunitaire humain provient de recherches menées sur des animaux, principalement des mammifères, comme modèles. Outre la recherche, les mammifères sont également utilisés pour la production de la plupart des anticorps et autres composants du système immunitaire nécessaires à l'immunodiagnostic. Les vaccins, les diagnostics, les thérapies et la médecine translationnelle en général ont tous été développés grâce à des recherches sur des modèles animaux.
Examinons certaines des utilisations courantes des animaux de laboratoire pour la production de composants du système immunitaire. Les cobayes sont utilisés comme source de complément, et les souris sont la principale source de cellules pour la production de mAbs. Ces MAb peuvent être utilisés dans la recherche et à des fins thérapeutiques. Les antisérums sont élevés chez diverses espèces, notamment les chevaux, les moutons, les chèvres et les lapins. Lors de la production d'un antisérum, l'animal est généralement injecté au moins deux fois et des adjuvants peuvent être utilisés pour renforcer la réponse immunitaire. Les gros animaux utilisés pour fabriquer des antisérums feront l'objet de prélèvements sanguins répétés sur de longues périodes, avec peu de danger pour les animaux, mais ce n'est généralement pas le cas pour les lapins. Bien que nous puissions obtenir quelques millilitres de sang dans les veines des oreilles des lapins, nous avons généralement besoin de volumes plus importants, ce qui entraîne la mort des animaux.
Nous utilisons également des animaux pour l'étude des maladies. La seule façon de cultiver Treponema pallidum pour l'étude de la syphilis est chez les animaux vivants. De nombreux virus peuvent être cultivés en culture cellulaire, mais la croissance en culture cellulaire ne nous apprend que très peu de choses sur la façon dont le système immunitaire réagira au virus. Lorsque nous travaillons sur une maladie récemment découverte, nous appliquons toujours les postulats de Koch, selon lesquels le fait de provoquer une maladie chez des animaux de laboratoire à l'aide d'agents pathogènes issus de la culture pure est une étape cruciale pour prouver qu'un microorganisme particulier est à l'origine d'une maladie. L'étude de la prolifération des bactéries et des virus chez les animaux hôtes et de la réaction du système immunitaire de l'hôte est au cœur de la recherche microbiologique depuis plus de 100 ans.
Bien que l'utilisation d'animaux de laboratoire soit essentielle à la recherche scientifique et aux diagnostics médicaux, de nombreuses personnes s'opposent vivement à l'exploitation des animaux au profit de l'homme. Cet argument éthique n'est pas nouveau : en effet, l'une des filles de Charles Darwin était une antivivisectionniste active (la vivisection est la pratique qui consiste à couper ou à disséquer un animal vivant pour l'étudier). La plupart des scientifiques reconnaissent qu'il devrait y avoir des limites à la mesure dans laquelle les animaux peuvent être exploités à des fins de recherche. Des considérations éthiques ont conduit les National Institutes of Health (NIH) à élaborer des réglementations strictes sur les types de recherches qui peuvent être effectuées. Ces réglementations comprennent également des directives pour le traitement sans cruauté des animaux de laboratoire, établissant des normes pour leur hébergement, leur soin et leur euthanasie. Le document des NIH intitulé « Guide for the Care and Use of Laboratory Animals » indique clairement que l'utilisation d'animaux dans la recherche est un privilège accordé par la société aux chercheurs.
Les directives du NIH sont basées sur le principe des trois R : remplacer, affiner et réduire. Les chercheurs devraient s'efforcer de remplacer les modèles animaux par des modèles non vivants, de remplacer les vertébrés par des invertébrés dans la mesure du possible, ou d'utiliser des modèles informatiques le cas échéant. Ils devraient affiner les procédures d'élevage et expérimentales afin de réduire la douleur et la souffrance, et utiliser des plans et des procédures expérimentaux qui réduisent le nombre d'animaux nécessaires pour obtenir les informations souhaitées. Pour obtenir un financement, les chercheurs doivent prouver aux évaluateurs des NIH que la recherche justifie l'utilisation d'animaux et que leur utilisation est conforme aux directives.
Au niveau local, tout établissement qui utilise des animaux et reçoit un financement fédéral doit disposer d'un comité institutionnel de soins et d'utilisation des animaux (IACUC) qui veille au respect des directives des NIH. L'IACUC doit comprendre des chercheurs, des administrateurs, un vétérinaire et au moins une personne n'ayant aucun lien avec l'institution, c'est-à-dire un citoyen concerné. Ce comité effectue également des inspections des laboratoires et des protocoles. Pour les recherches impliquant des sujets humains, un comité d'examen institutionnel (IRB) veille au respect des directives appropriées.
Visitez ce site pour consulter le guide des NIH pour le soin et l'utilisation des animaux de laboratoire.
Groupe sanguin et appariement croisé
Outre les anticorps dirigés contre les bactéries et les virus auxquels ils ont déjà été exposés, la plupart des individus sont également porteurs d'anticorps dirigés contre des groupes sanguins autres que le leur. Il existe actuellement 33 systèmes de groupes sanguins importants sur le plan immunologique, dont beaucoup sont restreints au sein de divers groupes ethniques ou aboutissent rarement à la production d'anticorps. Les plus importants et peut-être les plus connus sont les groupes sanguins ABO et Rh (voir Figure 19.1.3).
Lorsque des unités de sang sont envisagées pour la transfusion, des analyses sanguines doivent être effectuées avant la transfusion. Pour l'unité sanguine, des anticorps préparés commercialement contre les antigènes A, B et Rh sont mélangés à des globules rouges provenant des unités afin de confirmer initialement que le groupe sanguin sur l'unité est exact. Une fois qu'une unité de sang a été demandée pour transfusion, il est vital de s'assurer que le donneur (unité de sang) et le receveur (patient) sont compatibles avec ces antigènes cruciaux. En plus de confirmer le groupe sanguin de l'unité, le groupe sanguin du patient est également confirmé à l'aide des mêmes anticorps contre A, B et Rh préparés commercialement. Par exemple, comme le montre la figure\(\PageIndex{7}\), si le sang du donneur est A positif, il s'agglutinera avec l'antisérum anti-A et avec l'antisérum anti-RH. Si aucune agglutination n'est observée avec aucun des sérums, le groupe sanguin sera O négatif.
Après la détermination du groupe sanguin, juste avant de libérer le sang pour la transfusion, une comparaison croisée est réalisée au cours de laquelle une petite aliquote des globules rouges du donneur est mélangée au sérum du patient en attente de transfusion. Si le patient a des anticorps contre les globules rouges du donneur, une hémagglutination se produira. Pour confirmer tout résultat négatif et vérifier la présence de globules rouges sensibilisés, le réactif de Coombs peut être ajouté au mélange afin de faciliter la visualisation de l'interaction entre les anticorps et les globules rouges.
Dans certaines circonstances, un match croisé mineur peut également être effectué. Dans ce test, une petite aliquote de sérum de donneur est mélangée aux globules rouges du patient. Cela permet de détecter des anticorps agglutinants dans le sérum du donneur. Ce test est rarement nécessaire car les transfusions utilisent généralement des globules rouges concentrés dont la majeure partie du plasma est éliminée par centrifugation.
Les globules rouges contiennent de nombreux autres antigènes en plus de l'ABO et du Rh. Bien qu'il soit peu probable que la plupart des personnes possèdent des anticorps contre ces antigènes, les femmes qui ont eu des grossesses multiples ou les patientes ayant subi plusieurs transfusions peuvent en être porteuses en raison d'expositions répétées. Pour cette raison, un test de dépistage des anticorps est utilisé pour déterminer si de tels anticorps sont présents. Le sérum du patient est comparé aux globules rouges de type O préparés commercialement et regroupés qui expriment ces antigènes. En cas d'agglutination, l'antigène auquel le patient répond doit être identifié et il doit être déterminé qu'il n'est pas présent dans l'unité donneuse.

Exercice\(\PageIndex{3}\)
- Si le sang d'un patient s'agglutine avec du sérum anti-B, quel est le groupe sanguin du patient ?
- Qu'est-ce qu'un test d'appariement croisé et pourquoi est-il effectué ?
\(\PageIndex{1}\)Le tableau résume les différents types de tests d'agglutination abordés dans cette section.
| Type de test | Mécanisme | Exemple |
|---|---|---|
| Agglutination | Direct : L'anticorps est utilisé pour agglutiner les cellules bactériennes ou d'autres grandes structures | Bactéries sérotypées |
| Indirect : les billes de latex sont couplées à un antigène ou à un anticorps pour rechercher un anticorps ou un antigène, respectivement, dans le sérum du patient | Confirmation de la présence du facteur rhumatoïde (IgM liant les IgM) dans le sérum du patient | |
| Hémagglutination | Direct : Certaines bactéries et certains virus relient les globules rouges et les agglutinent | Diagnostic de la grippe, des oreillons et de la rougeole |
| Test de Coombs direct (DAT) : détecte les anticorps non agglutinants ou les protéines du complément sur les globules rouges in vivo | Vérification de la présence d'anticorps maternels se liant aux globules rouges néonatals | |
| Test de Coombs indirect (IAT) : permet de dépister chez un individu la présence d'anticorps dirigés contre les antigènes des globules rouges (autres que les antigènes A et B) qui ne sont pas liés dans le sérum d'un patient in vitro | Réalisation de tests sanguins avant la transfusion | |
| Inhibition de l'hémagglutination virale : utilise les anticorps d'un patient pour inhiber l'agglutination virale | Diagnostic de diverses maladies virales par la présence d'anticorps du patient contre le virus | |
| Typage sanguin et appariement croisé : détecte l'ABO, le Rh et les antigènes mineurs dans le sang | Adapte le sang du donneur aux besoins immunitaires du |
Concepts clés et résumé
- Les anticorps peuvent agglutiner des cellules ou de grosses particules pour former une matrice visible. Les tests d'agglutination sont souvent effectués sur des cartes ou sur des plaques de microtitrage qui permettent de multiples réactions côte à côte à l'aide de petits volumes de réactifs.
- L'utilisation d'antisérums contre certaines protéines permet d'identifier les sérotypes au sein des espèces de bactéries.
- La détection d'anticorps dirigés contre un agent pathogène peut être un outil puissant pour diagnostiquer une maladie, mais il faut un certain temps avant que les patients ne passent par la séroconversion et que le taux d'anticorps ne devienne détectable.
- L'agglutination de billes de latex lors d'essais d'agglutination indirecte peut être utilisée pour détecter la présence d'antigènes ou d'anticorps spécifiques dans le sérum du patient.
- La présence de certains anticorps antibactériens et antiviraux peut être confirmée par l'utilisation du test direct de Coombs, qui utilise le réactif de Coombs pour réticuler les anticorps liés aux globules rouges et faciliter l'hémagglutination.
- Certains virus et bactéries se lient aux globules rouges et les agglutinent ; cette interaction est à la base du test d'hémagglutination directe, le plus souvent utilisé pour déterminer le titre du virus en solution.
- Les tests de neutralisation quantifient le taux d'anticorps spécifiques au virus en mesurant la diminution de l'hémagglutination observée après mélange du sérum du patient avec une quantité normalisée de virus.
- Les tests d'hémagglutination sont également utilisés pour sélectionner et comparer le sang du donneur et du receveur afin de s'assurer que le receveur de la transfusion ne contient pas d'anticorps dirigés contre les antigènes dans le sang donné.
Notes
- 1 Lancefield, Rebecca C., « Le complexe antigénique de Streptococcus haemoliticus. I. Démonstration d'une substance spécifique à un type dans des extraits de Streptococcus haemolyticus », The Journal of Experimental Medicine 47, n° 1 (1928) : 91-103.


