20.2 : Détection de complexes antigène-anticorps in vitro
- Page ID
- 187794
Objectifs d'apprentissage
- Décrire les différents types de tests utilisés pour trouver des complexes antigène-anticorps
- Décrire les circonstances dans lesquelles les complexes antigène-anticorps précipitent hors de la solution
- Expliquer comment les anticorps contenus dans le sérum des patients peuvent être utilisés pour diagnostiquer une maladie
Les tests de laboratoire visant à détecter les anticorps et les antigènes à l'extérieur du corps (par exemple, dans un tube à essai) sont appelés essais in vitro. Lorsque les anticorps et leurs antigènes correspondants sont présents dans une solution, nous pouvons souvent observer une réaction de précipitation au cours de laquelle de grands complexes (réseaux) se forment et se déposent hors de la solution. Dans les prochaines sections, nous aborderons plusieurs essais in vitro courants.
Réactions à la précipitine
Un complexe antigène-anticorps visible est appelé précipitine, et les essais in vitro qui produisent une précipitine sont appelés réactions à la précipitine. Une réaction de précipitine implique généralement l'ajout d'antigènes solubles dans un tube à essai contenant une solution d'anticorps. Chaque anticorps possède deux bras, chacun pouvant se lier à un épitope. Lorsqu'un anticorps se lie à deux antigènes, les deux antigènes sont liés ensemble par l'anticorps. Un réseau peut se former lorsque les anticorps lient de plus en plus d'antigènes entre eux, ce qui entraîne une précipitine (Figure\(\PageIndex{1}\)). La plupart des tests de précipitine utilisent un antisérum polyclonal plutôt que des anticorps monoclonaux, car les anticorps polyclonaux peuvent se lier à de multiples épitopes, ce qui augmente la probabilité de formation de réseaux. Bien que les mAbs puissent se lier à certains antigènes, la liaison se produira moins souvent, ce qui réduira considérablement la probabilité de formation d'une précipitine visible.
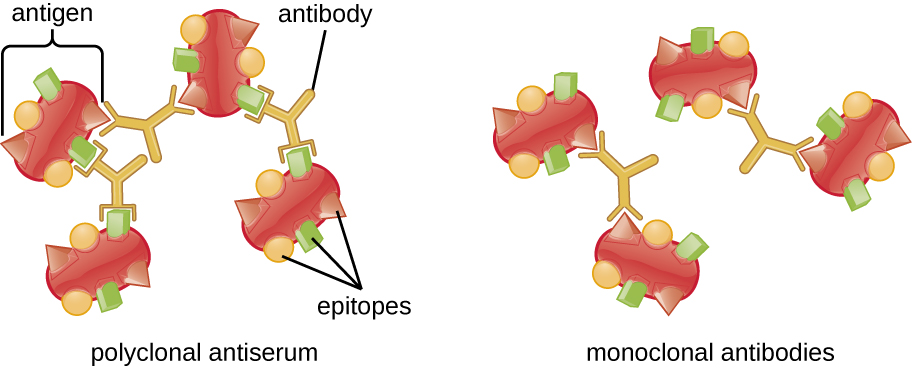
La quantité de précipitations dépend également de plusieurs autres facteurs. Par exemple, la précipitation est améliorée lorsque les anticorps ont une affinité élevée pour l'antigène. Alors que la plupart des anticorps se lient à l'antigène avec une affinité élevée, même la liaison à haute affinité utilise des liaisons non covalentes relativement faibles, de sorte que les interactions individuelles se brisent souvent et que de nouvelles interactions se produisent.
De plus, pour que la formation de précipitine soit visible, il doit y avoir un rapport optimal entre anticorps et antigène. Il est peu probable que le rapport optimal soit un ratio antigène/anticorps de 1:1 ; il peut varier considérablement en fonction du nombre d'épitopes présents sur l'antigène et de la classe d'anticorps. Certains antigènes peuvent ne comporter qu'un ou deux épitopes reconnus par l'antisérum, tandis que d'autres peuvent avoir de nombreux épitopes différents et/ou de multiples instances du même épitope sur une seule molécule d'antigène.
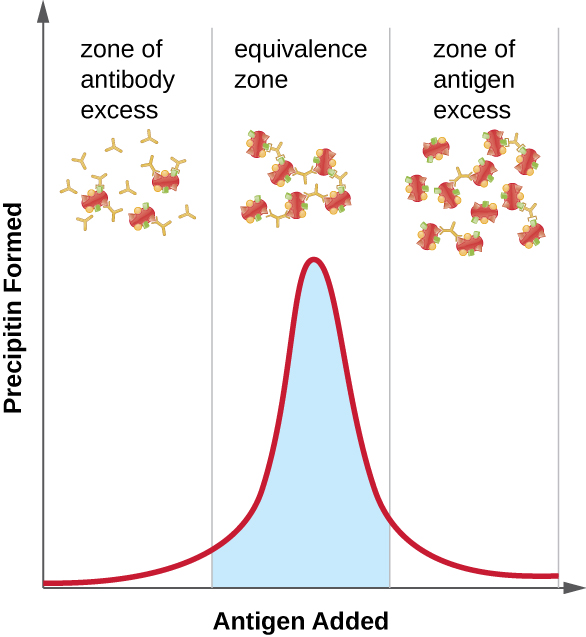
La figure\(\PageIndex{2}\) montre comment le rapport antigène/anticorps affecte la quantité de précipitations. Pour atteindre le ratio optimal, l'antigène est lentement ajouté à une solution contenant des anticorps et la quantité de precipitine est déterminée qualitativement. Au départ, il n'y a pas assez d'antigène pour produire la formation visible de réseaux ; c'est ce que l'on appelle la zone d'excès d'anticorps. Au fur et à mesure que de l'antigène est ajouté, la réaction entre dans la zone d'équivalence (ou zone d'équivalence), où se produisent à la fois l'interaction optimale antigène-anticorps et la précipitation maximale. Si davantage d'antigène était ajouté, la quantité d'antigène deviendrait excessive et provoquerait en fait une diminution de la quantité de précipitations.
Exercice\(\PageIndex{1}\)
- Qu'est-ce qu'une précipitation ?
- Pourquoi les antisérums polyclonaux produisent-ils une meilleure réaction de précipitine ?
Test de l'anneau de précipitine
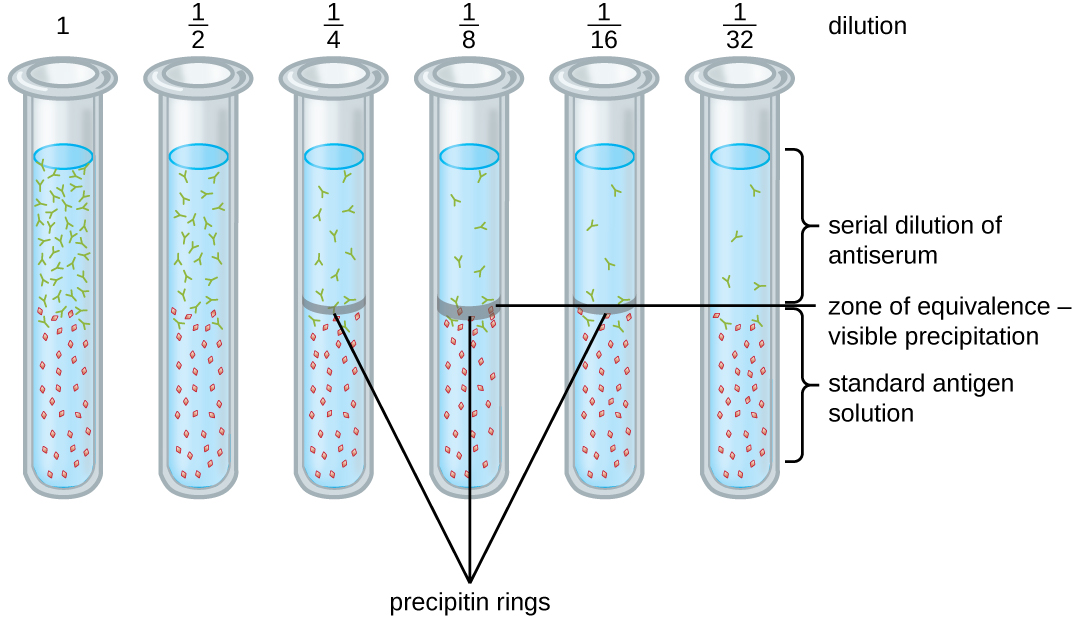
Diverses techniques nous permettent d'utiliser la formation de précipitine pour quantifier la concentration de l'antigène ou la quantité d'anticorps présents dans un antisérum. L'une de ces techniques est le test en anneau à la precipitine (Figure\(\PageIndex{3}\)), qui est utilisé pour déterminer la quantité relative d'anticorps spécifiques à l'antigène dans un échantillon de sérum. Pour réaliser ce test, un ensemble de tubes à essai est préparé en ajoutant une solution d'antigène au fond de chaque tube. Chaque tube reçoit le même volume de solution et la concentration d'antigènes est constante (par exemple, 1 mg/mL). Ensuite, du glycérol est ajouté à la solution d'antigène dans chaque tube à essai, suivi d'une dilution en série de l'antisérum. Le glycérol empêche le mélange de l'antisérum avec la solution d'antigène, ce qui permet la liaison antigène-anticorps uniquement à l'interface des deux solutions. Il en résulte un anneau visible de précipitine dans les tubes présentant un rapport antigène-anticorps à l'intérieur de la zone d'équivalence. Cette dilution maximale avec un anneau visible est utilisée pour déterminer le titre des anticorps. Le titre est l'inverse de la dilution la plus élevée donnant un résultat positif, exprimé sous la forme d'un nombre entier. Dans la figure\(\PageIndex{3}\), le titre est 16.
Bien que la mesure du titre ne nous indique pas en termes absolus la quantité d'anticorps présents, elle donne une mesure de l'activité biologique, qui est souvent plus importante que la quantité absolue. Dans cet exemple, il ne serait pas utile de connaître la masse d'IgG présente dans l'antisérum, car les anticorps présents présentent de nombreuses spécificités ; mais il est important pour nous de savoir dans quelle mesure l'activité des anticorps dans le sérum d'un patient est dirigée contre l'antigène d'intérêt (par exemple, un agent pathogène ou allergène particulier).
Test d'Ouchterlony
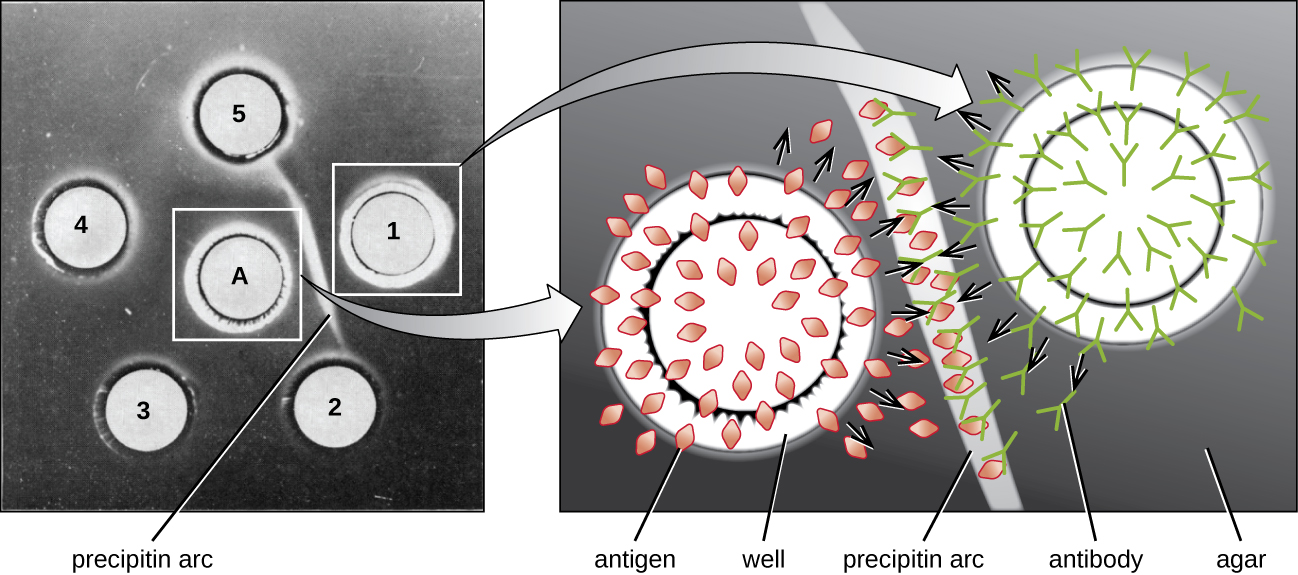
Bien que le test du cycle à la précipitine donne des informations sur les interactions anticorps-antigènes, il présente également certains inconvénients. Elle nécessite l'utilisation de grandes quantités de sérum, et il faut faire très attention à ne pas mélanger les solutions et à ne pas perturber l'anneau. La réalisation d'un test similaire dans une matrice de gel d'agar-agar peut minimiser ces problèmes. Ce type de test est diversement appelé double immunodiffusion ou test d'Ouchterlony pour Orjan Ouchterlony, 1 qui a décrit la technique pour la première fois en 1948.
Lorsque la gélose est hautement purifiée, elle produit un gel clair et incolore. Des trous sont percés dans le gel pour former des puits, et de l'antigène et des antisérums sont ajoutés aux puits voisins. Les protéines peuvent diffuser à travers le gel et des arcs de précipitine se forment entre les puits situés dans la zone d'équivalence. Comme le réseau de précipitine est trop large pour être diffusé à travers le gel, les arcs sont fermement maintenus en place et sont faciles à voir (Figure\(\PageIndex{4}\)).
Bien qu'il existe aujourd'hui des méthodes plus sensibles et plus quantitatives pour détecter les interactions anticorps-antigènes, le test d'Ouchterlony fournit un moyen rapide et qualitatif de déterminer si un antisérum contient des anticorps contre un antigène particulier. Le test d'Ouchterlony est particulièrement utile pour la recherche de réactivité croisée. Nous pouvons comparer un antisérum à un groupe d'antigènes étroitement apparentés et voir quelles combinaisons forment des arcs de précipitine.
Test d'immunodiffusion radiale
Le test d'immunodiffusion radiale (RID) est similaire au test d'Ouchterlony, mais il est utilisé pour quantifier précisément la concentration d'antigènes plutôt que pour comparer différents antigènes. Dans ce test, l'antisérum est ajouté à de la gélose tempérée (gélose liquide à une température légèrement supérieure à 45 °C), qui est versée dans une petite boîte de Pétri ou sur une lame de verre et laissée refroidir. Des puits sont découpés dans la gélose refroidie, puis de l'antigène est ajouté aux puits et laissé diffuser. Lorsque l'antigène et l'anticorps interagissent, ils forment une zone de précipitation. Le carré du diamètre de la zone de précipitation est directement proportionnel à la concentration d'antigène. En mesurant les zones de précipitations produites par des échantillons de concentration connue (voir l'anneau extérieur des échantillons sur la figure\(\PageIndex{5}\)), nous pouvons préparer une courbe standard pour déterminer la concentration d'une solution inconnue. Le test RID est également un test utile pour déterminer la concentration de nombreuses protéines sériques telles que les protéines du complément C3 et C4, entre autres.
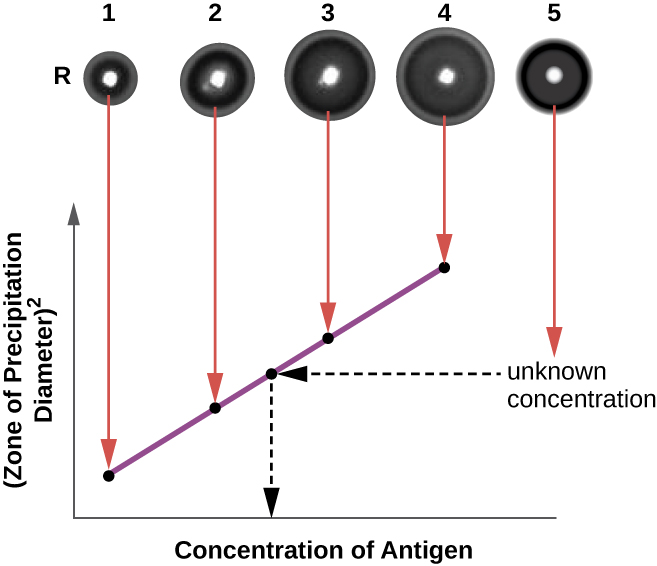
Exercice\(\PageIndex{2}\)
- Pourquoi un anneau de précipitine se forme-t-il lors d'un test d'anneau de précipitine, et quelles sont les raisons pour lesquelles un anneau peut ne pas se former ?
- Comparez et opposez les techniques utilisées dans un test d'Ouchterlony et un test d'immunodiffusion radiale.
Essais de floculation
Un test de floculation est similaire à une réaction de précipitine, sauf qu'il implique des antigènes insolubles tels que des lipides. Un floculant est similaire à une precipitine en ce sens qu'il existe un réseau visible d'antigène et d'anticorps, mais comme les lipides sont insolubles dans une solution aqueuse, ils ne peuvent pas précipiter. Au lieu d'une précipitation, on observe une floculation (formation de mousse) dans le liquide du tube à essai.
Utiliser la floculation pour détecter la syphilis
La syphilis est une infection transmissible sexuellement qui peut provoquer des maladies chroniques graves chez les adultes. En outre, elle se transmet facilement des mères infectées à leurs nouveau-nés pendant la grossesse et l'accouchement, ce qui entraîne souvent une mortinatalité ou de graves problèmes de santé à long terme pour le nourrisson. Malheureusement, la syphilis peut également être difficile à diagnostiquer chez les femmes enceintes, car elle est souvent asymptomatique, en particulier chez les femmes. De plus, l'agent causal, la bactérie Treponema pallidum, est à la fois difficile à cultiver sur des milieux de laboratoire classiques et trop petit pour être observé à l'aide d'une microcopie de routine. Pour ces raisons, les diagnostics présumés de syphilis sont généralement confirmés indirectement en laboratoire à l'aide de tests qui détectent les anticorps dirigés contre les antigènes tréponémiques.
En 1906, le scientifique allemand August von Wassermann (1866-1925) a introduit le premier test de dépistage de la syphilis qui reposait sur la détection d'anticorps antitréponémiques dans le sang du patient. Les anticorps détectés lors du test de Wassermann étaient des anticorps antiphospholipides non spécifiques à T. pallidum. Leur présence peut aider au diagnostic de la syphilis, mais comme elles ne sont pas spécifiques, elles peuvent également donner des résultats faussement positifs chez les patients atteints d'autres maladies et affections auto-immunes. Le test Wasserman original a été modifié au fil des ans pour minimiser les faux positifs et est maintenant connu sous le nom de test Venereal Disease Research Lab, mieux connu sous son acronyme, le test VDRL.
Pour effectuer le test VDRL, le sérum ou le liquide céphalo-rachidien du patient est placé sur une lame contenant un mélange de cardiolipine (un phospholipide antigénique présent dans la membrane mitochondriale de divers agents pathogènes), de lécithine et de cholestérol. La lécithine et le cholestérol stabilisent la réaction et diminuent les faux positifs. Les anticorps antitréponémiques provenant du sérum d'un patient infecté se lient à la cardiolipine et forment un floculant. Bien que le test VDRL soit plus spécifique que le test Wassermann original, des faux positifs peuvent tout de même survenir chez les patients atteints de maladies auto-immunes qui provoquent des lésions cellulaires importantes (par exemple, le lupus érythémateux disséminé).
Test de neutralisation
Pour provoquer une infection, les virus doivent se lier aux récepteurs des cellules hôtes. Les anticorps antiviraux peuvent neutraliser les infections virales en enrobant les virions, bloquant ainsi leur liaison (Figure 18.1.6). Cette activité neutralise les virions et peut entraîner la formation de grands complexes anticorps-virus (qui sont facilement éliminés par phagocytose) ou par la fixation d'anticorps au virus et bloquant sa liaison aux récepteurs des cellules hôtes. Cette activité de neutralisation est à la base des essais de neutralisation, des tests sensibles utilisés pour le diagnostic des infections virales.
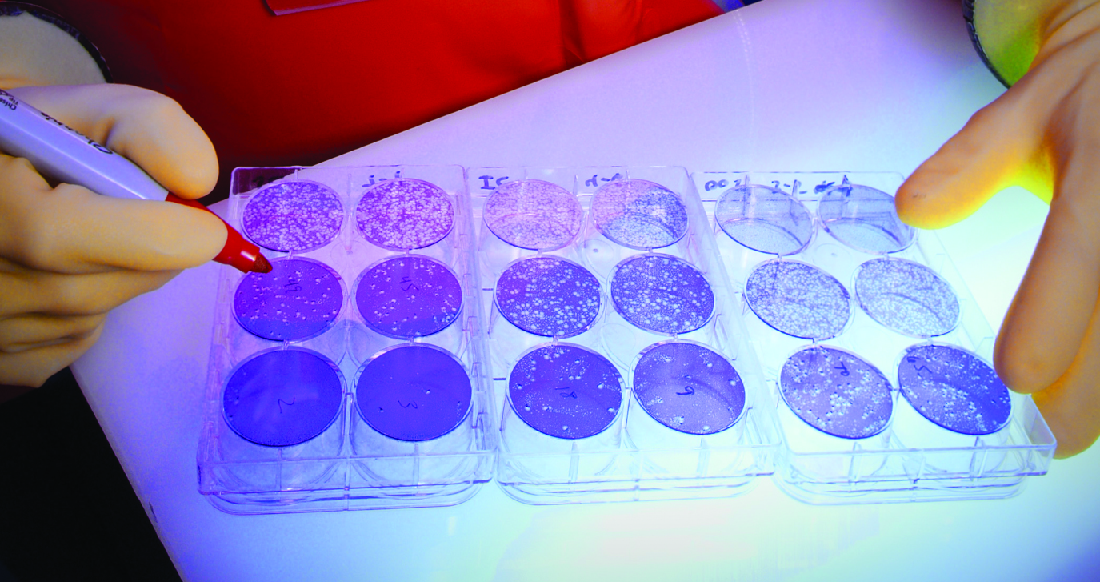
Lorsque les virus infectent des cellules, ils provoquent souvent des dommages (effets cytopathiques) qui peuvent inclure la lyse des cellules hôtes. Les effets cytopathiques peuvent être visualisés en cultivant des cellules hôtes dans une boîte de Pétri, en recouvrant les cellules d'une fine couche de gélose, puis en ajoutant le virus (voir Isolement, culture et identification des virus). Le virus se diffusera très lentement à travers la gélose. Un virus pénètre dans une cellule hôte, prolifère (endommageant les cellules), est libéré de la cellule hôte morte, puis se déplace vers les cellules voisines. À mesure que de plus en plus de cellules meurent, des plaques de cellules mortes se forment (Figure\(\PageIndex{6}\)).
Au cours d'une infection virale, le patient produira une réponse immunitaire au virus, et nous pouvons quantifier ces anticorps à l'aide d'un test de réduction de la plaque. Pour réaliser le test, une dilution en série est réalisée sur un échantillon de sérum. Chaque dilution est ensuite mélangée à une quantité normalisée du virus suspect. Tout anticorps spécifique au virus présent dans le sérum neutralisera une partie du virus. Les suspensions sont ensuite ajoutées aux cellules hôtes en culture pour permettre à tout virus non neutralisé d'infecter les cellules et de former des plaques après plusieurs jours. Le titre est défini comme l'inverse de la dilution la plus élevée montrant une réduction de 50 % du nombre de plaques. Le titre est toujours exprimé sous la forme d'un nombre entier. Par exemple, si une dilution de 1/64 est la plus forte pour obtenir une réduction de 50 % de la plaque dentaire, le titre est de 64.
La présence d'anticorps dans le sérum du patient ne permet pas de savoir si le patient est actuellement infecté ou s'il l'a été par le passé. Les infections actuelles peuvent être identifiées en attendant deux semaines et en testant un autre échantillon de sérum. Un titre neutralisant multiplié par quatre dans ce second échantillon indique une nouvelle infection.
Exercice\(\PageIndex{3}\)
Lors d'un test de neutralisation, si le sérum d'un patient contient un nombre élevé d'anticorps antiviraux, vous attendriez-vous à voir plus ou moins de plaques ?
Immunoélectrophorèse
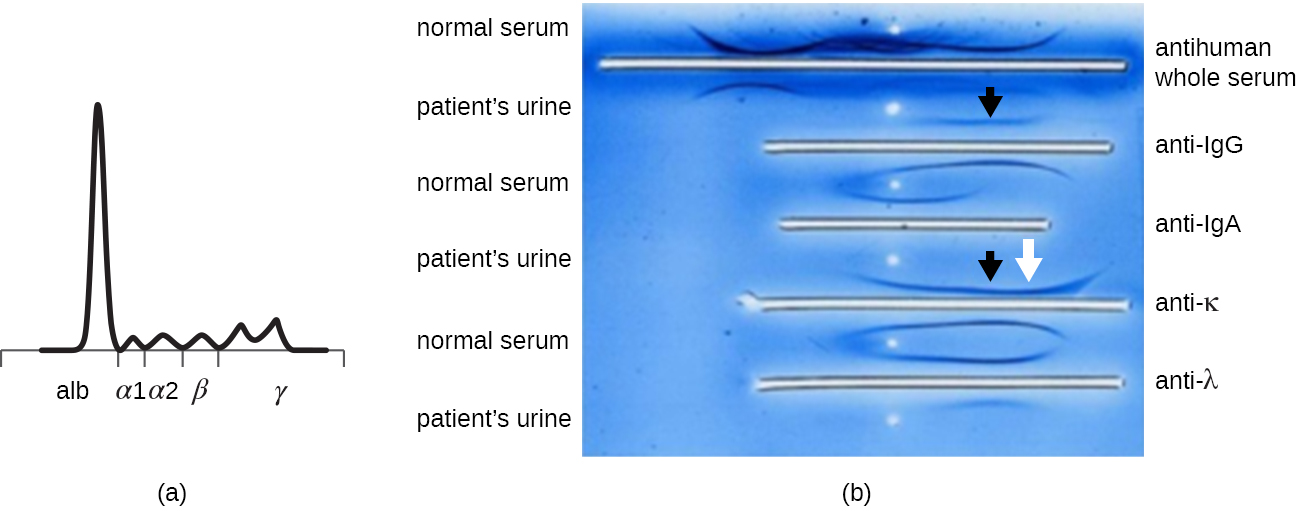
Lorsqu'un patient présente des taux élevés de protéines dans le sang ou perd des protéines dans les urines, un clinicien prescrira souvent un test d'électrophorèse sur gel de polyacrylamide (PAGE) (voir Visualisation et caractérisation de l'ADN, de l'ARN et des protéines). Ce test compare l'abondance relative des différents types de protéines sériques. Les profils anormaux d'électrophorèse des protéines peuvent être étudiés plus avant à l'aide de l'immunoélectrophorèse (IEP). L'IEP commence par exécuter une PAGE. Des antisérums dirigés contre des protéines sériques sélectionnées sont ajoutés à des cuvettes parallèles à la piste d'électrophorèse, formant des arcs de précipitine similaires à ceux observés dans un test d'Ouchterlony (Figure\(\PageIndex{7}\)). Cela permet d'identifier des protéines d'immunoglobulines anormales dans l'échantillon.
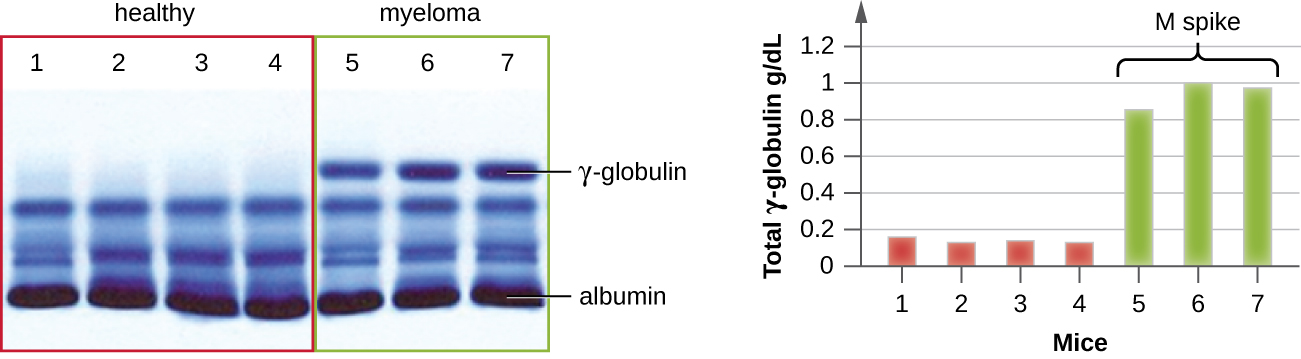
L'IEP est particulièrement utile pour diagnostiquer le myélome multiple, un cancer des cellules sécrétant des anticorps. Les patients atteints de myélome multiple ne peuvent pas produire d'anticorps sains ; ils produisent plutôt des anticorps anormaux qui sont des protéines monoclonales (protéines M). Ainsi, les patients atteints d'un myélome multiple présenteront des taux sériques élevés de protéines qui montreront une bande distincte dans la région des gammaglobulines d'un gel d'électrophorèse protéique et un pic marqué (de protéine M) sur le densitomètre plutôt que sur le frottis large normal (Figure\(\PageIndex{7}\)). Lorsque des anticorps dirigés contre les différents types de chaînes lourdes et légères d'anticorps sont utilisés pour former des arcs de précipitine, la protéine M provoquera des arcs nettement asymétriques contre une classe de chaînes lourdes et une classe de chaînes légères, comme le montre la figure\(\PageIndex{7}\).
Electrophorèse des protéines et caractérisation de la structure des immunoglobulines
L'avènement de l'électrophorèse a finalement conduit à la recherche et à la compréhension de la structure des anticorps. Lorsque le biochimiste suédois Arne Tiselius (1902-1971) a publié les premiers résultats d'électrophorèse des protéines en 1937 2, il a pu identifier la protéine albumine (la protéine sérique la plus petite et la plus abondante) grâce à la bande tranchante qu'elle produisait dans le gel. Les autres protéines sériques n'ayant pas pu être résolues par une simple électrophorèse des protéines, il a nommé les trois bandes larges, contenant de nombreuses protéines dans chaque bande, les alpha, bêta et gamma globulines. Deux ans plus tard, l'immunologiste américain Elvin Kabat (1914-2000) s'est rendu en Suède pour travailler avec Tiselius en utilisant cette nouvelle technique et a montré que les anticorps migraient sous forme de gammaglobulines. 3 Forts de ces nouvelles connaissances, les chercheurs ont rapidement découvert que le myélome multiple, en tant que cancer des cellules sécrétant des anticorps, pouvait être diagnostiqué provisoirement par la présence d'un important pic M dans la région des gammaglobulines par électrophorèse des protéines. Avant cette découverte, les études sur la structure des immunoglobulines étaient minimes, en raison de la difficulté d'obtenir des échantillons purs à étudier. Les sérums de patients atteints de myélome multiple se sont révélés être une excellente source d'immunoglobulines monoclonales hautement enrichies, fournissant la matière première pour les études menées au cours des 20 prochaines années et plus qui ont permis d'élucider la structure des immunoglobulines.
Exercice\(\PageIndex{4}\)
En général, à quoi sert un test d'immunoélectrophorèse ?
Test immunoblot : le Western Blot
Après avoir effectué une électrophorèse sur gel de protéines, des protéines spécifiques peuvent être identifiées dans le gel à l'aide d'anticorps. Cette technique est connue sous le nom de western blot. Après séparation des protéines par PAGE, les antigènes protéiques contenus dans le gel sont transférés vers une membrane de nitrocellulose et immobilisés sur celle-ci. Cette membrane peut ensuite être exposée à un anticorps primaire produit pour se lier spécifiquement à la protéine d'intérêt. Un second anticorps équipé d'une balise moléculaire se liera ensuite au premier. Ces anticorps secondaires sont couplés à une autre molécule telle qu'une enzyme ou un fluorophore (une molécule qui émet une fluorescence lorsqu'elle est excitée par la lumière). Lors de l'utilisation d'anticorps couplés à des enzymes, un substrat chromogène pour l'enzyme est ajouté. Ce substrat est généralement incolore mais se colore en présence de l'anticorps. La fluorescence ou la coloration du substrat permet d'identifier l'emplacement de la protéine spécifique dans la membrane à laquelle les anticorps sont liés (Figure\(\PageIndex{9}\)).
Généralement, les anticorps polyclonaux sont utilisés pour les tests Western Blot. Ils sont plus sensibles que les mAbs en raison de leur capacité à se lier à divers épitopes de l'antigène primaire, et le signal des anticorps polyclonaux est généralement plus fort que celui des mAbs. Des anticorps monoclonaux peuvent également être utilisés ; cependant, ils sont beaucoup plus coûteux à produire et sont moins sensibles, car ils ne peuvent reconnaître qu'un épitope spécifique.
Plusieurs variantes du western blot sont utiles pour la recherche. Dans le cas d'un transfert sud-ouest, les protéines sont séparées par SDS-PAGE, déposées sur une membrane de nitrocellulose, laissées à renaturer, puis sondées à l'aide d'une sonde à ADN marquée par fluorescence ou radioactivement ; le but du sud-ouest est d'identifier des interactions ADN et protéines spécifiques. Des tests de type Far Western sont effectués pour déterminer les interactions protéine-protéine entre les protéines immobilisées (séparées par SDS-PAGE, bloquées sur une membrane de nitrocellulose et laissées à renaturer) et les sondes protéiques sans anticorps. Les protéines non anticorps liées qui interagissent avec les protéines immobilisées lors d'un transfert Far Western peuvent être détectées par radiomarquage, fluorescence ou utilisation d'un anticorps avec une balise moléculaire enzymatique.
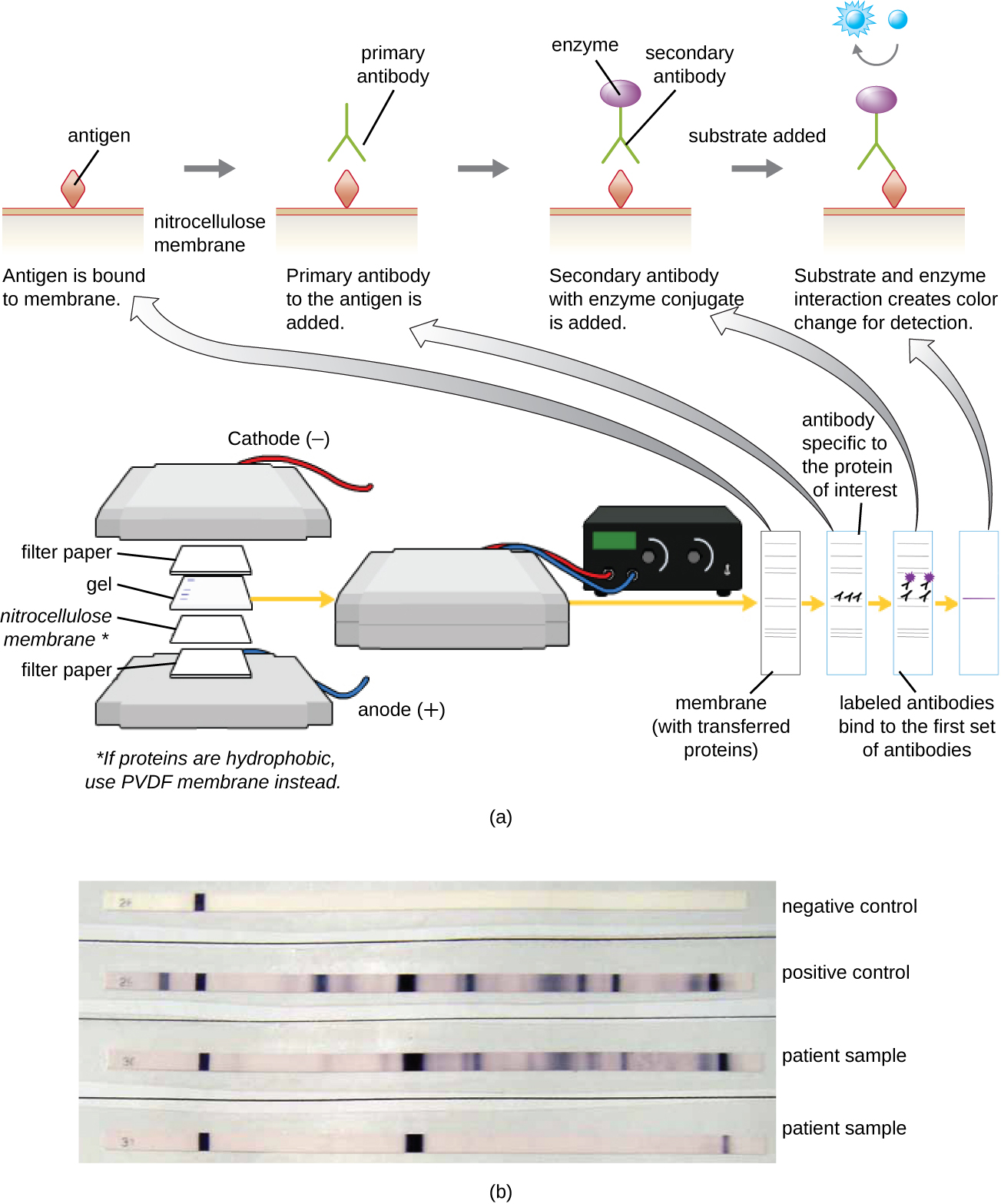
Exercice\(\PageIndex{5}\)
Quelle est la fonction de l'enzyme dans le test immunoblot ?
Test immunologique à médiation complémentaire
L'une des principales fonctions des anticorps est l'activation (fixation) du complément. Lorsque l'anticorps se lie à une bactérie, par exemple, certaines protéines du complément reconnaissent l'anticorps lié et activent la cascade du complément. En réponse, d'autres protéines du complément se lient à la bactérie, certaines servant d'opsonines pour augmenter l'efficacité de la phagocytose, tandis que d'autres créent des trous dans les membranes cellulaires des bactéries gram-négatives, provoquant ainsi une lyse. Cette activité lytique peut être utilisée pour détecter la présence d'anticorps dirigés contre des antigènes spécifiques dans le sérum.
Les globules rouges sont de bonnes cellules indicatrices à utiliser pour évaluer la cytolyse médiée par le complément. L'hémolyse des globules rouges libère de l'hémoglobine, un pigment de couleur vive, et l'hémolyse, même d'un petit nombre de globules rouges, fera en sorte que la solution devienne nettement rose (Figure\(\PageIndex{10}\)). Cette caractéristique joue un rôle dans le test de fixation du complément, qui permet la détection d'anticorps dirigés contre des agents pathogènes spécifiques. Le test de fixation du complément peut être utilisé pour vérifier la présence d'anticorps dirigés contre des agents pathogènes difficiles à cultiver en laboratoire, tels que les champignons, les virus ou la bactérie Chlamydia.
Pour effectuer le test de fixation du complément, l'antigène d'un agent pathogène est ajouté au sérum du patient. Si des anticorps dirigés contre l'antigène sont présents, l'anticorps se liera à l'antigène et fixera tout le complément disponible. Lorsque des globules rouges et des anticorps dirigés contre les globules rouges sont ensuite ajoutés au mélange, il ne restera plus de complément pour lyser les globules rouges. Ainsi, si la solution reste limpide, le test est positif. S'il n'y a pas d'anticorps antipathogènes dans le sérum du patient, les anticorps ajoutés activeront le complément pour lyser les globules rouges, ce qui donnera un résultat négatif (Figure\(\PageIndex{10}\)).
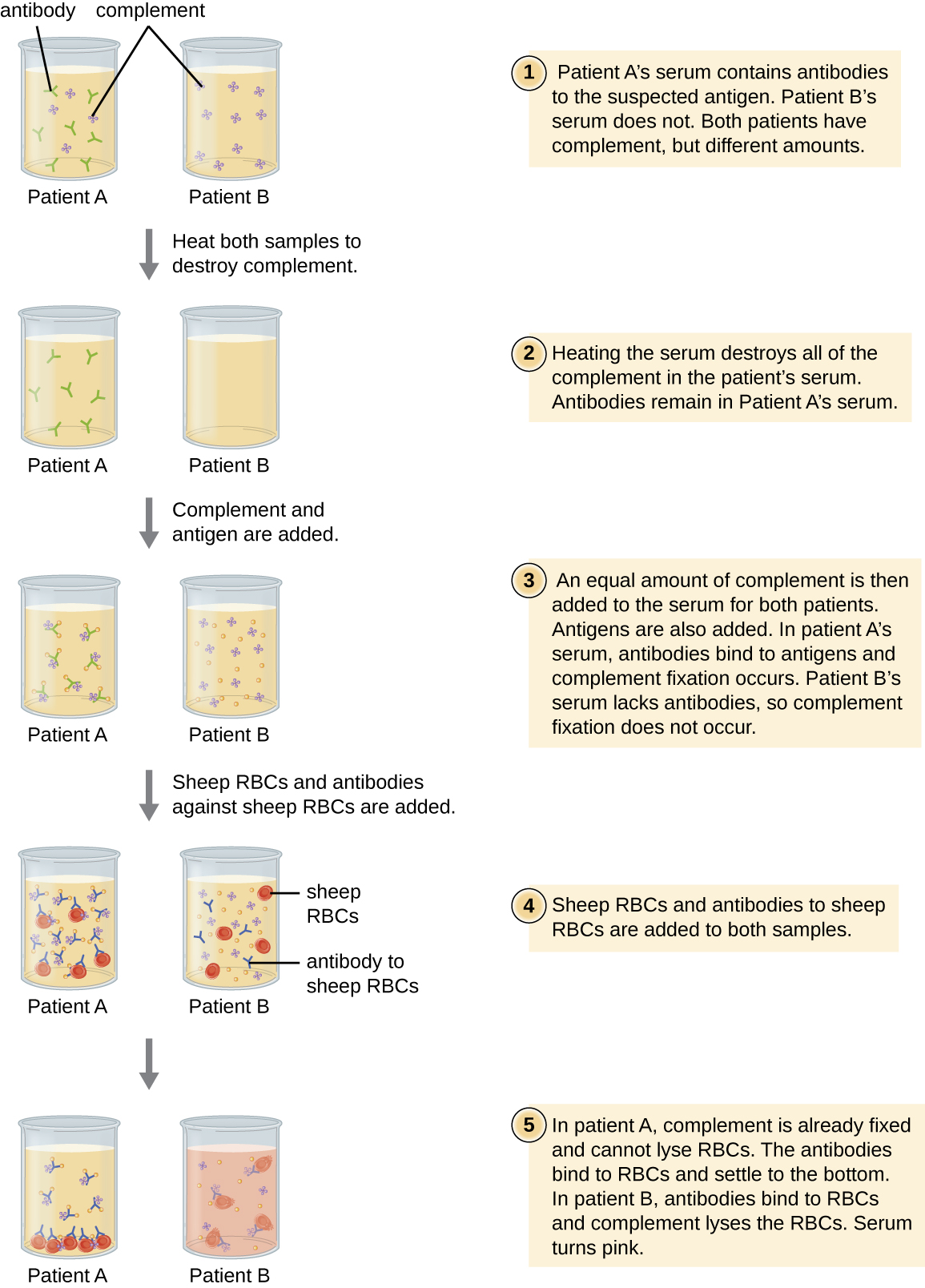
Regardez cette vidéo pour voir un aperçu des étapes du test de fixation du complément.
Exercice\(\PageIndex{6}\)
Lors d'un test de fixation du complément, si le sérum devient rose, le patient possède-t-il des anticorps dirigés contre l'antigène ou non ? Expliquez.
\(\PageIndex{1}\)Le tableau résume les différents types de tests anticorps-antigènes abordés dans cette section.
| Type de test | Mécanisme | Exemples |
|---|---|---|
| précipitation | L'anticorps se lie à l'antigène soluble, formant une précipitation visible | Test en anneau à la précipitine pour visualiser la formation de réseaux en solution |
| Immunoélectrophorèse pour examiner la distribution des antigènes après électrophorèse | ||
| Test d'Ouchterlony pour comparer divers antigènes | ||
| Test d'immunodiffusion radiale pour quantifier les antigènes | ||
| Floculation | L'anticorps se lie aux molécules insolubles en suspension, formant des agrégats visibles | Test VDRL pour la syphilis |
| Neutralisation | L'anticorps se lie au virus, bloquant l'entrée du virus dans les cellules cibles et empêchant la formation de plaques | Test de réduction de la plaque pour détecter la présence d'anticorps neutralisants dans le sérum des patients |
| Activation du complément | L'anticorps se lie à l'antigène, induisant l'activation du complément et ne laissant aucun complément pour la lyse des globules rouges | Test de fixation du complément pour les anticorps des patients contre des bactéries difficiles à cultiver telles que la chlamydia |
Concepts clés et résumé
- Lorsqu'ils sont présents dans le bon rapport, l'anticorps et l'antigène forment une précipitine, ou réseau, qui précipite hors de la solution.
- Un test en anneau de précipitine peut être utilisé pour visualiser la formation de réseaux en solution. Le test d'Ouchterlony démontre la formation de réseaux dans un gel. Le test d'immunodiffusion radiale est utilisé pour quantifier l'antigène en mesurant la taille d'une zone de précipitation dans un gel infusé d'anticorps.
- Les antigènes insolubles en suspension forment des floculants lorsqu'ils sont liés par des anticorps. C'est la base du test VDRL pour la syphilis dans lequel les anticorps antitréponémiques se lient à la cardiolipine en suspension.
- Les infections virales peuvent être détectées en quantifiant les anticorps neutralisant les virus dans le sérum d'un patient.
- Différentes classes d'anticorps dans le plasma ou le sérum sont identifiées par immunoélectrophorèse.
- La présence d'antigènes spécifiques (par exemple, des protéines bactériennes ou virales) dans le sérum peut être démontrée par des tests Western blot, dans lesquels les protéines sont transférées sur une membrane de nitrocellulose et identifiées à l'aide d'anticorps marqués.
- Dans le test de fixation du complément, le complément est utilisé pour détecter des anticorps contre divers agents pathogènes.
Notes
- 1 Ouchterlony, Örjan, « Méthode in vitro pour tester la capacité de production de toxines des bactéries diphtériques », Acta Pathologica Microbiologica Scandinavica 26, n° 4 (1949) : 516-24.
- 2 Tiselius, Arne, « Electrophorèse de la globuline sérique : analyse électrophorétique des sérums normaux et immunitaires », Biochemical Journal 31, n° 9 (1937) : 1464.
- 3 Tiselius, Arne et Elvin A. Kabat. « Une étude électrophorétique des sérums immunitaires et des préparations d'anticorps purifiés », The Journal of Experimental Medicine 69, n° 1 (1939) : 119-31.


