20.1 : Applications pratiques des anticorps monoclonaux et polyclonaux
- Page ID
- 187793
Objectifs d'apprentissage
- Comparer la méthode de développement, d'utilisation et les caractéristiques des anticorps monoclonaux et polyclonaux
- Expliquer la nature de la réactivité croisée des anticorps et expliquer pourquoi cela pose moins de problème avec les anticorps monoclonaux
Orientation clinique : 1ère partie
Lors d'un incident malheureux, un agent de santé aux prises avec une dépendance a été surpris en train de voler des seringues d'analgésiques et de les remplacer par des seringues remplies de substances inconnues. L'hôpital a immédiatement licencié l'employé et l'a fait arrêter ; toutefois, deux patients avec lesquels il avait travaillé ont par la suite été testés positifs au VIH.
Bien qu'il n'y ait aucune preuve que les infections provenaient des seringues contaminées, le médecin de santé publique de l'hôpital a pris des mesures immédiates pour déterminer si d'autres patients avaient été exposés à un risque. Bien que le travailleur n'ait été employé que depuis peu de temps, il a été établi qu'il avait été en contact avec plus de 1 300 patients. L'hôpital a décidé de contacter tous ces patients et de les faire tester pour le VIH.
Exercice\(\PageIndex{1}\)
- Pourquoi l'hôpital estime-t-il nécessaire de tester le VIH chez tous les patients ?
- Quels types de tests peuvent être utilisés pour déterminer si un patient est séropositif ?
En plus d'être essentiels à notre réponse immunitaire normale, les anticorps constituent de puissants outils de recherche et de diagnostic. La haute spécificité des anticorps en fait un excellent outil pour détecter et quantifier un large éventail de cibles, des médicaments aux protéines sériques en passant par les microorganismes. Grâce aux essais in vitro, les anticorps peuvent être utilisés pour précipiter des antigènes solubles, agglutiner (agglutiner) les cellules, opsoniser et tuer les bactéries à l'aide d'un complément, et neutraliser les médicaments, les toxines et les virus.
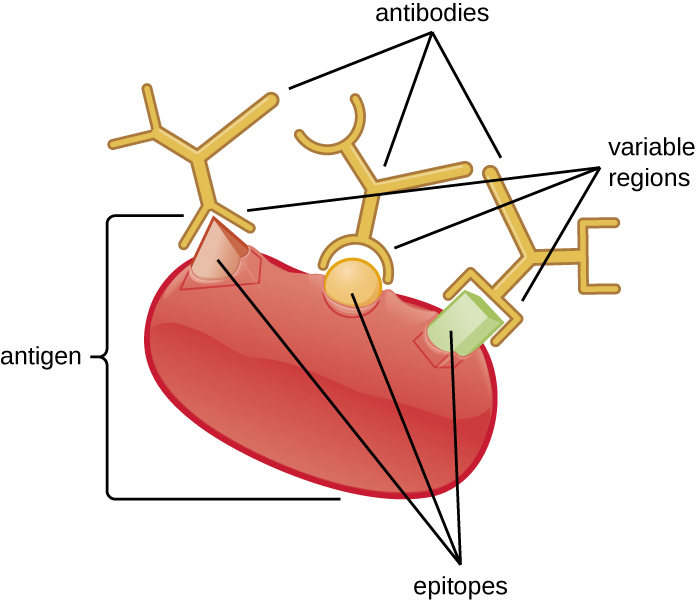
La spécificité d'un anticorps résulte du site de liaison à l'antigène formé dans les régions variables, c'est-à-dire des régions de l'anticorps qui présentent des profils uniques d'acides aminés qui ne peuvent se lier aux antigènes cibles que par une séquence moléculaire fournissant des charges complémentaires et des liaisons non covalentes. Il existe toutefois des limites à la spécificité des anticorps. Certains antigènes sont si similaires sur le plan chimique qu'une réactivité croisée se produit ; en d'autres termes, les anticorps produits contre un antigène se lient à un antigène chimiquement similaire mais différent. Prenons l'exemple d'un antigène constitué d'une seule protéine avec plusieurs épitopes (Figure\(\PageIndex{1}\)). Cette protéine unique peut stimuler la production de nombreux anticorps différents, dont certains peuvent se lier à des épitopes chimiquement identiques sur d'autres protéines.
Une réactivité croisée est plus susceptible de se produire entre des anticorps et des antigènes ayant une faible affinité ou une faible avidité. L'affinité, qui peut être déterminée expérimentalement, est une mesure de la force de liaison entre le site de liaison d'un anticorps et un épitope, tandis que l'avidité est la force totale de toutes les interactions dans un complexe anticorps-antigène (qui peut avoir plus d'un site de liaison). L'avidité est influencée par l'affinité ainsi que par les arrangements structuraux de l'épitope et par les régions variables de l'anticorps. Si un anticorps présente une affinité/avidité élevée pour un antigène spécifique, il est moins susceptible de réagir de manière croisée avec un antigène pour lequel il présente une affinité/avidité plus faible.
Exercice\(\PageIndex{2}\)
- Quelle propriété rend les anticorps utiles pour la recherche et le diagnostic clinique ?
- Qu'est-ce que la réactivité croisée et pourquoi se produit-elle ?
Production d'anticorps polyclonaux
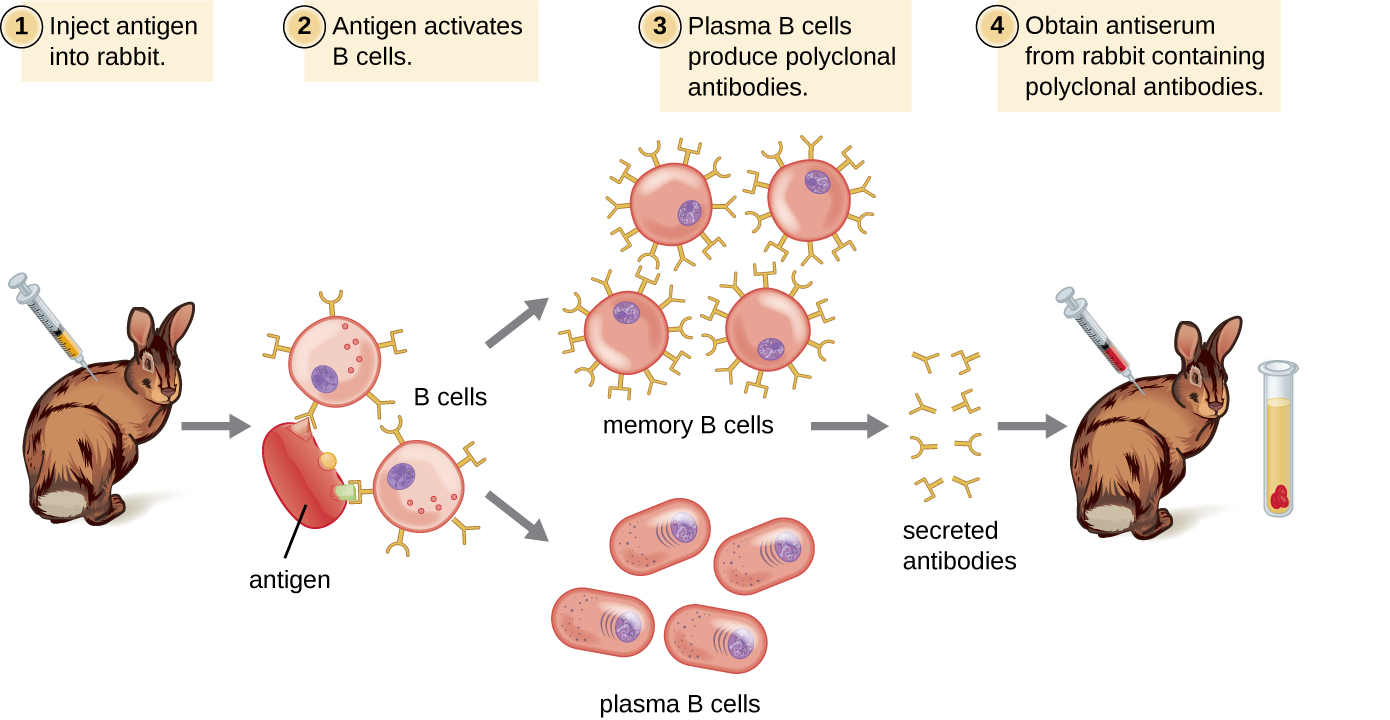
Les anticorps utilisés à des fins de recherche et de diagnostic sont souvent obtenus en injectant un antigène spécifique à un animal de laboratoire tel qu'un lapin ou une chèvre. En quelques semaines, le système immunitaire de l'animal produira des taux élevés d'anticorps spécifiques à l'antigène. Ces anticorps peuvent être collectés dans un antisérum, qui est du sérum entier prélevé sur un animal après exposition à un antigène. Comme la plupart des antigènes sont des structures complexes comportant de multiples épitopes, ils entraînent la production de multiples anticorps chez l'animal de laboratoire. Cette réponse dite d'anticorps polyclonaux est également typique de la réponse à une infection par le système immunitaire humain. L'antisérum prélevé sur un animal contiendra donc des anticorps provenant de plusieurs clones de lymphocytes B, chaque lymphocyte B répondant à un épitope spécifique de l'antigène (Figure\(\PageIndex{2}\)).
Les animaux de laboratoire reçoivent généralement au moins deux injections d'antigène lorsqu'ils sont utilisés pour produire de l'antisérum. La deuxième injection activera les cellules mémoire qui fabriquent des anticorps de classe IgG dirigés contre l'antigène. Les cellules mémoire subissent également une maturation par affinité, ce qui donne naissance à un pool d'anticorps présentant une affinité moyenne plus élevée. La maturation par affinité se produit en raison de mutations dans les régions variables du gène des immunoglobulines, ce qui entraîne la formation de lymphocytes B présentant des sites de liaison à l'antigène légèrement modifiés. Lors d'une réexposition à l'antigène, les lymphocytes B capables de produire des anticorps dotés de sites de liaison à l'antigène d'affinité plus élevée seront stimulés pour proliférer et produire plus d'anticorps que leurs homologues de moindre affinité. Un adjuvant, qui est un produit chimique qui provoque une activation généralisée du système immunitaire et stimule une plus grande production d'anticorps, est souvent mélangé à l'antigène avant l'injection.
L'antisérum obtenu à partir d'animaux contiendra non seulement des anticorps dirigés contre l'antigène introduit artificiellement en laboratoire, mais il contiendra également des anticorps dirigés contre tout autre antigène auquel l'animal a été exposé au cours de sa vie. Pour cette raison, les antisérums doivent d'abord être « purifiés » pour éliminer les autres anticorps avant de les utiliser à des fins de recherche ou de diagnostic.
Utilisations cliniques des antisérums polyclonaux
Les antisérums polyclonaux sont utilisés dans de nombreux tests cliniques conçus pour déterminer si un patient produit des anticorps en réponse à un pathogène particulier. Bien que ces tests soient certainement de puissants outils diagnostiques, ils ont leurs limites, car ils constituent un moyen indirect de déterminer la présence d'un agent pathogène particulier. Les tests basés sur une réponse polyclonale peuvent parfois mener à un résultat faussement positif, c'est-à-dire un test qui confirme la présence d'un antigène qui n'est en fait pas présent. Les tests à base d'anticorps peuvent également donner un résultat faussement négatif, qui se produit lorsque le test ne parvient pas à détecter un anticorps réellement présent.
La précision des tests d'anticorps peut être décrite en termes de sensibilité et de spécificité du test. La sensibilité du test est la probabilité d'obtenir un résultat positif lorsque le patient est effectivement infecté. Si un test présente une sensibilité élevée, la probabilité d'un faux négatif est faible. La spécificité du test, en revanche, est la probabilité d'obtenir un résultat négatif lorsque le patient n'est pas infecté. Si un test présente une spécificité élevée, la probabilité d'un faux positif est faible.
Les faux positifs se produisent souvent en raison de la réactivité croisée, qui peut se produire lorsque les épitopes d'un agent pathogène différent sont similaires à ceux trouvés sur le pathogène testé. Pour cette raison, les tests à base d'anticorps ne sont souvent utilisés que comme tests de dépistage ; si les résultats sont positifs, d'autres tests de confirmation sont utilisés pour s'assurer que les résultats n'étaient pas faussement positifs.
Par exemple, un échantillon de sang prélevé sur un patient soupçonné d'être atteint de l'hépatite C peut être analysé à l'aide d'anticorps qui se lient aux antigènes du virus de l'hépatite C. Si le patient est effectivement infecté par le virus de l'hépatite C, les anticorps se lieront aux antigènes, ce qui donnera un résultat de test positif. Si le patient n'est pas infecté par le virus de l'hépatite C, les anticorps ne se lient généralement à rien et le test doit être négatif ; toutefois, un faux positif peut survenir si le patient a déjà été infecté par l'un des nombreux agents pathogènes qui produisent des anticorps qui réagissent de manière croisée avec l'hépatite C antigènes viraux. Les tests d'anticorps pour l'hépatite C ont une sensibilité élevée (faible probabilité de faux négatif) mais une faible spécificité (forte probabilité de faux positif). Ainsi, les patients dont le test est positif doivent subir un deuxième test de confirmation afin d'exclure la possibilité d'un faux positif. Le test de confirmation est un test plus coûteux et plus long qui permet de détecter directement la présence d'ARN du virus de l'hépatite C dans le sang. Ce n'est que lorsque le test de confirmation est positif que le patient peut être définitivement diagnostiqué avec une infection par le virus de l'hépatite C. Les tests à base d'anticorps peuvent donner lieu à un faux négatif si, pour une raison quelconque, le système immunitaire du patient n'a pas produit de taux détectables d'anticorps. Pour certaines maladies, plusieurs semaines peuvent s'écouler après l'infection avant que le système immunitaire ne produise suffisamment d'anticorps pour atteindre le seuil de détection du test. Chez les patients immunodéprimés, le système immunitaire peut ne pas être capable de produire un taux détectable d'anticorps.
Une autre limite de l'utilisation de la production d'anticorps comme indicateur de la maladie est que les anticorps dans le sang persistent longtemps après la fin de l'infection. Selon le type d'infection, les anticorps seront présents pendant de nombreux mois ; parfois, ils peuvent être présents jusqu'à la fin de la vie du patient. Ainsi, un test positif à base d'anticorps signifie uniquement que le patient a été infecté à un moment donné ; cela ne prouve pas que l'infection est active.
Outre leur rôle dans le diagnostic, les antisérums polyclonaux peuvent activer le complément, détecter la présence de bactéries en milieu clinique et dans l'industrie alimentaire et effectuer un large éventail de réactions de précipitation permettant de détecter et de quantifier les protéines sériques, les virus ou d'autres antigènes. Toutefois, compte tenu des nombreuses spécificités des anticorps présents dans un antisérum polyclonal, il est fort probable que l'antisérum réagisse avec des antigènes auxquels la personne n'a jamais été exposée. Par conséquent, nous devons toujours tenir compte de la possibilité de résultats faussement positifs lorsque vous travaillez avec un antisérum polyclonal.
Exercice\(\PageIndex{3}\)
- Qu'est-ce qu'un faux positif et quelles sont les raisons pour lesquelles des faux positifs se produisent ?
- Qu'est-ce qu'un faux négatif et quelles sont les raisons pour lesquelles des faux positifs se produisent ?
- Si un patient obtient un résultat négatif à un test très sensible, quelle est la probabilité que la personne soit infectée par le pathogène ?
Production d'anticorps monoclonaux
Certains types de tests nécessitent une meilleure spécificité et une meilleure affinité en anticorps que celles qui peuvent être obtenues à l'aide d'un antisérum polyclonal. Pour atteindre cette haute spécificité, tous les anticorps doivent se lier avec une affinité élevée à un seul épitope. Cette haute spécificité peut être fournie par des anticorps monoclonaux (mAb). Le tableau\(\PageIndex{1}\) compare certaines des caractéristiques importantes des anticorps monoclonaux et polyclonaux.
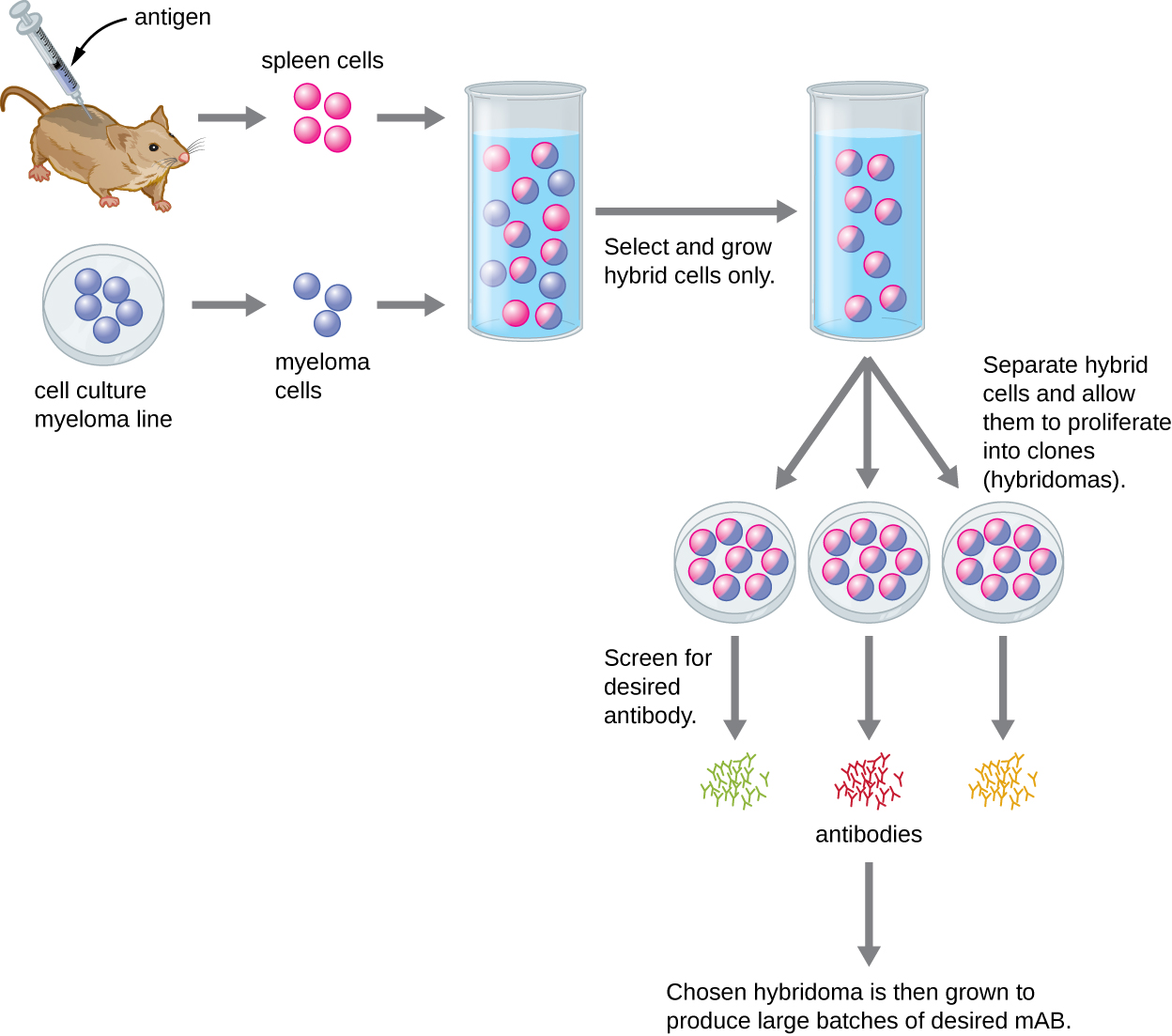
Contrairement aux anticorps polyclonaux, qui sont produits sur des animaux vivants, les anticorps monoclonaux sont produits in vitro par des techniques de culture tissulaire. Les mAb sont produits en immunisant plusieurs fois un animal, souvent une souris, avec un antigène spécifique. Les lymphocytes B de la rate de l'animal immunisé sont ensuite retirés. Comme les lymphocytes B normaux ne peuvent pas proliférer indéfiniment, ils sont fusionnés avec des lymphocytes B cancéreux immortels appelés cellules myélomateuses, pour produire des cellules d'hybridome. Toutes les cellules sont ensuite placées dans un milieu sélectif qui permet uniquement la croissance des hybridomes ; les cellules myélomateuses non fusionnées ne peuvent pas se développer et les lymphocytes B non fusionnés meurent. Les hybridomes, qui sont capables de croître en continu en culture tout en produisant des anticorps, sont ensuite criblés pour détecter le mAb souhaité. Ceux qui produisent le mAb souhaité sont cultivés en culture tissulaire ; le milieu de culture est récolté périodiquement et les mAbs sont purifiés à partir du milieu. Il s'agit d'un processus très coûteux et fastidieux. Des semaines de culture et plusieurs litres de milieu peuvent être nécessaires pour fournir suffisamment de mAbs pour une expérience ou pour traiter un seul patient. Les mAb sont coûteux (Figure\(\PageIndex{3}\)).
| Anticorps monoclonaux | Anticorps polyclonaux |
|---|---|
| Production coûteuse | Production peu coûteuse |
| Longue durée de production | Production rapide |
| De grandes quantités d'anticorps spécifiques | De grandes quantités d'anticorps non spécifiques |
| Reconnaître un épitope unique sur un antigène | Reconnaître plusieurs épitopes sur un antigène |
| La production est continue et uniforme une fois que l'hybridome est fabriqué | La composition des différents lots varie |
Utilisations cliniques des anticorps monoclonaux
Étant donné que les méthodes les plus courantes de production d'anticorps monoclonaux utilisent des cellules de souris, il est nécessaire de créer des anticorps monoclonaux humanisés à usage clinique chez l'homme. Les anticorps de souris ne peuvent pas être injectés à plusieurs reprises à l'homme, car le système immunitaire les reconnaîtra comme étrangers et y répondra par des anticorps neutralisants. Ce problème peut être minimisé en modifiant génétiquement l'anticorps présent dans le lymphocyte B de la souris. Les régions variables des gènes des chaînes légères et lourdes de souris sont ligaturées à des régions constantes humaines, et le gène chimère est ensuite transféré dans une cellule hôte. Cela permet la production d'un mAb qui est principalement « humain », seul le site de liaison à l'antigène étant d'origine murine.
Les MAB humanisés ont été utilisés avec succès pour traiter le cancer avec un minimum d'effets secondaires. Par exemple, l'anticorps monoclonal humanisé Herceptin s'est révélé utile pour le traitement de certains types de cancer du sein. Quelques essais préliminaires ont également été réalisés sur le mAb humanisé pour le traitement de maladies infectieuses, mais aucun de ces traitements n'est actuellement utilisé. Dans certains cas, les MAB se sont révélés trop spécifiques pour traiter des maladies infectieuses, car ils reconnaissent certains sérotypes d'un agent pathogène, mais pas d'autres. L'utilisation d'un cocktail de plusieurs mAb ciblant différentes souches de l'agent pathogène peut résoudre ce problème. Cependant, le coût élevé associé à la production de mAb constitue un autre défi qui a empêché les mAbs de devenir pratiques pour le traitement des infections microbiennes. 1
Une technologie prometteuse pour les mAbs peu coûteux est l'utilisation de plantes génétiquement modifiées pour produire des anticorps (ou planticorps). Cette technologie transforme les cellules végétales en usines d'anticorps au lieu de s'appuyer sur des cellules de culture tissulaire, qui sont coûteuses et techniquement exigeantes. Dans certains cas, il peut même être possible de délivrer ces anticorps en demandant aux patients de manger les plantes plutôt qu'en extrayant et en injectant les anticorps. Par exemple, en 2013, un groupe de recherche a cloné des gènes d'anticorps dans des plantes capables de neutraliser une toxine importante provenant de bactéries pouvant provoquer de graves maladies gastro-intestinales. 2 La consommation de plantes pourrait potentiellement transmettre les anticorps directement à la toxine.
Exercice\(\PageIndex{4}\)
- Comment sont produits les anticorps monoclonaux humanisés ?
- Que signifie le terme « monoclonal » des anticorps monoclonaux ?
Utilisation d'anticorps monoclonaux pour combattre le virus Ebola
Lors de l'épidémie d'Ebola de 2014-2015 en Afrique de l'Ouest, quelques patients infectés par le virus Ebola ont été traités avec le ZMapp, un médicament dont l'efficacité avait été démontrée lors d'essais réalisés sur des macaques rhésus quelques mois auparavant. 3 ZMapp est une combinaison de trois mAbs produite en incorporant les gènes des anticorps dans des plants de tabac à l'aide d'un vecteur viral. En utilisant trois mAbs, le médicament est efficace contre plusieurs souches du virus. Malheureusement, il n'y avait que suffisamment de ZMapp pour traiter un nombre infime de patients.
Bien que la technologie actuelle ne soit pas adaptée à la production de grandes quantités de ZMapp, elle montre que les corps végétaux, c'est-à-dire les MAB produits par des plantes, sont réalisables pour un usage clinique, potentiellement rentables et méritent d'être développés plus avant. Ces dernières années ont vu une explosion du nombre de nouveaux médicaments à base de MAB pour le traitement du cancer et des maladies infectieuses ; toutefois, l'utilisation généralisée de ces médicaments est actuellement freinée par leur coût exorbitant, en particulier dans les régions sous-développées du monde, où une dose unique peut coûter plus cher que le revenu viager du patient. Le développement de méthodes de clonage de gènes d'anticorps dans des plantes pourrait réduire les coûts de manière spectaculaire.
Concepts clés et résumé
- Les anticorps se lient de manière très spécifique aux antigènes utilisés pour défier le système immunitaire, mais ils peuvent également présenter une réactivité croisée en se liant à d'autres antigènes ayant des propriétés chimiques communes à celles de l'antigène d'origine.
- L'injection d'un antigène à un animal provoquera une réponse d'anticorps polyclonaux au cours de laquelle différents anticorps sont produits qui réagissent avec les différents épitopes de l'antigène.
- Les antisérums polyclonaux sont utiles pour certains types de tests de laboratoire, mais d'autres tests nécessitent une plus grande spécificité. Les tests diagnostiques qui utilisent des antisérums polyclonaux ne sont généralement utilisés que pour le dépistage en raison de la possibilité de résultats faussement positifs et faussement négatifs.
- Les anticorps monoclonaux présentent une spécificité plus élevée que les antisérums polyclonaux car ils se lient à un épitope unique et possèdent généralement une affinité élevée.
- Les anticorps monoclonaux sont généralement produits en cultivant des hybridomes sécrétant des anticorps dérivés de souris. Les mAb sont actuellement utilisés pour traiter le cancer, mais leur coût exorbitant les empêche d'être utilisés plus largement pour traiter les maladies infectieuses. Néanmoins, leur potentiel pour une utilisation en laboratoire et en clinique stimule le développement de nouvelles solutions rentables telles que les planticorps.
Notes
- 1 Saylor, Carolyn, Ekaterina Dadachova et Arturo Casadevall, « Thérapies à base d'anticorps monoclonaux pour les maladies microbiennes », vaccin 27 (2009) : G38-G46.
- 2 Nakanishi, Katsuhiro et al., « Production d'anticorps hybrides IGG/IgA avec activité neutralisante contre la toxine Shiga 1 », PLoS One 8, n° 11 (2013) : e80712.
- 3 Qiu, Xiangguo et al., « Réversion de la maladie à virus Ebola avancée chez les primates non humains avec ZMapp », Nature 514 (2014) : 47—53.


