16.3 : Comment les maladies se propagent
- Page ID
- 187894
Objectifs d'apprentissage
- Décrire les différents types de réservoirs de maladies
- Comparez les modes de transmission par contact, vecteur et véhicule
- Identifier les vecteurs de maladies importants
- Expliquer la prévalence des infections nosocomiales
Il est essentiel de comprendre comment les agents pathogènes se propagent pour prévenir les maladies infectieuses. De nombreux agents pathogènes ont besoin d'un hôte vivant pour survivre, tandis que d'autres peuvent persister à l'état dormant à l'extérieur d'un hôte vivant. Mais après avoir infecté un hôte, tous les agents pathogènes doivent également disposer d'un mécanisme de transfert d'un hôte à un autre, faute de quoi ils mourront à la mort de leur hôte. Les agents pathogènes ont souvent des adaptations complexes pour exploiter la biologie, le comportement et l'écologie de l'hôte pour vivre dans les hôtes et se déplacer entre les hôtes. Les hôtes ont développé des défenses contre les agents pathogènes, mais comme leur vitesse d'évolution est généralement plus lente que celle de leurs agents pathogènes (parce que leur durée de génération est plus longue), les hôtes sont généralement désavantagés sur le plan de l'évolution. Cette section explorera où les agents pathogènes survivent, à la fois à l'intérieur et à l'extérieur des hôtes, et certaines des nombreuses façons dont ils se déplacent d'un hôte à un autre.
Réservoirs et transporteurs
Pour que les agents pathogènes persistent pendant de longues périodes, ils ont besoin de réservoirs où ils se trouvent normalement. Les réservoirs peuvent être des organismes vivants ou des sites non vivants. Les réservoirs non vivants peuvent inclure du sol et de l'eau dans l'environnement. Ceux-ci peuvent abriter naturellement l'organisme, car il peut se développer dans cet environnement. Ces environnements peuvent également être contaminés par des agents pathogènes présents dans les matières fécales humaines, par des agents pathogènes émis par des hôtes intermédiaires ou par des agents pathogènes contenus dans les restes d'hôtes intermédiaires.
Les agents pathogènes peuvent avoir des mécanismes de dormance ou de résilience qui leur permettent de survivre (mais généralement de ne pas se reproduire) pendant des périodes variables dans des environnements non vivants. Par exemple, Clostridium tetani survit dans le sol et en présence d'oxygène sous forme d'endospore résistante. Bien que de nombreux virus soient rapidement détruits au contact de l'air, de l'eau ou d'autres conditions non physiologiques, certains types peuvent persister à l'extérieur d'une cellule vivante pendant des durées variables. Par exemple, une étude portant sur la capacité des virus de la grippe à infecter une culture cellulaire après avoir passé plus ou moins longtemps sur un billet de banque a révélé des durées de survie allant de 48 heures à 17 jours, selon la manière dont ils étaient déposés sur le billet. 1 En revanche, les rhinovirus responsables du rhume sont assez fragiles et survivent généralement moins d'une journée en dehors des liquides physiologiques.
Un être humain agissant en tant que réservoir d'un agent pathogène peut ou non être capable de transmettre l'agent pathogène, selon le stade de l'infection et le pathogène. Pour aider à prévenir la propagation de la maladie chez les écoliers, les CDC ont élaboré des directives basées sur le risque de transmission au cours de l'évolution de la maladie. Par exemple, les enfants atteints de la varicelle sont considérés comme contagieux pendant cinq jours à compter du début de l'éruption cutanée, tandis que les enfants atteints de la plupart des maladies gastro-intestinales doivent rester à la maison pendant 24 heures après la disparition des symptômes.
Un individu capable de transmettre un agent pathogène sans présenter de symptômes est appelé porteur. Un porteur passif est contaminé par l'agent pathogène et peut le transmettre mécaniquement à un autre hôte ; toutefois, un porteur passif n'est pas infecté. Par exemple, un professionnel de santé qui ne se lave pas les mains après avoir vu un patient héberger un agent infectieux peut devenir un porteur passif et transmettre l'agent pathogène à un autre patient infecté.
En revanche, un porteur actif est une personne infectée qui peut transmettre la maladie à d'autres personnes. Un porteur actif peut présenter ou non des signes ou des symptômes d'infection. Par exemple, les porteurs actifs peuvent transmettre la maladie pendant la période d'incubation (avant l'apparition de signes et de symptômes) ou pendant la période de convalescence (après la disparition des symptômes). Les porteurs actifs qui ne présentent aucun signe ou symptôme de maladie malgré l'infection sont appelés porteurs asymptomatiques. Les agents pathogènes tels que le virus de l'hépatite B, le virus de l'herpès simplex et le VIH sont fréquemment transmis par des porteurs asymptomatiques. Mary Mallon, mieux connue sous le nom de Typhoid Mary, est un célèbre exemple historique de porteuse asymptomatique. Immigrant irlandais, Mallon a travaillé comme cuisinier pour des ménages de New York et des environs entre 1900 et 1915. Dans chaque foyer, les résidents ont développé la fièvre typhoïde (causée par Salmonella typhi) quelques semaines après que Mallon a commencé à travailler. Des enquêtes ultérieures ont révélé que Mallon était responsable d'au moins 122 cas de fièvre typhoïde, dont cinq mortels. 2 Voir Eye on Ethics : Typhoid Mary pour en savoir plus sur l'affaire Mallon.
Un agent pathogène peut avoir plus d'un réservoir vivant. Dans les zoonoses, les animaux agissent comme des réservoirs de maladies humaines et transmettent l'agent infectieux aux humains par contact direct ou indirect. Dans certains cas, la maladie affecte également l'animal, mais dans d'autres cas, l'animal est asymptomatique.
Dans les infections parasitaires, l'hôte préféré du parasite est appelé hôte définitif. Chez les parasites dont le cycle vital est complexe, l'hôte définitif est l'hôte dans lequel le parasite atteint la maturité sexuelle. Certains parasites peuvent également infecter un ou plusieurs hôtes intermédiaires chez lesquels le parasite passe par plusieurs étapes immatures de son cycle vital ou se reproduit de manière asexuée.
George Soper, l'ingénieur sanitaire qui a retracé l'épidémie de typhoïde jusqu'à Mary Mallon, rend compte de son enquête, un exemple d'épidémiologie descriptive, dans « The Curious Career of Typhoid Mary ».
Exercice\(\PageIndex{1}\)
- Énumérez certains réservoirs non vivants d'agents pathogènes.
- Expliquez la différence entre un porteur passif et un porteur actif.
Transmission
Quel que soit le réservoir, la transmission doit avoir lieu pour qu'une infection se propage. Tout d'abord, la transmission du réservoir à l'individu doit avoir lieu. Ensuite, la personne doit transmettre l'agent infectieux à d'autres personnes sensibles, directement ou indirectement. Les microorganismes pathogènes utilisent divers mécanismes de transmission.
Transmission des contacts
La transmission par contact inclut le contact direct ou le contact indirect. La transmission de personne à personne est une forme de transmission par contact direct. Ici, l'agent est transmis par contact physique entre deux personnes (Figure\(\PageIndex{1}\)) par des actions telles que des attouchements, des baisers, des rapports sexuels ou des pulvérisations de gouttelettes. Le contact direct peut être classé comme une transmission verticale, horizontale ou par gouttelettes. La transmission verticale par contact direct se produit lorsque des agents pathogènes sont transmis de la mère à l'enfant pendant la grossesse, l'accouchement ou l'allaitement. D'autres types de transmission par contact direct sont appelés transmission à contact direct horizontale. Souvent, le contact entre les muqueuses est nécessaire pour que l'agent pathogène pénètre dans le nouvel hôte, bien que le contact peau à peau puisse entraîner un contact avec les muqueuses si le nouvel hôte touche ensuite une membrane muqueuse. La transmission par contact peut également être spécifique au site ; par exemple, certaines maladies peuvent être transmises par contact sexuel mais pas par d'autres formes de contact.
Lorsqu'une personne tousse ou éternue, de petites gouttelettes de mucus pouvant contenir des agents pathogènes sont éjectées. Cela conduit à la transmission directe par gouttelettes, c'est-à-dire la transmission par gouttelettes d'un agent pathogène à un nouvel hôte sur des distances d'un mètre ou moins. Une grande variété de maladies sont transmises par des gouttelettes, notamment la grippe et de nombreuses formes de pneumonie. La transmission sur des distances supérieures à un mètre est appelée transmission aéroportée.
La transmission par contact indirect implique des objets inanimés appelés vecteurs qui sont contaminés par des agents pathogènes provenant d'un individu ou d'un réservoir infecté (Figure\(\PageIndex{2}\)). Par exemple, une personne atteinte d'un rhume peut éternuer et faire en sorte que des gouttelettes tombent sur un objet imité tel qu'une nappe ou un tapis, ou elle peut s'essuyer le nez puis transférer du mucus vers un objet contaminé, comme une poignée de porte ou une serviette. La transmission se produit indirectement lorsqu'un nouvel hôte sensible touche plus tard le parasite et transfère le matériel contaminé vers une porte d'entrée sensible. Les parasites peuvent également inclure des objets utilisés en milieu clinique qui ne sont pas correctement stérilisés, tels que des seringues, des aiguilles, des cathéters et du matériel chirurgical. Les agents pathogènes transmis indirectement par de tels vecteurs sont une cause majeure d'infections associées aux soins de santé (voir Contrôle de la croissance microbienne).


Transmission du véhicule
Le terme transmission par véhicule fait référence à la transmission d'agents pathogènes par des véhicules tels que l'eau, les aliments et l'air. La contamination de l'eau par de mauvaises méthodes d'assainissement entraîne la transmission de maladies d'origine hydrique. Les maladies d'origine hydrique restent un grave problème dans de nombreuses régions du monde. L'Organisation mondiale de la santé (OMS) estime que l'eau potable contaminée est responsable de plus de 500 000 décès chaque année. 3 De même, les aliments contaminés par une manipulation ou un stockage inadéquats peuvent entraîner la transmission de maladies d'origine alimentaire (Figure\(\PageIndex{3}\)).
La poussière et les particules fines appelées aérosols, qui peuvent flotter dans l'air, peuvent transporter des agents pathogènes et faciliter la transmission de maladies par voie aérienne. Par exemple, les particules de poussière constituent le principal mode de transmission de l'hantavirus à l'homme. L'hantavirus est présent dans les matières fécales, l'urine et la salive des souris, mais lorsque ces substances sèchent, elles peuvent se désintégrer en fines particules qui peuvent se retrouver dans l'air lorsqu'elles sont perturbées ; l'inhalation de ces particules peut entraîner une infection respiratoire grave et parfois mortelle.
Bien que la transmission de gouttelettes sur de courtes distances soit considérée comme une transmission par contact, comme indiqué ci-dessus, la transmission sur de plus longues distances de gouttelettes dans l'air est considérée comme une transmission par véhicule. Contrairement aux particules plus grosses qui tombent rapidement de la colonne d'air, les fines gouttelettes de mucus produites par la toux ou les éternuements peuvent rester en suspension pendant de longues périodes et parcourir des distances considérables. Dans certaines conditions, les gouttelettes se dessèchent rapidement pour produire un noyau capable de transmettre des agents pathogènes ; la température et l'humidité de l'air peuvent avoir une incidence sur l'efficacité de la transmission par voie aérienne.
La tuberculose se transmet souvent par voie aérienne lorsque l'agent causal, Mycobacterium tuberculosis, est libéré sous forme de petites particules lors de la toux. Comme la tuberculose ne nécessite que 10 microbes pour déclencher une nouvelle infection, les patients atteints de tuberculose doivent être traités dans des pièces équipées d'une ventilation spéciale, et toute personne entrant dans la pièce doit porter un masque.

Orientation clinique : résolution
Après avoir identifié la source des turduckens contaminés, le bureau de santé publique de Floride en a informé le CDC, qui a demandé une inspection accélérée de l'établissement par des inspecteurs de l'État. Les inspecteurs ont découvert qu'une machine utilisée pour traiter le poulet était contaminée par la salmonelle en raison de protocoles de nettoyage non conformes aux normes. Les inspecteurs ont également constaté que le processus consistant à farcir et à emballer les turduckens avant leur réfrigération permettait à la viande de rester trop longtemps à des températures propices à la croissance bactérienne. La contamination et le retard de la réfrigération ont entraîné la transmission de la bactérie par des véhicules (aliments) chez les turduckens.
Sur la base de ces résultats, l'usine a été fermée pour une décontamination complète et complète. Tous les turduckens produits dans l'usine ont été rappelés et retirés des rayons des magasins avant la période des fêtes de décembre, afin de prévenir de nouvelles épidémies.
Transmission vectorielle
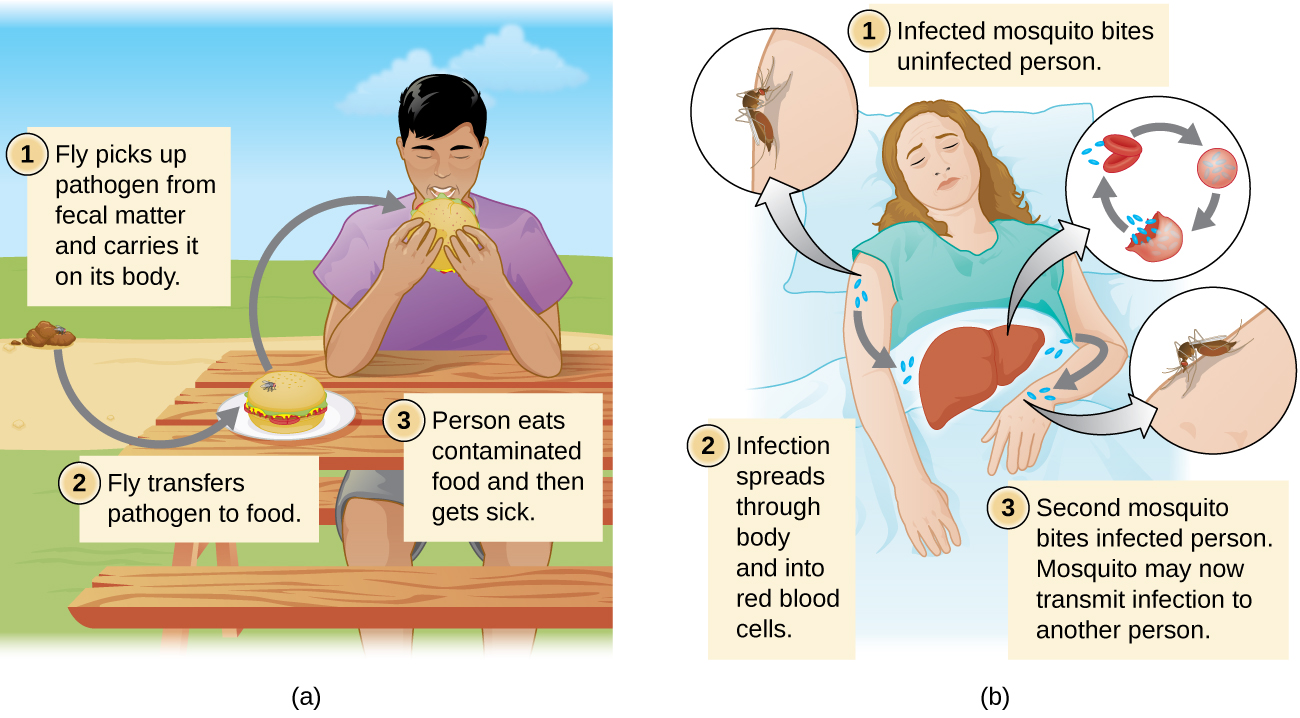
Les maladies peuvent également être transmises par un vecteur mécanique ou biologique, un animal (généralement un arthropode) qui transporte la maladie d'un hôte à un autre. La transmission mécanique est facilitée par un vecteur mécanique, un animal qui transporte un agent pathogène d'un hôte à un autre sans être lui-même infecté. Par exemple, une mouche peut se poser sur des matières fécales et transmettre ensuite des bactéries présentes dans les matières fécales aux aliments sur lesquels elle atterrit ; un humain qui mange la nourriture peut alors être infecté par la bactérie, provoquant un cas de diarrhée ou de dysenterie (Figure\(\PageIndex{4}\)).
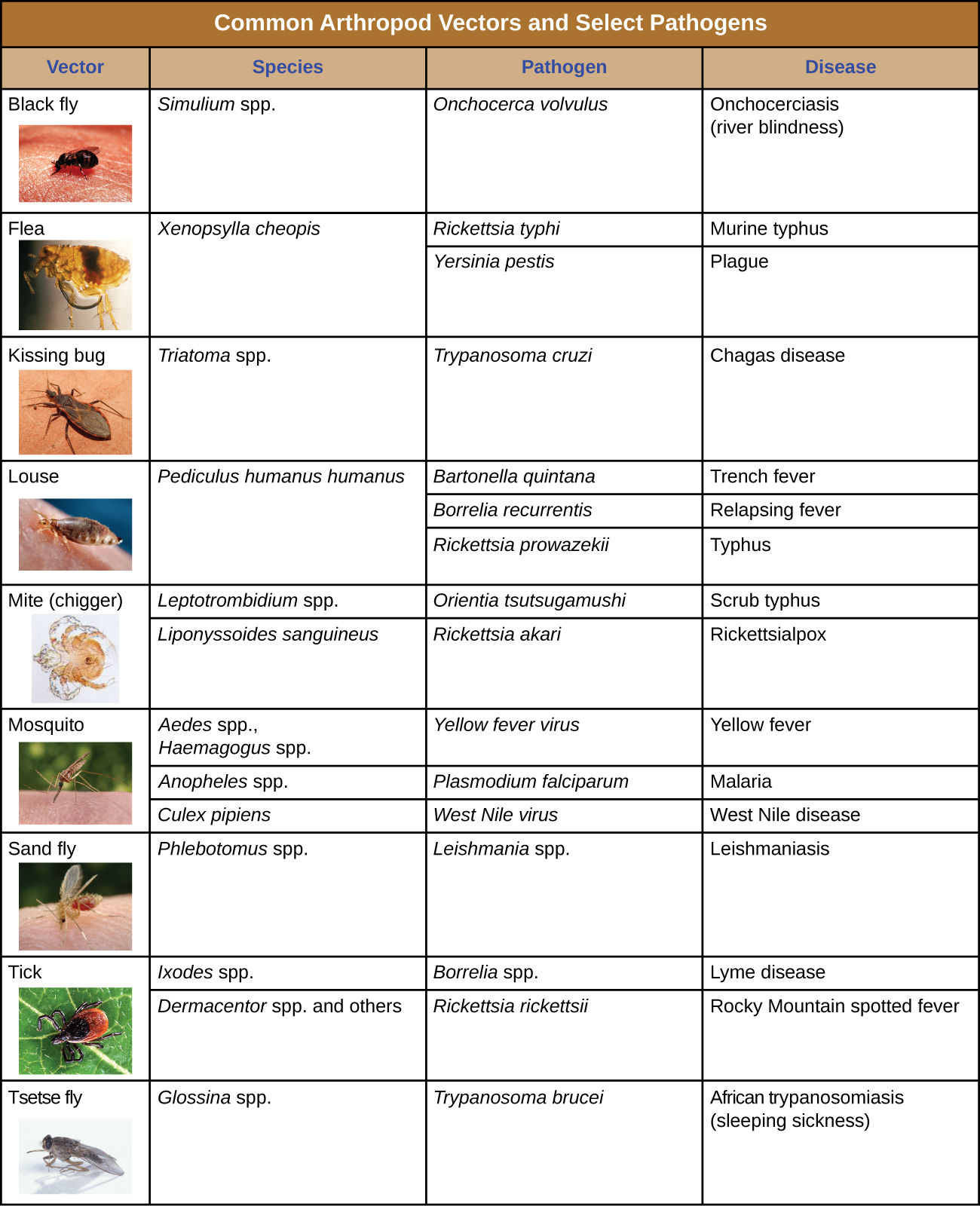
La transmission biologique se produit lorsque l'agent pathogène se reproduit au sein d'un vecteur biologique qui le transmet d'un hôte à un autre (Figure\(\PageIndex{4}\)). Les arthropodes sont les principaux vecteurs responsables de la transmission biologique (Figure\(\PageIndex{5}\)). La plupart des arthropodes vecteurs transmettent le pathogène en mordant l'hôte, créant ainsi une blessure qui sert de porte d'entrée. L'agent pathogène peut passer une partie de son cycle de reproduction dans l'intestin ou les glandes salivaires de l'arthropode afin de faciliter sa transmission par la morsure. Par exemple, les hémiptères (appelés « punaises qui s'embrassent » ou « punaises assassines ») transmettent la maladie de Chagas aux humains en déféquant lorsqu'ils mordent, après quoi l'être humain gratte ou frotte les matières fécales infectées pour les faire pénétrer dans une muqueuse ou percer la peau.
Les insectes vecteurs biologiques incluent les moustiques, qui transmettent le paludisme et d'autres maladies, et les poux, qui transmettent le typhus. Parmi les autres vecteurs d'arthropodes, on peut citer les arachnides, principalement les tiques, qui transmettent la maladie de Lyme et d'autres maladies, et les acariens, qui transmettent le typhus des broussailles et la rickettsiose. La transmission biologique, parce qu'elle implique la survie et la reproduction au sein d'un vecteur parasité, complique la biologie du pathogène et sa transmission. Il existe également d'importants vecteurs de maladies autres que les arthropodes, notamment les mammifères et les oiseaux. Diverses espèces de mammifères peuvent transmettre la rage à l'homme, généralement par une morsure qui transmet le virus de la rage. Les poulets et les autres volailles domestiques peuvent transmettre la grippe aviaire aux humains par contact direct ou indirect avec le virus de la grippe aviaire A qui se répand dans la salive, les muqueuses et les matières fécales des oiseaux.
Exercice\(\PageIndex{2}\)
- Décrivez comment les maladies peuvent être transmises par voie aérienne.
- Expliquez la différence entre un vecteur mécanique et un vecteur biologique.
Utiliser des OGM pour stopper la propagation du virus Zika
En 2016, une épidémie du virus Zika a été associée à une forte incidence de malformations congénitales en Amérique du Sud et en Amérique centrale. Alors que l'hiver approchait du printemps dans l'hémisphère nord, les autorités sanitaires avaient correctement prédit que le virus se propagerait en Amérique du Nord, coïncidant avec la saison de reproduction de son principal vecteur, le moustique Aedes aegypti.
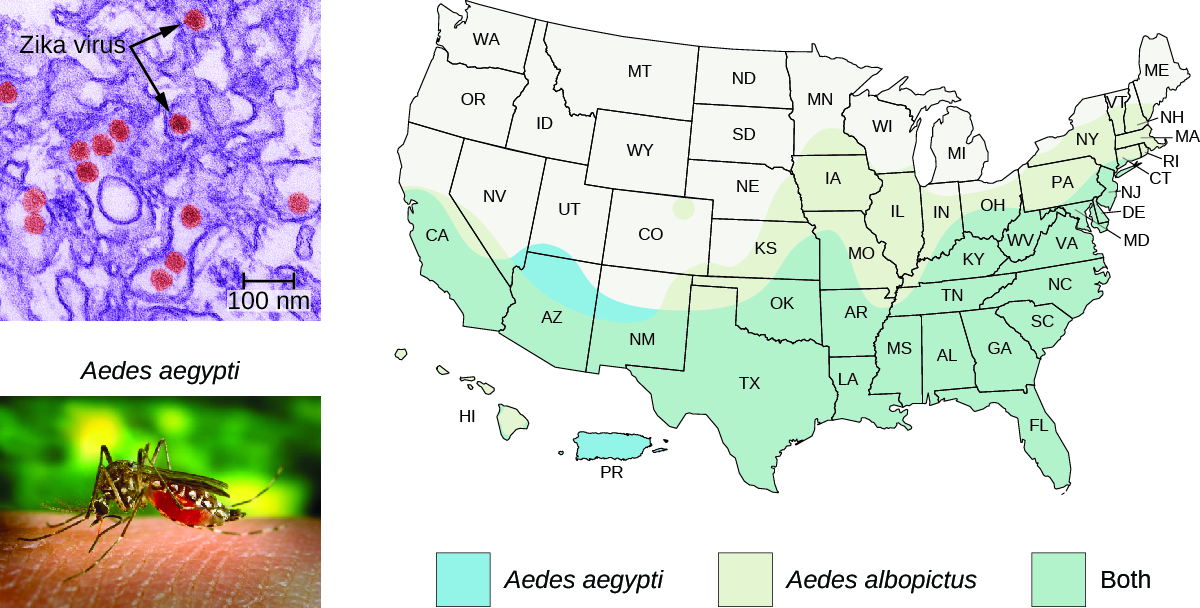
L'aire de répartition du moustique A. aegypti s'étend jusque dans le sud des États-Unis (Figure\(\PageIndex{6}\)). Comme ces mêmes moustiques servent de vecteurs à d'autres maladies problématiques (dengue, fièvre jaune, etc.), diverses méthodes de lutte contre les moustiques ont été proposées comme solutions. Les pesticides chimiques ont été utilisés efficacement par le passé et seront probablement réutilisés ; mais comme les pesticides chimiques peuvent avoir des effets négatifs sur l'environnement, certains scientifiques ont proposé une alternative qui implique le génie génétique d'A. aegypti afin qu'il ne puisse pas se reproduire. Cette méthode a toutefois fait l'objet d'une certaine controverse.
L'introduction d'animaux mâles stériles est une méthode qui a donné de bons résultats dans le passé pour lutter contre les ravageurs, mais qui n'a guère d'inconvénients apparents. Cette méthode a permis de lutter contre la mouche à vis dans le sud-ouest des États-Unis et contre les mouches des fruits des cultures fruitières. Dans le cadre de cette méthode, les mâles des espèces cibles sont élevés en laboratoire, stérilisés par irradiation et relâchés dans l'environnement où ils s'accouplent avec des femelles sauvages, qui ne portent ensuite aucune progéniture vivante. Les disséminations répétées réduisent la population de ravageurs.
Une méthode similaire, qui tire parti de la technologie de l'ADN recombinant4, introduit chez les moustiques mâles un allèle létal dominant qui est supprimé en présence de tétracycline (un antibiotique) lors de l'élevage en laboratoire. Les mâles sont relâchés dans l'environnement et s'accouplent avec des moustiques femelles. Contrairement à la méthode des mâles stériles, ces accouplements produisent une progéniture, mais ils meurent sous forme de larves à cause du gène létal en l'absence de tétracycline dans l'environnement. En 2016, cette méthode n'avait pas encore été mise en œuvre aux États-Unis, mais une entreprise britannique l'a testée à Piracicaba, au Brésil, et a constaté une réduction de 82 % des larves sauvages d'A. aegypti et une réduction de 91 % des cas de dengue dans la zone traitée. 5 En août 2016, alors que plusieurs communautés de Floride avaient été infectées par le virus Zika, la FDA a autorisé l'entreprise britannique à tester cette même méthode de lutte contre les moustiques à Key West, en Floride, dans l'attente du respect des réglementations locales et nationales et de la tenue d'un référendum dans les communautés touchées.
L'utilisation d'organismes génétiquement modifiés (OGM) pour lutter contre un vecteur de maladie a ses partisans comme ses opposants. En théorie, le système pourrait être utilisé pour faire disparaître le moustique A. aegypti, un objectif noble selon certains, étant donné les dommages qu'il cause aux populations humaines. 6 Mais les opposants à cette idée craignent que le gène n'échappe à la limite spécifique d'A. aegypti et ne cause des problèmes à d'autres espèces, entraînant des conséquences écologiques imprévues. Les opposants se méfient également du programme parce qu'il est administré par une société à but lucratif, ce qui crée des risques de conflits d'intérêts qui devraient être strictement réglementés ; et il n'est pas clair comment les conséquences imprévues du programme pourraient être annulées.
Il existe également d'autres considérations épidémiologiques. Aedes aegypti n'est apparemment pas le seul vecteur du virus Zika. Aedes albopictus, le moustique tigre asiatique, est également un vecteur du virus Zika. 7 A. albopictus est aujourd'hui largement répandu sur la planète, y compris dans une grande partie des États-Unis (Figure\(\PageIndex{6}\)). On a découvert que de nombreux autres moustiques hébergeaient le virus Zika, bien que leur capacité à agir en tant que vecteurs soit inconnue. 8 Les souches génétiquement modifiées d'A. aegypti ne contrôleront pas les autres espèces de vecteurs. Enfin, le virus Zika peut apparemment être transmis sexuellement entre hôtes humains, de la mère à l'enfant, et éventuellement par transfusion sanguine. Tous ces facteurs doivent être pris en compte dans toute approche visant à contrôler la propagation du virus.
Il est clair que la réalisation d'une expérience en environnement ouvert avec une technologie encore mal comprise comporte des risques et des inconnues. Mais laisser le virus Zika se propager de manière incontrôlée est également risqué. La menace d'une épidémie de Zika justifie-t-elle le risque écologique lié au génie génétique des moustiques ? Les méthodes actuelles de lutte contre les moustiques sont-elles suffisamment inefficaces ou nocives pour que nous devions essayer des alternatives non testées ? Telles sont les questions qui sont actuellement posées aux responsables de la santé publique.
Mise en quarantaine
Les personnes soupçonnées ou connues d'avoir été exposées à certains agents pathogènes contagieux peuvent être mises en quarantaine ou isolées pour empêcher la transmission de la maladie à d'autres personnes. Les hôpitaux et autres établissements de santé mettent généralement en place des services spéciaux pour isoler les patients atteints de maladies particulièrement dangereuses telles que la tuberculose ou le virus Ebola (Figure\(\PageIndex{7}\)). Selon l'environnement, ces services peuvent être équipés de méthodes spéciales de traitement de l'air, et le personnel peut mettre en œuvre des protocoles spéciaux pour limiter le risque de transmission, tels que des équipements de protection individuelle ou l'utilisation de sprays désinfectants chimiques à l'entrée et à la sortie du personnel médical.
La durée de la quarantaine dépend de facteurs tels que la période d'incubation de la maladie et les preuves suggérant une infection. Le patient peut être libéré si les signes et symptômes ne se manifestent pas comme prévu ou si un traitement préventif peut être administré afin de limiter le risque de transmission. Si l'infection est confirmée, le patient peut être contraint de rester en isolement jusqu'à ce que la maladie ne soit plus considérée comme contagieuse.
Aux États-Unis, les autorités de santé publique ne peuvent mettre en quarantaine les patients que pour certaines maladies, telles que le choléra, la diphtérie, la tuberculose infectieuse et les souches de grippe susceptibles de provoquer une pandémie. Les personnes qui entrent aux États-Unis ou qui se déplacent entre les États peuvent être mises en quarantaine par les CDC si elles sont soupçonnées d'avoir été exposées à l'une de ces maladies. Bien que le CDC surveille régulièrement les points d'entrée aux États-Unis pour détecter les membres d'équipage ou les passagers atteints de maladie, la quarantaine est rarement mise en place.

Infections (nosocomiales) associées aux soins de santé
Les hôpitaux, les maisons de retraite et les prisons attirent l'attention des épidémiologistes parce que ces milieux sont associés à une incidence accrue de certaines maladies. Des taux de transmission plus élevés peuvent être causés par des caractéristiques de l'environnement lui-même, des caractéristiques de la population, ou les deux. Par conséquent, des efforts particuliers doivent être déployés pour limiter les risques d'infection dans ces milieux.
Les infections contractées dans les établissements de santé, y compris les hôpitaux, sont appelées infections nosocomiales ou infections associées aux soins de santé (IAS). Les infections respiratoires aiguës sont souvent associées à des interventions chirurgicales ou à d'autres interventions invasives qui permettent à l'agent pathogène d'accéder à la porte de l'infection. Pour qu'une infection soit classée comme un HAI, le patient doit avoir été admis dans l'établissement de santé pour une raison autre que l'infection. Dans ces milieux, les patients atteints d'une maladie primaire sont souvent atteints d'une immunité affaiblie et sont plus vulnérables aux infections secondaires et aux agents pathogènes opportunistes.
En 2011, plus de 720 000 infections respiratoires aiguës sont survenues dans des hôpitaux aux États-Unis, selon les CDC. Environ 22 % de ces infections graves se sont produites sur un site chirurgical, et les cas de pneumonie en ont représenté 22 % ; les infections des voies urinaires ont représenté 13 % supplémentaires et les infections primaires du sang 10 %. 9 Ces IAS se produisent souvent lorsque des agents pathogènes sont introduits dans le corps des patients par le biais d'équipements chirurgicaux ou médicaux contaminés, tels que des cathéters et des ventilateurs respiratoires. Les établissements de santé cherchent à limiter les infections nosocomiales grâce à des protocoles de formation et d'hygiène tels que ceux décrits dans Contrôle de la croissance microbienne.
Exercice\(\PageIndex{3}\)
Donnez les raisons pour lesquelles les IAS apparaissent.
Concepts clés et résumé
- Les réservoirs de maladies humaines peuvent inclure les populations humaines et animales, le sol, l'eau et les objets ou matériaux inanimés.
- La transmission par contact peut être directe ou indirecte par contact physique avec un hôte infecté (direct) ou par contact avec un parasite avec lequel un hôte infecté a déjà été en contact (indirect).
- La transmission vectorielle se produit lorsqu'un organisme vivant transporte un agent infectieux sur son corps (mécanique) ou, en tant qu'hôte de l'infection lui-même (biologique), à un nouvel hôte.
- La transmission par véhicule se produit lorsqu'une substance, telle que le sol, l'eau ou l'air, transporte un agent infectieux vers un nouvel hôte.
- Les infections associées aux soins (IAS), ou infections nosocomiales, sont contractées en milieu clinique. La transmission est facilitée par les interventions médicales et la forte concentration de personnes vulnérables immunodéprimées en milieu clinique.
Notes
- 1 Yves Thomas, Guido Vogel, Werner Wunderli, Patricia Suter, Mark Witschi, Daniel Koch, Caroline Tapparel et Laurent Kaiser. « Survie du virus de la grippe sur les billets de banque. » Microbiologie appliquée et environnementale 74, n° 10 (2008) : 3002—3007.
- 2 Filio Marineli, Grégory Tsoucalas, Marianna Karamanou et George Androutsos. « Mary Mallon (1869-1938) et l'histoire de la fièvre typhoïde. » Annales de gastroentérologie 26 (2013) : 132—134. www.ncbi.nlm.nih.gov/pmc/arti... rol-26-132.pdf.
- 3 Organisation mondiale de la santé. Fiche d'information no 391 — Eau potable. Juin 2005. www.who.int/mediacentre/factsheets/fs391/en.
- 4 Blandine Massonnet-Bruneel, Nicole Corre-Catelin, Renaud Lacroix, Rosemary S. Lees, Kim Phuc Hoang, Derric Nimmo, Luke Alphey et Paul Reiter. « Aptitude des mâles du moustique transgénique Aedes aegypti porteurs d'un système génétique létal dominant. » PLOS ONE 8, n° 5 (2013) : e62711.
- 5 Richard Levine. « Les cas de dengue diminuent de 91 % à cause des moustiques génétiquement modifiés. » L'entomologie aujourd'hui. entomologytoday.org/2016/07/... moustiques morts.
- 6 Olivia Judson. « La mort d'un insecte. » The New York Times, 25 septembre 2003. www.nytimes.com/2003/09/25/op... g-s-death.html.
- 7 Gilda Grard, Mélanie Caron, Illich Manfred Mombo, Dieudonné Nkoghe, Statiana Mboui Ondo, Davy Jiolle, Didier Fontenille, Christophe Paupy et Eric Maurice Leroy. « Le virus Zika au Gabon (Afrique centrale) —2007 : une nouvelle menace provenant d'Aedes albopictus ? » PLOS Neglected Tropical Diseases 8, n° 2 (2014) : e2681.
- 8 Constância F.J. Ayres. « Identification des vecteurs du virus Zika et implications pour le contrôle. » The Lancet Infectious Diseases 16, n° 3 (2016) : 278—279.
- 9 centres pour le contrôle et la prévention des maladies. « Données et statistiques HAI ». 2016. http://www.cdc.gov/hai/surveillance. Consulté le 2 janvier 2016.


