6.3 : Isolement, culture et identification des virus
- Page ID
- 187622
Objectifs d'apprentissage
- Expliquer pourquoi les virus étaient initialement décrits comme des agents filtrables
- Décrire la culture de virus ainsi que le prélèvement et la manipulation des échantillons
- Comparer les techniques in vivo et in vitro utilisées pour cultiver des virus
Au début de ce chapitre, nous avons décrit comment les filtres Chamberland en porcelaine dont les pores sont suffisamment petits pour permettre le passage des virus ont été utilisés pour découvrir le TMV. Aujourd'hui, les filtres en porcelaine ont été remplacés par des filtres à membrane et d'autres dispositifs utilisés pour isoler et identifier les virus.
Isolement des virus
Contrairement aux bactéries, dont beaucoup peuvent être cultivées sur un milieu nutritif artificiel, les virus ont besoin d'une cellule hôte vivante pour se répliquer. Les cellules hôtes infectées (eucaryotes ou procaryotes) peuvent être cultivées et cultivées, puis le milieu de croissance peut être récolté comme source de virus. Les virions présents dans le milieu liquide peuvent être séparés des cellules hôtes par centrifugation ou filtration. Les filtres peuvent éliminer physiquement tout élément présent dans la solution qui est plus gros que les virions ; les virus peuvent ensuite être collectés dans le filtrat (Figure\(\PageIndex{1}\)).
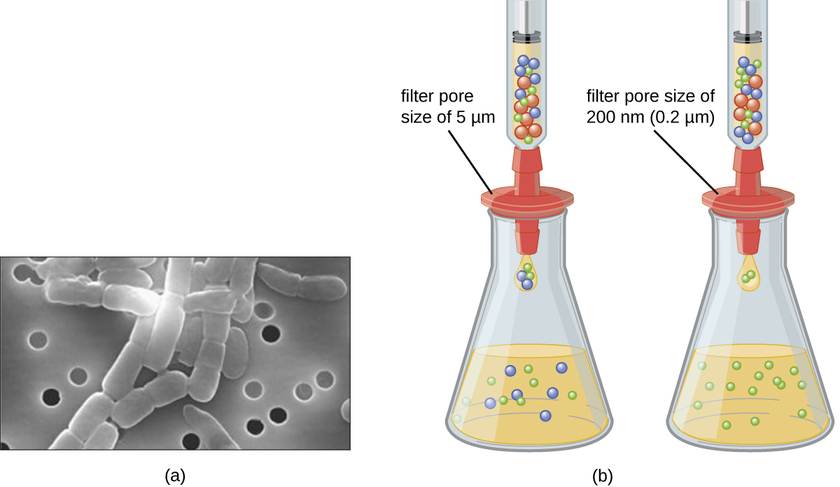
Exercice\(\PageIndex{1}\)
Quelle est la taille du pore filtrant nécessaire pour recueillir un virus ?
Culture de virus
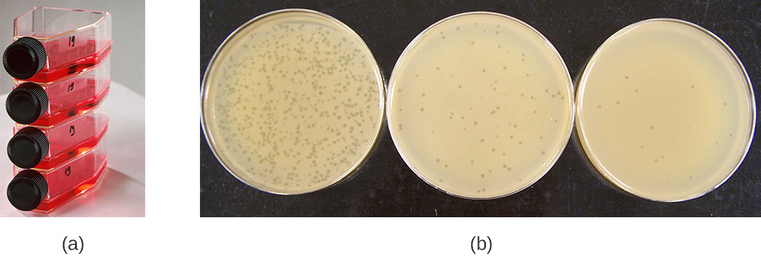
Les virus peuvent être cultivés in vivo (au sein d'un organisme vivant, d'une plante ou d'un animal entier) ou in vitro (à l'extérieur d'un organisme vivant dans des cellules dans un environnement artificiel, tel qu'un tube à essai, un flacon de culture cellulaire ou une plaque de gélose). Les bactériophages peuvent être cultivés en présence d'une couche dense de bactéries (également appelée pelouse bactérienne) cultivées dans une gélose molle à 0,7 % dans une boîte de Pétri ou une fiole plate (horizontale) (Figure\(\PageIndex{2a}\)). La concentration de gélose est diminuée par rapport aux 1,5 % habituellement utilisés pour la culture des bactéries. La gélose molle à 0,7 % permet aux bactériophages de diffuser facilement dans le milieu. Pour les bactériophages lytiques, la lyse des bactéries hôtes peut alors être facilement observée lorsqu'une zone claire appelée plaque est détectée (Figure\(\PageIndex{1b}\)). Au fur et à mesure que le phage tue la bactérie, de nombreuses plaques sont observées sur la pelouse bactérienne trouble.
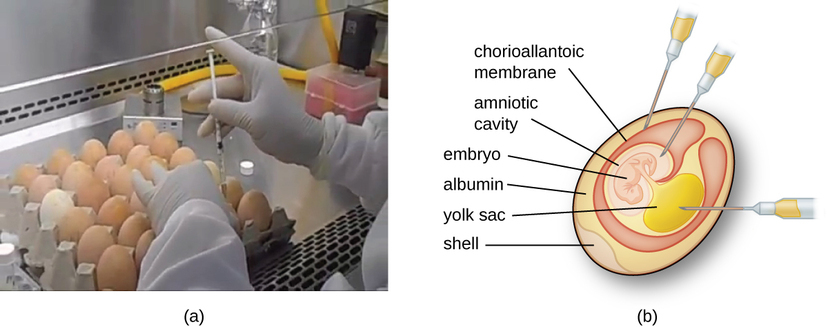
Les virus animaux ont besoin de cellules d'un animal hôte ou de cellules de culture tissulaire dérivées d'un animal. La culture de virus animaux est importante pour 1) l'identification et le diagnostic des virus pathogènes dans les échantillons cliniques, 2) la production de vaccins et 3) les études de recherche fondamentale. Les sources hôtes in vivo peuvent être un embryon en développement dans un œuf d'oiseau embryonné (par exemple, poulet, dinde) ou un animal entier. Par exemple, la plupart des vaccins antigrippaux fabriqués pour les programmes annuels de vaccination antigrippale sont cultivés dans des œufs de poule.
L'embryon ou l'animal hôte sert d'incubateur pour la réplication virale (Figure\(\PageIndex{3}\)). La localisation au sein de l'embryon ou de l'animal hôte est importante. De nombreux virus ont un tropisme tissulaire et doivent donc être introduits dans un site spécifique pour se développer. Au sein d'un embryon, les sites cibles incluent la cavité amniotique, la membrane chorioallantoïque ou le sac vitellin. L'infection virale peut endommager les membranes tissulaires et provoquer des lésions appelées variole, perturber le développement embryonnaire ou entraîner la mort de l'embryon.
Pour les études in vitro, différents types de cellules peuvent être utilisés pour favoriser la croissance des virus. Une culture cellulaire primaire est fraîchement préparée à partir d'organes ou de tissus animaux. Les cellules sont extraites des tissus par grattage mécanique ou hachage pour libérer les cellules ou par une méthode enzymatique utilisant de la trypsine ou de la collagénase pour fragmenter les tissus et libérer des cellules individuelles en suspension. En raison des exigences liées à l'ancrage, les cultures de cellules primaires nécessitent un milieu de culture liquide dans une boîte de Pétri ou un flacon de culture tissulaire afin que les cellules aient une surface solide, telle que du verre ou du plastique, pour leur fixation et leur croissance. Les cultures primaires ont généralement une durée de vie limitée. Lorsque les cellules d'une culture primaire subissent une mitose et qu'une densité suffisante de cellules est produite, les cellules entrent en contact avec d'autres cellules. Lorsque ce contact de cellule à cellule se produit, la mitose est déclenchée pour s'arrêter. C'est ce que l'on appelle l'inhibition du contact et elle empêche la densité des cellules de devenir trop élevée. Pour éviter l'inhibition du contact, les cellules de la culture cellulaire primaire doivent être transférées dans un autre récipient contenant du milieu de croissance frais. C'est ce que l'on appelle une culture cellulaire secondaire. Périodiquement, la densité cellulaire doit être réduite en déversant certaines cellules et en ajoutant du milieu frais pour fournir de l'espace et des nutriments nécessaires à la croissance cellulaire. Contrairement aux cultures de cellules primaires, les lignées cellulaires continues, généralement dérivées de cellules transformées ou de tumeurs, peuvent souvent être sous-cultivées de nombreuses fois ou même cultivées indéfiniment (auquel cas elles sont dites immortelles). Les lignées cellulaires continues peuvent ne pas présenter de dépendance à l'ancrage (elles se développeront en suspension) et peuvent avoir perdu leur inhibition du contact. Par conséquent, les lignées cellulaires continues peuvent se développer en tas ou en grumeaux ressemblant à de petites excroissances tumorales (Figure\(\PageIndex{4}\)).
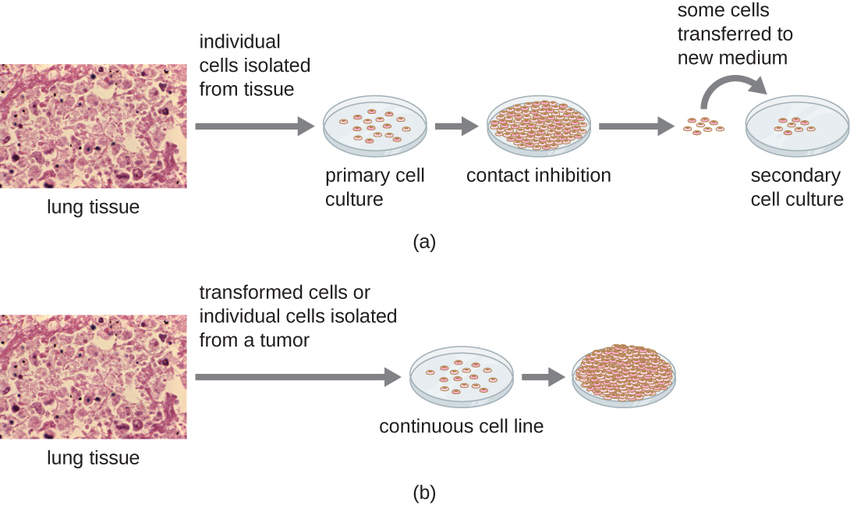
La lignée cellulaire HeLa, qui a été initialement cultivée à partir de cellules tumorales provenant d'Henrietta Lacks, une patiente décédée d'un cancer du col de l'utérus en 1951, est un exemple de lignée cellulaire immortelle. Les cellules HeLa ont été la première lignée cellulaire à culture tissulaire continue et ont été utilisées pour faire de la culture tissulaire une technologie importante pour la recherche en biologie cellulaire, en virologie et en médecine. Avant la découverte des cellules HeLa, les scientifiques n'étaient pas en mesure d'établir des cultures tissulaires fiables ou stables. Plus de six décennies plus tard, cette lignée cellulaire est toujours vivante et utilisée pour la recherche médicale. Voir La lignée cellulaire immortelle d'Henrietta Lacks pour en savoir plus sur cette importante lignée cellulaire et les moyens controversés par lesquels elle a été obtenue.
Exercice\(\PageIndex{2}\)
Quelle propriété des cellules rend nécessaires des dilutions périodiques des cultures de cellules primaires ?
La lignée cellulaire immortelle d'Henrietta Lacks
En janvier 1951, Henrietta Lacks, une Afro-Américaine de 30 ans de Baltimore, a reçu un diagnostic de cancer du col de l'utérus à l'hôpital John Hopkins. Nous savons maintenant que son cancer a été causé par le virus du papillome humain (VPH). Les effets cytopathiques du virus ont modifié les caractéristiques de ses cellules au cours d'un processus appelé transformation, qui donne aux cellules la capacité de se diviser continuellement. Bien entendu, cette capacité a provoqué une tumeur cancéreuse qui a finalement tué Mme Lacks en octobre à l'âge de 31 ans. Avant sa mort, des échantillons de ses cellules cancéreuses ont été prélevés à son insu et sans son autorisation. Les échantillons se sont finalement retrouvés en possession du Dr George Gey, chercheur biomédical à l'université Johns Hopkins. Gey a réussi à faire pousser certaines des cellules de l'échantillon de Lacks, créant ainsi ce que l'on appelle aujourd'hui la lignée cellulaire immortelle HeLa. Ces cellules ont la capacité de vivre et de se développer indéfiniment et, encore aujourd'hui, elles sont encore largement utilisées dans de nombreux domaines de recherche.
Selon le mari de Lacks, ni Henrietta ni la famille n'ont autorisé l'hôpital à prélever son échantillon de tissu. En effet, la famille n'a appris que 20 ans après la mort de Lacks que ses cellules étaient toujours vivantes et qu'elles étaient activement utilisées à des fins commerciales et de recherche. Pourtant, les cellules HeLa ont joué un rôle central dans de nombreuses découvertes scientifiques liées à la poliomyélite, au cancer et au sida, entre autres maladies. Les cellules ont également été commercialisées, bien qu'elles n'aient jamais été elles-mêmes brevetées. Malgré cela, la succession d'Henrietta Lacks n'a jamais bénéficié de l'utilisation des cellules, même si, en 2013, la famille Lacks a obtenu le contrôle de la publication de la séquence génétique de ses cellules.
Cette affaire soulève plusieurs questions bioéthiques concernant le consentement éclairé des patients et le droit de savoir. Au moment où les mouchoirs de Lacks ont été prélevés, il n'existait aucune loi ou directive concernant le consentement éclairé. Cela signifie-t-il qu'elle a été traitée équitablement à l'époque ? Selon les normes actuelles, la réponse serait certainement non. Prélever des tissus ou des organes sur un patient mourant sans son consentement est non seulement considéré comme contraire à l'éthique mais également illégal, qu'un tel acte puisse ou non sauver la vie d'autres patients. Est-il donc éthique pour les scientifiques de continuer à utiliser les tissus de Lacks à des fins de recherche, même s'ils ont été obtenus illégalement selon les normes actuelles ?
Qu'elles soient éthiques ou pas, les cellules de Lacks sont aujourd'hui largement utilisées pour de nombreuses applications qu'il est impossible de toutes les énumérer. S'agit-il d'un cas où la fin justifie les moyens ? Lacks serait-elle heureuse de connaître sa contribution à la science et les millions de personnes qui en ont bénéficié ? Voudrait-elle que sa famille soit indemnisée pour les produits commerciaux qui ont été développés à l'aide de ses cellules ? Ou se sentirait-elle violée et exploitée par les chercheurs qui ont pris une partie de son corps sans son consentement ? Comme on ne l'a jamais interrogée, on ne le saura jamais.
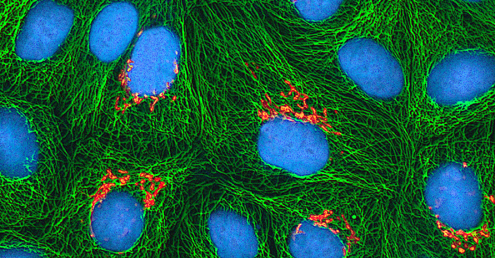
Détection d'un virus
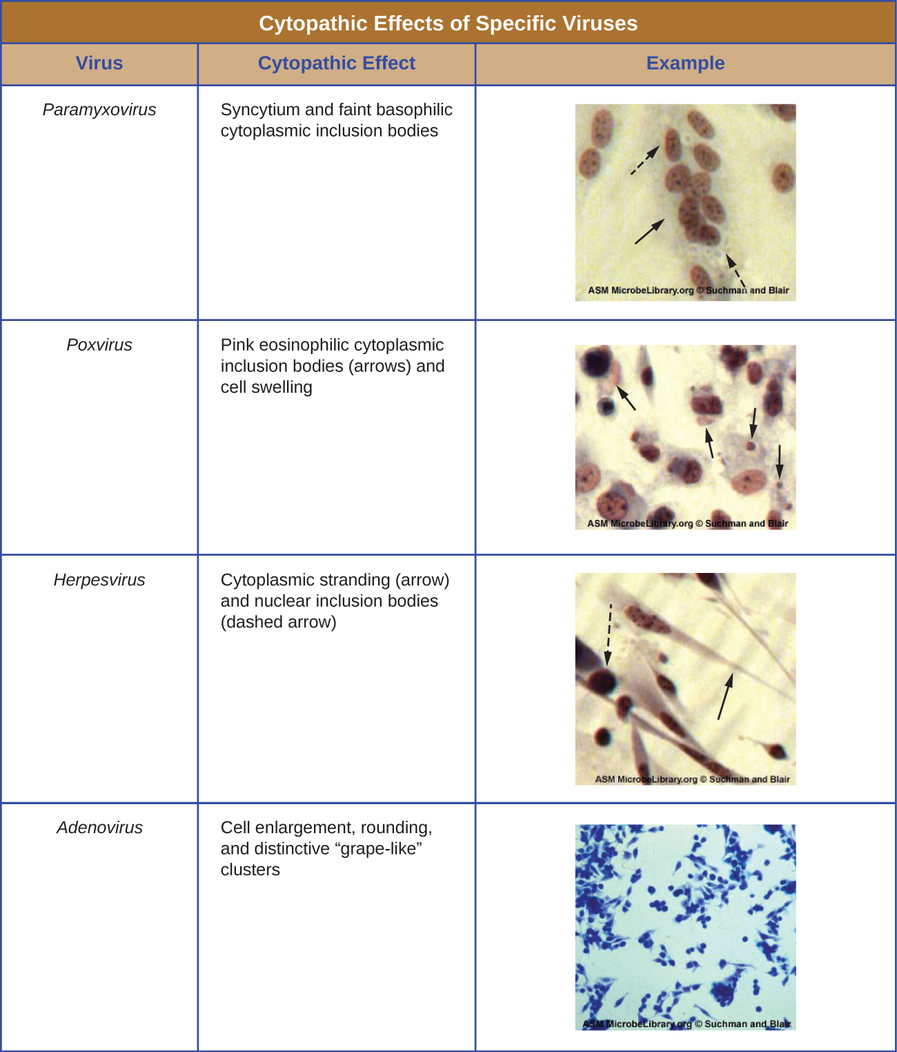
Quelle que soit la méthode de culture, une fois qu'un virus a été introduit dans l'ensemble d'un organisme hôte, d'un embryon ou d'une cellule de culture tissulaire, un échantillon peut être préparé à partir de l'hôte, de l'embryon ou de la lignée cellulaire infectés pour une analyse plus approfondie au microscope à fond clair, électronique ou fluorescent. Les effets cytopathiques (CPE) sont des anomalies cellulaires observables distinctes dues à une infection virale. Les CPE peuvent inclure une perte d'adhérence à la surface du contenant, des changements de forme cellulaire, passant de plate à ronde, un rétrécissement du noyau, des vacuoles dans le cytoplasme, la fusion des membranes cytoplasmiques et la formation de syncyties multinucléées, des corps d'inclusion dans le noyau ou le cytoplasme, et une lyse cellulaire complète ( (voir Figure\(\PageIndex{6}\)).
D'autres changements pathologiques incluent la perturbation virale du génome de l'hôte et la transformation des cellules normales en cellules transformées, qui sont les types de cellules associées aux carcinomes et aux sarcomes. Le type ou la gravité de l'EPC dépendent du type de virus concerné. La figure\(\PageIndex{6}\) répertorie les CPE pour des virus spécifiques.
Regardez cette vidéo pour en savoir plus sur les effets des virus sur les cellules.
Test d'hémagglutination
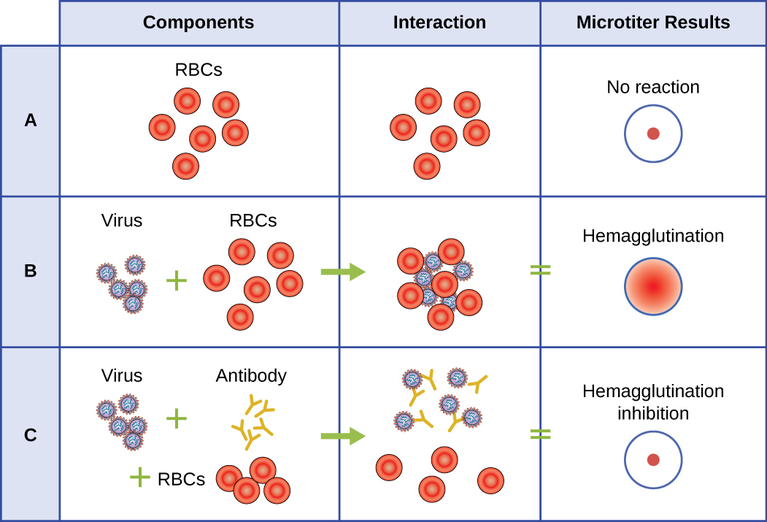
Un test sérologique est utilisé pour détecter la présence de certains types de virus dans le sérum des patients. Le sérum est la fraction liquide de couleur paille du plasma sanguin à partir de laquelle les facteurs de coagulation ont été éliminés. Le sérum peut être utilisé dans le cadre d'un test direct appelé test d'hémagglutination afin de détecter des types spécifiques de virus dans l'échantillon du patient. L'hémagglutination est l'agglutination (agglutination) des érythrocytes (globules rouges). De nombreux virus produisent des protéines de surface ou des pointes appelées hémagglutinines qui peuvent se lier aux récepteurs des membranes des érythrocytes et provoquer l'agglutination des cellules. L'hémagglutination est observable sans utiliser le microscope, mais cette méthode ne permet pas toujours de différencier les particules virales infectieuses des particules virales non infectieuses, car les deux peuvent agglutiner les érythrocytes.
Pour identifier un virus pathogène spécifique par hémagglutination, nous devons utiliser une approche indirecte. Des protéines appelées anticorps, générées par le système immunitaire du patient pour combattre un virus spécifique, peuvent être utilisées pour se lier à des composants tels que les hémagglutinines qui sont uniquement associés à des types spécifiques de virus. La liaison des anticorps aux hémagglutinines présentes sur le virus empêche ensuite les érythrocytes d'interagir directement avec le virus. Ainsi, lorsque des érythrocytes sont ajoutés aux virus recouverts d'anticorps, il n'y a aucune apparence d'agglutination ; l'agglutination a été inhibée. Nous appelons ces types de tests indirects pour les tests d'inhibition de l'hémagglutination (HAI) d'anticorps spécifiques au virus. L'HAI peut être utilisée pour détecter la présence d'anticorps spécifiques à de nombreux types de virus susceptibles de provoquer ou d'avoir causé une infection chez un patient, même des mois ou des années après l'infection (voir Figure\(\PageIndex{7}\)). Ce test est décrit plus en détail dans Essais d'agglutination.
Exercice\(\PageIndex{3}\)
Quel est le résultat d'un test HIA positif ?
Test d'amplification des acides nucléiques
Les tests d'amplification des acides nucléiques (NAAT) sont utilisés en biologie moléculaire pour détecter des séquences d'acides nucléiques uniques de virus dans des échantillons de patients. La réaction en chaîne par polymérase (PCR) est un NAAT utilisé pour détecter la présence d'ADN viral dans un échantillon de tissu ou de liquide corporel d'un patient. La PCR est une technique qui permet d'amplifier (c'est-à-dire de synthétiser de nombreuses copies) d'un segment d'ADN viral d'intérêt. À l'aide de la PCR, de courtes séquences nucléotidiques appelées amorces se lient à des séquences spécifiques de l'ADN viral, ce qui permet d'identifier le virus.
La transcriptase-PCR inverse (RT-PCR) est un NAAT utilisé pour détecter la présence de virus à ARN. La RT-PCR diffère de la PCR en ce que l'enzyme transcriptase inverse (RT) est utilisée pour fabriquer un ADNc à partir de la petite quantité d'ARN viral présente dans l'échantillon. L'ADNc peut ensuite être amplifié par PCR. La PCR et la RT-PCR sont toutes deux utilisées pour détecter et confirmer la présence de l'acide nucléique viral dans des échantillons de patients.
La peur du VPH
Michelle, une étudiante en soins infirmiers de 21 ans, s'est présentée à la clinique universitaire, craignant d'avoir été exposée à une maladie sexuellement transmissible (MST). Son partenaire sexuel avait récemment développé plusieurs bosses à la base de son pénis. Il avait reporté sa visite chez le médecin, mais Michelle soupçonne qu'il s'agit de verrues génitales causées par le VPH. Elle est particulièrement préoccupée parce qu'elle sait que le VPH cause non seulement des verrues, mais aussi une cause importante du cancer du col de l'utérus. Elle et son partenaire utilisent toujours des préservatifs pour la contraception, mais elle n'est pas certaine que cette précaution la protégera du VPH.
Le médecin de Michelle ne décèle aucun signe physique de verrues génitales ou d'autres MST, mais recommande à Michelle de subir un test Pap en même temps qu'un test de dépistage du VPH. Le test Pap permettra de dépister les cellules cervicales anormales et les CPE associées au VPH ; le test HPV permettra de détecter la présence du virus. Si les deux tests sont négatifs, Michelle peut être plus sûre qu'elle n'a probablement pas été infectée par le VPH. Cependant, son médecin suggère qu'il serait sage pour Michelle de se faire vacciner contre le VPH afin de se protéger d'une éventuelle exposition future.
Exercice\(\PageIndex{4}\)
Pourquoi le médecin de Michelle prescrit-il deux tests différents au lieu de se fier à l'un ou à l'autre ?
Test immunoenzymatique
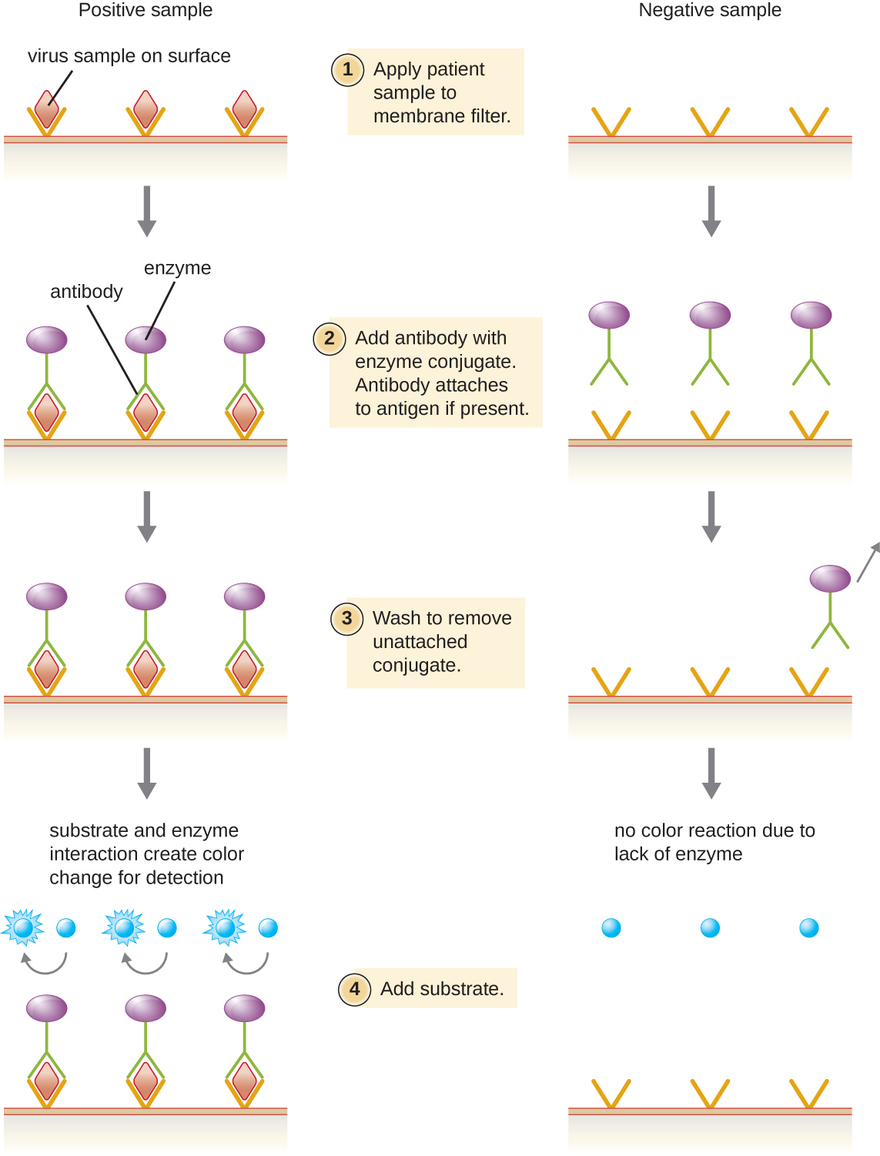
Les immunoessais enzymatiques (EIE) reposent sur la capacité des anticorps à détecter des biomolécules spécifiques appelées antigènes et à s'y fixer. L'anticorps détecteur se fixe à l'antigène cible avec un degré élevé de spécificité dans ce qui pourrait être un mélange complexe de biomolécules. Ce type de test comprend également une enzyme incolore fixée à l'anticorps détecteur. L'enzyme agit comme un marqueur sur l'anticorps détecteur et peut interagir avec un substrat incolore, conduisant à la production d'un produit final coloré. Les EIE s'appuient souvent sur des couches d'anticorps pour capturer et réagir avec les antigènes, qui sont tous attachés à un filtre à membrane (voir Figure\(\PageIndex{8}\)). Les EIE pour les antigènes viraux sont souvent utilisés comme tests de dépistage préliminaires. Si les résultats sont positifs, une confirmation supplémentaire nécessitera des tests d'une sensibilité encore plus grande, tels qu'un Western Blot ou un NAAT. Les EIE sont abordées plus en détail dans les EIE et les ELISA.
Exercice\(\PageIndex{5}\)
Qu'est-ce qui indique généralement un test d'EIE positif ?
Orientation clinique : 3e partie
Parallèlement à l'analyse par RT/PCR, la salive de David a également été collectée pour la culture virale. En général, aucun test diagnostique n'est suffisant pour établir un diagnostic antmortem, car les résultats dépendront de la sensibilité du test, de la quantité de virions présents au moment du test et du moment de l'essai, étant donné que la libération des virions dans la salive peut varier. Il s'avère que le résultat était négatif pour la culture virale à partir de la salive. Cela n'est pas surprenant pour le médecin de David, car un résultat négatif n'est pas une indication absolue de l'absence d'infection. Il se peut que le nombre de virions dans la salive soit faible au moment du prélèvement. Il n'est pas rare de répéter le test à intervalles réguliers pour augmenter les chances de détecter des charges virales plus élevées.
Exercice\(\PageIndex{6}\)
Le médecin de David devrait-il modifier son traitement en fonction des résultats de ces tests ?
Résumé
- La culture virale nécessite la présence d'une forme de cellule hôte (organisme entier, embryon ou culture cellulaire).
- Les virus peuvent être isolés des échantillons par filtration.
- Le filtrat viral est une riche source de virions libérés.
- Les bactériophages sont détectés par la présence de plaques transparentes sur le gazon bactérien.
- Les virus animaux et végétaux sont détectés par des effets cytopathiques, des techniques moléculaires (PCR, RT-PCR), des immunoessais enzymatiques et des tests sérologiques (test d'hémagglutination, test d'inhibition de l'hémagglutination).


