6.2 : Le cycle de vie viral
- Page ID
- 187615
Objectifs d'apprentissage
- Décrire les cycles de vie lytique et lysogénique
- Décrire le processus de réplication des virus animaux
- Décrire les caractéristiques uniques des rétrovirus et des virus latents
- Discuter des virus humains et de leurs interactions virus-cellule hôte
- Expliquer le processus de transduction
- Décrire le processus de réplication des virus végétaux
Tous les virus dépendent des cellules pour la reproduction et les processus métaboliques. À eux seuls, les virus ne codent pas pour toutes les enzymes nécessaires à la réplication virale. Mais au sein d'une cellule hôte, un virus peut réquisitionner la machinerie cellulaire pour produire davantage de particules virales. Les bactériophages ne se répliquent que dans le cytoplasme, car les cellules procaryotes n'ont ni noyau ni organites. Dans les cellules eucaryotes, la plupart des virus à ADN peuvent se répliquer à l'intérieur du noyau, à l'exception des virus à ADN de grande taille, tels que les poxvirus, qui peuvent se répliquer dans le cytoplasme. Les virus à ARN qui infectent les cellules animales se répliquent souvent dans le cytoplasme.
Le cycle de vie des virus avec des hôtes procaryotes
Le cycle de vie des bactériophages constitue un bon modèle pour comprendre comment les virus affectent les cellules qu'ils infectent, car des processus similaires ont été observés pour les virus eucaryotes, qui peuvent entraîner la mort immédiate de la cellule ou établir une infection latente ou chronique. Les phages virulents entraînent généralement la mort de la cellule par lyse cellulaire. Les phages tempérés, quant à eux, peuvent faire partie d'un chromosome hôte et être répliqués avec le génome cellulaire jusqu'à ce qu'ils soient incités à fabriquer des virus nouvellement assemblés ou des virus de descendance.
Le cycle lytique
Au cours du cycle lytique du phage virulent, le bactériophage prend le contrôle de la cellule, reproduit de nouveaux phages et détruit la cellule. Le phage T-even est un bon exemple d'une classe bien caractérisée de phages virulents. Le cycle lytique des bactériophages comporte cinq étapes (voir Figure\(\PageIndex{1}\)). La fixation est la première étape du processus d'infection au cours de laquelle le phage interagit avec des récepteurs de surface bactériens spécifiques (par exemple, les lipopolysaccharides et la protéine OmpC sur la surface de l'hôte). La plupart des phages ont une gamme d'hôtes étroite et peuvent infecter une espèce de bactérie ou une souche au sein d'une même espèce. Cette reconnaissance unique peut être exploitée pour le traitement ciblé d'une infection bactérienne par phagothérapie ou pour le typage des phages afin d'identifier des sous-espèces ou des souches bactériennes uniques. Le deuxième stade de l'infection est l'entrée ou la pénétration. Cela se produit par la contraction de la gaine caudale, qui agit comme une aiguille hypodermique pour injecter le génome viral à travers la paroi cellulaire et la membrane. La tête du phage et les composants restants restent à l'extérieur de la bactérie.
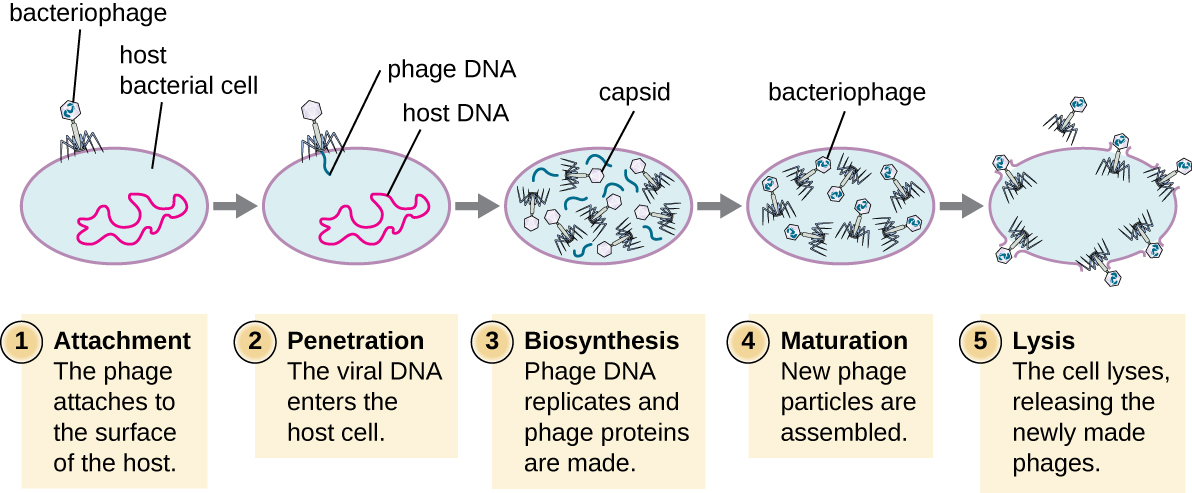
Le troisième stade de l'infection est la biosynthèse de nouveaux composants viraux. Après avoir pénétré dans la cellule hôte, le virus synthétise des endonucléases codées par le virus pour dégrader le chromosome bactérien. Il détourne ensuite la cellule hôte pour répliquer, transcrire et traduire les composants viraux nécessaires (capsomères, gaine, plaques de base, fibres caudales et enzymes virales) nécessaires à l'assemblage de nouveaux virus. Les gènes de la polymérase sont généralement exprimés au début du cycle, tandis que les protéines de la capside et de la queue sont exprimées plus tard. Au cours de la phase de maturation, de nouveaux virions sont créés. Pour libérer les phages libres, la paroi cellulaire bactérienne est perturbée par des protéines phagiques telles que l'holine ou le lysozyme. La dernière étape est la sortie. Les virus matures sortent de la cellule hôte au cours d'un processus appelé lyse, et les virus descendants sont libérés dans l'environnement pour infecter de nouvelles cellules.
Le cycle lysogénique
Dans un cycle lysogénique, le génome du phage pénètre également dans la cellule par fixation et pénétration. Le phage lambda est un excellent exemple de phage ayant ce type de cycle de vie. Au cours du cycle lysogénique, au lieu de tuer l'hôte, le génome du phage s'intègre au chromosome bactérien et devient partie intégrante de l'hôte. Le génome phagique intégré est appelé prophage. Un hôte bactérien doté d'un prophage est appelé lysogène. Le processus par lequel une bactérie est infectée par un phage tempéré est appelé lysogénie. Il est typique des phages tempérés d'être latents ou inactifs au sein de la cellule. En répliquant son chromosome, la bactérie reproduit également l'ADN du phage et le transmet à de nouvelles cellules filles pendant la reproduction. La présence du phage peut modifier le phénotype de la bactérie, car il peut introduire des gènes supplémentaires (par exemple, des gènes de toxine qui peuvent augmenter la virulence bactérienne). Cette modification du phénotype de l'hôte est appelée conversion lysogénique ou conversion phagique. Certaines bactéries, comme Vibrio cholerae et Clostridium botulinum, sont moins virulentes en l'absence du prophage. Les phages qui infectent ces bactéries transportent les gènes de la toxine dans leur génome et augmentent la virulence de l'hôte lorsque les gènes de la toxine sont exprimés. Dans le cas de V. cholera, la toxine codée par des phages peut provoquer une diarrhée sévère ; chez C. botulinum, la toxine peut provoquer une paralysie. Au cours de la lysogénie, le prophage persiste dans le chromosome hôte jusqu'à l'induction, ce qui entraîne l'excision du génome viral du chromosome hôte. Après l'induction, le phage tempéré peut suivre un cycle lytique puis subir une lysogénie dans une cellule nouvellement infectée (voir Figure\(\PageIndex{2}\)).
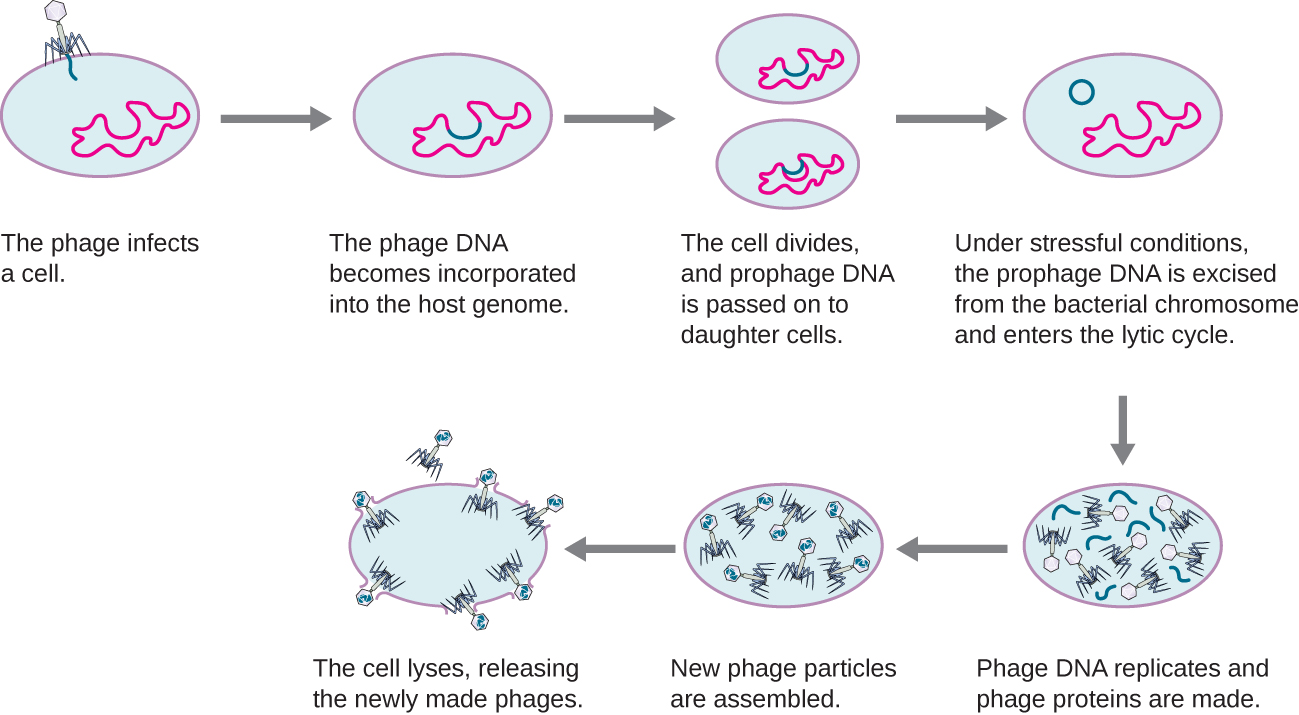
Cette vidéo illustre les étapes du cycle de vie lysogénique d'un bactériophage et le passage à une phase lytique.
Exercice\(\PageIndex{1}\)
Un phage latent est-il indétectable dans une bactérie ?
Transduction
La transduction se produit lorsqu'un bactériophage transfère l'ADN bactérien d'une bactérie à une autre lors d'infections séquentielles. Il existe deux types de transduction : la transduction généralisée et la transduction spécialisée. Au cours du cycle lytique de réplication virale, le virus détourne la cellule hôte, dégrade le chromosome de l'hôte et produit d'autres génomes viraux. Lorsqu'il assemble et emballe l'ADN dans la tête du phage, l'emballage commet parfois une erreur. Au lieu de conditionner l'ADN viral, il prélève un fragment aléatoire de l'ADN de l'hôte et l'insère dans la capside. Une fois libéré, ce virion injectera l'ADN de l'ancien hôte à un hôte nouvellement infecté. Le transfert asexué d'informations génétiques peut permettre une recombinaison de l'ADN, fournissant ainsi au nouvel hôte de nouveaux gènes (par exemple, un gène de résistance aux antibiotiques ou un gène métabolisant le sucre). La transduction généralisée se produit lorsqu'un fragment aléatoire d'ADN chromosomique bactérien est transféré par le phage au cours du cycle lytique. La transduction spécialisée se produit à la fin du cycle lysogénique, lorsque le prophage est excisé et que le bactériophage entre dans le cycle lytique. Comme le phage est intégré au génome de l'hôte, le prophage peut se répliquer en tant que partie intégrante de l'hôte. Cependant, certaines conditions (par exemple, exposition aux rayons ultraviolets ou exposition à des produits chimiques) stimulent l'induction du prophage, provoquant l'excrétion du phage du génome, son entrée dans le cycle lytique et la production de nouveaux phages qui quitteront les cellules hôtes. Au cours du processus d'excision du chromosome hôte, un phage peut parfois retirer une partie de l'ADN bactérien à proximité du site d'intégration virale. Le phage et l'ADN de l'hôte provenant d'une extrémité ou des deux extrémités du site d'intégration sont emballés dans la capside et sont transférés vers le nouvel hôte infecté. Comme l'ADN transféré par le phage n'est pas emballé de manière aléatoire mais constitue plutôt un fragment d'ADN spécifique situé à proximité du site d'intégration, ce mécanisme de transfert de gènes est appelé transduction spécialisée (voir Figure\(\PageIndex{3}\)). L'ADN peut ensuite se recombiner avec le chromosome de l'hôte, conférant à ce dernier de nouvelles caractéristiques. La transduction semble jouer un rôle important dans le processus évolutif des bactéries, en leur donnant un mécanisme d'échange asexué d'informations génétiques.
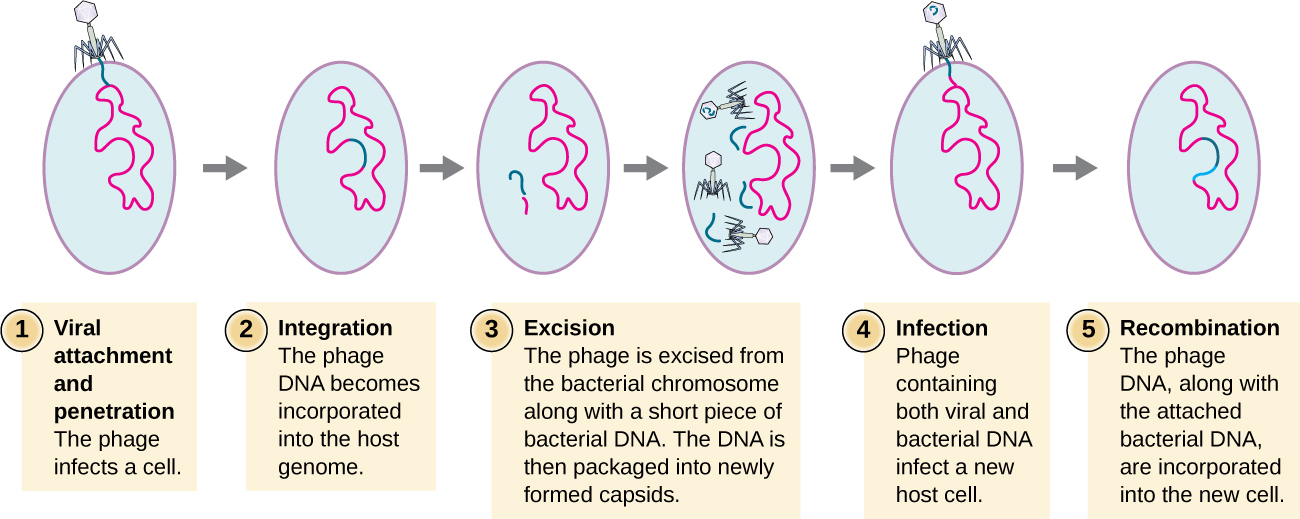
Exercice\(\PageIndex{2}\)
Quel cycle de vie phagique est associé à quelles formes de transduction ?
Cycle de vie des virus chez les animaux hôtes
Les virus animaux lytiques suivent des stades d'infection similaires à ceux des bactériophages : fixation, pénétration, biosynthèse, maturation et libération (voir Figure\(\PageIndex{4}\)). Cependant, les mécanismes de pénétration, de biosynthèse des acides nucléiques et de libération diffèrent entre les virus bactériens et les virus animaux. Après s'être liés aux récepteurs de l'hôte, les virus animaux pénètrent par endocytose (engloutissement par la cellule hôte) ou par fusion membranaire (enveloppe virale avec la membrane de la cellule hôte). De nombreux virus sont spécifiques à l'hôte, c'est-à-dire qu'ils n'infectent qu'un certain type d'hôte ; et la plupart des virus n'infectent que certains types de cellules des tissus. Cette spécificité est appelée tropisme tissulaire. Le poliovirus, qui présente un tropisme pour les tissus du cerveau et de la moelle épinière, ou le virus de la grippe, qui possède un tropisme primaire pour les voies respiratoires, en sont des exemples.
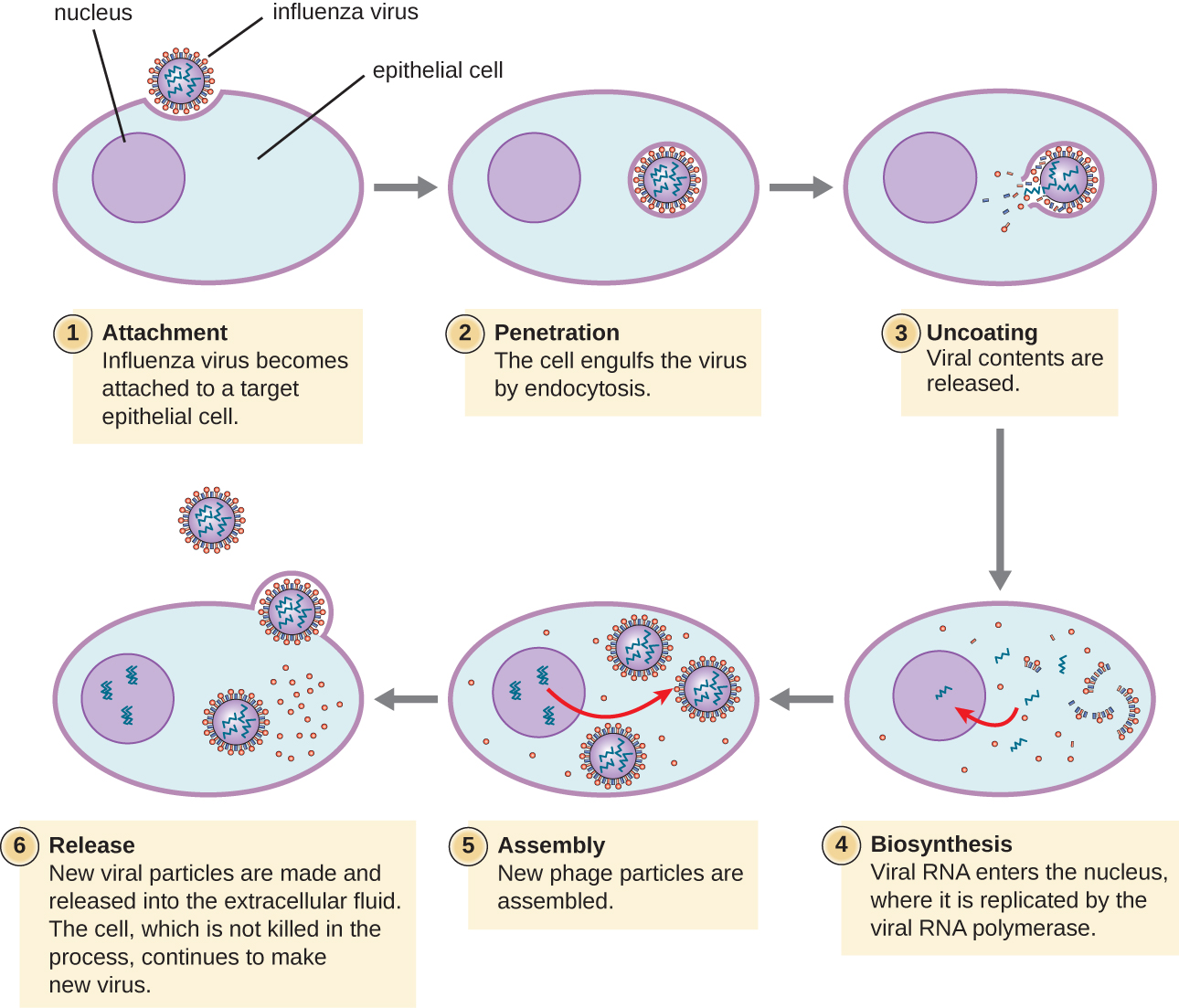
Les virus animaux n'expriment pas toujours leurs gènes en utilisant le flux normal d'informations génétiques, de l'ADN à l'ARN en passant par les protéines. Certains virus possèdent un génome dSDNA, comme les organismes cellulaires, et peuvent suivre le flux normal. Cependant, d'autres peuvent avoir des génomes SSDNA, dsRNA ou SSRNA. La nature du génome détermine la manière dont le génome est répliqué et exprimé sous forme de protéines virales. Si un génome est de l'ADNss, des enzymes hôtes seront utilisées pour synthétiser un second brin complémentaire au brin génomique, produisant ainsi du dsDNA. Le dsDNA peut désormais être répliqué, transcrit et traduit de la même manière que l'ADN de l'hôte.
Si le génome viral est de l'ARN, un mécanisme différent doit être utilisé. Il existe trois types de génomes d'ARN : le dsRNA, l'ARN simple brin positif (+) (+) ou l'ARN simple brin négatif (−) (−SSRNA). Si un virus possède un génome d'ARN+SSRNA, il peut être traduit directement pour fabriquer des protéines virales. L'ARN+sRNA génomique viral agit comme un ARNm cellulaire. Cependant, si un virus contient un génome −SSRNA, les ribosomes de l'hôte ne peuvent pas le traduire tant que l'ARN−ssRNA n'est pas répliqué en ARN+par l'ARN polymérase dépendante de l'ARN viral (rDRP) (voir Figure\(\PageIndex{5}\)). Le rDRP est introduit par le virus et peut être utilisé pour fabriquer de l'ARN+sRNA à partir du génome −ssRNA original. Le rDRP est également une enzyme importante pour la réplication des virus à ARNdS, car il utilise le brin négatif du génome bicaténaire comme matrice pour créer l'ARN+sRNA. Les copies d'ARN+sRNA nouvellement synthétisées peuvent ensuite être traduites par des ribosomes cellulaires.
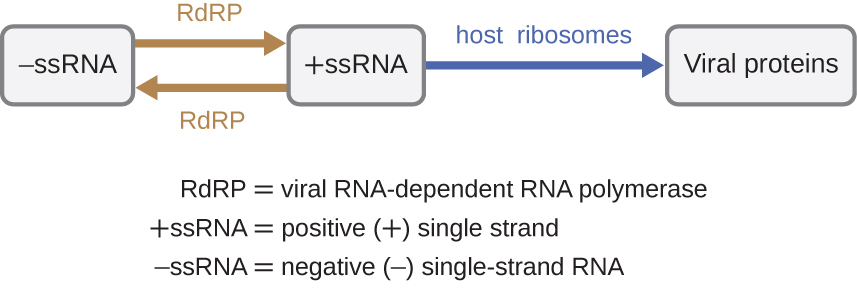
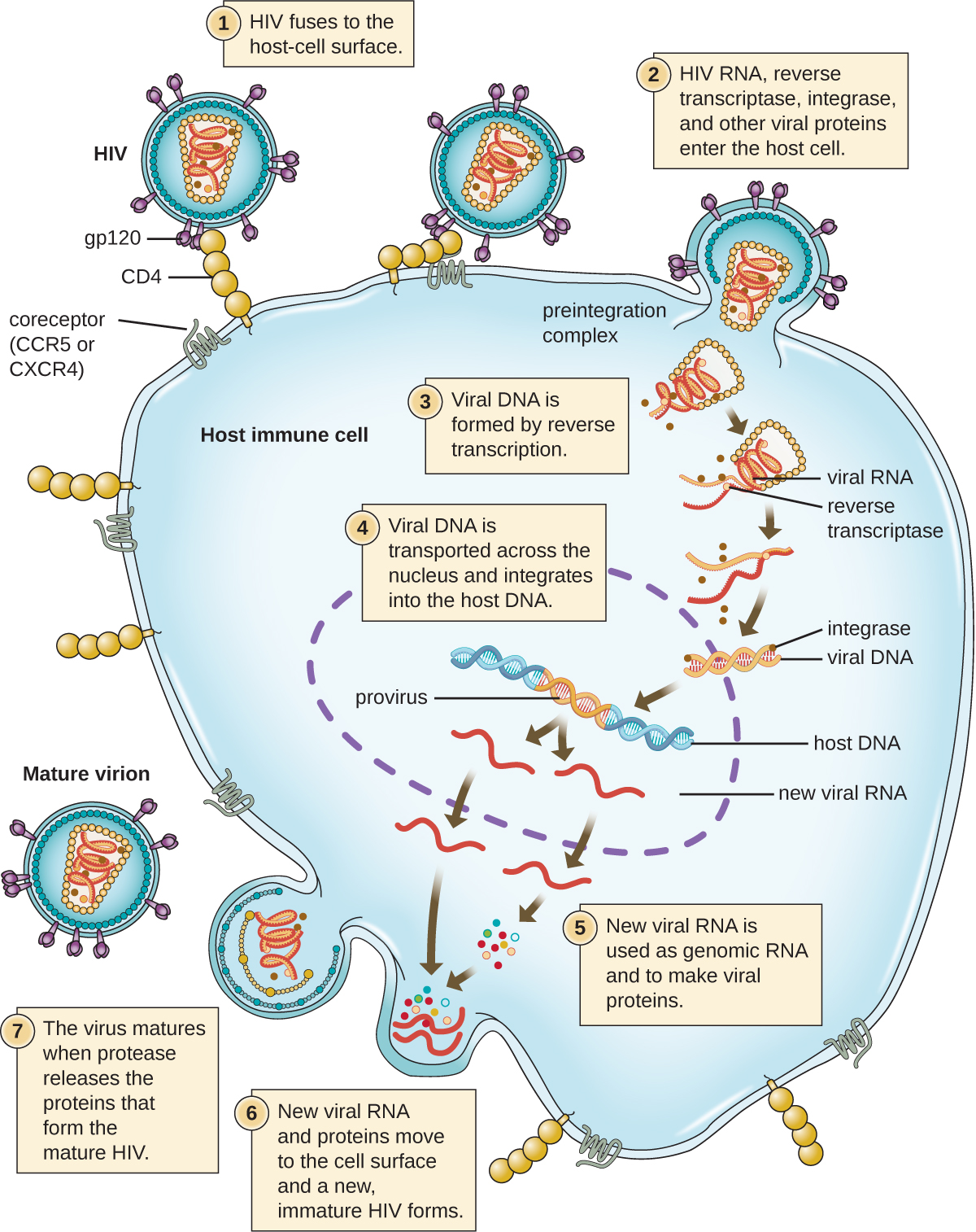
Un mécanisme alternatif pour la synthèse des acides nucléiques viraux est observé dans les rétrovirus es, qui sont des virus +SSRNA (voir Figure\(\PageIndex{6}\)). Les virus à ARN monocaténaire tels que le VIH sont porteurs d'une enzyme spéciale appelée transcriptase inverse dans la capside qui synthétise une copie complémentaire de l'ADNss (ADNc) en utilisant le génome de l'ARNs-+ comme matrice. L'ADNss est ensuite transformé en dsDNA, qui peut s'intégrer au chromosome de l'hôte et devenir un élément permanent de l'hôte. Le génome viral intégré est appelé provirus. Le virus peut maintenant rester longtemps dans l'hôte et provoquer une infection chronique. Le stade du provirus est similaire au stade de prophage d'une infection bactérienne au cours du cycle lysogénique. Cependant, contrairement au prophage, le provirus ne subit pas d'excision après épissage dans le génome.
Exercice\(\PageIndex{3}\)
L'ARN polymérase dépendante de l'ARN est-elle fabriquée à partir d'un gène viral ou d'un gène hôte ?
Infections persistantes
Une infection persistante se produit lorsqu'un virus n'est pas complètement éliminé du système de l'hôte mais demeure dans certains tissus ou organes de la personne infectée. Le virus peut rester silencieux ou subir une infection productive sans nuire gravement à l'hôte ni le tuer. Les mécanismes d'une infection persistante peuvent impliquer la régulation de l'expression du gène viral ou de l'hôte ou la modification de la réponse immunitaire de l'hôte. Les deux principales catégories d'infections persistantes sont les infections latentes et les infections chroniques. Parmi les virus responsables d'infections latentes, on peut citer le virus de l'herpès simplex (herpès oral et génital), le virus de la varicelle et du zona (varicelle et zona) et le virus d'Epstein-Barr (mononucléose). Le virus de l'hépatite C et le VIH sont deux exemples de virus responsables d'infections chroniques à long terme.
Infection latente
Tous les virus animaux ne se répliquent pas par le cycle lytique. Certains virus sont capables de rester cachés ou dormants à l'intérieur de la cellule au cours d'un processus appelé latence. Ces types de virus sont appelés virus latents et peuvent provoquer des infections latentes. Les virus capables de latence peuvent d'abord provoquer une infection aiguë avant de devenir dormants.
Par exemple, le virus de la varicelle infecte de nombreuses cellules du corps et provoque la varicelle, caractérisée par une éruption de cloques recouvrant la peau. Environ 10 à 12 jours après l'infection, la maladie disparaît et le virus devient dormant, vivant dans les ganglions des cellules nerveuses pendant des années. Pendant ce temps, le virus ne tue pas les cellules nerveuses et ne continue pas à se répliquer. La raison pour laquelle le virus cesse de se répliquer dans les cellules nerveuses et exprime peu de protéines virales n'est pas claire mais, dans certains cas, généralement après de nombreuses années de dormance, le virus est réactivé et provoque une nouvelle maladie appelée zona (Figure\(\PageIndex{7}\)). Alors que la varicelle touche de nombreuses régions du corps, le zona est une maladie spécifique aux cellules nerveuses qui émerge des ganglions dans lesquels le virus était dormant.
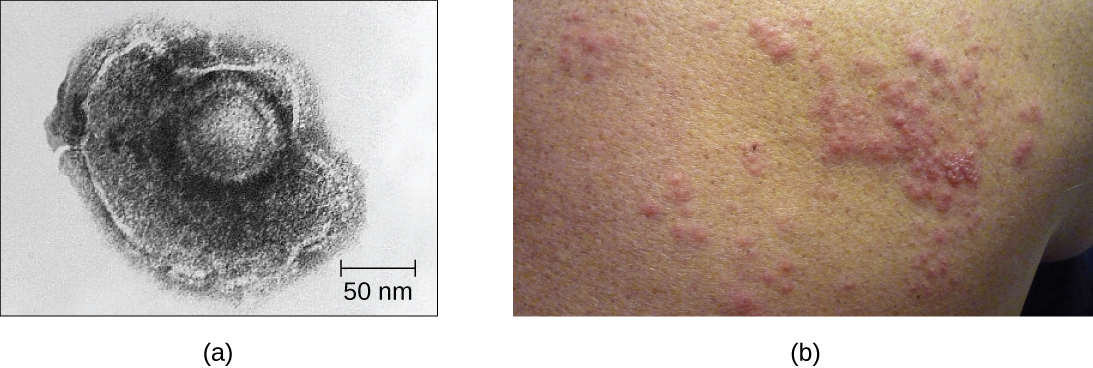
Les virus latents peuvent rester dormants en se présentant sous forme de molécules circulaires du génome viral à l'extérieur du chromosome hôte. D'autres deviennent des provirus en s'intégrant au génome de l'hôte. Pendant la période de dormance, les virus ne provoquent aucun symptôme de maladie et peuvent être difficiles à détecter. Un patient peut ne pas savoir qu'il est porteur du virus à moins qu'un test de diagnostic viral n'ait été effectué.
Infection chronique
Une infection chronique est une maladie dont les symptômes sont récurrents ou persistants sur une longue période. Certaines infections virales peuvent être chroniques si l'organisme est incapable d'éliminer le virus. Le VIH est un exemple de virus qui provoque une infection chronique, souvent après une longue période de latence. Une fois qu'une personne est infectée par le VIH, le virus peut être détecté dans les tissus de façon continue par la suite, mais les patients non traités ne présentent souvent aucun symptôme pendant des années. Cependant, le virus maintient une persistance chronique grâce à plusieurs mécanismes qui interfèrent avec la fonction immunitaire, notamment la prévention de l'expression d'antigènes viraux à la surface des cellules infectées, la modification des cellules immunitaires elles-mêmes, la restriction de l'expression des gènes viraux et la modification rapide des antigènes viraux grâce à mutation. Finalement, les dommages causés au système immunitaire entraînent une progression de la maladie menant au syndrome d'immunodéficience acquise (SIDA). Les divers mécanismes utilisés par le VIH pour éviter d'être éliminé par le système immunitaire sont également utilisés par d'autres virus infectieux chroniques, dont le virus de l'hépatite C.
Exercice\(\PageIndex{4}\)
De quelles deux manières un virus parvient-il à maintenir une infection persistante ?
Cycle de vie des virus chez les plantes hôtes
Les virus végétaux ressemblent davantage aux virus animaux qu'aux bactériophages. Les virus végétaux peuvent être enveloppés ou non. Comme de nombreux virus animaux, les virus végétaux peuvent avoir un génome d'ADN ou d'ARN et être monocaténaires ou bicaténaires. Cependant, la plupart des virus végétaux n'ont pas de génome d'ADN ; la majorité possède un génome d'ARNs-+, qui agit comme de l'ARN messager (ARNm). Seule une minorité de virus végétaux possède d'autres types de génomes.
Les virus végétaux peuvent avoir une gamme d'hôtes étroite ou étendue. Par exemple, le virus de la tristeza des agrumes n'infecte que quelques plantes du genre Citrus, alors que le virus de la mosaïque du concombre infecte des milliers de plantes de différentes familles végétales. La plupart des virus végétaux sont transmis par contact entre plantes ou par des champignons, des nématodes, des insectes ou d'autres arthropodes qui agissent comme des vecteurs mécaniques. Cependant, certains virus ne peuvent être transmis que par un type spécifique d'insecte vecteur ; par exemple, un virus particulier peut être transmis par les pucerons mais pas par les aleurodes. Dans certains cas, les virus peuvent également pénétrer dans des plantes saines par des blessures, comme cela peut se produire lors de l'élagage ou de dommages causés par les intempéries.
Les virus qui infectent les plantes sont considérés comme des parasites biotrophes, ce qui signifie qu'ils peuvent établir une infection sans tuer l'hôte, comme cela est observé dans les cycles de vie lysogéniques des bactériophages. L'infection virale peut être asymptomatique (latente) ou entraîner la mort cellulaire (infection lytique). Le cycle de vie commence par la pénétration du virus dans la cellule hôte. Ensuite, le virus n'est pas recouvert du cytoplasme de la cellule lorsque la capside est retirée. Selon le type d'acide nucléique, les composants cellulaires sont utilisés pour répliquer le génome viral et synthétiser des protéines virales pour l'assemblage de nouveaux virions. Pour établir une infection systémique, le virus doit pénétrer dans une partie du système vasculaire de la plante, telle que le phloème. Le temps requis pour une infection systémique peut varier de quelques jours à quelques semaines en fonction du virus, de l'espèce végétale et des conditions environnementales. Le cycle de vie du virus est terminé lorsqu'il est transmis d'une plante infectée à une plante saine.
Exercice\(\PageIndex{5}\)
Quels sont la structure et le génome d'un virus végétal typique ?
Courbe de croissance virale
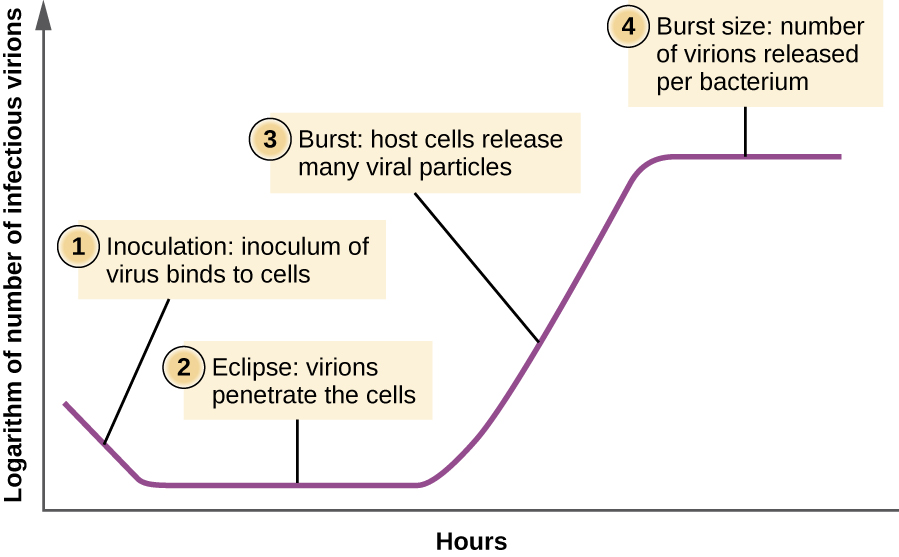
Contrairement à la courbe de croissance d'une population bactérienne, la courbe de croissance d'une population virale au cours de son cycle de vie ne suit pas de courbe sigmoïde. Au stade initial, un inoculum de virus provoque une infection. Pendant la phase d'éclipse, les virus se lient et pénètrent dans les cellules sans qu'aucun virion ne soit détecté dans le milieu. La principale différence qui apparaît ensuite entre la courbe de croissance virale et la courbe de croissance bactérienne se produit lorsque des virions sont libérés de la cellule hôte lysée en même temps. Un tel événement est appelé sursaut, et le nombre de virions par bactérie libérée est décrit comme la taille de l'éclatement. Dans une courbe de multiplication en une étape pour les bactériophages, les cellules hôtes se lysent, libérant de nombreuses particules virales dans le milieu, ce qui entraîne une très forte augmentation du titre viral (le nombre de virions par unité de volume). S'il ne reste aucune cellule hôte viable, les particules virales commencent à se dégrader au cours du déclin de la culture (voir Figure\(\PageIndex{8}\)).
Exercice\(\PageIndex{6}\)
Quel aspect du cycle de vie d'un virus entraîne l'augmentation soudaine de la courbe de croissance ?
Traitements non enregistrés
Le virus Ebola est incurable et mortel. L'épidémie en Afrique de l'Ouest en 2014 était sans précédent, éclipsant les autres épidémies humaines d'Ebola en termes de taux de mortalité. Sur 24 666 cas suspects ou confirmés signalés, 10 179 personnes sont décédées. 1
Aucun traitement ou vaccin approuvé contre le virus Ebola n'est disponible. Bien que certains médicaments aient démontré leur potentiel dans des études de laboratoire et sur des modèles animaux, leur innocuité et leur efficacité n'ont pas été testées chez l'homme. Non seulement ces médicaments ne sont ni testés ni enregistrés, mais ils sont également rares.
Compte tenu des grandes souffrances et des taux de mortalité élevés, il est juste de se demander si des médicaments non homologués et non testés sont meilleurs que rien du tout. Ces médicaments devraient-ils être distribués et, dans l'affirmative, qui devrait les recevoir, compte tenu de leur approvisionnement extrêmement limité ? Est-il éthique de traiter des médicaments non testés sur des patients atteints d'Ebola ? D'un autre côté, est-il éthique de refuser de donner des médicaments susceptibles de sauver des vies à des patients mourants ? Ou les médicaments devraient-ils être réservés aux prestataires de soins de santé qui s'efforcent de contenir la maladie ?
En août 2014, deux travailleurs humanitaires américains infectés et un prêtre espagnol ont été traités avec ZMapp, un médicament non enregistré qui avait été testé sur des singes mais pas sur des humains. Les deux travailleurs humanitaires américains se sont rétablis, mais le prêtre est mort. Plus tard dans le mois, l'OMS a publié un rapport sur l'éthique du traitement des patients avec ce médicament. Comme le virus Ebola est souvent mortel, le panel a estimé qu'il était éthique de donner des médicaments non enregistrés et contraire à l'éthique de ne pas les distribuer pour des raisons de sécurité. Cette situation est un exemple d' « usage compassionnel » en dehors du système bien établi de réglementation et de gouvernance des thérapies.
Ebola aux États-Unis
Le 24 septembre 2014, Thomas Eric Duncan est arrivé au Texas Health Presbyterian Hospital de Dallas pour se plaindre de fièvre, de maux de tête, de vomissements et de diarrhée, symptômes fréquemment observés chez les patients souffrant du rhume ou de la grippe. Après examen, un médecin des urgences lui a diagnostiqué une sinusite, lui a prescrit des antibiotiques et l'a renvoyé chez lui. Deux jours plus tard, Duncan est retourné à l'hôpital en ambulance. Son état s'est détérioré et des analyses sanguines supplémentaires ont confirmé qu'il était infecté par le virus Ebola.
D'autres enquêtes ont révélé que Duncan venait de rentrer du Libéria, l'un des pays en proie à une grave épidémie d'Ebola. Le 15 septembre, neuf jours avant son arrivée à l'hôpital de Dallas, Duncan avait aidé à transporter un voisin atteint d'Ebola vers un hôpital au Libéria. L'hôpital a continué de traiter Duncan, mais il est décédé plusieurs jours après son admission.
La chronologie du cas Duncan est révélatrice du cycle de vie du virus Ebola. La durée d'incubation du virus Ebola varie de 2 jours à 21 jours. Neuf jours se sont écoulés entre l'exposition de Duncan à l'infection virale et l'apparition de ses symptômes. Cela correspond, en partie, à la période d'éclipse de croissance de la population virale. Pendant la phase de l'éclipse, Duncan aurait été incapable de transmettre la maladie à d'autres personnes. Cependant, dès qu'une personne infectée commence à présenter des symptômes, la maladie devient très contagieuse. Le virus Ebola se transmet par contact direct avec des gouttelettes de liquides corporels tels que la salive, le sang et les vomissements. Duncan aurait pu transmettre la maladie à d'autres personnes à tout moment après l'apparition des symptômes, probablement quelque temps avant son arrivée à l'hôpital de Dallas. Une fois qu'un hôpital se rend compte qu'un patient comme Duncan est infecté par le virus Ebola, le patient est immédiatement mis en quarantaine et les responsables de la santé publique lancent une recherche rétrospective pour identifier toutes les personnes avec lesquelles un patient comme Duncan aurait pu interagir pendant la période où il présentait des symptômes.
Les responsables de la santé publique ont pu retrouver 10 personnes à haut risque (membres de la famille de Duncan) et 50 personnes à faible risque afin de les surveiller afin de détecter tout signe d'infection. Aucun n'a contracté la maladie. Cependant, l'une des infirmières chargées des soins de Duncan a été infectée. Ceci, ajouté à l'erreur de diagnostic initiale de Duncan, a clairement montré que les hôpitaux américains devaient fournir une formation supplémentaire au personnel médical afin de prévenir une éventuelle épidémie d'Ebola aux États-Unis.
Exercice\(\PageIndex{7}\)
- Quels types de formation peuvent préparer les professionnels de santé à contenir les épidémies émergentes, comme l'épidémie d'Ebola de 2014 ?
- Quelle est la différence entre un agent pathogène contagieux et un agent pathogène infectieux ?

Pour plus d'informations sur le virus Ebola, veuillez consulter le site Web des CDC.
Résumé
- De nombreux virus ciblent des hôtes ou des tissus spécifiques. Certains peuvent avoir plus d'un hôte.
- De nombreux virus suivent plusieurs étapes pour infecter les cellules hôtes. Ces étapes incluent la fixation, la pénétration, le décapage, la biosynthèse, la maturation et la libération.
- Les bactériophages ont un cycle lytique ou lysogénique. Le cycle lytique entraîne la mort de l'hôte, tandis que le cycle lysogénique entraîne l'intégration du phage dans le génome de l'hôte.
- Les bactériophages injectent de l'ADN dans la cellule hôte, tandis que les virus animaux y pénètrent par endocytose ou fusion membranaire.
- Les virus animaux peuvent subir une latence, similaire à la lysogénie d'un bactériophage.
- La majorité des virus végétaux sont des ARNss à brin positif et peuvent subir une infection latente, chronique ou lytique, comme cela a été observé pour les virus animaux.
- La courbe de croissance des populations de bactériophages est une courbe de multiplication en une étape et non une courbe sigmoïde, par rapport à la courbe de croissance bactérienne.
- Les bactériophages transfèrent des informations génétiques entre hôtes par transduction généralisée ou spécialisée.
Notes
- 1 Organisation mondiale de la santé. « Données et statistiques de l'OMS sur le virus Ebola ». 18 mars 2005. http://apps.who.int/gho/data/view.eb...150318 ? lang=fr


