6.4 : Viroïdes, virusoïdes et prions
- Page ID
- 187616
Objectifs d'apprentissage
- Décrire les viroïdes et leurs caractéristiques uniques
- Décrire les virusoïdes et leurs caractéristiques uniques
- Décrire les prions et leurs caractéristiques uniques
Les recherches visant à découvrir les agents responsables de maladies qui n'avaient pas encore fait l'objet d'études ont permis de découvrir des agents pathogènes non vivants très différents des virus. Il s'agit notamment de particules constituées uniquement d'ARN ou de protéines qui, néanmoins, peuvent s'auto-propager aux dépens de l'hôte, une similitude essentielle avec les virus qui leur permet de provoquer des maladies. À ce jour, ces découvertes incluent les viroïdes, les virusoïdes et les prions protéiques.
Viroïdes
En 1971, Theodor Diener, pathologiste travaillant au Service de recherche agricole, a découvert une particule acellulaire qu'il a nommée viroïde, ce qui signifie « semblable à un virus ». Les viroïdes ne sont constitués que d'un petit brin d'ARN circulaire capable de s'autorépliquer. Le premier viroïde découvert s'est révélé être à l'origine de la maladie du fuseau des tubercules de la pomme de terre, qui ralentit la germination et entraîne diverses déformations chez les plants de pommes de terre (voir Figure\(\PageIndex{1}\)). Comme les virus, les viroïdes des tubercules fusiformes de la pomme de terre (PSTV) contrôlent la machinerie hôte pour répliquer leur génome d'ARN. Contrairement aux virus, les viroïdes ne possèdent pas de couche protéique qui protège leurs informations génétiques.

Les viroïdes peuvent entraîner des pertes dévastatrices de cultures vivrières d'importance commerciale cultivées dans les champs et les vergers. Depuis la découverte du PSTV, d'autres viroïdes responsables de maladies des plantes ont été découverts. Le viroïde macho de la plante de tomate (TPMVD) infecte les plants de tomates, ce qui entraîne une perte de chlorophylle, des feuilles défigurées et cassantes et de très petites tomates, ce qui entraîne une perte de productivité dans cette culture de grande culture. Le viroïde de la tache solaire de l'avocat (AsBvD) entraîne des rendements plus faibles et des fruits de moins bonne qualité. L'AsBvD est le plus petit viroïde découvert à ce jour qui infecte les plantes. Le viroïde mosaïque latent de la pêche (pLMVD) peut provoquer la nécrose des boutons floraux et des branches et endommager les fruits mûrs, ce qui entraîne la croissance de champignons et de bactéries dans les fruits. Le PLMVD peut également provoquer des changements pathologiques similaires chez les prunes, les nectarines, les abricots et les cerises, ce qui entraîne également une baisse de la productivité dans ces vergers. Les viroïdes, en général, peuvent être dispersés mécaniquement lors de l'entretien ou de la récolte des cultures, de la reproduction végétative, et éventuellement par l'intermédiaire des graines et des insectes, ce qui entraîne une baisse importante de la disponibilité alimentaire et des conséquences économiques dévastatrices.
Exercice\(\PageIndex{1}\)
De quoi est composé le génome d'un viroïde ?
Virusoïdes
Un deuxième type d'ARN pathogène qui peut infecter des cultures agricoles importantes sur le plan commercial est celui des virusoïdes, qui sont des particules subvirales que l'on décrit mieux comme des ARNs non autoréplicatifs. La réplication de l'ARN des virusoïdes est similaire à celle des viroïdes mais, contrairement aux viroïdes, les virus nécessitent que la cellule soit également infectée par un virus « auxiliaire » spécifique. Il n'existe actuellement que cinq types de virusoïdes décrits et les virus auxiliaires associés. Les virus auxiliaires appartiennent tous à la famille des sobémovirus. Un exemple de virus auxiliaire est le virus souterrain de la marbrure du trèfle, auquel est associé un virusoïde encapsulé à l'intérieur de la capside virale. Une fois que le virus auxiliaire pénètre dans la cellule hôte, les virusoïdes sont libérés et peuvent être retrouvés libres dans le cytoplasme des cellules végétales, où ils possèdent une activité ribozymique. Le virus auxiliaire subit une réplication virale typique indépendamment de l'activité du virusoïde. Les génomes des virusoïdes sont petits, longs de seulement 220 à 388 nucléotides. Le génome d'un virusoïde ne code aucune protéine, mais sert uniquement à répliquer l'ARN virusoïde.
Les virusoïdes appartiennent à un groupe plus vaste d'agents infectieux appelés ARN satellites, qui sont des ARN pathogènes similaires à ceux que l'on trouve chez les animaux. Contrairement aux virusoïdes végétaux, les ARN satellites peuvent coder pour des protéines ; toutefois, comme les virusoïdes végétaux, les ARN satellites doivent coinfecter un virus auxiliaire pour se répliquer. Un ARN satellite qui infecte les humains et qui a été décrit par certains scientifiques comme un virusoïde est le virus de l'hépatite delta (HDV), qui, selon certains rapports, est également appelé virusoïde de l'hépatite delta. Bien plus gros qu'un virusoïde végétal, le HDV possède un génome d'ARNss circulaire de 1 700 nucléotides et peut diriger la biosynthèse des protéines associées au HDV. Le virus auxiliaire du HDV est le virus de l'hépatite B (HBV). La co-infection par le VHB et le HDV entraîne des modifications pathologiques plus graves du foie au cours de l'infection, c'est ainsi que le HDV a été découvert pour la première fois.
Exercice\(\PageIndex{2}\)
Quelle est la principale différence entre un viroïde et un virusoïde ?
Prions
À une certaine époque, les scientifiques croyaient que toute particule infectieuse devait contenir de l'ADN ou de l'ARN. Puis, en 1982, Stanley Prusiner, médecin étudiant la tremblante du mouton (une maladie dégénérative mortelle chez les ovins), a découvert que la maladie était causée par des particules infectieuses protéiques, ou prions. Comme les protéines sont acellulaires et ne contiennent ni ADN ni ARN, les découvertes de Prusiner ont d'abord rencontré résistance et scepticisme ; cependant, ses recherches ont finalement été validées et il a reçu le prix Nobel de physiologie ou de médecine en 1997.
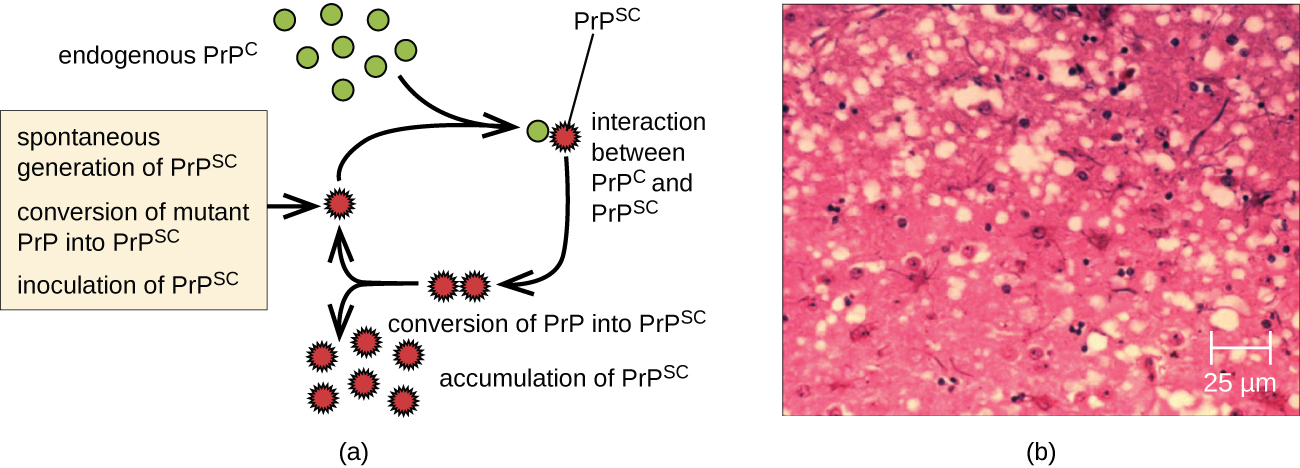
Un prion est une forme voyous mal repliée d'une protéine normale (PrPC) présente dans la cellule. Cette protéine prion malhonnête (PrPSc), qui peut être causée par une mutation génétique ou apparaître spontanément, peut être infectieuse et inciter d'autres protéines normales endogènes à se replier mal et à former des plaques (voir Figure\(\PageIndex{2}\)). On sait aujourd'hui que les prions sont à l'origine de diverses formes d'encéphalopathie spongiforme transmissible (EST) chez les humains et les animaux. L'EST est une maladie dégénérative rare qui touche le cerveau et le système nerveux. L'accumulation de protéines indésirables fait en sorte que le tissu cérébral ressemble à une éponge, tuant les cellules cérébrales et formant des trous dans les tissus, entraînant des lésions cérébrales, une perte de coordination motrice et une démence (voir Figure\(\PageIndex{3}\)). Les personnes infectées sont atteintes de troubles mentaux et deviennent incapables de bouger ou de parler. Il n'existe aucun remède et la maladie progresse rapidement et finit par entraîner la mort en quelques mois ou quelques années.
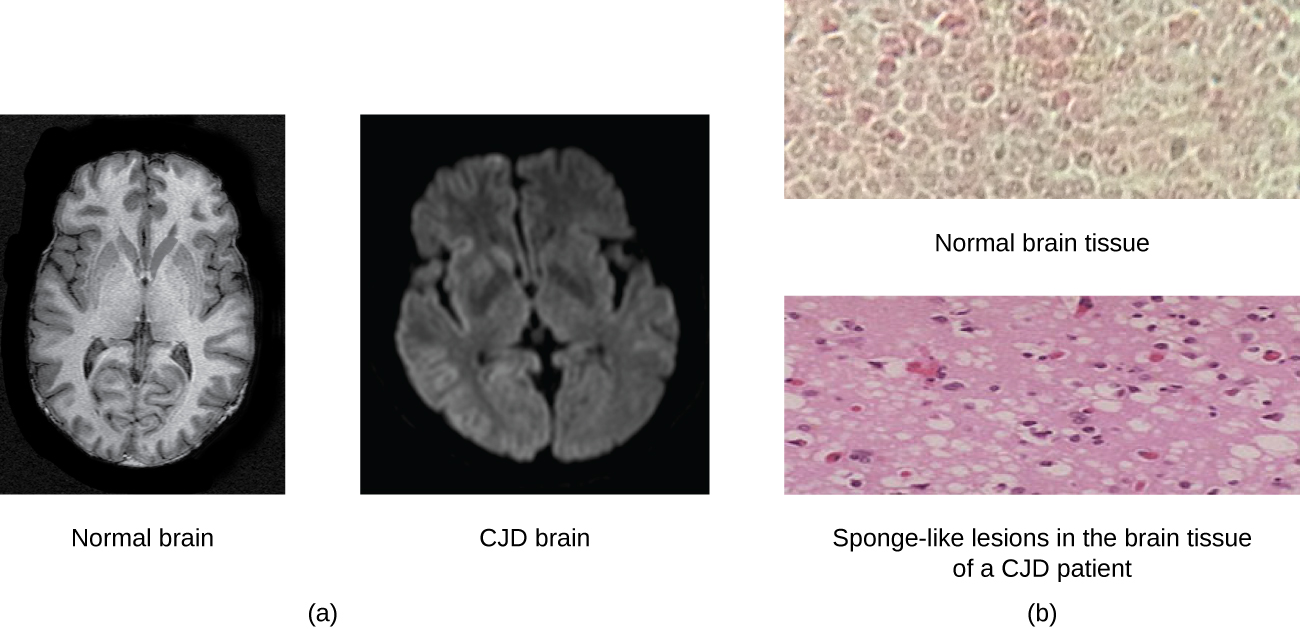
Les EST chez l'homme incluent le kuru, l'insomnie familiale fatale, la maladie de Gerstmann-Straussler-Scheinker et la maladie de Creutzfeldt-Jakob (voir Figure\(\PageIndex{3}\)). Les EST chez les animaux incluent la maladie de la vache folle, la tremblante du mouton (chez les ovins et les chèvres) et la maladie débilitante chronique (chez les wapitis et les cerfs). Les EST peuvent être transmises d'un animal à l'autre et de l'animal à l'homme par la consommation de viande ou d'aliments pour animaux contaminés. La transmission entre humains peut se faire par hérédité (comme c'est souvent le cas pour le SGS et la MCJ) ou par contact avec des tissus contaminés, comme cela peut se produire lors d'une transfusion sanguine ou d'une greffe d'organe. Il n'existe aucune preuve de transmission par contact occasionnel avec une personne infectée. Le tableau\(\PageIndex{1}\) répertorie les EST qui affectent les humains et leurs modes de transmission.
| Maladie | Mécanisme (s) de transmission 1 |
|---|---|
| MCJ sporadique (ScJD) | Inconnu ; peut-être par modification de la protéine antérieure normale (PrP) en une forme irrégulière due à une mutation somatique |
| Variante de la MCJ (vCJD) | Consommation de produits bovins contaminés et transmission secondaire par le sang |
| MCJ familiale (FcJD) | Mutation du gène PrP de la lignée germinale |
| MCJ iatrogène (ICJD) | Instruments neurochirurgicaux contaminés, greffe de cornée, hormone gonadotrophique et, accessoirement, par transfusion sanguine |
| Kuru | Manger de la viande infectée par le cannibalisme rituel |
| Maladie de Gerstmann-Straussler-Scheinker (GSS) | Mutation du gène PrP de la lignée germinale |
| Insomnie familiale fatale (FFI) | Mutation du gène PrP de la lignée germinale |
Les prions sont extrêmement difficiles à détruire car ils résistent à la chaleur, aux produits chimiques et aux radiations. Même les procédures de stérilisation standard ne garantissent pas la destruction de ces particules. À l'heure actuelle, il n'existe aucun traitement ou remède contre l'EST, et les viandes contaminées ou les animaux infectés doivent être manipulés conformément aux directives fédérales afin de prévenir la transmission.
Exercice\(\PageIndex{3}\)
Un prion possède-t-il un génome ?
Orientation clinique : résolution
Quelques jours plus tard, le médecin de David reçoit les résultats du test d'immunofluorescence sur son échantillon de peau. Le test est négatif pour l'antigène de la rage. Un deuxième test d'antigène viral sur son échantillon de salive s'avère également négatif. Malgré ces résultats, le médecin décide de poursuivre le traitement actuel de David. Étant donné que le test RT-PCR est positif, il est préférable de ne pas exclure une éventuelle infection par la rage.
Près du site de la morsure, David reçoit une injection d'immunoglobuline antirabique, qui se fixe à tout virus de la rage pouvant être présent dans ses tissus et l'inactive. Au cours des 14 jours suivants, il reçoit une série de quatre vaccins spécifiques contre la rage dans le bras. Ces vaccins activent la réponse immunitaire de David et aident son corps à reconnaître et à combattre le virus. Heureusement, grâce au traitement, les symptômes de David s'améliorent et il se rétablit complètement.
Tous les cas de rage n'ont pas une issue aussi heureuse. En fait, la rage est généralement fatale lorsque le patient commence à présenter des symptômes, et les traitements post-morsure sont principalement palliatifs (sédation et gestion de la douleur).
Résumé
- D'autres agents acellulaires tels que les viroïdes, les virusoïdes et les prions provoquent également des maladies. Les viroïdes sont de petits ARNs nus qui provoquent des maladies chez les plantes. Les virusoïdes sont des ARNs qui ont besoin d'autres virus auxiliaires pour établir une infection. Les prions sont des particules infectieuses protéiques qui provoquent des encéphalopathies spongiformes transmissibles.
- Les prions sont extrêmement résistants aux produits chimiques, à la chaleur et aux radiations.
- Il n'existe aucun traitement contre l'infection à prions.
Notes
- 1 Institut national des troubles neurologiques et des accidents vasculaires cérébraux. « Fiche d'information sur la maladie de Creutzfeldt-Jakob ». http://www.ninds.nih.gov/disorders/cjd/detail_cjd.htm (consulté le 31 décembre 2015).


