2.2 : Eau
- Page ID
- 186339
Vous êtes-vous déjà demandé pourquoi les scientifiques passent du temps à chercher de l'eau sur d'autres planètes ? C'est parce que l'eau est essentielle à la vie ; même de minuscules traces de celle-ci sur une autre planète peuvent indiquer que la vie a existé ou a existé sur cette planète. L'eau est l'une des molécules les plus abondantes des cellules vivantes et la plus essentielle à la vie telle que nous la connaissons. Environ 60 à 70 % de votre corps est constitué d'eau. Sans elle, la vie n'existerait tout simplement pas.
L'eau est polaire
Les atomes d'hydrogène et d'oxygène contenus dans les molécules d'eau forment des liaisons covalentes polaires. Les électrons partagés passent plus de temps associés à l'atome d'oxygène qu'aux atomes d'hydrogène. Il n'y a pas de charge globale pour une molécule d'eau, mais il y a une légère charge positive sur chaque atome d'hydrogène et une légère charge négative sur l'atome d'oxygène. En raison de ces charges, les atomes d'hydrogène légèrement positifs se repoussent mutuellement et forment la forme unique illustrée à la Figure 2.1.6. Chaque molécule d'eau attire d'autres molécules d'eau en raison des charges positives et négatives dans les différentes parties de la molécule. L'eau attire également d'autres molécules polaires (comme les sucres), formant des liaisons hydrogène. Lorsqu'une substance forme facilement des liaisons hydrogènes avec l'eau, elle peut se dissoudre dans l'eau et est qualifiée d'hydrophile (« aimant l'eau »). Les liaisons hydrogène ne se forment pas facilement avec des substances non polaires telles que les huiles et les graisses (Figure\(\PageIndex{1}\)). Ces composés non polaires sont hydrophobes (« craignant l'eau ») et ne se dissolvent pas dans l'eau.

L'eau stabilise la température
Les liaisons hydrogène de l'eau lui permettent d'absorber et de libérer de l'énergie thermique plus lentement que de nombreuses autres substances. La température est une mesure du mouvement (énergie cinétique) des molécules. À mesure que le mouvement augmente, l'énergie augmente et donc la température augmente. L'eau absorbe une grande quantité d'énergie avant que sa température ne s'élève. L'augmentation de l'énergie perturbe les liaisons hydrogène entre les molécules d'eau. Comme ces liaisons peuvent être créées et perturbées rapidement, l'eau n'absorbe que très peu l'augmentation de l'énergie et les changements de température. Cela signifie que l'eau atténue les changements de température au sein des organismes et de leur environnement. À mesure que l'apport d'énergie se poursuit, l'équilibre entre la formation de liaisons hydrogènes et la destruction oscille vers le côté de la destruction. Plus de liens sont brisés qu'ils ne se forment. Ce processus entraîne la libération de molécules d'eau individuelles à la surface du liquide (comme un plan d'eau, les feuilles d'une plante ou la peau d'un organisme) dans le cadre d'un processus appelé évaporation. L'évaporation de la sueur, qui est composée à 90 % d'eau, permet de refroidir l'organisme, car la rupture des liaisons hydrogènes nécessite un apport d'énergie et évacue la chaleur du corps.
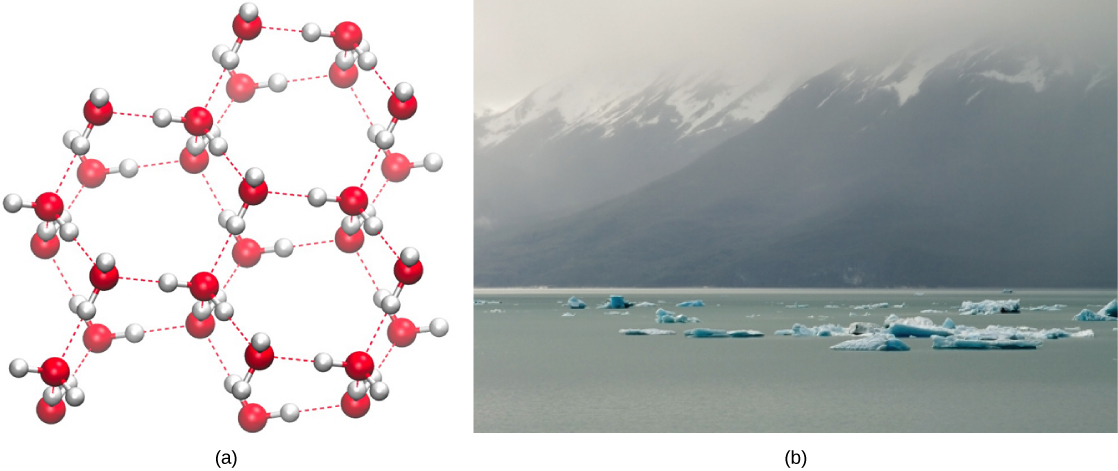
Inversement, à mesure que le mouvement moléculaire diminue et que les températures baissent, moins d'énergie est présente pour rompre les liaisons hydrogène entre les molécules d'eau. Ces liaisons restent intactes et commencent à former une structure rigide semblable à un réseau (par exemple, de la glace) (Figure\(\PageIndex{2}\) a). Lorsqu'elle est gelée, la glace est moins dense que l'eau liquide (les molécules sont plus éloignées les unes des autres). Cela signifie que de la glace flotte à la surface d'un plan d'eau (Figure\(\PageIndex{2}\) b). Dans les lacs, les étangs et les océans, de la glace se forme à la surface de l'eau, créant une barrière isolante qui protège les animaux et les plantes sous-jacents du gel dans l'eau. Si cela ne se produisait pas, les plantes et les animaux vivant dans l'eau gèleraient dans un bloc de glace et ne pourraient plus se déplacer librement, rendant la vie par temps froid difficile, voire impossible.
L'eau est un excellent solvant
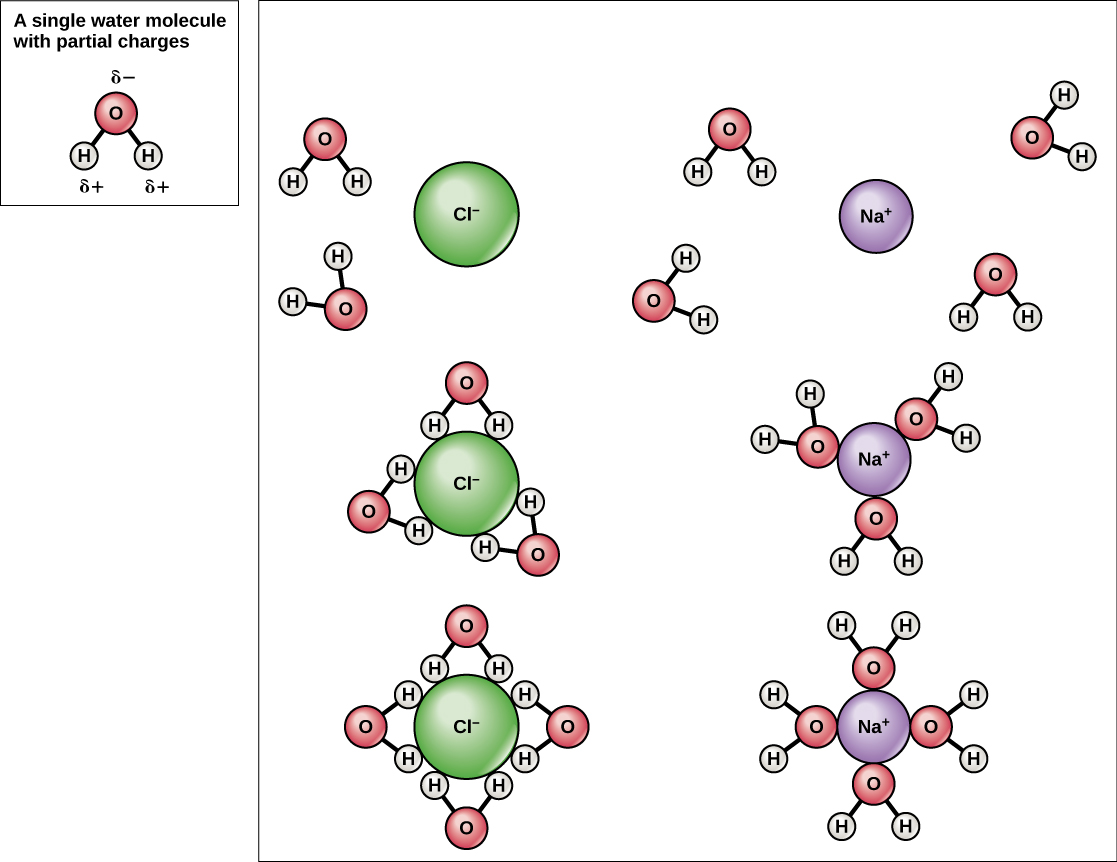
Comme l'eau est polaire, avec de légères charges positives et négatives, les composés ioniques et les molécules polaires peuvent facilement s'y dissoudre. L'eau est donc ce que l'on appelle un solvant, une substance capable de dissoudre une autre substance. Les particules chargées formeront des liaisons hydrogène avec la couche environnante de molécules d'eau. C'est ce que l'on appelle une sphère d'hydratation et sert à maintenir les particules séparées ou dispersées dans l'eau. Dans le cas du sel de table (NaCl) mélangé à de l'eau (Figure\(\PageIndex{3}\)), les ions sodium et chlorure se séparent, ou se dissocient, dans l'eau, et des sphères d'hydratation se forment autour des ions. Un ion sodium chargé positivement est entouré par les charges partiellement négatives des atomes d'oxygène dans les molécules d'eau. Un ion chlorure chargé négativement est entouré par les charges partiellement positives des atomes d'hydrogène dans les molécules d'eau. Ces sphères d'hydratation sont également appelées coques d'hydratation. La polarité de la molécule d'eau en fait un solvant efficace et joue un rôle important dans ses nombreux rôles dans les systèmes vivants.
L'eau est cohésive
Avez-vous déjà rempli un verre d'eau jusqu'au sommet puis ajouté lentement quelques gouttes supplémentaires ? Avant qu'elle ne déborde, l'eau forme en fait une coupole au-dessus du bord du verre. Cette eau peut rester au-dessus du verre en raison de la propriété de cohésion. Lors de la cohésion, les molécules d'eau sont attirées les unes vers les autres (à cause de la liaison hydrogène), ce qui permet de maintenir les molécules ensemble à l'interface liquide-air (gaz), bien qu'il n'y ait plus de place dans le verre. La cohésion engendre une tension superficielle, c'est-à-dire la capacité d'une substance à résister à la rupture lorsqu'elle est mise sous tension ou sous contrainte. Lorsque vous déposez un petit bout de papier sur une gouttelette d'eau, le papier flotte au-dessus de la gouttelette d'eau, bien que l'objet soit plus dense (plus lourd) que l'eau. Cela se produit en raison de la tension superficielle créée par les molécules d'eau. La cohésion et la tension superficielle maintiennent les molécules d'eau intactes et permettent à l'objet de flotter sur le dessus. Il est même possible de « faire flotter » une aiguille en acier sur un verre d'eau si vous la placez doucement, sans rompre la tension superficielle (Figure\(\PageIndex{4}\)).

Ces forces de cohésion sont également liées à la propriété d'adhésion de l'eau, ou à l'attraction entre les molécules d'eau et d'autres molécules. C'est ce que l'on observe lorsque l'eau « grimpe » sur une paille placée dans un verre d'eau. Vous remarquerez que l'eau semble être plus haute sur les côtés de la paille qu'au milieu. En effet, les molécules d'eau sont attirées par la paille et y adhèrent donc.
Les forces de cohésion et d'adhérence sont importantes pour le maintien de la vie. Par exemple, en raison de ces forces, l'eau peut s'écouler des racines vers le sommet des plantes pour nourrir celles-ci.
CONCEPT EN ACTION
Pour en savoir plus sur l'eau, consultez le site Web de l'US Geological Survey Water Science for Schools : All About Water ! site Web.
Tampons, pH, acides et bases
Le pH d'une solution est une mesure de son acidité ou de son alcalinité. Vous avez probablement utilisé du papier de tournesol, du papier qui a été traité avec un colorant naturel soluble dans l'eau afin de pouvoir être utilisé comme indicateur de pH, pour tester la quantité d'acide ou de base (alcalinité) présente dans une solution. Vous en avez peut-être même utilisé pour vous assurer que l'eau d'une piscine extérieure est correctement traitée. Dans les deux cas, ce test de pH mesure la quantité d'ions hydrogène présente dans une solution donnée. De fortes concentrations d'ions hydrogène produisent un faible pH, tandis que de faibles niveaux d'ions hydrogène entraînent un pH élevé. La concentration globale en ions hydrogène est inversement proportionnelle à son pH et peut être mesurée sur l'échelle du pH (Figure\(\PageIndex{5}\)). Par conséquent, plus il y a d'ions hydrogène, plus le pH est bas ; inversement, moins il y a d'ions hydrogène, plus le pH est élevé.
L'échelle de pH est comprise entre 0 et 14. Un changement d'une unité sur l'échelle de pH représente un changement de la concentration en ions hydrogène d'un facteur 10, un changement de deux unités représente un changement de la concentration en ions hydrogène d'un facteur 100. Ainsi, de faibles variations du pH représentent des variations importantes des concentrations d'ions hydrogène. L'eau pure est neutre. Il n'est ni acide ni basique et a un pH de 7,0. Tout ce qui est inférieur à 7,0 (allant de 0,0 à 6,9) est acide, et tout ce qui est supérieur à 7,0 (de 7,1 à 14,0) est alcalin. Le sang dans vos veines est légèrement alcalin (pH = 7,4). L'environnement de votre estomac est très acide (pH = 1 à 2). Le jus d'orange est légèrement acide (pH = environ 3,5), tandis que le bicarbonate de soude est basique (pH = 9,0).

Les acides sont des substances qui fournissent des ions hydrogène (H +) et abaissent le pH, tandis que les bases fournissent des ions hydroxyde (OH —) et augmentent le pH. Plus l'acide est fort, plus il donne facilement du H+. Par exemple, l'acide chlorhydrique et le jus de citron sont très acides et dégagent facilement du H+ lorsqu'ils sont ajoutés à l'eau. À l'inverse, les bases sont les substances qui donnent facilement de l'OH —. Les ions OH — se combinent à H + pour produire de l'eau, ce qui augmente le pH de la substance. L'hydroxyde de sodium et de nombreux nettoyants ménagers sont très alcalins et libèrent rapidement de l'OH lorsqu'ils sont placés dans de l'eau, ce qui augmente le pH.
La plupart des cellules de notre corps fonctionnent dans une plage de pH très étroite, généralement comprise entre 7,2 et 7,6. Si le pH du corps se situe en dehors de cette plage, le système respiratoire fonctionne mal, comme le font les autres organes du corps. Les cellules ne fonctionnent plus correctement et les protéines vont se décomposer. Un écart en dehors de la plage de pH peut provoquer un coma ou même entraîner la mort.
Alors, comment se fait-il que nous puissions ingérer ou inhaler des substances acides ou basiques sans mourir ? Les zones tampon sont essentielles. Les tampons absorbent facilement l'excès de H + ou d'OH —, en maintenant le pH du corps soigneusement maintenu dans la plage étroite susmentionnée. Le dioxyde de carbone fait partie d'un système tampon important du corps humain ; il maintient le pH dans la plage appropriée. Ce système tampon fait intervenir l'acide carbonique (H 2 CO 3) et l'anion bicarbonate (HCO 3 —). Si une trop grande quantité de H + pénètre dans l'organisme, le bicarbonate se combine au H + pour créer de l'acide carbonique et limiter la baisse du pH. De même, si une trop grande quantité d'OH — est introduite dans le système, l'acide carbonique se dissociera rapidement en bicarbonate et en ions H +. Les ions H + peuvent se combiner avec les ions OH —, limitant ainsi l'augmentation du pH. Bien que l'acide carbonique soit un produit important dans cette réaction, sa présence est éphémère car l'acide carbonique est libéré de l'organisme sous forme de dioxyde de carbone chaque fois que nous respirons. Sans ce système tampon, le pH de notre corps fluctuerait trop et nous ne pourrions pas survivre.
Résumé
L'eau possède de nombreuses propriétés essentielles au maintien de la vie. Il est polaire, ce qui permet la formation de liaisons hydrogène, qui permettent aux ions et aux autres molécules polaires de se dissoudre dans l'eau. L'eau est donc un excellent solvant. Les liaisons hydrogène entre les molécules d'eau permettent à l'eau de mieux retenir la chaleur que de nombreuses autres substances. À mesure que la température augmente, les liaisons hydrogène entre l'eau se rompent et se reforment continuellement, ce qui permet à la température globale de rester stable, bien qu'une énergie accrue soit ajoutée au système. Les forces de cohésion de l'eau permettent la propriété de la tension superficielle. Toutes ces propriétés uniques de l'eau jouent un rôle important dans la chimie des organismes vivants.
Le pH d'une solution est une mesure de la concentration d'ions hydrogène dans la solution. Une solution contenant un nombre élevé d'ions hydrogène est acide et présente un faible pH. Une solution contenant un nombre élevé d'ions hydroxyde est basique et possède un pH élevé. L'échelle de pH est comprise entre 0 et 14, un pH de 7 étant neutre. Les tampons sont des solutions qui modérent les variations de pH lorsqu'un acide ou une base est ajouté au système tampon. Les zones tampons sont importantes dans les systèmes biologiques en raison de leur capacité à maintenir des conditions de pH constantes.
Notes
- 1 Humphrey, W., Dalke, A. et Schulten, K., « VMD—Visual Molecular Dynamics », J. Molec. Graphics, 1996, vol. 14, p. 33-38. http://www.ks.uiuc.edu/Research/vmd/
Lexique
- acide
- une substance qui donne des ions hydrogène et abaisse donc le pH
- adhésion
- l'attraction entre les molécules d'eau et les molécules d'une substance différente
- base
- une substance qui absorbe les ions hydrogène et augmente donc le pH
- tampon
- une solution qui résiste à une modification du pH en absorbant ou en libérant des ions hydrogène ou hydroxyde
- cohésion
- les forces intermoléculaires entre les molécules d'eau causées par la nature polaire de l'eau ; elles créent une tension superficielle
- évaporation
- la libération de molécules d'eau à partir de l'eau liquide pour former de la vapeur d'eau
- hydrophile
- décrit une substance qui se dissout dans l'eau ; qui aime l'eau
- hydrophobe
- décrit une substance qui ne se dissout pas dans l'eau ; qui craint l'eau
- papier à base de tournesol
- papier filtre traité avec un colorant hydrosoluble naturel afin de pouvoir être utilisé comme indicateur de pH
- échelle de pH
- une échelle de 0 à 14 qui mesure la concentration approximative d'ions hydrogène d'une substance
- solvant
- une substance capable de dissoudre une autre substance
- tension de surface
- la force de cohésion à la surface d'un corps liquide qui empêche les molécules de se séparer
- température
- une mesure du mouvement moléculaire



