2.1 : Les éléments constitutifs des molécules
- Page ID
- 186328
À son niveau le plus fondamental, la vie est faite de matière. La matière occupe l'espace et possède une masse. Toute matière est composée d'éléments, de substances qui ne peuvent être ni décomposées ni transformées chimiquement en d'autres substances. Chaque élément est composé d'atomes, chacun possédant un nombre constant de protons et des propriétés uniques. Au total, 118 éléments ont été définis ; toutefois, seuls 92 sont présents à l'état naturel et moins de 30 se trouvent dans des cellules vivantes. Les 26 éléments restants sont instables et n'existent donc pas depuis très longtemps ou sont théoriques et n'ont pas encore été détectés.
Chaque élément est désigné par son symbole chimique (tel que H, N, O, C et Na) et possède des propriétés uniques. Ces propriétés uniques permettent aux éléments de se combiner et de se lier les uns aux autres de manière spécifique.
Des atomes
Un atome est le plus petit composant d'un élément qui conserve toutes les propriétés chimiques de cet élément. Par exemple, un atome d'hydrogène possède toutes les propriétés de l'élément hydrogène, par exemple, qu'il existe sous forme de gaz à température ambiante et qu'il se lie à l'oxygène pour créer une molécule d'eau. Les atomes d'hydrogène ne peuvent pas être décomposés en éléments plus petits tout en conservant les propriétés de l'hydrogène. Si un atome d'hydrogène était décomposé en particules subatomiques, il n'aurait plus les propriétés de l'hydrogène.
Au niveau le plus élémentaire, tous les organismes sont constitués d'une combinaison d'éléments. Ils contiennent des atomes qui se combinent pour former des molécules. Dans les organismes multicellulaires, tels que les animaux, les molécules peuvent interagir pour former des cellules qui se combinent pour former des tissus, qui constituent des organes. Ces combinaisons se poursuivent jusqu'à la formation d'organismes multicellulaires entiers.
Tous les atomes contiennent des protons, des électrons et des neutrons (Figure\(\PageIndex{1}\)). La seule exception est l'hydrogène (H), qui est composé d'un proton et d'un électron. Un proton est une particule chargée positivement qui réside dans le noyau (le cœur de l'atome) d'un atome et qui a une masse de 1 et une charge de +1. Un électron est une particule chargée négativement qui se déplace dans l'espace entourant le noyau. En d'autres termes, il se trouve à l'extérieur du noyau. Il a une masse négligeable et une charge de -1.
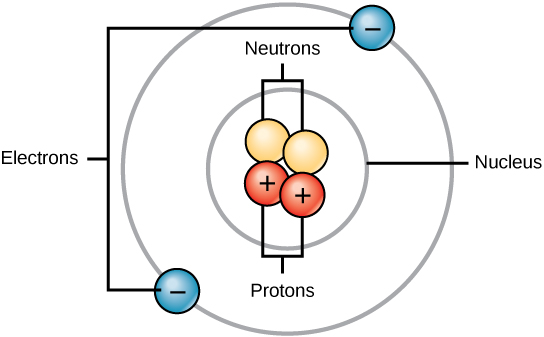
Les neutrons, comme les protons, se trouvent dans le noyau d'un atome. Ils ont une masse de 1 et sont gratuits. Les charges positives (protons) et négatives (électrons) s'équilibrent dans un atome neutre, qui a une charge nette nulle.
Comme les protons et les neutrons ont chacun une masse de 1, la masse d'un atome est égale au nombre de protons et de neutrons de cet atome. Le nombre d'électrons n'entre pas en ligne de compte dans la masse globale, car leur masse est si petite.
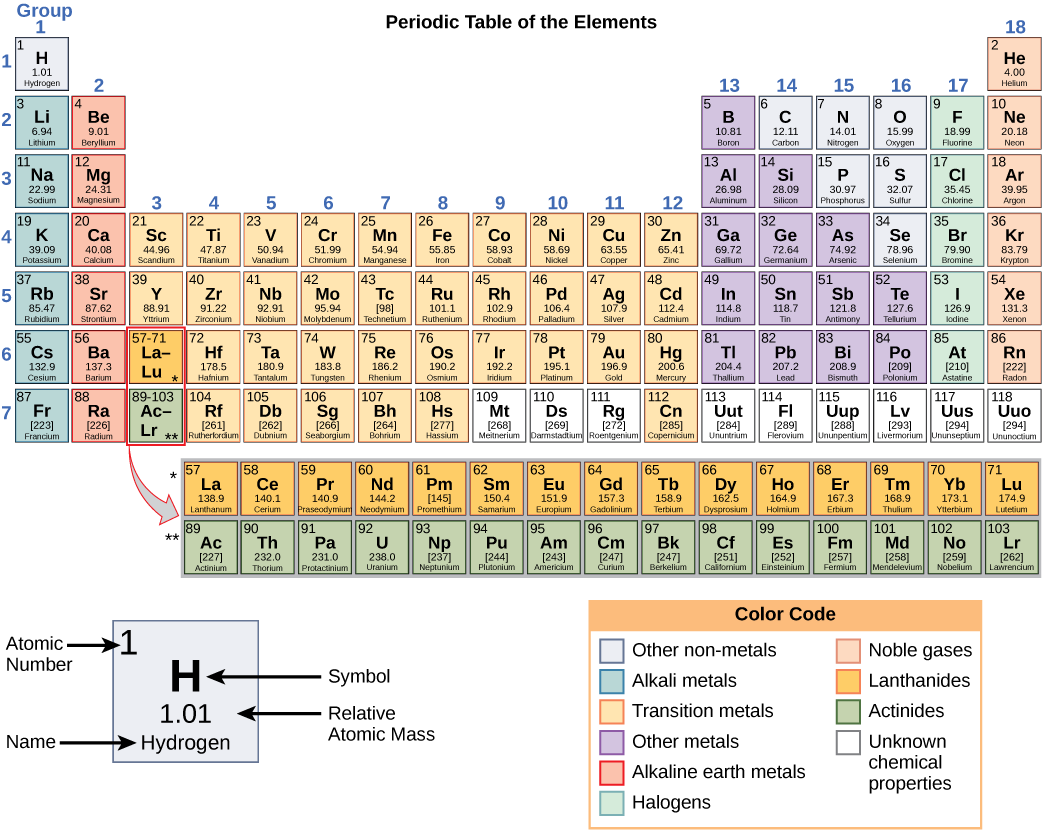
Comme indiqué précédemment, chaque élément possède ses propres propriétés uniques. Chacune contient un nombre différent de protons et de neutrons, ce qui lui donne son propre numéro atomique et son propre numéro de masse. Le numéro atomique d'un élément est égal au nombre de protons que cet élément contient. Le nombre de masse, ou masse atomique, est le nombre de protons plus le nombre de neutrons de cet élément. Il est donc possible de déterminer le nombre de neutrons en soustrayant le numéro atomique du nombre de masse.
Ces chiffres fournissent des informations sur les éléments et la façon dont ils réagiront lorsqu'ils sont combinés. Les différents éléments ont des points de fusion et d'ébullition différents et se trouvent dans des états différents (liquide, solide ou gazeux) à température ambiante. Ils se combinent également de différentes manières. Certains forment des types d'obligations spécifiques, alors que d'autres ne le font pas. La façon dont ils se combinent dépend du nombre d'électrons présents. En raison de ces caractéristiques, les éléments sont rangés dans le tableau périodique des éléments, un tableau des éléments qui inclut le numéro atomique et la masse atomique relative de chaque élément. Le tableau périodique fournit également des informations clés sur les propriétés des éléments (Figure\(\PageIndex{2}\)), souvent indiquées par un code couleur. La disposition du tableau montre également comment les électrons de chaque élément sont organisés et fournit des détails importants sur la façon dont les atomes réagiront les uns avec les autres pour former des molécules.
Les isotopes sont des formes différentes d'un même élément qui contiennent le même nombre de protons, mais un nombre différent de neutrons. Certains éléments, tels que le carbone, le potassium et l'uranium, contiennent des isotopes naturels. Le carbone 12, l'isotope le plus courant du carbone, contient six protons et six neutrons. Il a donc un nombre de masse de 12 (six protons et six neutrons) et un numéro atomique de 6 (ce qui en fait du carbone). Le carbone 14 contient six protons et huit neutrons. Il a donc un nombre de masse de 14 (six protons et huit neutrons) et un numéro atomique de 6, ce qui signifie qu'il s'agit toujours de l'élément carbone. Ces deux formes alternatives de carbone sont des isotopes. Certains isotopes sont instables et perdent des protons, d'autres particules subatomiques ou de l'énergie pour former des éléments plus stables. Ils sont appelés isotopes radioactifs ou radio-isotopes.
ART CONNECTION
Combien de neutrons contiennent respectivement le (K) potassium 39 et le potassium 40 ?
L'ÉVOLUTION EN ACTION : Datation au carbone
Le carbone 14 (14 C) est un radio-isotope naturel créé dans l'atmosphère par les rayons cosmiques. Il s'agit d'un processus continu, donc plus de 14 C est toujours créé. Au fur et à mesure qu'un organisme vivant se développe, le niveau relatif de 14 C dans son corps est égal à la concentration de 14 C dans l'atmosphère. Lorsqu'un organisme meurt, il n'ingère plus de 14 C, donc le ratio diminue. Le 14 C se désintègre en 14 N par un processus appelé désintégration bêta ; il dégage de l'énergie au cours de ce processus lent.
Après environ 5 730 ans, seule la moitié de la concentration initiale de 14 C aura été convertie en 14 N. Le temps qu'il faut à la moitié de la concentration initiale d'un isotope pour se désintégrer et prendre sa forme la plus stable est appelé demi-vie. Comme la demi-vie du 14° C est longue, il est utilisé pour vieillir des objets autrefois vivants, tels que des fossiles. En utilisant le rapport entre la concentration de 14 C trouvée dans un objet et la quantité de 14 C détectée dans l'atmosphère, la quantité d'isotope qui ne s'est pas encore désintégrée peut être déterminée. Sur la base de cette quantité, l'âge du fossile peut être calculé à environ 50 000 ans (Figure\(\PageIndex{3}\)). Les isotopes ayant des demi-vies plus longues, tels que le potassium 40, sont utilisés pour calculer l'âge des fossiles plus anciens. Grâce à la datation au carbone, les scientifiques peuvent reconstituer l'écologie et la biogéographie des organismes vivant au cours des 50 000 dernières années.

CONCEPT EN ACTION
Pour en savoir plus sur les atomes et les isotopes, et sur la façon de distinguer un isotope d'un autre, visitez ce site et lancez la simulation.
Liaisons chimiques
La façon dont les éléments interagissent les uns avec les autres dépend de la façon dont leurs électrons sont disposés et du nombre d'ouvertures pour les électrons qui existent dans la région la plus externe où les électrons sont présents dans un atome. Les électrons existent à des niveaux d'énergie qui forment des coquilles autour du noyau. La coque la plus proche peut contenir jusqu'à deux électrons. La coque la plus proche du noyau est toujours remplie en premier, avant que toute autre coque ne puisse être remplie. L'hydrogène possède un électron ; par conséquent, il n'a qu'un seul point occupé dans la couche la plus basse. L'hélium possède deux électrons ; il peut donc remplir complètement la couche la plus basse avec ses deux électrons. Si vous regardez le tableau périodique, vous verrez que l'hydrogène et l'hélium sont les deux seuls éléments de la première rangée. C'est parce qu'ils n'ont que des électrons dans leur première couche. L'hydrogène et l'hélium sont les deux seuls éléments qui ont la coque la plus basse et aucune autre coque.
Les deuxième et troisième niveaux d'énergie peuvent contenir jusqu'à huit électrons. Les huit électrons sont disposés en quatre paires et une position de chaque paire est remplie d'un électron avant que toute paire ne soit terminée.
En regardant à nouveau le tableau périodique (Figure\(\PageIndex{2}\)), vous remarquerez qu'il y a sept lignes. Ces lignes correspondent au nombre de coques que possèdent les éléments de cette rangée. Les éléments d'une rangée donnée contiennent un nombre croissant d'électrons à mesure que les colonnes se déplacent de gauche à droite. Bien que chaque élément possède le même nombre de couches, celles-ci ne sont pas toutes complètement remplies d'électrons. Si vous regardez la deuxième ligne du tableau périodique, vous trouverez du lithium (Li), du béryllium (Be), du bore (B), du carbone (C), de l'azote (N), de l'oxygène (O), du fluor (F) et du néon (Ne). Ils ont tous des électrons qui n'occupent que la première et la deuxième couche. Le lithium n'a qu'un seul électron dans sa couche la plus externe, le béryllium en a deux, le bore en a trois, et ainsi de suite, jusqu'à ce que la coque entière soit remplie de huit électrons, comme c'est le cas pour le néon.
Tous les éléments n'ont pas assez d'électrons pour remplir leur couche la plus externe, mais un atome atteint son maximum de stabilité lorsque toutes les positions électroniques de la couche la plus externe sont remplies. En raison de ces lacunes dans les couches les plus externes, nous assistons à la formation de liaisons chimiques ou d'interactions entre deux ou plusieurs éléments identiques ou différents qui entraînent la formation de molécules. Pour atteindre une plus grande stabilité, les atomes auront tendance à remplir complètement leur enveloppe extérieure et à se lier à d'autres éléments pour atteindre cet objectif en partageant des électrons, en acceptant des électrons d'un autre atome ou en donnant des électrons à un autre atome. Comme les couches les plus externes des éléments à faible numéro atomique (jusqu'au calcium, avec le numéro atomique 20) peuvent contenir huit électrons, c'est ce que l'on appelle la règle de l'octet. Un élément peut donner, accepter ou partager des électrons avec d'autres éléments pour remplir sa coque extérieure et satisfaire à la règle des octuors.
Lorsqu'un atome ne contient pas le même nombre de protons et d'électrons, on parle d'ion. Comme le nombre d'électrons n'est pas égal au nombre de protons, chaque ion possède une charge nette. Les ions positifs se forment en perdant des électrons et sont appelés cations. Les ions négatifs se forment en gagnant des électrons et sont appelés anions.
Par exemple, le sodium ne possède qu'un seul électron dans sa couche la plus externe. Il faut moins d'énergie au sodium pour donner cet électron que pour accepter sept électrons de plus pour remplir l'enveloppe extérieure. Si le sodium perd un électron, il possède désormais 11 protons et seulement 10 électrons, ce qui lui laisse une charge globale de +1. On l'appelle maintenant ion sodium.
L'atome de chlore possède sept électrons dans sa couche externe. Encore une fois, il est plus économe en énergie pour le chlore de gagner un électron que d'en perdre sept. Par conséquent, il a tendance à gagner un électron pour créer un ion composé de 17 protons et 18 électrons, ce qui lui donne une charge négative nette (-1). On l'appelle maintenant ion chlorure. Ce mouvement d'électrons d'un élément à un autre est appelé transfert d'électrons. Comme l'\(\PageIndex{4}\)illustre la figure, un atome de sodium (Na) ne possède qu'un seul électron dans sa couche la plus externe, alors qu'un atome de chlore (Cl) possède sept électrons dans sa couche la plus externe. Un atome de sodium donnera son électron pour vider sa coque, et un atome de chlore acceptera cet électron pour remplir sa coque, devenant ainsi du chlorure. Les deux ions satisfont désormais à la règle des octuors et possèdent des couches extérieures complètes. Comme le nombre d'électrons n'est plus égal au nombre de protons, chacun est maintenant un ion et possède une charge +1 (sodium) ou -1 (chlorure).
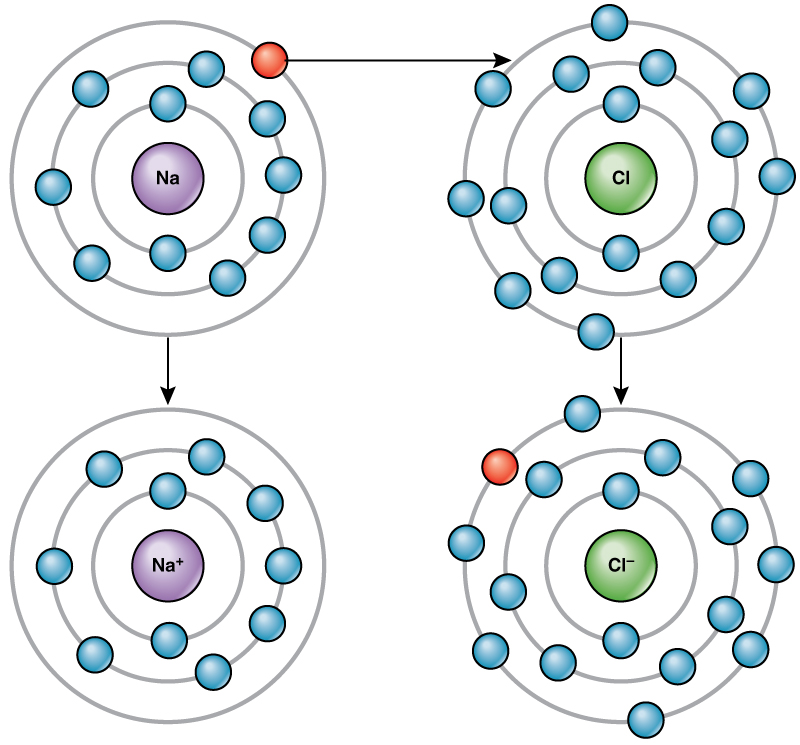
Liaisons ioniques
Il existe quatre types de liaisons ou d'interactions : les liaisons ioniques, les liaisons covalentes, les liaisons hydrogène et les interactions de Van der Waals. Les liaisons ioniques et covalentes sont des interactions fortes qui nécessitent un apport énergétique plus important pour se séparer. Lorsqu'un élément donne un électron depuis son enveloppe extérieure, comme dans l'exemple d'atome de sodium ci-dessus, un ion positif se forme. L'élément qui accepte l'électron est maintenant chargé négativement. Comme les charges positives et négatives s'attirent, ces ions restent ensemble et forment une liaison ionique, ou une liaison entre les ions. Les éléments se lient à l'électron d'un élément en restant principalement liés à l'autre élément. Lorsque les ions Na + et Cl — se combinent pour produire du NaCl, un électron d'un atome de sodium reste avec les sept autres de l'atome de chlore, et les ions sodium et chlorure s'attirent mutuellement dans un réseau d'ions avec une charge nette nulle.
Liaisons covalentes
Un autre type de liaison chimique forte entre deux atomes ou plus est la liaison covalente. Ces liaisons se forment lorsqu'un électron est partagé entre deux éléments et constituent la forme de liaison chimique la plus forte et la plus courante chez les organismes vivants. Des liaisons covalentes se forment entre les éléments qui composent les molécules biologiques de nos cellules. Contrairement aux liaisons ioniques, les liaisons covalentes ne se dissocient pas dans l'eau.
Les atomes d'hydrogène et d'oxygène qui se combinent pour former des molécules d'eau sont liés entre eux par des liaisons covalentes. L'électron de l'atome d'hydrogène divise son temps entre l'enveloppe externe de l'atome d'hydrogène et la couche externe incomplète de l'atome d'oxygène. Pour remplir complètement l'enveloppe extérieure d'un atome d'oxygène, deux électrons provenant de deux atomes d'hydrogène sont nécessaires, d'où l'indice « 2 » de H 2 O. Les électrons sont partagés entre les atomes, divisant leur temps entre eux pour « remplir » la couche externe de chacun d'eux. Ce partage est un état énergétique plus faible pour tous les atomes impliqués que s'ils existaient sans que leur enveloppe extérieure ne soit remplie.
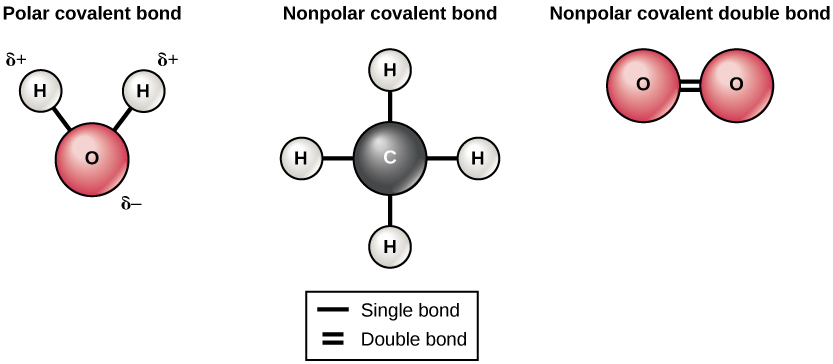
Il existe deux types de liaisons covalentes : polaires et non polaires. Des liaisons covalentes non polaires se forment entre deux atomes du même élément ou entre différents éléments qui se partagent les électrons de manière égale. Par exemple, un atome d'oxygène peut se lier à un autre atome d'oxygène pour remplir leur enveloppe extérieure. Cette association est non polaire car les électrons seront répartis de manière égale entre chaque atome d'oxygène. Deux liaisons covalentes se forment entre les deux atomes d'oxygène, car l'oxygène a besoin de deux électrons communs pour remplir sa couche la plus externe. Les atomes d'azote formeront trois liaisons covalentes (également appelées triples covalentes) entre deux atomes d'azote, car chaque atome d'azote a besoin de trois électrons pour remplir sa couche la plus externe. Un autre exemple de liaison covalente non polaire se trouve dans la molécule de méthane (CH 4). L'atome de carbone possède quatre électrons dans sa couche la plus externe et en a besoin de quatre autres pour la remplir. Il obtient ces quatre atomes à partir de quatre atomes d'hydrogène, chaque atome fournissant un. Ces éléments partagent tous les électrons de manière égale, créant ainsi quatre liaisons covalentes non polaires (Figure\(\PageIndex{5}\)).
Dans une liaison covalente polaire, les électrons partagés par les atomes passent plus de temps à proximité d'un noyau que de l'autre noyau. En raison de la distribution inégale des électrons entre les différents noyaux, une charge légèrement positive (δ+) ou légèrement négative (δ—) se développe. Les liaisons covalentes entre les atomes d'hydrogène et d'oxygène dans l'eau sont des liaisons covalentes polaires. Les électrons partagés passent plus de temps à proximité du noyau d'oxygène, ce qui lui confère une petite charge négative, qu'à proximité des noyaux d'hydrogène, ce qui donne à ces molécules une petite charge positive.
Liaisons hydrogène
Les liaisons ioniques et covalentes sont des liaisons solides qui nécessitent une énergie considérable pour se rompre. Cependant, toutes les liaisons entre les éléments ne sont pas des liaisons ioniques ou covalentes. Des obligations plus faibles peuvent également se former. Ce sont des attractions qui se produisent entre des charges positives et négatives qui ne nécessitent pas beaucoup d'énergie pour se briser. Deux liaisons faibles qui se produisent fréquemment sont les liaisons hydrogène et les interactions de Van der Waals. Ces liaisons donnent naissance aux propriétés uniques de l'eau et aux structures uniques de l'ADN et des protéines.
Lorsque des liaisons covalentes polaires contenant un atome d'hydrogène se forment, l'atome d'hydrogène de cette liaison a une charge légèrement positive. Cela est dû au fait que l'électron partagé est attiré plus fortement vers l'autre élément et éloigné du noyau d'hydrogène. Comme l'atome d'hydrogène est légèrement positif (δ+), il sera attiré par les charges partielles négatives voisines (δ—). Lorsque cela se produit, une faible interaction se produit entre la charge δ+ de l'atome d'hydrogène d'une molécule et la charge δ— de l'autre molécule. Cette interaction s'appelle une liaison hydrogène. Ce type de liaison est courant ; par exemple, la nature liquide de l'eau est causée par les liaisons hydrogène entre les molécules d'eau (Figure\(\PageIndex{6}\)). Les liaisons hydrogène confèrent à l'eau des propriétés uniques qui soutiennent la vie. Sans la liaison hydrogène, l'eau serait un gaz plutôt qu'un liquide à température ambiante.
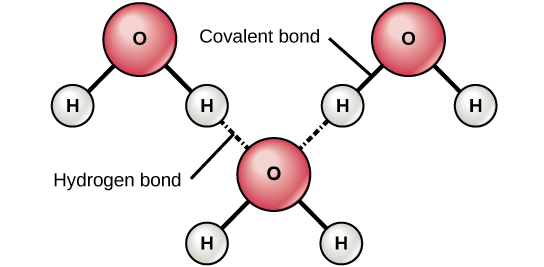
Des liaisons hydrogène peuvent se former entre différentes molécules et elles ne doivent pas toujours inclure une molécule d'eau. Les atomes d'hydrogène présents dans les liaisons polaires d'une molécule peuvent former des liaisons avec d'autres molécules adjacentes. Par exemple, les liaisons hydrogène maintiennent ensemble deux longs brins d'ADN pour donner à la molécule d'ADN sa structure bicaténaire caractéristique. Les liaisons hydrogène sont également responsables d'une partie de la structure tridimensionnelle des protéines.
Interactions entre Van der Waals
Comme les liaisons hydrogène, les interactions de Van der Waals sont de faibles attractions ou interactions entre molécules. Ils se produisent entre des atomes polaires liés par covalence dans différentes molécules. Certaines de ces faibles attractions sont causées par des charges partielles temporaires formées lorsque des électrons se déplacent autour d'un noyau. Ces faibles interactions entre les molécules sont importantes dans les systèmes biologiques.
DES CARRIÈRES EN ACTION : Technicien en radiographie
Avez-vous déjà subi une imagerie par résonance magnétique (IRM), une mammographie ou une radiographie, ou quelqu'un que vous connaissez ? Ces tests produisent des images de vos tissus mous et de vos organes (comme lors d'une IRM ou d'une mammographie) ou de vos os (comme c'est le cas lors d'une radiographie) en utilisant des ondes radio ou des isotopes spéciaux (radiomarqués ou marqués par fluorescence) qui sont ingérés ou injectés dans le corps. Ces tests fournissent des données permettant de diagnostiquer des maladies en créant des images de vos organes ou de votre système squelettique.
L'imagerie par IRM consiste à soumettre les noyaux d'hydrogène, qui sont abondants dans l'eau des tissus mous, à des champs magnétiques fluctuants, qui les amènent à émettre leur propre champ magnétique. Ce signal est ensuite lu par les capteurs de la machine et interprété par un ordinateur pour former une image détaillée.
Certains technologues et techniciens en radiographie se spécialisent en tomodensitométrie, en IRM et en mammographie. Ils produisent des films ou des images du corps qui aident les professionnels de la santé à examiner et à diagnostiquer. Les radiologues travaillent directement avec les patients, leur expliquent les machines, les préparent aux examens et s'assurent que leur corps ou les parties de leur corps sont correctement positionnés pour produire les images nécessaires. Les médecins ou les radiologues analysent ensuite les résultats des tests.
Les techniciens en radiographie peuvent travailler dans des hôpitaux, des cabinets médicaux ou des centres d'imagerie spécialisés. La formation pour devenir technicien en radiographie se déroule dans les hôpitaux, les collèges et les universités qui offrent des certificats, des diplômes d'associé ou des diplômes de baccalauréat en radiographie.
Résumé
La matière est tout ce qui occupe l'espace et possède une masse. Il est composé d'atomes de différents éléments. Les 92 éléments naturels possèdent tous des qualités uniques qui leur permettent de se combiner de différentes manières pour créer des composés ou des molécules. Les atomes, composés de protons, de neutrons et d'électrons, sont les plus petites unités d'un élément qui conservent toutes les propriétés de cet élément. Les électrons peuvent être donnés ou partagés entre les atomes pour créer des liaisons, notamment des liaisons ioniques, covalentes et hydrogène, ainsi que des interactions de Van der Waals.
Connexions artistiques
Figure\(\PageIndex{2}\) : Combien de neutrons contiennent respectivement le (K) potassium 39 et le potassium 40 ?
- Réponse
-
Le potassium 39 contient vingt neutrons. Le potassium 40 contient vingt et un neutrons.
Lexique
- anion
- un ion négatif formé en gagnant des électrons
- numéro atomique
- le nombre de protons dans un atome
- cation
- un ion positif formé par la perte d'électrons
- liaison chimique
- une interaction entre deux ou plusieurs éléments identiques ou différents qui entraîne la formation de molécules
- liaison covalente
- type de liaison forte entre deux ou plusieurs éléments identiques ou différents ; se forme lorsque des électrons sont partagés entre des éléments
- électron
- particule chargée négativement qui se trouve à l'extérieur du noyau, sur l'orbite des électrons ; elle n'a pas de masse fonctionnelle et a une charge de -1
- transfert d'électrons
- le mouvement des électrons d'un élément à l'autre
- élément
- l'une des 118 substances uniques qui ne peuvent pas être décomposées en substances plus petites et qui conservent les caractéristiques de cette substance ; chaque élément possède un nombre spécifié de protons et des propriétés uniques
- liaison hydrogène
- une liaison faible entre des atomes d'hydrogène partiellement chargés positivement et des éléments ou des molécules partiellement chargés négativement
- ion
- un atome ou un composé qui ne contient pas le même nombre de protons et d'électrons et qui possède donc une charge nette
- liaison ionique
- une liaison chimique qui se forme entre des ions de charges opposées
- isotope
- une ou plusieurs formes d'un élément qui ont un nombre différent de neutrons
- numéro de masse
- le nombre de protons et de neutrons dans un atome
- problème
- tout ce qui a de la masse et occupe l'espace
- neutron
- particule sans charge qui réside dans le noyau d'un atome ; a une masse de 1
- liaison covalente non polaire
- type de liaison covalente qui se forme entre les atomes lorsque les électrons sont partagés de manière égale entre les atomes, ce qui entraîne l'absence de régions avec des charges partielles, comme dans les liaisons covalentes polaires
- noyau
- (chimie) le centre dense d'un atome composé de protons et (sauf dans le cas d'un atome d'hydrogène) de neutrons
- règle des octuors
- indique que l'enveloppe la plus externe d'un élément à faible numéro atomique peut contenir huit électrons
- tableau périodique des éléments
- un organigramme des éléments, indiquant le numéro atomique et le numéro de masse de chaque élément ; fournit également des informations clés sur les propriétés des éléments
- liaison covalente polaire
- type de liaison covalente dans laquelle les électrons sont attirés vers un atome et s'éloignent d'un autre, ce qui donne des régions chargées légèrement positives et légèrement négatives de la molécule
- proton
- une particule chargée positivement qui réside dans le noyau d'un atome ; a une masse de 1 et une charge de +1
- isotope radioactif
- un isotope qui émet spontanément des particules ou de l'énergie pour former un élément plus stable
- Interaction avec Van der Waals
- une faible attraction ou interaction entre les molécules causée par des atomes légèrement chargés positivement ou légèrement chargés négativement


