42.2 : Réponse immunitaire adaptative
- Page ID
- 189355
Compétences à développer
- expliquer l'immunité adaptative
- Comparez et opposez l'immunité adaptative et l'immunité innée
- Décrire la réponse immunitaire à médiation cellulaire et la réponse immunitaire humorale
- Décrire la tolérance immunitaire
La réponse immunitaire adaptative, ou acquise, prend des jours, voire des semaines, à s'établir, bien plus longtemps que la réponse innée ; cependant, l'immunité adaptative est plus spécifique aux agents pathogènes et possède de la mémoire. L'immunité adaptative est une immunité qui survient après l'exposition à un antigène provenant d'un agent pathogène ou d'une vaccination. Cette partie du système immunitaire est activée lorsque la réponse immunitaire innée est insuffisante pour contrôler une infection. En fait, sans information provenant du système immunitaire inné, la réponse adaptative n'a pas pu être mobilisée. Il existe deux types de réponses adaptatives : la réponse immunitaire à médiation cellulaire, qui est réalisée par les lymphocytes T, et la réponse immunitaire humorale, contrôlée par les lymphocytes B activés et les anticorps. Les lymphocytes T et B activés qui sont spécifiques aux structures moléculaires du pathogène prolifèrent et attaquent l'agent pathogène envahissant. Leur attaque peut tuer directement les agents pathogènes ou sécréter des anticorps qui améliorent la phagocytose des agents pathogènes et perturbent l'infection. L'immunité adaptative implique également une mémoire qui fournit à l'hôte une protection à long terme contre une réinfection par le même type d'agent pathogène ; lors d'une réexposition, cette mémoire facilitera une réponse efficace et rapide.
Cellules présentant l'antigène
Contrairement aux cellules NK du système immunitaire inné, les lymphocytes B (lymphocytes B) sont un type de globule blanc qui produit des anticorps, tandis que les lymphocytes T (lymphocytes T) sont un type de globule blanc qui joue un rôle important dans la réponse immunitaire. Les lymphocytes T sont un élément clé de la réponse médiée par les cellules, c'est-à-dire la réponse immunitaire spécifique qui utilise les lymphocytes T pour neutraliser les cellules infectées par des virus et certaines bactéries. Il existe trois types de lymphocytes T : les lymphocytes T cytotoxiques, les lymphocytes T auxiliaires et les lymphocytes T suppresseurs. Les lymphocytes T cytotoxiques détruisent les cellules infectées par le virus lors de la réponse immunitaire médiée par les cellules, et les lymphocytes T auxiliaires jouent un rôle dans l'activation à la fois de l'anticorps et des réponses immunitaires à médiation cellulaire. Les lymphocytes T suppresseurs désactivent les lymphocytes T et les lymphocytes B lorsque cela est nécessaire, empêchant ainsi la réponse immunitaire de devenir trop intense.
Un antigène est une macromolécule étrangère ou « non autonome » qui réagit avec les cellules du système immunitaire. Tous les antigènes ne provoqueront pas de réponse. Par exemple, les individus produisent d'innombrables « auto-antigènes » et sont constamment exposés à des antigènes étrangers inoffensifs, tels que des protéines alimentaires, du pollen ou des composants de poussière. La suppression des réponses immunitaires à des macromolécules inoffensives est hautement régulée et empêche généralement des processus susceptibles de nuire à l'hôte, connus sous le nom de tolérance.
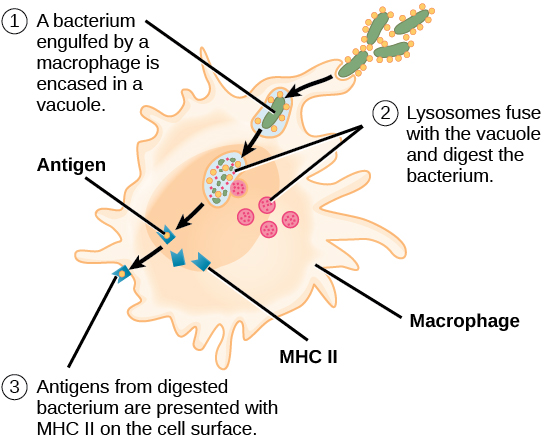
Le système immunitaire inné contient des cellules qui détectent des antigènes potentiellement dangereux, puis informent la réponse immunitaire adaptative de la présence de ces antigènes. Une cellule présentatrice d'antigène (APC) est une cellule immunitaire qui détecte, engloutit et informe la réponse immunitaire adaptative à une infection. Lorsqu'un agent pathogène est détecté, ces APC phagocytent le pathogène et le digèrent pour former de nombreux fragments différents de l'antigène. Les fragments d'antigène seront ensuite transportés à la surface de l'APC, où ils serviront d'indicateurs pour d'autres cellules immunitaires. Les cellules dendritiques sont des cellules immunitaires qui transforment le matériel antigénique ; elles sont présentes dans la peau (cellules de Langerhans) et dans les parois du nez, des poumons, de l'estomac et des intestins. Parfois, une cellule dendritique se présente à la surface d'autres cellules pour induire une réponse immunitaire, agissant ainsi comme une cellule présentatrice d'antigène. Les macrophages fonctionnent également comme des APC. Avant l'activation et la différenciation, les lymphocytes B peuvent également fonctionner comme des APC.
Après phagocytose par APC, la vésicule phagocytaire fusionne avec un lysosome intracellulaire formant un phagolysosome. Au sein du phagolysosome, les composants sont décomposés en fragments ; les fragments sont ensuite chargés sur des molécules du MHC de classe I ou du MHC de classe II et sont transportés à la surface de la cellule pour la présentation de l'antigène, comme illustré à la figure\(\PageIndex{1}\). Notez que les lymphocytes T ne peuvent pas répondre correctement à l'antigène à moins qu'il ne soit traité et intégré dans une molécule MHC II. Les APC expriment le MHC à leur surface et, lorsqu'ils sont combinés à un antigène étranger, ces complexes signalent un envahisseur « non autonome ». Une fois que le fragment d'antigène est intégré à la molécule MHC II, la cellule immunitaire peut réagir. Les lymphocytes T auxiliaires sont l'un des principaux lymphocytes qui répondent aux cellules présentatrices d'antigènes. Rappelons que toutes les autres cellules nucléées du corps ont exprimé des molécules MHC I, qui indiquent « saines » ou « normales ».
Lymphocytes T et B
Les lymphocytes présents dans le sang circulant humain sont composés d'environ 80 à 90 pour cent de lymphocytes T, comme le montre la figure\(\PageIndex{2}\), et de 10 à 20 pour cent de lymphocytes B. Rappelons que les lymphocytes T sont impliqués dans la réponse immunitaire médiée par les cellules, tandis que les lymphocytes B font partie de la réponse immunitaire humorale.
Les lymphocytes T regroupent une population hétérogène de cellules aux fonctions extrêmement diverses. Certains lymphocytes T répondent aux APC du système immunitaire inné et induisent indirectement des réponses immunitaires en libérant des cytokines. D'autres lymphocytes T stimulent les lymphocytes B pour qu'ils préparent leur propre réponse. Une autre population de lymphocytes T détecte les signaux APC et tue directement les cellules infectées. D'autres lymphocytes T sont impliqués dans la suppression des réactions immunitaires inappropriées à des antigènes inoffensifs ou « auto-».

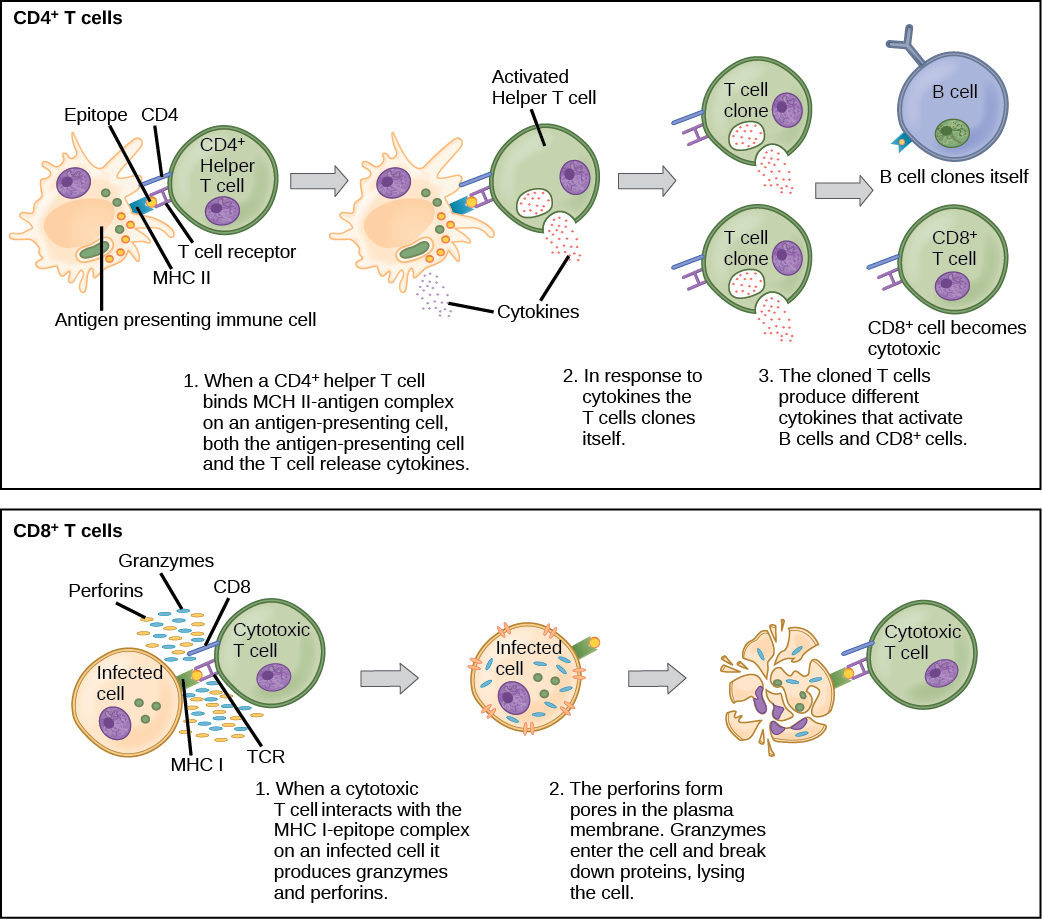
Les lymphocytes T et B présentent un thème commun de reconnaissance/liaison d'antigènes spécifiques via un récepteur complémentaire, suivie de l'activation et de l'auto-amplification/maturation pour se lier spécifiquement à l'antigène particulier du pathogène infectieux. Les lymphocytes T et B sont également similaires en ce sens que chaque cellule n'exprime qu'un seul type de récepteur antigénique. Tout individu peut posséder une population de lymphocytes T et B qui, ensemble, expriment une variété quasi illimitée de récepteurs antigéniques capables de reconnaître pratiquement tous les agents pathogènes infectieux. Les lymphocytes T et B sont activés lorsqu'ils reconnaissent de petits composants d'antigènes, appelés épitopes, présentés par des APC, illustrés dans la Figure\(\PageIndex{3}\). Notez que la reconnaissance se fait au niveau d'un épitope spécifique plutôt que de l'antigène entier ; c'est pourquoi les épitopes sont appelés « déterminants antigéniques ». En l'absence d'informations provenant des APC, les lymphocytes T et B restent inactifs, ou naïfs, et sont incapables de préparer une réponse immunitaire. La nécessité de disposer d'informations provenant des APC de l'immunité innée pour déclencher l'activation des lymphocytes B ou T illustre la nature essentielle de la réponse immunitaire innée au fonctionnement de l'ensemble du système immunitaire.

Les lymphocytes T naïfs peuvent exprimer l'une des deux molécules différentes, CD4 ou CD8, à leur surface, comme le montre la figure\(\PageIndex{4}\), et sont donc classés en tant que cellules CD4 + ou CD8 +. Ces molécules sont importantes car elles régulent la façon dont un lymphocyte T interagit avec un APC et y répond. Les cellules CD4+ naïves se lient aux APC via leurs molécules MHC II intégrées à l'antigène et sont stimulées pour devenir des lymphocytes T (T H) auxiliaires, des cellules qui stimulent directement les lymphocytes B (ou lymphocytes T cytotoxiques) ou sécrètent des cytokines pour informer de plus en plus de cellules cibles sur menace pathogène. En revanche, les cellules CD8+ engagent des molécules MHC I intégrées à l'antigène sur les CPA et sont stimulées pour devenir des lymphocytes T cytotoxiques (CTL), qui tuent directement les cellules infectées par apoptose et émettent des cytokines pour amplifier la réponse immunitaire. Les deux populations de lymphocytes T possèdent des mécanismes de protection immunitaire différents, mais elles se lient toutes deux aux molécules du CMH via leurs récepteurs antigéniques appelés récepteurs des lymphocytes T (TCR). Les molécules de surface CD4 ou CD8 différencient si le TCR va engager une molécule MHC II ou MHC I. Parce qu'elles contribuent à la spécificité de liaison, les molécules CD4 et CD8 sont décrites comme des corécepteurs.
Exercice\(\PageIndex{1}\)
Laquelle des affirmations suivantes concernant les lymphocytes T est fausse ?
- Les lymphocytes T auxiliaires libèrent des cytokines tandis que les lymphocytes T cytotoxiques tuent la cellule infectée.
- Les lymphocytes T auxiliaires sont des CD4 +, tandis que les lymphocytes T cytotoxiques sont des CD8 +.
- Le MHC II est un récepteur présent dans la plupart des cellules du corps, tandis que le MHC I est un récepteur présent uniquement sur les cellules immunitaires.
- Le récepteur des lymphocytes T se trouve à la fois sur les lymphocytes T CD4+ et CD8+.
- Réponse
-
C
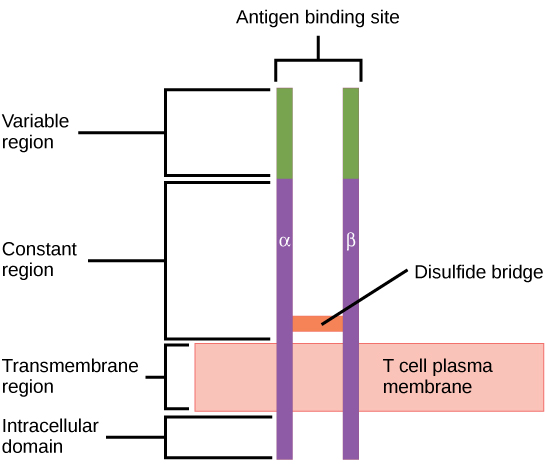
Considérez les innombrables antigènes possibles auxquels une personne sera exposée au cours de sa vie. Le système immunitaire adaptatif des mammifères est capable de répondre de manière appropriée à chaque antigène. Les mammifères possèdent une énorme diversité de populations de lymphocytes T, en raison de la diversité des TCR. Chaque TCR est constitué de deux chaînes polypeptidiques qui recouvrent la membrane des lymphocytes T, comme illustré à la figure\(\PageIndex{5}\) ; les chaînes sont liées par un pont disulfure. Chaque chaîne polypeptidique est composée d'un domaine constant et d'un domaine variable : un domaine, en ce sens, est une région spécifique d'une protéine qui peut être régulatrice ou structurelle. Le domaine intracellulaire est impliqué dans la signalisation intracellulaire. Un seul lymphocyte T exprimera des milliers de copies identiques d'un variant spécifique du TCR à la surface de sa cellule. La spécificité du système immunitaire adaptatif tient au fait qu'il synthétise des millions de populations de lymphocytes T différentes, chacune exprimant un TCR différent dans son domaine variable. Cette diversité des TCR est obtenue par la mutation et la recombinaison de gènes qui codent ces récepteurs dans les cellules souches précurseurs des lymphocytes T. La liaison entre une molécule MHC affichant l'antigène et une « correspondance » complémentaire avec le TCR indique que le système immunitaire adaptatif doit activer et produire ce lymphocyte T spécifique, car sa structure est appropriée pour reconnaître et détruire l'agent pathogène envahissant.
Lymphocytes T auxiliaires
Les lymphocytes T H fonctionnent indirectement pour identifier des agents pathogènes potentiels pour d'autres cellules du système immunitaire. Ces cellules sont importantes pour les infections extracellulaires, telles que celles causées par certaines bactéries, helminthes et protozoaires. Les lymphocytes T H reconnaissent des antigènes spécifiques présents dans les complexes MHC II des APC. Il existe deux grandes populations de lymphocytes T H : T H 1 et T H 2. Les cellules T H 1 sécrètent des cytokines pour améliorer les activités des macrophages et autres lymphocytes T. Les cellules T H 1 activent l'action des lymphocytes T cytotoxiques, ainsi que des macrophages. Les lymphocytes T H 2 stimulent les lymphocytes B naïfs pour détruire les envahisseurs étrangers par sécrétion d'anticorps. Le développement d'une réponse immunitaire T H 1 ou T H 2 dépend des types spécifiques de cytokines sécrétées par les cellules du système immunitaire inné, qui dépend à son tour de la nature du pathogène envahissant.
La réponse médiée par T H 1 implique des macrophages et est associée à une inflammation. Rappelons les défenses de première ligne des macrophages impliqués dans la réponse immunitaire innée. Certaines bactéries intracellulaires, comme Mycobacterium tuberculosis, ont évolué pour se multiplier dans les macrophages après les avoir englouties. Ces agents pathogènes échappent aux tentatives des macrophages de détruire et de digérer le pathogène. Lorsque l'infection à M. tuberculosis survient, les macrophages peuvent stimuler les lymphocytes T naïfs pour qu'ils deviennent des cellules T H 1. Ces lymphocytes T stimulés sécrètent des cytokines spécifiques qui envoient une rétroaction au macrophage pour stimuler ses capacités digestives et lui permettre de détruire la bactérie colonisatrice M. tuberculosis. De la même manière, les macrophages activés par T H 1 sont également mieux adaptés à l'ingestion et à la destruction des cellules tumorales. En résumé, les réponses T H 1 sont dirigées vers les envahisseurs intracellulaires tandis que les réponses T H 2 visent ceux qui sont extracellulaires.
Lymocytes B
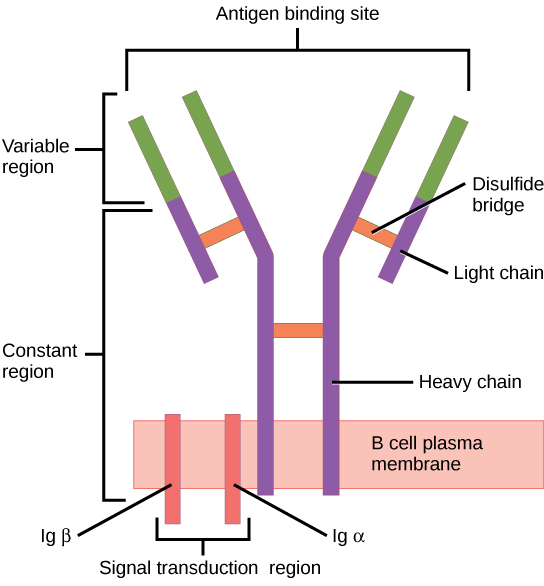
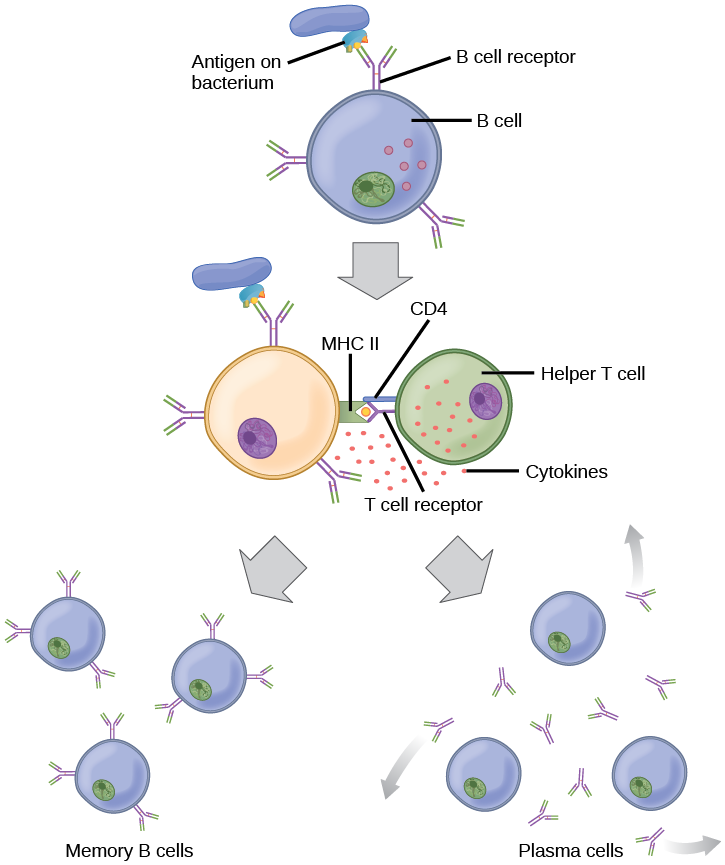
Lorsqu'ils sont stimulés par la voie T H 2, les lymphocytes B naïfs se différencient en plasmocytes sécrétant des anticorps. Un plasmocyte est une cellule immunitaire qui cache les anticorps ; ces cellules proviennent de lymphocytes B stimulés par des antigènes. Comme les lymphocytes T, les lymphocytes B naïfs sont initialement recouverts de milliers de récepteurs des lymphocytes B (BCR), qui sont des formes d'Ig liées à la membrane (immunoglobuline ou anticorps). Le récepteur des lymphocytes B possède deux chaînes lourdes et deux chaînes légères reliées par des liaisons disulfure. Chaque chaîne possède une région constante et une région variable ; cette dernière est impliquée dans la liaison à l'antigène. Deux autres protéines membranaires, l'Ig alpha et l'Ig bêta, sont impliquées dans la signalisation. Comme le montre la figure, les récepteurs de chaque lymphocyte B\(\PageIndex{6}\) sont tous les mêmes, mais les centaines de millions de lymphocytes B différents d'un individu possèdent des domaines de reconnaissance distincts qui contribuent à une grande diversité des types de structures moléculaires auxquelles ils peuvent se lier. Dans cet état, les lymphocytes B fonctionnent comme des APC. Ils lient et engloutissent des antigènes étrangers via leurs BCR, puis exposent les antigènes traités aux cellules T H 2 dans le contexte des molécules du MHC II. Lorsqu'un lymphocyte T H 2 détecte qu'un lymphocyte B est lié à un antigène pertinent, il sécrète des cytokines spécifiques qui induisent la prolifération rapide du lymphocyte B, ce qui en fait des milliers de copies identiques (clonales), puis il synthétise et sécrète des anticorps présentant le même schéma de reconnaissance antigénique que les BCR. L'activation des lymphocytes B correspondant à un variant spécifique de la BCR et la prolifération spectaculaire de ce variant sont connues sous le nom de sélection clonale. Ce phénomène modifie radicalement, mais brièvement, les proportions de variants de la BCR exprimés par le système immunitaire et fait pencher la balance vers des BCR spécifiques au pathogène infectieux.
Les lymphocytes T et B diffèrent d'une manière fondamentale : alors que les lymphocytes T se lient à des antigènes qui ont été digérés et intégrés dans les molécules du CMH par les CPA, les lymphocytes B fonctionnent comme des APC qui lient des antigènes intacts qui n'ont pas été traités. Bien que les lymphocytes T et B réagissent tous deux avec des molécules appelées « antigènes », ces lymphocytes répondent en fait à des types de molécules très différents. Les lymphocytes B doivent être capables de se lier à des antigènes intacts, car ils sécrètent des anticorps qui doivent reconnaître directement le pathogène, plutôt que des restes digérés du pathogène. Les molécules de glucides et de lipides des bactéries peuvent activer les lymphocytes B indépendamment des lymphocytes T.
Lymphocytes T cytotoxiques
Les CTL, une sous-classe de lymphocytes T, ont pour fonction d'éliminer directement les infections. La partie du système immunitaire adaptatif à médiation cellulaire est constituée de CTL qui attaquent et détruisent les cellules infectées. Les CTL jouent un rôle particulièrement important dans la protection contre les infections virales, car les virus se répliquent dans les cellules où ils sont protégés du contact extracellulaire avec les anticorps en circulation. Lorsque les CPA phagocytent des agents pathogènes et présentent des antigènes intégrés au MHC I aux lymphocytes T CD8+ naïfs qui expriment des TCR complémentaires, les lymphocytes T CD8+ s'activent pour proliférer en fonction de la sélection clonale. Les CTL qui en résultent identifient ensuite les non-APC présentant les mêmes antigènes intégrés au MHC I (par exemple, des protéines virales). Par exemple, les CTL identifient les cellules hôtes infectées.
Au niveau intracellulaire, les cellules infectées meurent généralement après que l'agent pathogène se soit reproduit à une concentration suffisante et ait lysé la cellule, comme le font de nombreux virus. Les CTL tentent d'identifier et de détruire les cellules infectées avant que le pathogène ne puisse se répliquer et s'échapper, stoppant ainsi la progression des infections intracellulaires. Les CTL aident également les lymphocytes NK à détruire les cancers précoces. Les cytokines sécrétées par la réponse T H 1 qui stimule les macrophages stimulent également les CTL et améliorent leur capacité à identifier et à détruire les cellules et les tumeurs infectées.
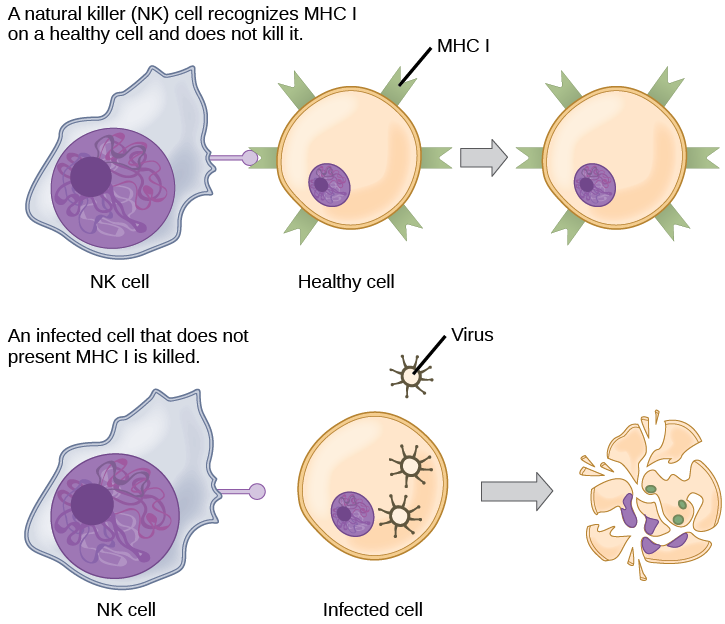
Les CTL détectent les antigènes intégrés au MHC I en interagissant directement avec les cellules infectées via leurs TCR. La liaison des TCR aux antigènes active les CTL pour libérer de la perforine et du granzyme, des enzymes de dégradation qui induiront l'apoptose de la cellule infectée. Rappelons qu'il s'agit d'un mécanisme de destruction similaire à celui utilisé par les cellules NK. Au cours de ce processus, le CTL n'est pas infecté et n'est pas endommagé par la sécrétion de perforine et de granzymes. En fait, les fonctions des cellules NK et des CTL sont complémentaires et maximisent l'élimination des cellules infectées, comme l'illustre la Figure\(\PageIndex{7}\). Si la cellule NK ne parvient pas à identifier le schéma de « soi manquant » des molécules du MHC I régulées à la baisse, alors le CTL peut l'identifier grâce au complexe du MHC I avec des antigènes étrangers, qui signale un « soi altéré ». De même, si le CTL ne peut pas détecter le MHC I intégré à l'antigène parce que les récepteurs sont épuisés à la surface de la cellule, les cellules NK détruiront plutôt la cellule. Les CTL émettent également des cytokines, telles que des interférons, qui modifient l'expression des protéines de surface dans d'autres cellules infectées, de telle sorte que les cellules infectées peuvent être facilement identifiées et détruites. De plus, ces interférons peuvent également empêcher les cellules infectées par des virus de libérer des particules virales.
Exercice\(\PageIndex{2}\)
D'après ce que vous savez sur les récepteurs du CMH, pourquoi pensez-vous qu'un organe transplanté d'un donneur incompatible à un receveur sera rejeté ?
- Réponse
-
Les récepteurs du CMH diffèrent d'une personne à l'autre. Ainsi, les récepteurs du CMH d'un donneur incompatible sont considérés comme « non personnels » et sont rejetés par le système immunitaire.
Les plasmocytes et les CTL sont collectivement appelés cellules effectrices : ils représentent des versions différenciées de leurs homologues naïfs et participent à la mise en place de la défense immunitaire en tuant les agents pathogènes et les cellules hôtes infectées.
Surfaces des muqueuses et tolérance immunitaire
Les réponses immunitaires innées et adaptatives discutées jusqu'à présent concernent le système immunitaire systémique (qui affecte l'ensemble du corps), qui est distinct du système immunitaire des muqueuses. L'immunité muqueuse est formée par le tissu lymphoïde associé aux muqueuses, qui fonctionne indépendamment du système immunitaire systémique et qui possède ses propres composants innés et adaptatifs. Le tissu lymphoïde associé aux muqueuses (MALT), illustré dans la figure\(\PageIndex{8}\), est un ensemble de tissu lymphatique qui se combine au tissu épithélial qui tapisse la muqueuse dans tout le corps. Ce tissu fait office de barrière immunitaire et de réponse dans les zones du corps en contact direct avec l'environnement extérieur. Le système immunitaire systémique et le système immunitaire des muqueuses utilisent bon nombre des mêmes types de cellules. Les particules étrangères qui se dirigent vers le MALT sont absorbées par des cellules épithéliales absorbantes appelées cellules M et acheminées vers des CPA situées directement sous le tissu muqueux. Les cellules M fonctionnent selon le mode de transport décrit et sont localisées dans la plaque de Peyer, un nodule lymphoïde. Les CPA du système immunitaire des muqueuses sont principalement des cellules dendritiques, les lymphocytes B et les macrophages jouant un rôle mineur. Les antigènes traités affichés sur les APC sont détectés par les lymphocytes T du MALT et sur divers sites d'induction des muqueuses, tels que les amygdales, les adénoïdes, l'appendice ou les ganglions lymphatiques mésentériques de l'intestin. Les lymphocytes T activés migrent ensuite à travers le système lymphatique et dans le système circulatoire vers les sites d'infection des muqueuses.
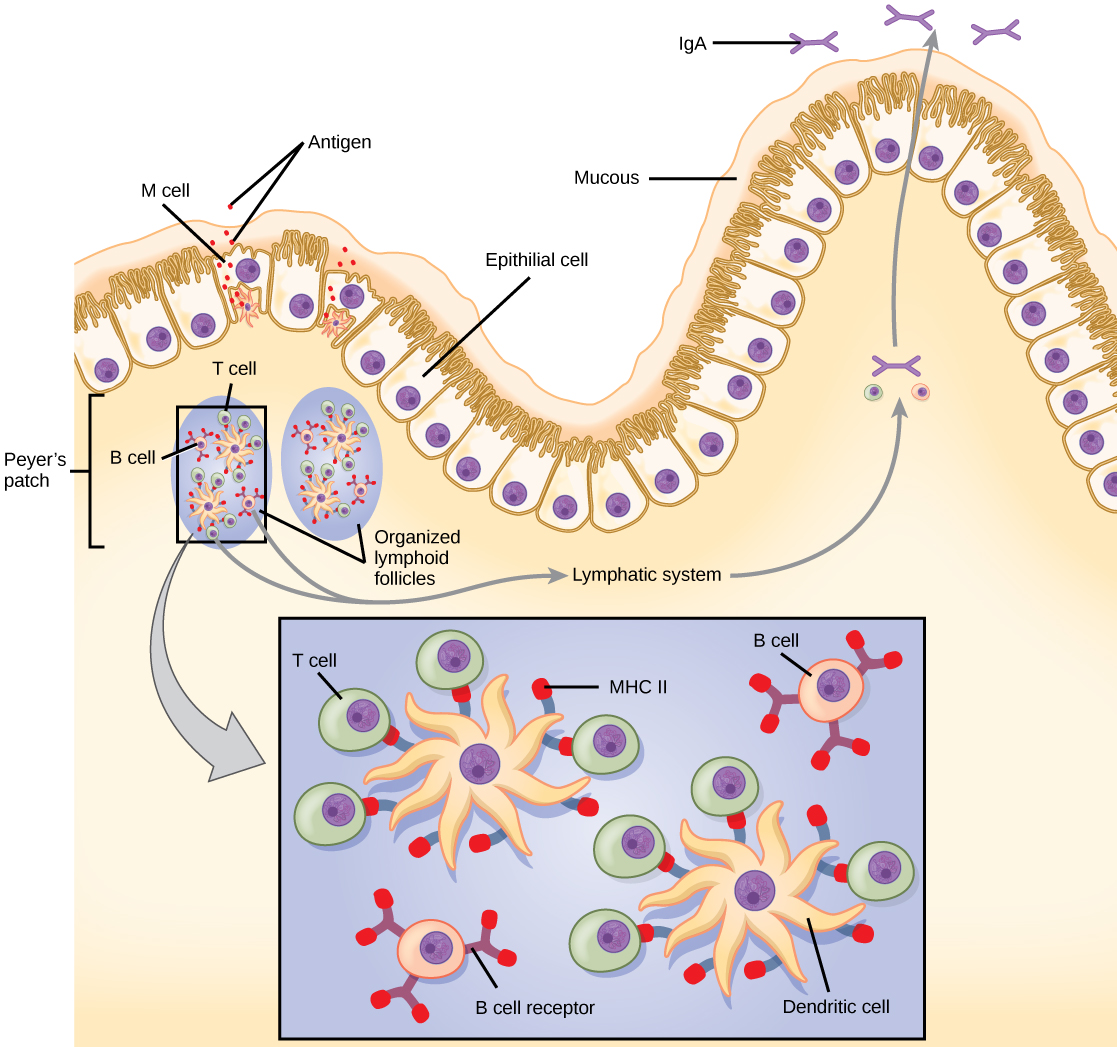
Le MALT est un élément crucial du fonctionnement du système immunitaire, car les surfaces des muqueuses, telles que les voies nasales, sont les premiers tissus sur lesquels se déposent les agents pathogènes inhalés ou ingérés. Le tissu muqueux comprend la bouche, le pharynx et l'œsophage, ainsi que les voies gastro-intestinales, respiratoires et urogénitales.
Le système immunitaire doit être régulé pour éviter des réactions inutiles et inutiles à des substances inoffensives et, plus important encore, pour qu'il ne s'attaque pas à « soi-même ». La capacité acquise à prévenir une réponse immunitaire inutile ou néfaste à une substance étrangère détectée connue pour ne pas provoquer de maladie est décrite comme une tolérance immunitaire. La tolérance immunitaire est essentielle au maintien de l'homéostasie des muqueuses étant donné le nombre énorme de substances étrangères (telles que les protéines alimentaires) que rencontrent les CPA de la cavité buccale, du pharynx et de la muqueuse gastro-intestinale. La tolérance immunitaire est provoquée par des APC spécialisés dans le foie, les ganglions lymphatiques, l'intestin grêle et les poumons qui présentent des antigènes inoffensifs à une population exceptionnellement diversifiée de lymphocytes T (T reg) régulateurs, des lymphocytes spécialisés qui suppriment l'inflammation locale et inhibent sécrétion de facteurs immunitaires stimulants. Le résultat combiné des lymphocytes T reg est de prévenir l'activation immunologique et l'inflammation dans les compartiments tissulaires indésirables et de permettre au système immunitaire de se concentrer plutôt sur les agents pathogènes. En plus de favoriser la tolérance immunitaire à des antigènes inoffensifs, d'autres sous-ensembles de lymphocytes T reg sont impliqués dans la prévention de la réponse auto-immune, qui est une réponse immunitaire inappropriée aux cellules hôtes ou aux auto-antigènes. Une autre classe T reg supprime les réponses immunitaires aux agents pathogènes nocifs une fois l'infection éliminée afin de minimiser les dommages causés aux cellules hôtes par l'inflammation et la lyse cellulaire.
Mémoire immunologique
Le système immunitaire adaptatif possède une composante de mémoire qui permet une réponse efficace et spectaculaire en cas de réinvasion du même agent pathogène. La mémoire est gérée par le système immunitaire adaptatif qui s'appuie peu sur les signaux de la réponse innée. Au cours de la réponse immunitaire adaptative à un pathogène qui n'avait jamais été détecté auparavant, appelée réponse primaire, les plasmocytes sécrétant des anticorps et des lymphocytes T différenciés augmentent, puis se stabilisent avec le temps. Au fur et à mesure que les lymphocytes B et T deviennent des cellules effectrices, un sous-ensemble des populations naïves se différencie en cellules mémoire B et T présentant les mêmes spécificités antigéniques, comme illustré à la Figure\(\PageIndex{9}\).
Une cellule mémoire est un lymphocyte B ou T spécifique à un antigène qui ne se différencie pas en cellules effectrices lors de la réponse immunitaire primaire, mais qui peut immédiatement devenir des cellules effectrices lors d'une réexposition au même agent pathogène. Lors de la réponse immunitaire primaire, les cellules de mémoire ne répondent pas aux antigènes et ne contribuent pas aux défenses de l'hôte. Au fur et à mesure que l'infection est éliminée et que les stimuli pathogènes disparaissent, les effecteurs ne sont plus nécessaires et ils subissent une apoptose. En revanche, les cellules mémoire persistent dans la circulation.
Exercice\(\PageIndex{3}\)
L'antigène Rh se trouve sur les globules rouges Rh positifs. Une femme Rh négative peut généralement mener à terme un fœtus Rh positif sans difficulté. Cependant, si elle a un deuxième fœtus Rh positif, son corps peut déclencher une attaque immunitaire qui provoque une maladie hémolytique du nouveau-né. Pourquoi pensez-vous que la maladie hémolytique n'est un problème que pendant la deuxième grossesse ou les suivantes ?
- Réponse
-
Si le sang de la mère et du fœtus se mélange, des cellules de mémoire qui reconnaissent l'antigène Rh peuvent se former tard au cours de la première grossesse. Au cours des grossesses suivantes, ces cellules mémoire déclenchent une attaque immunitaire contre les cellules sanguines du fœtus. L'injection d'anticorps anti-RH au cours de la première grossesse empêche l'apparition de la réponse immunitaire.
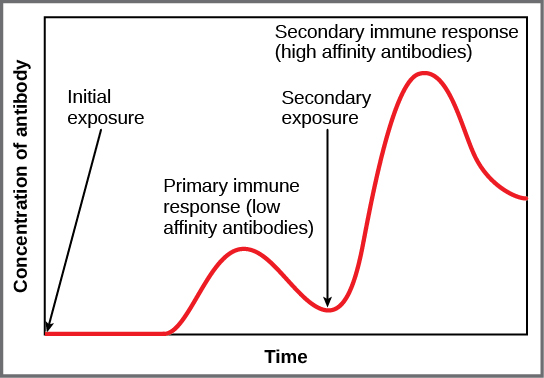
Si l'agent pathogène n'est plus jamais rencontré au cours de la vie de l'individu, les cellules mémoire B et T circuleront pendant quelques années, voire plusieurs décennies et mourront progressivement, n'ayant jamais fonctionné comme des cellules effectrices. Toutefois, si l'hôte est réexposé au même type d'agent pathogène, les cellules mémoire circulantes se différencieront immédiatement en plasmocytes et en CTL sans intervention des CPA ou des lymphocytes T H. L'une des raisons pour lesquelles la réponse immunitaire adaptative est retardée est qu'il faut du temps pour identifier et activer les lymphocytes B et T naïfs présentant les spécificités antigéniques appropriées. Lors de la réinfection, cette étape est ignorée et le résultat est une production plus rapide de défenses immunitaires. Les lymphocytes mémoire B qui se différencient en plasmocytes produisent des quantités d'anticorps dix à cent fois plus élevées que celles sécrétées lors de la réponse primaire, comme l'\(\PageIndex{10}\)illustre le graphique de la figure. Cette réponse immunitaire rapide et spectaculaire peut arrêter l'infection avant même qu'elle ne s'installe, et la personne peut ne pas se rendre compte qu'elle a été exposée.
La vaccination repose sur la connaissance que l'exposition à des antigènes non infectieux, dérivés de pathogènes connus, génère une réponse immunitaire primaire légère. La réponse immunitaire à la vaccination peut ne pas être perçue par l'hôte comme une maladie, mais elle confère tout de même une mémoire immunitaire. En cas d'exposition au pathogène correspondant contre lequel la personne a été vaccinée, la réaction est similaire à une exposition secondaire. Comme chaque réinfection génère un plus grand nombre de cellules mémoire et augmente la résistance au pathogène, et parce que certaines cellules mémoire meurent, certains cycles vaccinaux impliquent un ou plusieurs vaccins de rappel pour imiter les expositions répétées : par exemple, les stimulants antitétaniques sont nécessaires tous les dix ans parce que les cellules mémoire ne contiennent que des cellules mémoires vis aussi longtemps.
Mémoire immunitaire des muqueuses
Un sous-ensemble de lymphocytes T et B du système immunitaire des muqueuses se différencie en cellules mémoire, tout comme dans le système immunitaire systémique. Lors de la réinvasion du même type d'agent pathogène, une réponse immunitaire prononcée se produit au niveau de la muqueuse où l'agent pathogène d'origine s'est déposé, mais une défense collective est également organisée au sein du tissu muqueux interconnecté ou adjacent. Par exemple, la mémoire immunitaire d'une infection de la cavité buccale provoquerait également une réponse dans le pharynx si la cavité buccale était exposée au même agent pathogène.
Lien de carrière : vaccinologue
La vaccination (ou immunisation) implique l'administration, généralement par injection comme le montre la figure\(\PageIndex{11}\), d'antigènes non infectieux dérivés de pathogènes connus. D'autres composants, appelés adjuvants, sont administrés en parallèle pour aider à stimuler la réponse immunitaire. La mémoire immunologique est la raison pour laquelle les vaccins fonctionnent. Idéalement, la vaccination a pour effet de susciter une mémoire immunologique, et donc une résistance à des agents pathogènes spécifiques, sans que la personne ait à subir une infection.
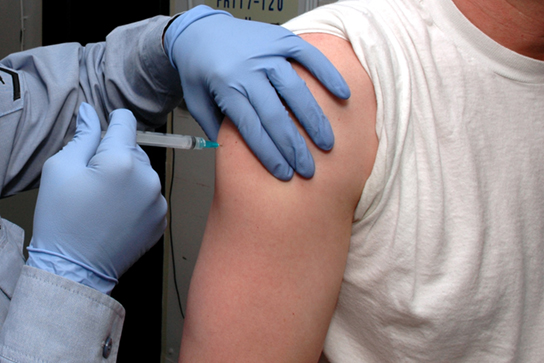
Les vaccinologues participent au processus de développement du vaccin, depuis l'idée initiale jusqu'à la mise à disposition du vaccin complet. Ce processus peut prendre des décennies, coûter des millions de dollars et comporter de nombreux obstacles en cours de route. Par exemple, les vaccins injectés stimulent le système immunitaire systémique, déclenchant une immunité humorale et cellulaire, mais ils ont peu d'effet sur la réponse des muqueuses, ce qui représente un défi car de nombreux agents pathogènes se déposent et se répliquent dans les compartiments muqueux, et l'injection n'en fournit pas le plus mémoire immunitaire efficace pour ces agents pathogènes. C'est pourquoi les vaccinologues participent activement à la mise au point de nouveaux vaccins qui sont administrés par voie intranasale, aérosol, orale ou transcutanée (absorbés par la peau). Il est important de noter que les vaccins administrés par voie muqueuse déclenchent une immunité à la fois muqueuse et systémique et produisent le même niveau de résistance aux maladies que les vaccins injectés.
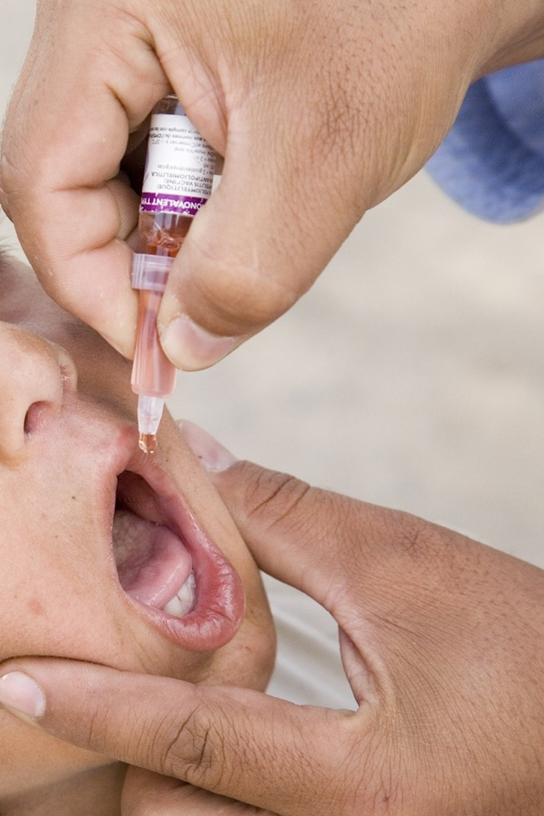
Actuellement, une version du vaccin antigrippal intranasal est disponible et les vaccins contre la polio et la typhoïde peuvent être administrés par voie orale, comme le montre la figure\(\PageIndex{12}\). De même, les vaccins contre la rougeole et la rubéole sont adaptés à l'administration par aérosol à l'aide de dispositifs d'inhalation. À terme, les plantes transgéniques peuvent être modifiées pour produire des antigènes vaccinaux qui peuvent être consommés pour conférer une résistance aux maladies. D'autres vaccins peuvent être adaptés à une application rectale ou vaginale afin de provoquer des réponses immunitaires dans les muqueuses rectale, génito-urinaire ou reproductrice. Enfin, les antigènes vaccinaux peuvent être adaptés à une application transdermique dans laquelle la peau est légèrement grattée et des micro-aiguilles sont utilisées pour percer la couche la plus externe. En plus de mobiliser la réponse immunitaire des muqueuses, cette nouvelle génération de vaccins peut mettre fin à l'anxiété associée aux injections et, par conséquent, améliorer la participation des patients.
Centres primaires du système immunitaire
Bien que le système immunitaire soit caractérisé par la circulation de cellules dans tout le corps, la régulation, la maturation et l'intercommunication des facteurs immunitaires se produisent à des sites spécifiques. Le sang fait circuler les cellules immunitaires, les protéines et d'autres facteurs dans l'organisme. Environ 0,1 % de toutes les cellules du sang sont des leucocytes, qui comprennent les monocytes (le précurseur des macrophages) et les lymphocytes. La majorité des cellules du sang sont des érythrocytes (globules rouges). La lymphe est un liquide aqueux qui baigne les tissus et les organes avec des globules blancs protecteurs et ne contient pas d'érythrocytes. Les cellules du système immunitaire peuvent se déplacer entre le système lymphatique et le système circulatoire sanguin distincts, qui sont séparés par un espace interstitiel, par un processus appelé extravasation (passage dans les tissus environnants).
Les cellules du système immunitaire proviennent des cellules souches hématopoïétiques de la moelle osseuse. Les cytokines stimulent la différenciation de ces cellules souches en cellules immunitaires. La maturation des lymphocytes B se produit dans la moelle osseuse, tandis que les lymphocytes T naïfs passent de la moelle osseuse au thymus pour mûrir. Dans le thymus, les lymphocytes T immatures qui expriment des TCR complémentaires aux auto-antigènes sont détruits. Ce processus permet de prévenir les réponses auto-immunes.
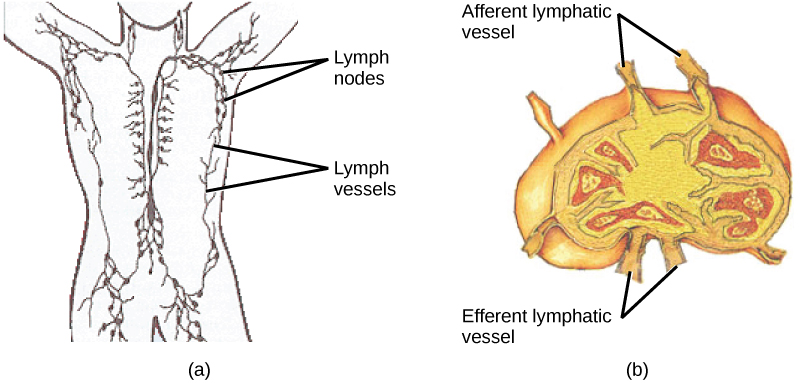
À la maturation, les lymphocytes T et B circulent vers diverses destinations. Les ganglions lymphatiques disséminés dans tout le corps, comme l'illustre la figure\(\PageIndex{13}\), abritent de grandes populations de lymphocytes T et B, de cellules dendritiques et de macrophages. La lymphe accumule des antigènes lorsqu'elle s'écoule des tissus. Ces antigènes sont ensuite filtrés à travers les ganglions lymphatiques avant que la lymphe ne soit remise en circulation. Les APC situés dans les ganglions lymphatiques capturent et traitent les antigènes et informent les lymphocytes voisins des agents pathogènes potentiels.
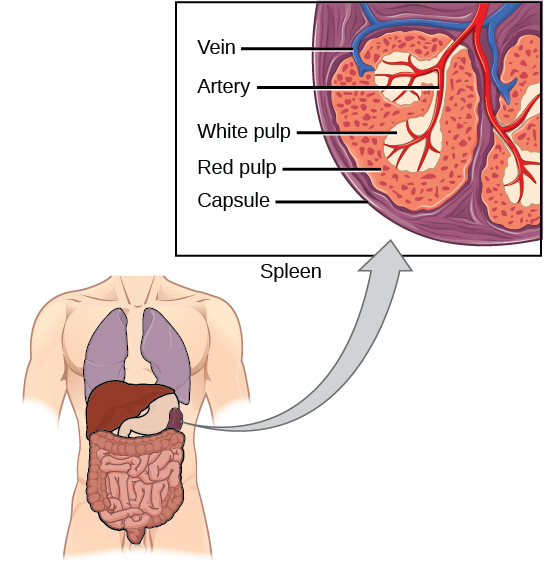
La rate abrite des lymphocytes B et T, des macrophages, des cellules dendritiques et des cellules NK. La rate, illustrée à la figure\(\PageIndex{14}\), est le site où les CPA qui ont piégé des particules étrangères dans le sang peuvent communiquer avec les lymphocytes. Les anticorps sont synthétisés et sécrétés par les plasmocytes activés de la rate, et la rate filtre les substances étrangères et les agents pathogènes complexes aux anticorps présents dans le sang. Sur le plan fonctionnel, la rate est transmise au sang comme les ganglions lymphatiques le sont à la lymphe.
Résumé
La réponse immunitaire adaptative est une réponse plus lente, plus durable et plus spécifique que la réponse innée. Cependant, la réponse adaptative nécessite des informations provenant du système immunitaire inné pour fonctionner. Les APC présentent des antigènes via des molécules MHC aux lymphocytes T naïfs complémentaires. En réponse, les lymphocytes T se différencient et prolifèrent, devenant des lymphocytes T H ou CTL. Les lymphocytes T H stimulent les lymphocytes B qui ont englouti et présenté des antigènes dérivés d'agents pathogènes. Les lymphocytes B se différencient en plasmocytes qui sécrètent des anticorps, tandis que les CTL induisent l'apoptose dans les cellules infectées ou cancéreuses au niveau intracellulaire. Les cellules mémoire persistent après une exposition primaire à un agent pathogène. En cas de réexposition, les cellules mémoire se différencient en cellules effectrices sans intervention du système immunitaire inné. Le système immunitaire des muqueuses est largement indépendant du système immunitaire systémique mais fonctionne de manière parallèle pour protéger les surfaces muqueuses étendues du corps.
Lexique
- immunité adaptative
- immunité qui a une mémoire et qui survient après une exposition à un antigène provenant soit d'un agent pathogène, soit d'une vaccination
- antigène
- protéine étrangère ou « non personnelle » qui déclenche la réponse immunitaire
- cellule présentatrice d'antigènes (APC)
- cellule immunitaire qui détecte, engloutit et informe la réponse immunitaire adaptative concernant une infection en présentant l'antigène traité à la surface de la cellule
- réponse auto-immune
- réponse immunitaire inappropriée aux cellules hôtes ou aux auto-antigènes
- réponse immunitaire à médiation cellulaire
- réponse immunitaire adaptative réalisée par les lymphocytes T
- sélection clonale
- activation des lymphocytes B correspondant à un variant spécifique de la BCR et prolifération spectaculaire de ce variant
- lymphocyte T cytotoxique (CTL)
- cellule immunitaire adaptative qui tue directement les cellules infectées via la perforine et les granzymes, et libère des cytokines pour améliorer la réponse immunitaire
- cellule dendritique
- cellule immunitaire qui traite le matériel antigénique et le présente à la surface d'autres cellules pour induire une réponse immunitaire
- cellule effectrice
- un lymphocyte différencié, tel qu'un lymphocyte B, un plasmocyte ou un lymphocyte T cytotoxique
- épitope
- petit composant d'un antigène spécifiquement reconnu par les anticorps, les lymphocytes B et les lymphocytes T ; le déterminant antigénique
- lymphocyte T auxiliaire (T H)
- cellule du système immunitaire adaptatif qui lie les APC via des molécules MHC II et stimule les lymphocytes B ou sécrète des cytokines pour initier la réponse immunitaire
- réponse immunitaire humorale
- réponse immunitaire adaptative contrôlée par des lymphocytes B et des anticorps activés
- tolérance immunitaire
- capacité acquise à prévenir une réponse immunitaire inutile ou néfaste à un corps étranger détecté dont on sait qu'il ne cause pas de maladie ou à des auto-antigènes
- lymphe
- liquide aqueux qui baigne les tissus et les organes de globules blancs protecteurs et ne contient pas d'érythrocytes
- tissu lymphoïde associé aux muqueuses (MALT)
- collection de tissu lymphatique qui se combine au tissu épithélial qui tapisse la muqueuse dans tout le corps
- cellule de mémoire
- lymphocyte B ou T spécifique à un antigène qui ne se différencie pas en cellules effectrices lors de la réponse immunitaire primaire, mais qui peut immédiatement devenir une cellule effectrice lors d'une réexposition au même pathogène
- plasmocyte
- cellule immunitaire qui sécrète les anticorps ; ces cellules proviennent de lymphocytes B stimulés par des antigènes
- cellule T (T reg) régulatrice
- lymphocyte spécialisé qui supprime l'inflammation locale et inhibe la sécrétion de cytokines, d'anticorps et d'autres facteurs immunitaires stimulants ; impliqué dans la tolérance immunitaire


