42.1 : Réponse immunitaire innée
- Page ID
- 189381
Compétences à développer
- Décrire les barrières immunitaires physiques et chimiques
- Expliquer les réponses immunitaires innées immédiates et induites
- Discutez des cellules tueuses naturelles
- Décrire les principales molécules d'histocompatibilité de classe I
- Résumez la façon dont les protéines d'un système complémentaire fonctionnent pour détruire les agents pathogènes extracellulaires
Le système immunitaire comprend à la fois des réponses immunitaires innées et adaptatives. L'immunité innée est naturelle en raison de facteurs génétiques ou de la physiologie ; elle n'est pas induite par une infection ou une vaccination, mais contribue à réduire la charge de travail liée à la réponse immunitaire adaptative. Les niveaux inné et adaptatif de la réponse immunitaire impliquent des protéines sécrétées, une signalisation médiée par les récepteurs et une communication intercellulaire complexe. Le système immunitaire inné s'est développé au début de l'évolution des animaux, il y a environ un milliard d'années, en tant que réponse essentielle à l'infection. L'immunité innée a un nombre limité de cibles spécifiques : toute menace pathogène déclenche une séquence constante d'événements permettant d'identifier le type d'agent pathogène et soit d'éliminer l'infection de manière indépendante, soit de mobiliser une réponse immunitaire adaptative hautement spécialisée. Par exemple, les larmes et les sécrétions de mucus contiennent des facteurs microbicides.
Barrières physiques et chimiques
Avant que des facteurs immunitaires ne soient déclenchés, la peau agit comme une barrière continue et infranchissable contre les agents pathogènes potentiellement infectieux. Les agents pathogènes sont tués ou inactivés sur la peau par dessiccation (dessèchement) et par l'acidité de la peau. De plus, les microorganismes bénéfiques qui coexistent sur la peau entrent en concurrence avec les agents pathogènes envahissants, prévenant ainsi les infections. Les régions du corps qui ne sont pas protégées par la peau (comme les yeux et les muqueuses) ont d'autres moyens de défense, tels que les larmes et les sécrétions de mucus qui piègent et éliminent les agents pathogènes, et les cils des voies nasales et des voies respiratoires qui expulsent le mucus et les agents pathogènes hors du corps. D'autres défenses sont présentes dans tout le corps, telles que le faible pH de l'estomac (qui inhibe la croissance des agents pathogènes), les protéines sanguines qui lient et perturbent les membranes cellulaires bactériennes et le processus d'urination (qui évacue les agents pathogènes des voies urinaires).
Malgré ces obstacles, les agents pathogènes peuvent pénétrer dans l'organisme par des abrasions ou des perforations de la peau, ou en s'accumulant sur la surface des muqueuses en grand nombre pour surmonter le mucus ou les cils. Certains agents pathogènes ont développé des mécanismes spécifiques qui leur permettent de surmonter les obstacles physiques et chimiques. Lorsque des agents pathogènes pénètrent dans l'organisme, le système immunitaire inné réagit par l'inflammation, l'engloutissement des agents pathogènes et la sécrétion de facteurs immunitaires et de protéines.
Reconnaissance des pathogènes
Une infection peut être intracellulaire ou extracellulaire, selon le pathogène. Tous les virus infectent les cellules et se répliquent dans ces cellules (intracellulairement), tandis que les bactéries et autres parasites peuvent se répliquer de manière intracellulaire ou extracellulaire, selon l'espèce. Le système immunitaire inné doit réagir en conséquence : en identifiant le pathogène extracellulaire et/ou en identifiant les cellules hôtes déjà infectées. Lorsqu'un agent pathogène pénètre dans l'organisme, les cellules du sang et de la lymphe détectent les modèles moléculaires spécifiques associés aux agents pathogènes (PAMP) à la surface de l'agent pathogène. Les PAMP sont des « signatures » de glucides, de polypeptides et d'acides nucléiques qui sont exprimées par les virus, les bactéries et les parasites, mais qui diffèrent des molécules présentes sur les cellules hôtes. Le système immunitaire possède des cellules spécifiques, décrites dans la Figure\(\PageIndex{1}\) et illustrées dans la Figure\(\PageIndex{2}\), dotées de récepteurs qui reconnaissent ces PAMP. Un macrophage est une grosse cellule phagocytaire qui engloutit des particules étrangères et des agents pathogènes. Les macrophages reconnaissent les PAMP via des récepteurs de reconnaissance de formes complémentaires (PRR). Les PRR sont des molécules présentes sur les macrophages et les cellules dendritiques qui sont en contact avec l'environnement extérieur. Un monocyte est un type de globule blanc qui circule dans le sang et la lymphe et qui se différencie en macrophages après avoir pénétré dans les tissus infectés. Les cellules dendritiques lient les signatures moléculaires des agents pathogènes et favorisent leur assimilation et leur destruction. Les récepteurs de type Toll (TLR) sont un type de PRR qui reconnaît les molécules communes aux agents pathogènes (mais qui peuvent être distinguées des molécules hôtes). Les TLR sont présents chez les invertébrés comme chez les vertébrés et semblent être l'un des composants les plus anciens du système immunitaire. Des TLR ont également été identifiés dans le système nerveux des mammifères.
Effet de libération de cytokines
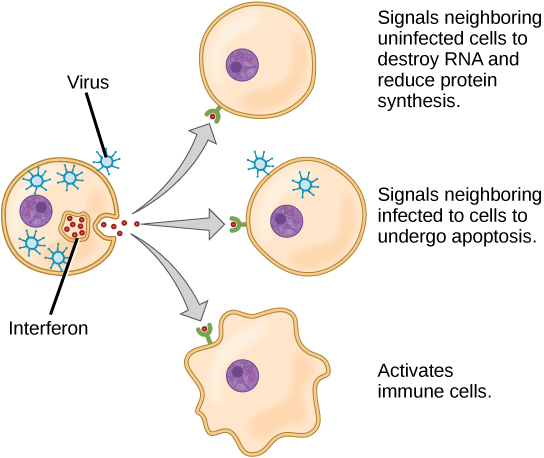
La liaison des PRR aux PAMP déclenche la libération de cytokines, qui signalent la présence d'un agent pathogène et doit être détruit en même temps que les cellules infectées. Une cytokine est un messager chimique qui régule la différenciation cellulaire (forme et fonction), la prolifération (production) et l'expression génique afin d'affecter les réponses immunitaires. Il existe au moins 40 types de cytokines chez l'homme qui diffèrent selon le type de cellule qui les produit, le type de cellule qui y répond et les changements qu'elles produisent. Un type de cytokine, l'interféron, est illustré sur la figure\(\PageIndex{3}\).
L'une des sous-classes de cytokines est l'interleukine (IL), ainsi nommée parce qu'elles médient les interactions entre les leucocytes (globules blancs). Les interleukines sont impliquées dans le pontage des réponses immunitaires innées et adaptatives. En plus d'être libérées par les cellules après reconnaissance du PAMP, les cytokines sont libérées par les cellules infectées qui se lient aux cellules non infectées voisines et induisent ces cellules à libérer des cytokines, ce qui entraîne une explosion de cytokines.
Une deuxième classe de cytokines à action précoce est constituée par les interférons, qui sont libérés par les cellules infectées pour avertir les cellules non infectées voisines. L'une des fonctions d'un interféron est d'inhiber la réplication virale. Ils ont également d'autres fonctions importantes, telles que la surveillance des tumeurs. Les interférons agissent en signalant aux cellules voisines non infectées de détruire l'ARN et de réduire la synthèse des protéines, en signalant aux cellules infectées voisines de subir une apoptose (mort cellulaire programmée) et en activant les cellules immunitaires.
En réponse aux interférons, les cellules non infectées modifient leur expression génique, ce qui augmente leur résistance aux infections. L'expression génique induite par l'interféron a notamment pour effet de réduire fortement la synthèse des protéines cellulaires. Les cellules infectées par des virus produisent davantage de virus en synthétisant de grandes quantités de protéines virales. Ainsi, en réduisant la synthèse des protéines, une cellule devient résistante aux infections virales.
Phagocytose et inflammation
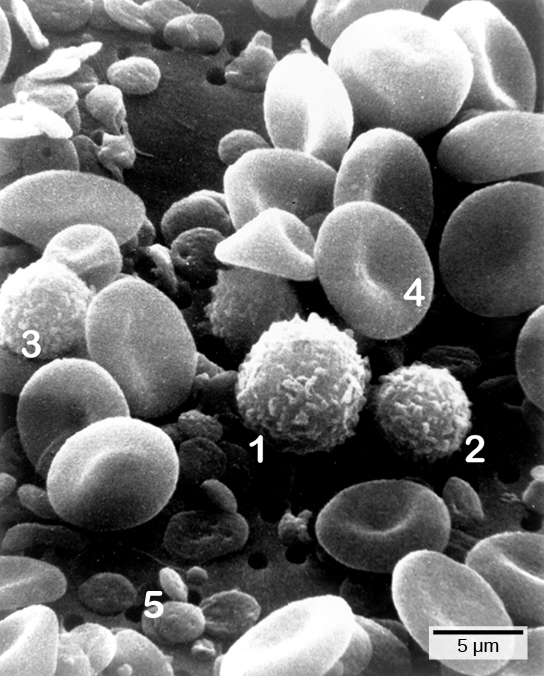
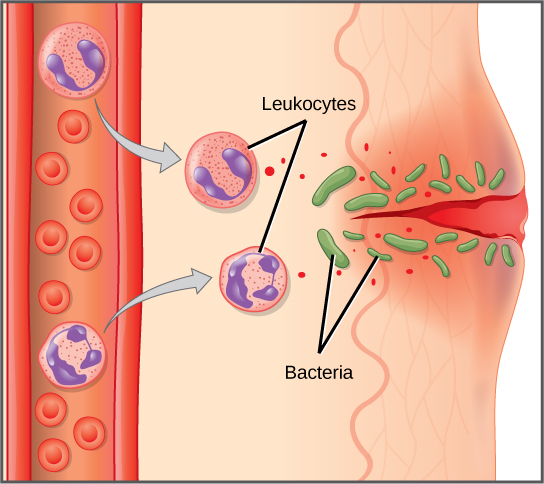
Les premières cytokines produites sont pro-inflammatoires, c'est-à-dire qu'elles favorisent l'inflammation, les rougeurs localisées, l'enflure, la chaleur et la douleur qui résultent du mouvement des leucocytes et des liquides à travers des capillaires de plus en plus perméables vers un site d'infection. La population de leucocytes qui arrive sur un site d'infection dépend de la nature du pathogène infectieux. Les macrophages et les cellules dendritiques engloutissent les agents pathogènes et les débris cellulaires par phagocytose. Un neutrophile est également un leucocyte phagocytaire qui engloutit et digère les agents pathogènes. Les neutrophiles, illustrés sur la figure\(\PageIndex{1}\), sont les leucocytes les plus abondants du système immunitaire. Les neutrophiles ont un noyau de deux à cinq lobes et contiennent des organites, appelés lysosomes, qui digèrent les agents pathogènes engloutis. Un éosinophile est un leucocyte qui agit avec d'autres éosinophiles pour entourer un parasite ; il intervient dans la réponse allergique et dans la protection contre les helminthes (vers parasites).
Les neutrophiles et les éosinophiles sont des leucocytes particulièrement importants qui engloutissent de gros agents pathogènes, tels que des bactéries et des champignons. Un mastocyte est un leucocyte qui produit des molécules inflammatoires, comme l'histamine, en réponse à de gros agents pathogènes. Un basophile est un leucocyte qui, comme un neutrophile, libère des substances chimiques pour stimuler la réponse inflammatoire, comme illustré à la figure\(\PageIndex{4}\). Les basophiles sont également impliqués dans les réactions allergiques et d'hypersensibilité et induisent des types spécifiques de réponses inflammatoires. Les éosinophiles et les basophiles produisent des médiateurs inflammatoires supplémentaires pour recruter davantage de leucocytes. Une réponse immunitaire hypersensible à des antigènes inoffensifs, tels que le pollen, implique souvent la libération d'histamine par les basophiles et les mastocytes.
Les cytokines envoient également une rétroaction aux cellules du système nerveux pour provoquer les symptômes généraux de la sensation de malaise, notamment la léthargie, les douleurs musculaires et les nausées. Ces effets peuvent avoir évolué parce que les symptômes incitent la personne à se reposer et l'empêchent de transmettre l'infection à d'autres personnes. Les cytokines augmentent également la température corporelle centrale, provoquant de la fièvre, qui amène le foie à retenir le fer du sang. Sans fer, certains agents pathogènes, tels que certaines bactéries, sont incapables de se répliquer ; c'est ce que l'on appelle l'immunité nutritionnelle.
Cellules tueuses naturelles
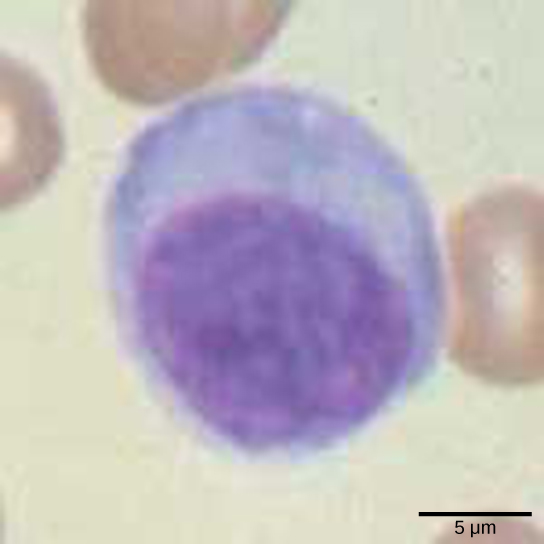
Les lymphocytes sont des leucocytes identifiables histologiquement par leurs gros noyaux foncés ; ce sont de petites cellules avec très peu de cytoplasme, comme le montre la figure\(\PageIndex{5}\). Les cellules infectées sont identifiées et détruites par des cellules tueuses naturelles (NK), des lymphocytes capables de tuer les cellules infectées par des virus ou des cellules tumorales (cellules anormales qui se divisent et envahissent d'autres tissus de manière incontrôlable). Les lymphocytes T et les lymphocytes B du système immunitaire adaptatif sont également classés dans la catégorie des lymphocytes. Les lymphocytes T sont des lymphocytes qui arrivent à maturité dans le thymus et les lymphocytes B sont des lymphocytes qui arrivent à maturité dans la moelle osseuse. Les cellules NK identifient les infections intracellulaires, en particulier celles causées par les virus, par l'expression modifiée des molécules de la classe majeure d'histocompatibilité (MHC) I à la surface des cellules infectées. Les molécules du MHC I sont des protéines présentes à la surface de toutes les cellules nucléées ; elles sont donc rares dans les globules rouges et les plaquettes qui ne sont pas nucléés. Les molécules du MHC I ont pour fonction de présenter des fragments de protéines provenant des agents infectieux contenus dans la cellule aux lymphocytes T ; les cellules saines seront ignorées, tandis que les protéines « non personnelles » ou étrangères seront attaquées par le système immunitaire. Les molécules du MHC II se trouvent principalement sur les cellules contenant des antigènes (« protéines autres que les auto-protéines ») et sur les lymphocytes. Les molécules du MHC II interagissent avec les lymphocytes T auxiliaires pour déclencher la réponse immunitaire appropriée, qui peut inclure la réponse inflammatoire.
Une cellule infectée (ou une cellule tumorale) est généralement incapable de synthétiser et d'afficher les molécules du MHC I de manière appropriée. Les ressources métaboliques des cellules infectées par certains virus produisent des protéines qui interfèrent avec le traitement et/ou le trafic du MHC I vers la surface cellulaire. La réduction du MHC I sur les cellules hôtes varie d'un virus à l'autre et résulte de la production d'inhibiteurs actifs par les virus. Ce processus peut épuiser les molécules hôtes du MHC I à la surface des cellules, que les cellules NK détectent comme « malsaines » ou « anormales » lors de la recherche de molécules MHC I cellulaires. De même, la modification spectaculaire de l'expression génique des cellules tumorales entraîne l'expression de molécules MHC I extrêmement déformées ou absentes, qui signalent également « malsaines » ou « anormales ».
Les cellules NK sont toujours actives ; une interaction avec des molécules MHC I normales et intactes sur une cellule saine désactive la séquence de destruction et la cellule NK passe à autre chose. Une fois que la cellule NK a détecté une cellule infectée ou tumorale, son cytoplasme sécrète des granules composés de perforine, une protéine destructrice qui crée un pore dans la cellule cible. Les granzymes sont libérés avec la perforine dans la synapse immunologique. Un granzyme est une protéase qui digère les protéines cellulaires et amène la cellule cible à subir une mort cellulaire programmée, ou apoptose. Les cellules phagocytaires digèrent ensuite les débris cellulaires laissés. Les cellules NK patrouillent constamment dans le corps et constituent un mécanisme efficace pour contrôler les infections potentielles et prévenir la progression du cancer.
Complément
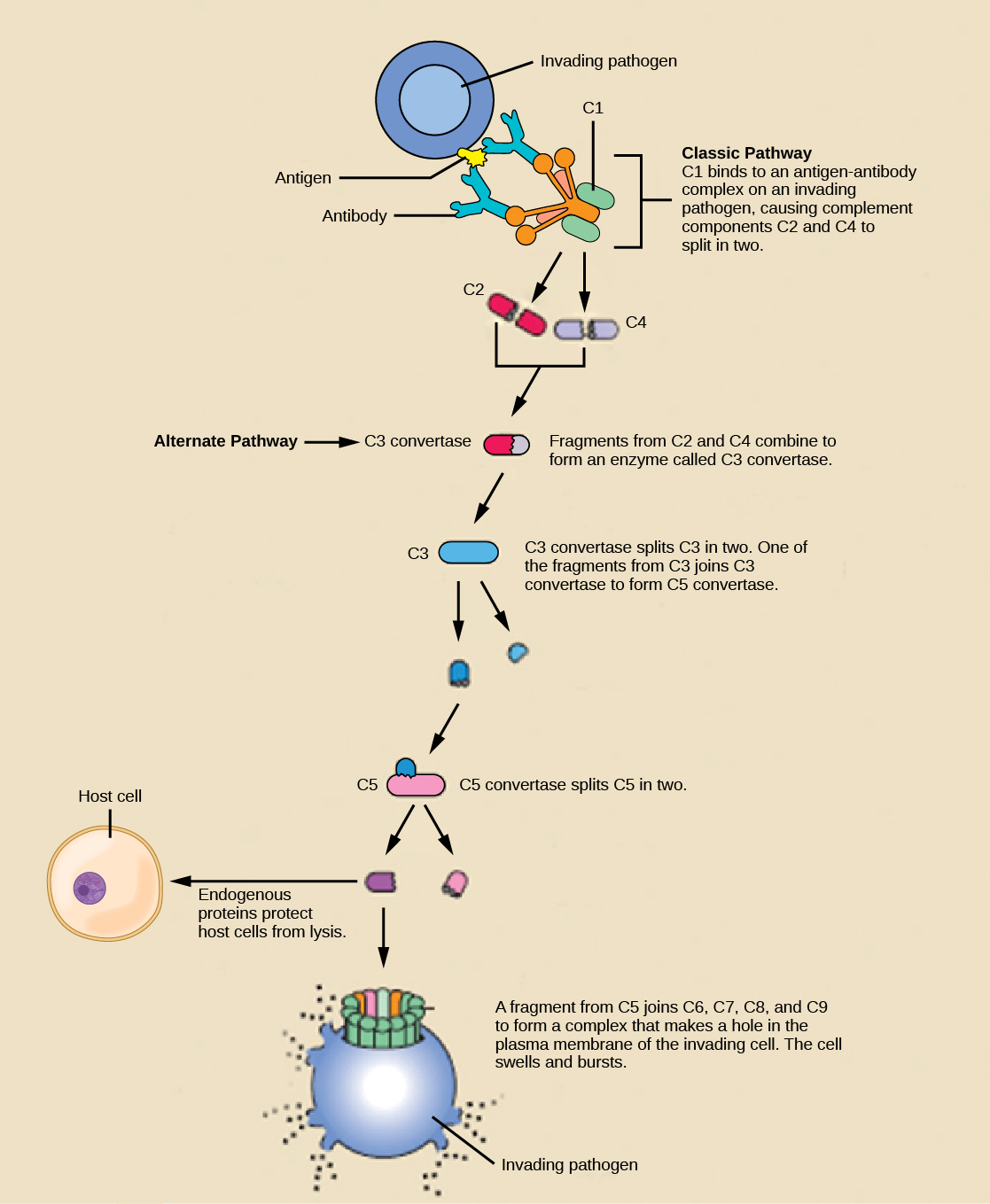
Un ensemble d'environ 20 types de protéines solubles, appelé système complémentaire, a pour fonction de détruire les agents pathogènes extracellulaires. Les cellules du foie et les macrophages synthétisent les protéines du complément en continu ; ces protéines sont abondantes dans le sérum sanguin et sont capables de réagir immédiatement aux microorganismes infectieux. Le système du complément est ainsi nommé parce qu'il est complémentaire de la réponse anticorps du système immunitaire adaptatif. Les protéines du complément se lient à la surface des microorganismes et sont particulièrement attirées par les agents pathogènes déjà liés par des anticorps. La liaison des protéines du complément se produit selon une séquence spécifique et hautement régulée, chaque protéine successive étant activée par le clivage et/ou les modifications structurales induites lors de la liaison de la ou des protéines précédentes. Après la fixation des premières protéines du complément, une cascade d'événements de liaison séquentiels s'ensuit au cours de laquelle le pathogène est rapidement recouvert de protéines du complément.
Les protéines du complément remplissent plusieurs fonctions. Les protéines servent de marqueur pour indiquer la présence d'un agent pathogène sur les cellules phagocytaires, telles que les macrophages et les lymphocytes B, et favorisent l'engloutissement ; ce processus est appelé opsonisation. Certaines protéines du complément peuvent se combiner pour former des complexes d'attaque qui ouvrent les pores des membranes des cellules microbiennes. Ces structures détruisent les agents pathogènes en provoquant une fuite de leur contenu, comme illustré à la figure\(\PageIndex{6}\).
Résumé
Le système immunitaire inné est le premier à réagir aux menaces pathogènes qui contournent les barrières physiques et chimiques naturelles de l'organisme. À l'aide d'une combinaison d'attaques cellulaires et moléculaires, le système immunitaire inné identifie la nature d'un pathogène et réagit par une inflammation, une phagocytose, la libération de cytokines, la destruction par les cellules NK et/ou un système complémentaire. Lorsque les mécanismes innés sont insuffisants pour éliminer une infection, la réponse immunitaire adaptative est informée et mobilisée.
Lexique
- basophile
- leucocyte qui libère des substances chimiques habituellement impliquées dans la réponse inflammatoire
- Cellule B
- lymphocyte qui arrive à maturité dans la moelle osseuse et se différencie en plasmocytes sécrétant des anticorps
- système de complément
- ensemble d'environ 20 protéines solubles du système immunitaire inné qui stimulent la phagocytose, creusent des trous dans les agents pathogènes et recrutent des lymphocytes ; améliore la réponse adaptative lors de la production d'anticorps
- cytokine
- messager chimique qui régule la différenciation cellulaire, la prolifération, l'expression génique et le trafic cellulaire pour agir sur les réponses immunitaires
- éosinophile
- leucocyte qui répond aux parasites et participe à la réponse allergique
- granzyme
- protéase qui pénètre dans les cellules cibles par la perforine et induit l'apoptose dans les cellules cibles ; utilisée par les cellules NK et les lymphocytes T tueurs
- inflammation
- rougeur, gonflement, chaleur et douleur localisés résultant du mouvement des leucocytes et du liquide à travers les capillaires ouverts jusqu'au site de l'infection
- immunité innée
- immunité naturelle due à des facteurs génétiques ou à la physiologie et qui n'est pas induite par une infection ou une vaccination
- interféron
- cytokine qui inhibe la réplication virale et module la réponse immunitaire
- lymphocyte
- leucocyte identifiable histologiquement par ses gros noyaux ; c'est une petite cellule avec très peu de cytoplasme
- macrophage
- grosse cellule phagocytaire qui engloutit les particules étrangères et les agents pathogènes
- molécule majeure de classe d'histocompatibilité (MHC) I/II
- protéine présente à la surface de toutes les cellules nucléées (I) ou spécifiquement sur les cellules présentatrices d'antigènes (II) qui indique aux cellules immunitaires si la cellule est saine/normale ou si elle est infectée/cancéreuse ; elle fournit le modèle approprié dans lequel les antigènes peuvent être chargés pour la reconnaissance par les lymphocytes
- mastocyte
- leucocyte qui produit des molécules inflammatoires, comme l'histamine, en réponse à de gros agents pathogènes et allergènes
- monocyte
- type de globule blanc qui circule dans le sang et la lymphe et qui se différencie en macrophages après avoir pénétré dans les tissus infectés
- cellule tueuse naturelle (NK)
- lymphocyte capable de tuer les cellules infectées par des virus ou des cellules tumorales
- neutrophile
- leucocyte phagocytaire qui engloutit et digère les agents pathogènes
- personnalisation
- procédé qui améliore la phagocytose à l'aide de protéines pour indiquer la présence d'un agent pathogène aux cellules phagocytaires
- modèle moléculaire associé aux agents pathogènes (PAMP)
- « signature » des glucides, des polypeptides et des acides nucléiques qui est exprimée par les virus, les bactéries et les parasites, mais qui diffère des molécules présentes sur les cellules hôtes
- récepteur de reconnaissance de formes (PRR)
- molécule sur les macrophages et les cellules dendritiques qui lie les signatures moléculaires des agents pathogènes et favorise l'engloutissement et la destruction des agents pathogènes
- perforant
- protéine destructrice qui crée un pore dans la cellule cible ; utilisée par les cellules NK et les lymphocytes T tueurs
- Cellules T
- lymphocyte qui arrive à maturité dans le thymus ; l'une des principales cellules impliquées dans le système immunitaire adaptatif


