42.3 : Anticorps
- Page ID
- 189367
Compétences à développer
- Expliquer la réactivité croisée
- Décrire la structure et la fonction des anticorps
- Discuter de la
Un anticorps, également connu sous le nom d'immunoglobuline (Ig), est une protéine produite par les plasmocytes après stimulation par un antigène. Les anticorps constituent la base fonctionnelle de l'immunité humorale. Les anticorps sont présents dans le sang, dans les sécrétions gastriques et muqueuses et dans le lait maternel. Les anticorps contenus dans ces fluides corporels peuvent se lier aux agents pathogènes et marquer leur destruction par les phagocytes avant qu'ils n'infectent les cellules.
Structure des anticorps
Une molécule d'anticorps est composée de quatre polypeptides : deux chaînes lourdes identiques (grandes unités peptidiques) partiellement liées l'une à l'autre selon une formation en « Y », qui sont flanquées de deux chaînes légères identiques (petites unités peptidiques), comme illustré à la figure\(\PageIndex{1}\). Les liaisons entre les acides aminés de la cystéine dans la molécule d'anticorps fixent les polypeptides les uns aux autres. Les zones où l'antigène est reconnu sur l'anticorps sont des domaines variables et la base d'anticorps est composée de domaines constants.
Dans les lymphocytes B de la lignée germinale, la région variable du gène de la chaîne légère comporte 40 segments variables (V) et cinq segments jointifs (J). Une enzyme appelée ADN recombinase élimine de manière aléatoire la plupart de ces segments du gène et sépare un segment V en un segment J. Pendant le traitement de l'ARN, tous les segments V et J sauf un sont épissés. La recombinaison et l'épissage peuvent donner lieu à plus de 10 à 6 combinaisons VJ possibles. Par conséquent, chaque lymphocyte B différencié du corps humain possède généralement une chaîne variable unique. Le domaine constant, qui ne lie pas les anticorps, est le même pour tous les anticorps.
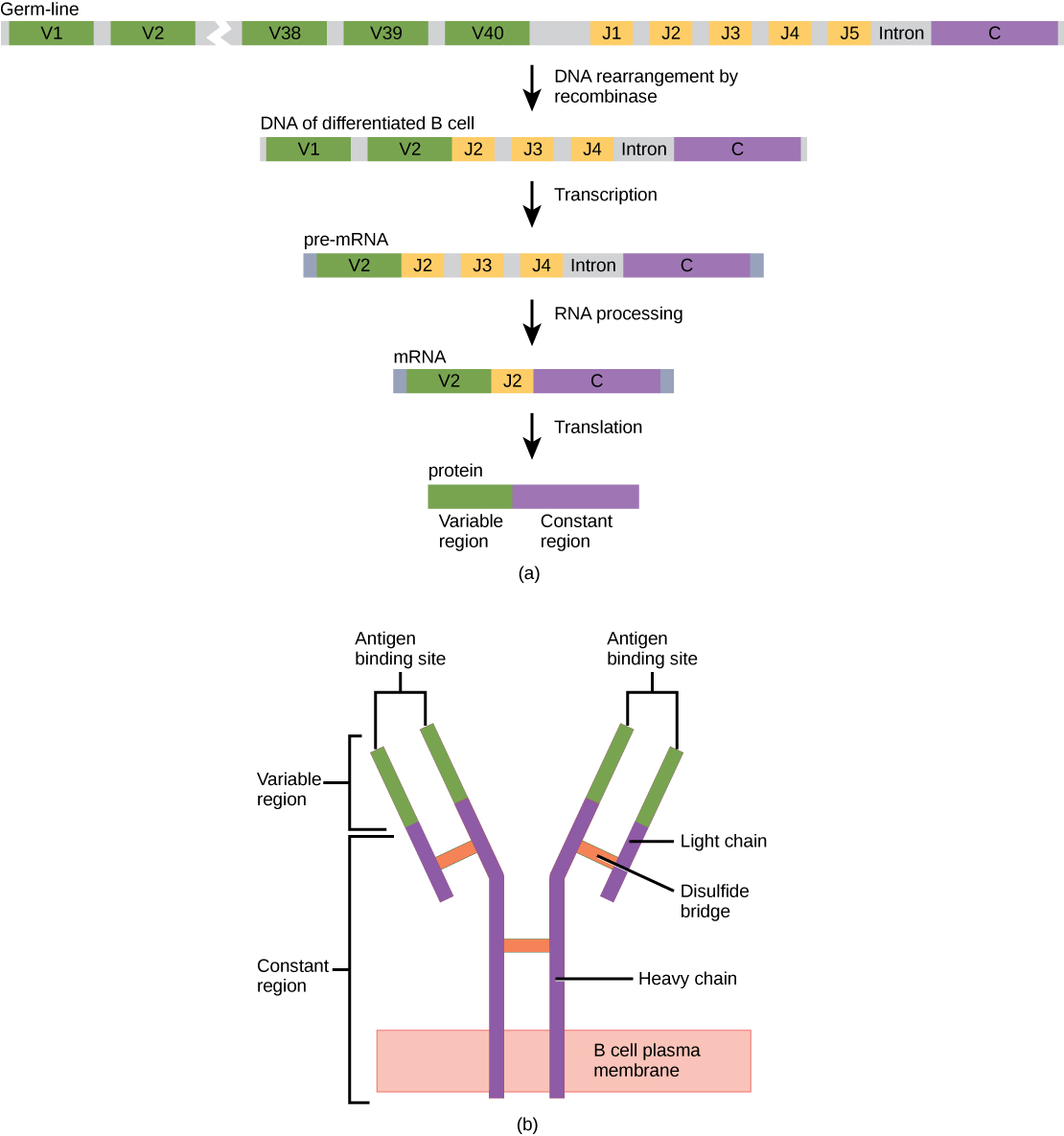
À l'instar des TCR et des BCR, la diversité des anticorps est produite par la mutation et la recombinaison d'environ 300 segments géniques différents codant les domaines variables des chaînes légères et lourdes dans des cellules précurseurs destinées à devenir des lymphocytes B. Les domaines variables des chaînes lourdes et légères interagissent pour former le site de liaison par lequel un anticorps peut se lier à un épitope spécifique sur un antigène. Le nombre de domaines constants répétés dans les classes Ig est le même pour tous les anticorps correspondant à une classe spécifique. Les anticorps sont structurellement similaires à la composante extracellulaire des BCR, et la maturation des lymphocytes B en plasmocytes peut être visualisée en termes simples à mesure que la cellule acquiert la capacité de sécréter la partie extracellulaire de son BCR en grande quantité.
Classes d'anticorps
Les anticorps peuvent être divisés en cinq classes : IgM, IgG, IgA, IgD, IgE, en fonction de leurs propriétés physicochimiques, structurales et immunologiques. Les IgG, qui constituent environ 80 % de tous les anticorps, possèdent des chaînes lourdes composées d'un domaine variable et de trois domaines constants identiques. Les IgA et les IgD ont également trois domaines constants par chaîne lourde, tandis que les IgM et les IgE ont chacune quatre domaines constants par chaîne lourde. Le domaine variable détermine la spécificité de liaison et le domaine constant de la chaîne lourde détermine le mécanisme d'action immunologique de la classe d'anticorps correspondante. Il est possible que deux anticorps aient les mêmes spécificités de liaison mais appartiennent à des classes différentes et, par conséquent, soient impliqués dans des fonctions différentes.
Une fois qu'une défense adaptative est produite contre un agent pathogène, les plasmocytes sécrètent généralement d'abord des IgM dans le sang. Les BCR des lymphocytes B naïfs appartiennent à la classe IgM et parfois à la classe IgD. Les molécules d'IgM constituent environ dix pour cent de tous les anticorps. Avant la sécrétion d'anticorps, les plasmocytes assemblent les molécules d'IgM en pentamères (cinq anticorps individuels) liés par une chaîne de jonction (J), comme le montre la figure\(\PageIndex{1}\). L'arrangement des pentamères signifie que ces macromolécules peuvent se lier à dix antigènes identiques. Cependant, les molécules d'IgM libérées au début de la réponse immunitaire adaptative ne se lient pas aux antigènes de manière aussi stable que les IgG, qui constituent l'un des types possibles d'anticorps sécrétés en grande quantité lors d'une réexposition au même pathogène. La figure\(\PageIndex{2}\) résume les propriétés des immunoglobulines et illustre leurs structures de base.
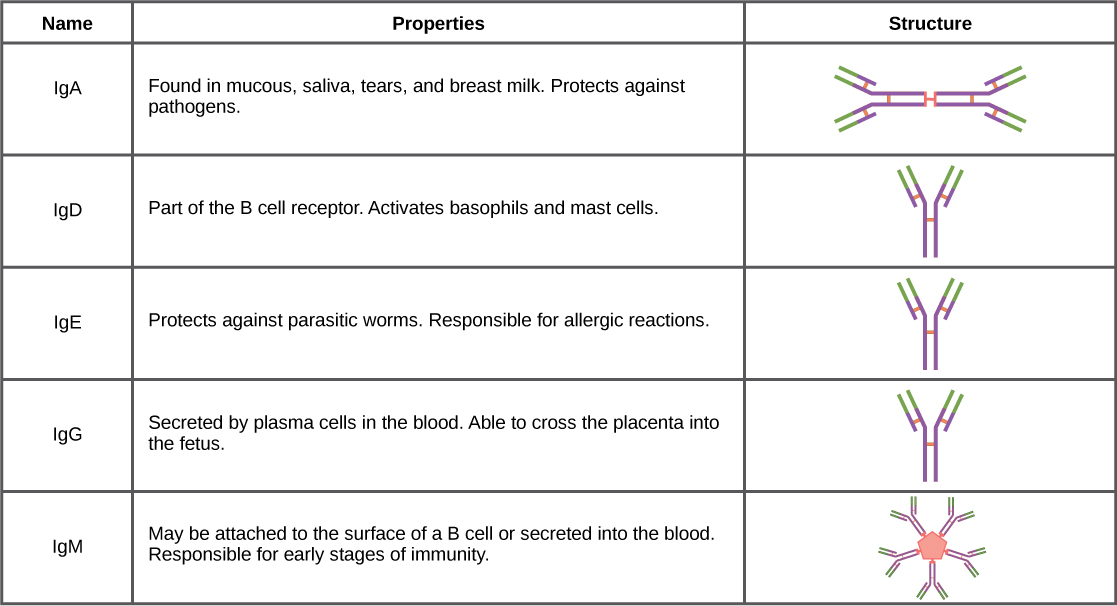
Les IgA peuplent la salive, les larmes, le lait maternel et les sécrétions de mucus des voies gastro-intestinales, respiratoires et génito-urinaires. Ensemble, ces fluides corporels recouvrent et protègent la vaste muqueuse (4 000 pieds carrés chez l'homme). Le nombre total de molécules d'IgA dans ces sécrétions corporelles est supérieur au nombre de molécules d'IgG dans le sérum sanguin. Une petite quantité d'IgA est également sécrétée dans le sérum sous forme monomère. À l'inverse, certaines IgM sont sécrétées dans les fluides corporels de la muqueuse. Comme les IgM, les molécules d'IgA sont sécrétées sous forme de structures polymères liées à une chaîne J. Cependant, les IgA sont sécrétés principalement sous forme de molécules dimères, et non sous forme de pentamères.
L'IgE est présente dans le sérum en petites quantités et se caractérise mieux par son rôle de médiateur des allergies. L'IgD est également présente en petites quantités. Comme les IgM, les BCR de la classe des IgD se trouvent à la surface des lymphocytes B naïfs. Cette classe soutient la reconnaissance antigénique et la maturation des lymphocytes B en plasmocytes.
Fonctions des anticorps
Les plasmocytes différenciés jouent un rôle crucial dans la réponse humorale, et les anticorps qu'ils sécrètent sont particulièrement importants contre les agents pathogènes et les toxines extracellulaires. Les anticorps circulent librement et agissent indépendamment des plasmocytes. Les anticorps peuvent être transférés d'un individu à un autre pour se protéger temporairement contre les maladies infectieuses. Par exemple, une personne qui a récemment produit une réponse immunitaire efficace contre un agent pathogène particulier peut donner du sang à un receveur non immunisé et conférer une immunité temporaire grâce à la présence d'anticorps dans le sérum sanguin du donneur. Ce phénomène est appelé immunité passive ; il se produit également naturellement pendant l'allaitement, ce qui rend les nourrissons allaités très résistants aux infections au cours des premiers mois de vie.
Les anticorps recouvrent les agents pathogènes extracellulaires et les neutralisent, comme l'illustre la figure\(\PageIndex{3}\), en bloquant les sites clés du pathogène qui augmentent leur infectiosité (tels que les récepteurs qui « ancrent » les agents pathogènes sur les cellules hôtes). La neutralisation des anticorps peut empêcher les agents pathogènes de pénétrer dans les cellules hôtes et de les infecter, contrairement à l'approche médiée par le CTL qui consiste à tuer les cellules déjà infectées pour empêcher la progression d'une infection établie. Les agents pathogènes neutralisés recouverts d'anticorps peuvent ensuite être filtrés par la rate et éliminés dans l'urine ou les matières fécales.
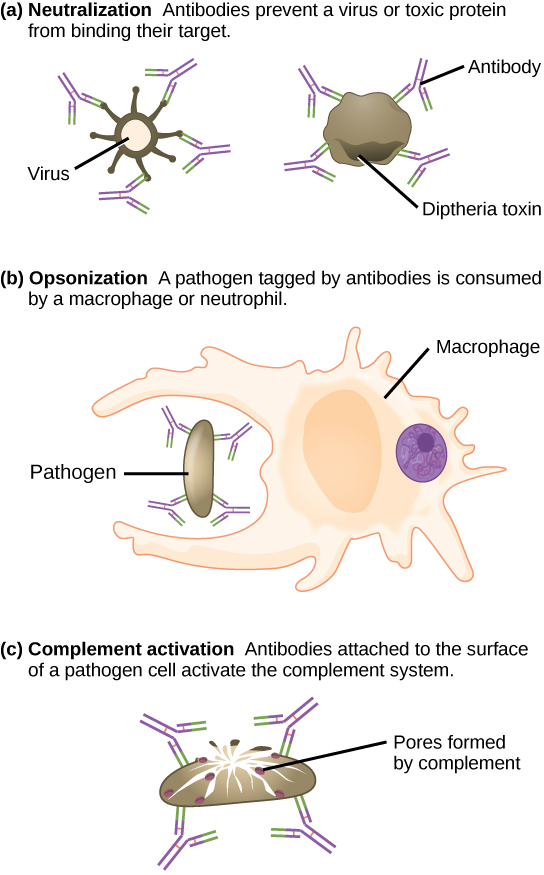
Les anticorps marquent également les agents pathogènes destinés à être détruits par les cellules phagocytaires, telles que les macrophages ou les neutrophiles, car les cellules phagocytaires sont très attirées par les macromolécules complexées avec des anticorps. L'augmentation phagocytaire par des anticorps est appelée opsonisation. Dans le cadre d'un processus appelé fixation du complément, les IgM et les IgG présentes dans le sérum se lient aux antigènes et fournissent des sites d'ancrage sur lesquels les protéines séquentielles du complément peuvent se lier. La combinaison d'anticorps et de complément améliore encore l'opsonisation et favorise l'élimination rapide des agents pathogènes.
Affinité, avidité et réactivité croisée
Les anticorps ne se lient pas tous avec la même force, la même spécificité et la même stabilité. En fait, les anticorps présentent différentes affinités (attraction) en fonction de la complémentarité moléculaire entre les molécules d'antigène et d'anticorps, comme l'illustre la Figure\(\PageIndex{4}\). Un anticorps ayant une affinité plus élevée pour un antigène particulier se lierait de manière plus forte et plus stable, et devrait donc présenter une défense plus difficile contre le pathogène correspondant à l'antigène spécifique.
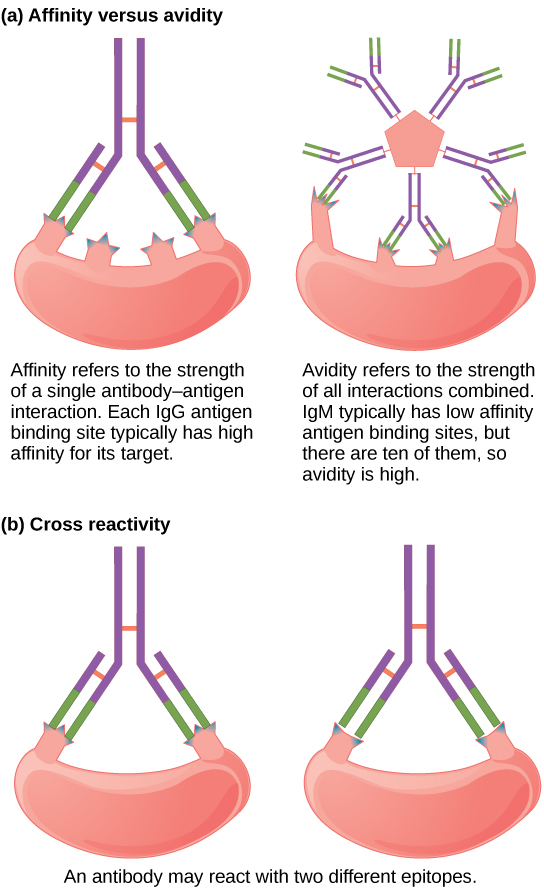
Le terme avidité décrit la liaison par des classes d'anticorps sécrétées sous forme de structures multivalentes jointes (telles que les IgM et les IgA). Bien que l'avidité mesure la force de liaison, tout comme l'affinité, l'avidité n'est pas simplement la somme des affinités des anticorps dans une structure multimère. L'avidité dépend du nombre de sites de liaison identiques sur l'antigène détecté, ainsi que d'autres facteurs physiques et chimiques. Généralement, les anticorps multimères, tels que les IgM pentamériques, sont classés comme ayant une affinité plus faible que les anticorps monomères, mais une avidité élevée. Essentiellement, le fait que les anticorps multimères puissent se lier à de nombreux antigènes simultanément équilibre leur force de liaison légèrement plus faible pour chaque interaction anticorps/antigène.
Les anticorps sécrétés après liaison à un épitope d'un antigène peuvent présenter une réactivité croisée pour des épitopes identiques ou similaires sur différents antigènes. Comme un épitope correspond à une si petite région (la surface d'environ quatre à six acides aminés), il est possible que différentes macromolécules présentent les mêmes identités moléculaires et les mêmes orientations sur de courtes régions. La réactivité croisée décrit le fait qu'un anticorps se lie non pas à l'antigène qui a provoqué sa synthèse et sa sécrétion, mais à un antigène différent.
La réactivité croisée peut être bénéfique si une personne développe une immunité contre plusieurs agents pathogènes apparentés alors qu'elle n'a été exposée qu'à l'un d'entre eux ou vaccinée contre celui-ci. Par exemple, la réactivité croisée des anticorps peut se produire contre les structures de surface similaires de diverses bactéries à Gram négatif. À l'inverse, les anticorps produits contre des composants moléculaires pathogènes qui ressemblent à des molécules autonomes peuvent marquer incorrectement les cellules hôtes en vue de leur destruction et provoquer des dommages auto-immuns. Les patients qui développent un lupus érythémateux disséminé (LED) présentent généralement des anticorps qui réagissent avec leur propre ADN. Ces anticorps peuvent avoir été initialement produits contre l'acide nucléique des microorganismes, puis avoir réagi de manière croisée avec des auto-antigènes. Ce phénomène est également appelé mimétisme moléculaire.
Anticorps du système immunitaire des muqueuses
Les anticorps synthétisés par le système immunitaire des muqueuses comprennent les IgA et les IgM. Les lymphocytes B activés se différencient en plasmocytes des muqueuses qui synthétisent et sécrètent des IgA dimères et, dans une moindre mesure, des IgM pentamériques. Les IgA sécrétées sont abondantes dans les larmes, la salive, le lait maternel et dans les sécrétions des voies gastro-intestinales et respiratoires. La sécrétion d'anticorps entraîne une réponse humorale locale au niveau des surfaces épithéliales et prévient l'infection de la muqueuse en liant et en neutralisant les agents pathogènes.
Résumé
Les anticorps (immunoglobulines) sont les molécules sécrétées par les plasmocytes qui médient la réponse immunitaire humorale. Il existe cinq classes d'anticorps ; la classe d'un anticorps détermine son mécanisme d'action et son site de production mais ne contrôle pas sa spécificité de liaison. Les anticorps se lient aux antigènes via des domaines variables et peuvent soit neutraliser les agents pathogènes, soit les marquer pour la phagocytose, soit activer la cascade du complément.
Lexique
- affinité
- attraction de la complémentarité moléculaire entre les molécules d'antigène et d'anticorps
- anticorps
- protéine produite par les plasmocytes après stimulation par un antigène ; également appelée immunoglobuline
- avidité
- force de liaison totale d'un anticorps multivalent avec un antigène
- réactivité croisée
- liaison d'un anticorps à un épitope correspondant à un antigène différent de celui contre lequel l'anticorps a été produit
- immunité passive
- transfert d'anticorps d'un individu à un autre pour fournir une protection temporaire contre les agents pathogènes


