35.2 : Comment les neurones communiquent
- Page ID
- 189615
Compétences à développer
- Décrire la base du potentiel de la membrane au repos
- Expliquer les étapes d'un potentiel d'action et la manière dont les potentiels d'action se propagent
- Expliquer les similitudes et les différences entre les synapses chimiques et électriques
- Décrire la potentialisation et la dépression à long terme
Toutes les fonctions du système nerveux, qu'il s'agisse d'un simple réflexe moteur ou de fonctions plus avancées comme la mémorisation ou la prise de décisions, nécessitent que les neurones communiquent entre eux. Alors que les humains utilisent les mots et le langage corporel pour communiquer, les neurones utilisent des signaux électriques et chimiques. Tout comme un membre d'un comité, un neurone reçoit et synthétise généralement les messages de plusieurs autres neurones avant de « prendre la décision » d'envoyer le message à d'autres neurones.
Transmission de l'influx nerveux dans un neurone
Pour que le système nerveux fonctionne, les neurones doivent pouvoir envoyer et recevoir des signaux. Ces signaux sont possibles parce que chaque neurone possède une membrane cellulaire chargée (différence de tension entre l'intérieur et l'extérieur), et la charge de cette membrane peut changer en réponse à des molécules de neurotransmetteurs libérées par d'autres neurones et à des stimuli environnementaux. Pour comprendre comment les neurones communiquent, il faut d'abord comprendre la base de la charge membranaire de base ou « au repos ».
Membranes chargées neuronales
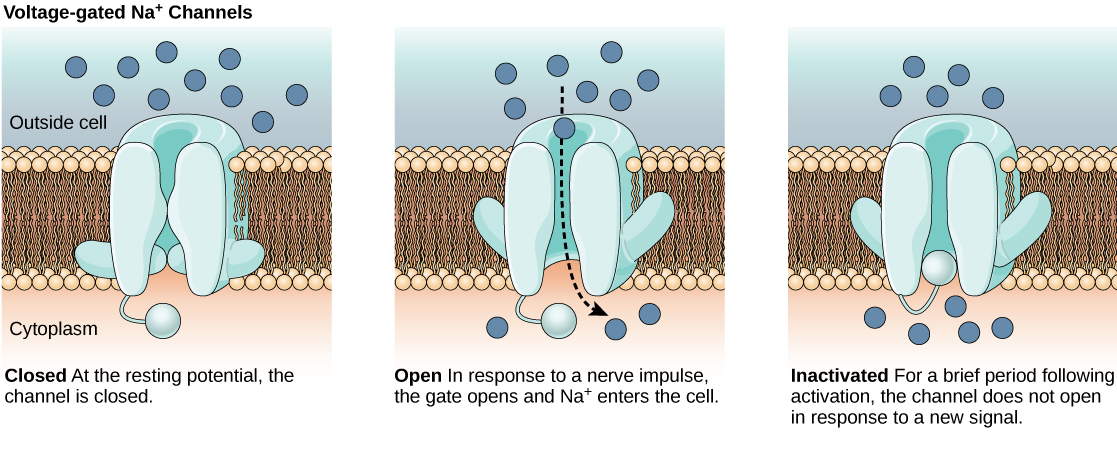
La membrane bicouche lipidique qui entoure un neurone est imperméable aux molécules ou aux ions chargés. Pour entrer dans le neurone ou en sortir, les ions doivent traverser des protéines spéciales appelées canaux ioniques qui traversent la membrane. Les canaux ioniques ont différentes configurations : ouverts, fermés et inactifs, comme illustré sur la figure\(\PageIndex{1}\). Certains canaux ioniques doivent être activés pour s'ouvrir et permettre aux ions de passer à l'intérieur ou à l'extérieur de la cellule. Ces canaux ioniques sont sensibles à l'environnement et peuvent changer de forme en conséquence. Les canaux ioniques qui changent de structure en réponse aux variations de tension sont appelés canaux ioniques dépendants de la tension. Les canaux ioniques dépendants de la tension régulent les concentrations relatives des différents ions à l'intérieur et à l'extérieur de la cellule. La différence de charge totale entre l'intérieur et l'extérieur de la cellule est appelée potentiel de membrane.
Lien vers l'apprentissage
Cette vidéo explique la base du potentiel de la membrane au repos.
Potentiel membranaire
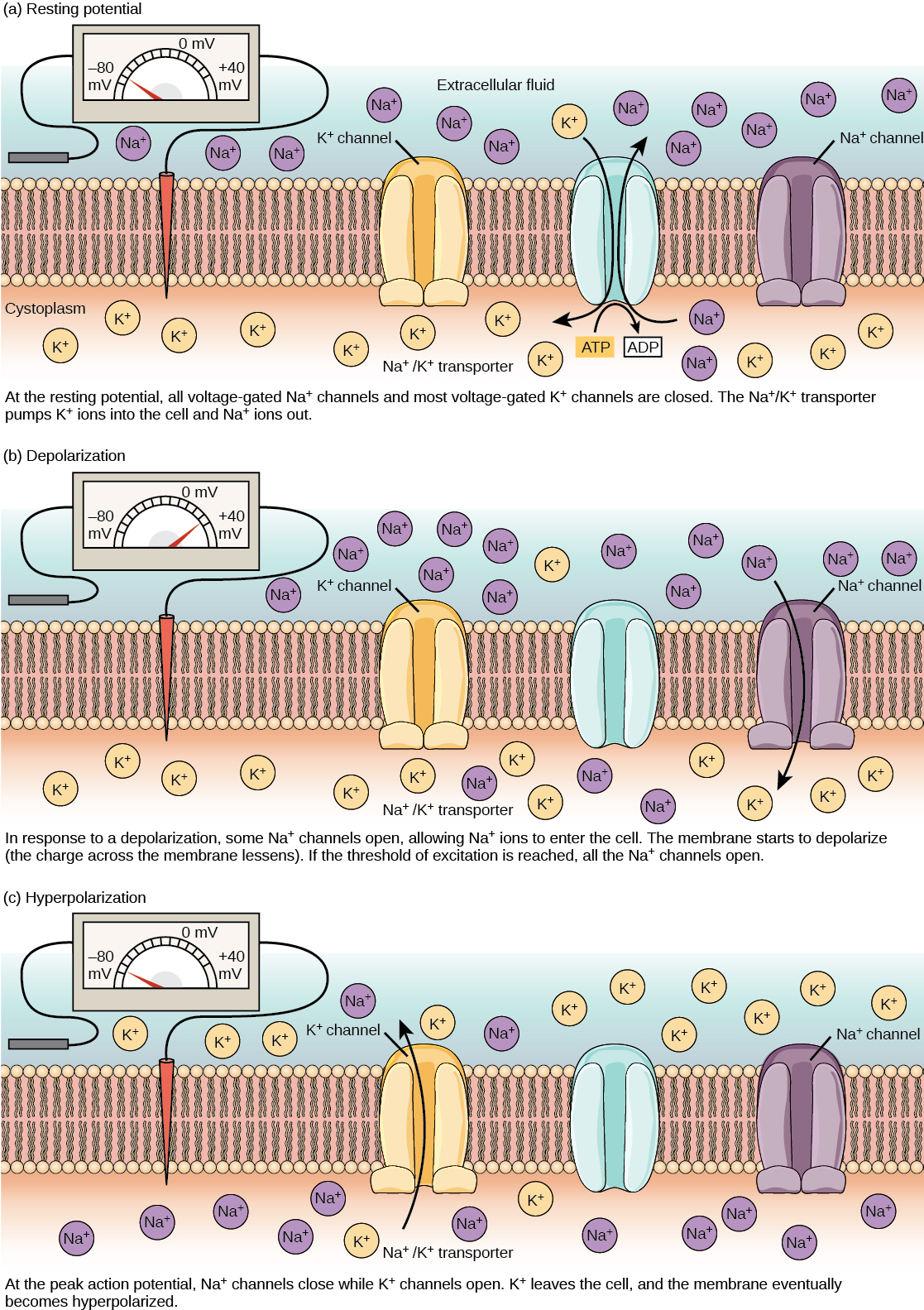
Un neurone au repos est chargé négativement : l'intérieur d'une cellule est environ 70 millivolts plus négatif que l'extérieur (−70 mV, notez que ce nombre varie selon le type de neurone et l'espèce). Cette tension est appelée potentiel de la membrane au repos ; elle est causée par les différences de concentration d'ions à l'intérieur et à l'extérieur de la cellule. Si la membrane était également perméable à tous les ions, chaque type d'ion traverserait la membrane et le système atteindrait l'équilibre. Comme les ions ne peuvent pas simplement traverser la membrane à volonté, il existe différentes concentrations de plusieurs ions à l'intérieur et à l'extérieur de la cellule, comme le montre le tableau ci-dessous. La différence entre le nombre d'ions potassium chargés positivement (K +) à l'intérieur et à l'extérieur de la cellule domine le potentiel de la membrane au repos (Figure\(\PageIndex{2}\)). Lorsque la membrane est au repos, les ions K + s'accumulent à l'intérieur de la cellule en raison d'un mouvement net avec le gradient de concentration. Le potentiel négatif de la membrane au repos est créé et maintenu en augmentant la concentration de cations à l'extérieur de la cellule (dans le liquide extracellulaire) par rapport à l'intérieur de la cellule (dans le cytoplasme). La charge négative à l'intérieur de la cellule est créée par le fait que la membrane cellulaire est plus perméable au mouvement des ions potassium qu'au mouvement des ions sodium. Dans les neurones, les ions potassium sont maintenus à des concentrations élevées à l'intérieur de la cellule, tandis que les ions sodium sont maintenus à des concentrations élevées à l'extérieur de la cellule. La cellule possède des canaux de fuite de potassium et de sodium qui permettent aux deux cations de se diffuser le long de leur gradient de concentration. Cependant, les neurones ont beaucoup plus de canaux de fuite de potassium que de canaux de fuite de sodium. Par conséquent, le potassium se diffuse à l'extérieur de la cellule beaucoup plus rapidement que le sodium ne s'y infiltre. Comme plus de cations quittent la cellule qu'ils n'entrent, cela entraîne une charge négative de l'intérieur de la cellule par rapport à l'extérieur de la cellule. Les actions de la pompe sodium-potassium aident à maintenir le potentiel de repos, une fois établi. Rappelons que les pompes sodium-potassium introduisent deux ions K + dans la cellule tout en éliminant trois ions Na + par ATP consommé. Comme plus de cations sont expulsés de la cellule qu'ils n'en absorbent, l'intérieur de la cellule reste chargé négativement par rapport au liquide extracellulaire. Il convient de noter que les ions calcium (Cl —) ont tendance à s'accumuler à l'extérieur de la cellule parce qu'ils sont repoussés par des protéines chargées négativement dans le cytoplasme.
| Ion | Concentration extracellulaire (mM) | Concentration intracellulaire (mM) | Rapport extérieur/intérieur |
|---|---|---|---|
| Na + | 145 | 12 | 12 |
| K + | 4 | 155 | 0,026 |
| Cl − | 120 | 4 | 30 |
| Anions organiques (A−) | — | 100 |
Possibilité d'action
Un neurone peut recevoir l'entrée d'autres neurones et, si cette entrée est suffisamment forte, envoyer le signal aux neurones situés en aval. La transmission d'un signal entre les neurones est généralement assurée par une substance chimique appelée neurotransmetteur. La transmission d'un signal à l'intérieur d'un neurone (de la dendrite à l'extrémité axonale) s'effectue par une brève inversion du potentiel de la membrane au repos appelée potentiel d'action. Lorsque des molécules de neurotransmetteurs se lient à des récepteurs situés sur les dendrites d'un neurone, des canaux ioniques s'ouvrent. Au niveau des synapses excitatrices, cette ouverture permet aux ions positifs de pénétrer dans le neurone et entraîne une dépolarisation de la membrane, c'est-à-dire une diminution de la différence de tension entre l'intérieur et l'extérieur du neurone. Un stimulus provenant d'une cellule sensorielle ou d'un autre neurone dépolarise le neurone cible jusqu'à son potentiel seuil (-55 mV). Les canaux Na + de la butte axonale s'ouvrent, permettant aux ions positifs de pénétrer dans la cellule (Figure\(\PageIndex{3}\) et Figure\(\PageIndex{4}\)). Une fois les canaux sodiques ouverts, le neurone se dépolarise complètement jusqu'à un potentiel membranaire d'environ +40 mV. Les potentiels d'action sont considérés comme un événement « tout ou rien », en ce sens que, une fois que le potentiel seuil est atteint, le neurone se dépolarise toujours complètement. Une fois la dépolarisation terminée, la cellule doit maintenant « remettre » la tension de sa membrane au potentiel de repos. Pour ce faire, les canaux Na + se ferment et ne peuvent pas être ouverts. Cela marque le début de la période réfractaire du neurone, au cours de laquelle il ne peut pas produire d'autre potentiel d'action car ses canaux sodiques ne s'ouvrent pas. En même temps, les canaux K + dépendants de la tension s'ouvrent, permettant à K + de quitter la cellule. Lorsque les ions K + quittent la cellule, le potentiel de la membrane redevient négatif. La diffusion de K + hors de la cellule hyperpolarise en fait la cellule, en ce sens que le potentiel de membrane devient plus négatif que le potentiel de repos normal de la cellule. À ce stade, les canaux sodiques reprennent leur état de repos, ce qui signifie qu'ils sont prêts à s'ouvrir à nouveau si le potentiel de la membrane dépasse à nouveau le potentiel seuil. Finalement, les ions K + supplémentaires se diffusent hors de la cellule par les canaux de fuite de potassium, ramenant la cellule de son état hyperpolarisé à son potentiel de membrane de repos.
Connexion artistique
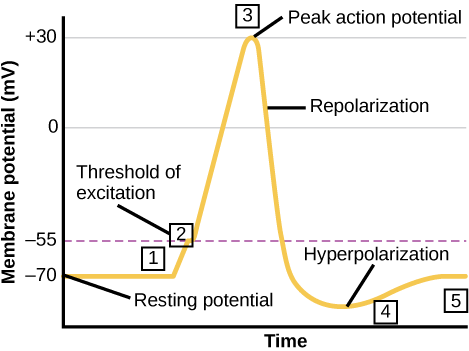
Les inhibiteurs des canaux potassiques, tels que l'amiodarone et le procaïnamide, utilisés pour traiter l'activité électrique anormale du cœur, appelée dysrythmie cardiaque, entravent le mouvement du K + à travers les canaux K+ dépendants de la tension. Sur quelle partie du potentiel d'action pensez-vous que les canaux potassiques devraient affecter ?
Lien vers l'apprentissage
Cette vidéo présente un aperçu du potentiel d'action.
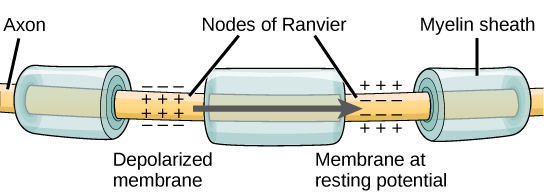
La myéline et la propagation du potentiel d'action
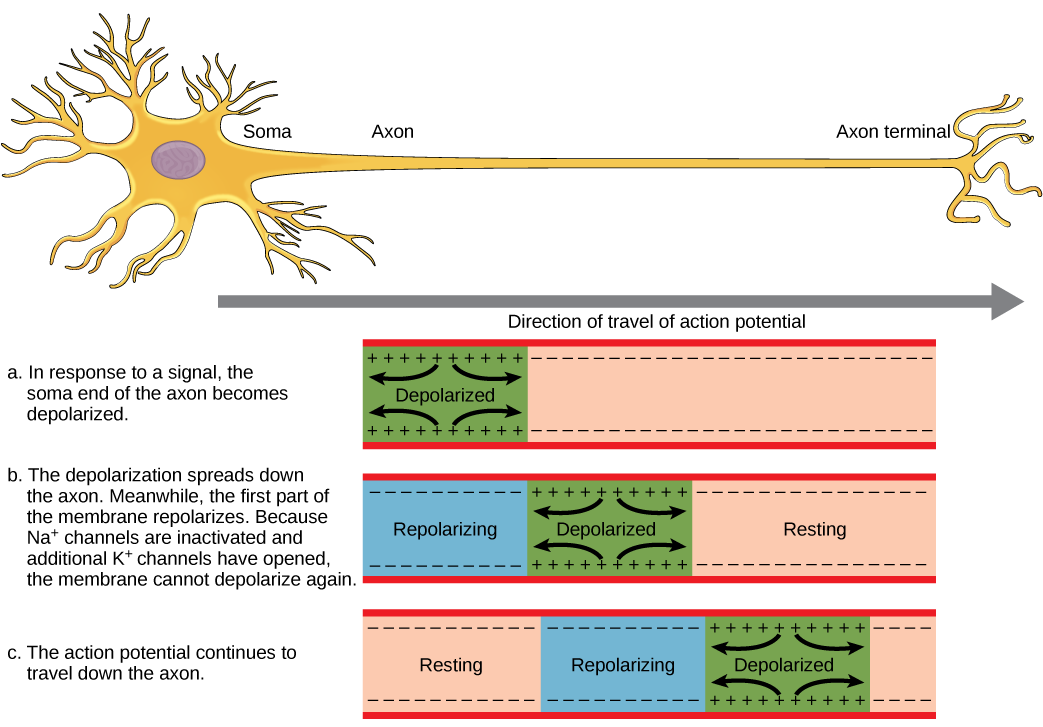
Pour qu'un potentiel d'action communique des informations à un autre neurone, celui-ci doit se déplacer le long de l'axone et atteindre les terminaisons axonales où il peut déclencher la libération des neurotransmetteurs. La vitesse de conduction d'un potentiel d'action le long d'un axone est influencée à la fois par le diamètre de l'axone et par la résistance de l'axone aux fuites de courant. La myéline agit comme un isolant qui empêche le courant de quitter l'axone ; cela augmente la vitesse d'action (conduction potentielle). Dans les maladies démyélinisantes comme la sclérose en plaques, la conduction du potentiel d'action ralentit en raison des fuites de courant provenant de zones axonales précédemment isolées. Les nœuds de Ranvier, illustrés sur la figure,\(\PageIndex{5}\) sont des interstices dans la gaine de myéline le long de l'axone. Ces espaces non myélinisés mesurent environ un micromètre de long et contiennent des canaux Na + et K + dépendants de la tension. Le flux d'ions à travers ces canaux, en particulier les canaux Na +, régénère le potentiel d'action à plusieurs reprises le long de l'axone. Ce « saut » du potentiel d'action d'un nœud à l'autre est appelé conduction saltatoire. Si aucun nœud de Ranvier n'était présent le long d'un axone, le potentiel d'action se propagerait très lentement puisque les canaux Na + et K + devraient régénérer continuellement les potentiels d'action en tout point le long de l'axone plutôt qu'en des points spécifiques. Les nœuds de Ranvier permettent également d'économiser de l'énergie pour le neurone, car les canaux ne doivent être présents que sur les nœuds et non sur tout l'axone.
Transmission synaptique
La synapse ou « lacune » est l'endroit où l'information est transmise d'un neurone à un autre. Les synapses se forment généralement entre les terminaisons axonales et les épines dendritiques, mais cela n'est pas universellement vrai. Il existe également des synapses corporelles axon-axone, dendrite-dendrite et axon-cellule. Le neurone qui transmet le signal est appelé neurone présynaptique, et le neurone qui reçoit le signal est appelé neurone postsynaptique. Notez que ces désignations se rapportent à une synapse particulière : la plupart des neurones sont à la fois présynaptiques et postsynaptiques. Il existe deux types de synapses : chimiques et électriques.
Synapse chimique
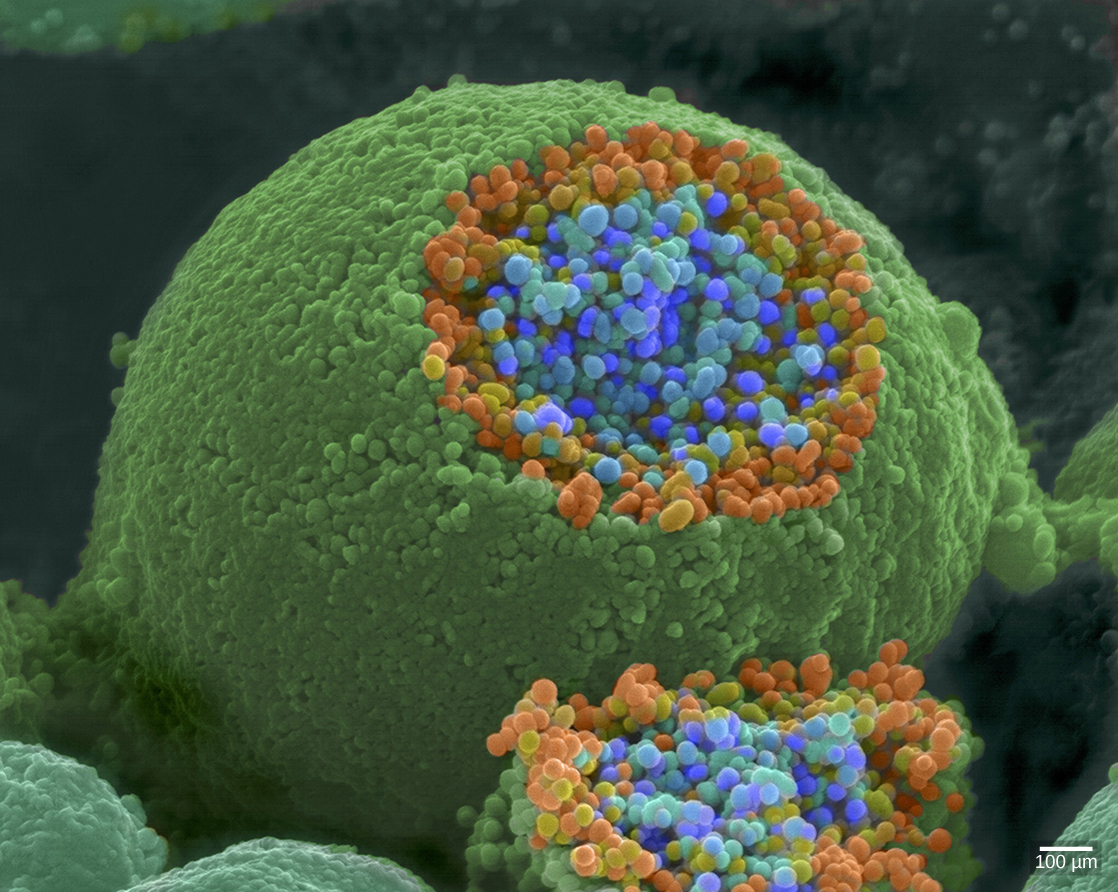
Lorsqu'un potentiel d'action atteint la borne axonale, il dépolarise la membrane et ouvre des canaux Na + dépendants de la tension. Les ions Na + pénètrent dans la cellule, dépolarisant davantage la membrane présynaptique. Cette dépolarisation provoque l'ouverture de canaux Ca 2+ dépendants de la tension. Les ions calcium qui pénètrent dans la cellule déclenchent une cascade de signalisation qui provoque la fusion de petites vésicules liées à la membrane, appelées vésicules synaptiques, contenant des molécules de neurotransmetteurs avec la membrane présynaptique. Les vésicules synaptiques sont illustrées sur la figure\(\PageIndex{6}\), qui est une image d'un microscope électronique à balayage.
La fusion d'une vésicule avec la membrane présynaptique provoque la libération d'un neurotransmetteur dans la fente synaptique, l'espace extracellulaire entre les membranes présynaptique et postsynaptique, comme illustré à la figure\(\PageIndex{7}\). Le neurotransmetteur diffuse à travers la fente synaptique et se lie aux protéines réceptrices de la membrane postsynaptique.
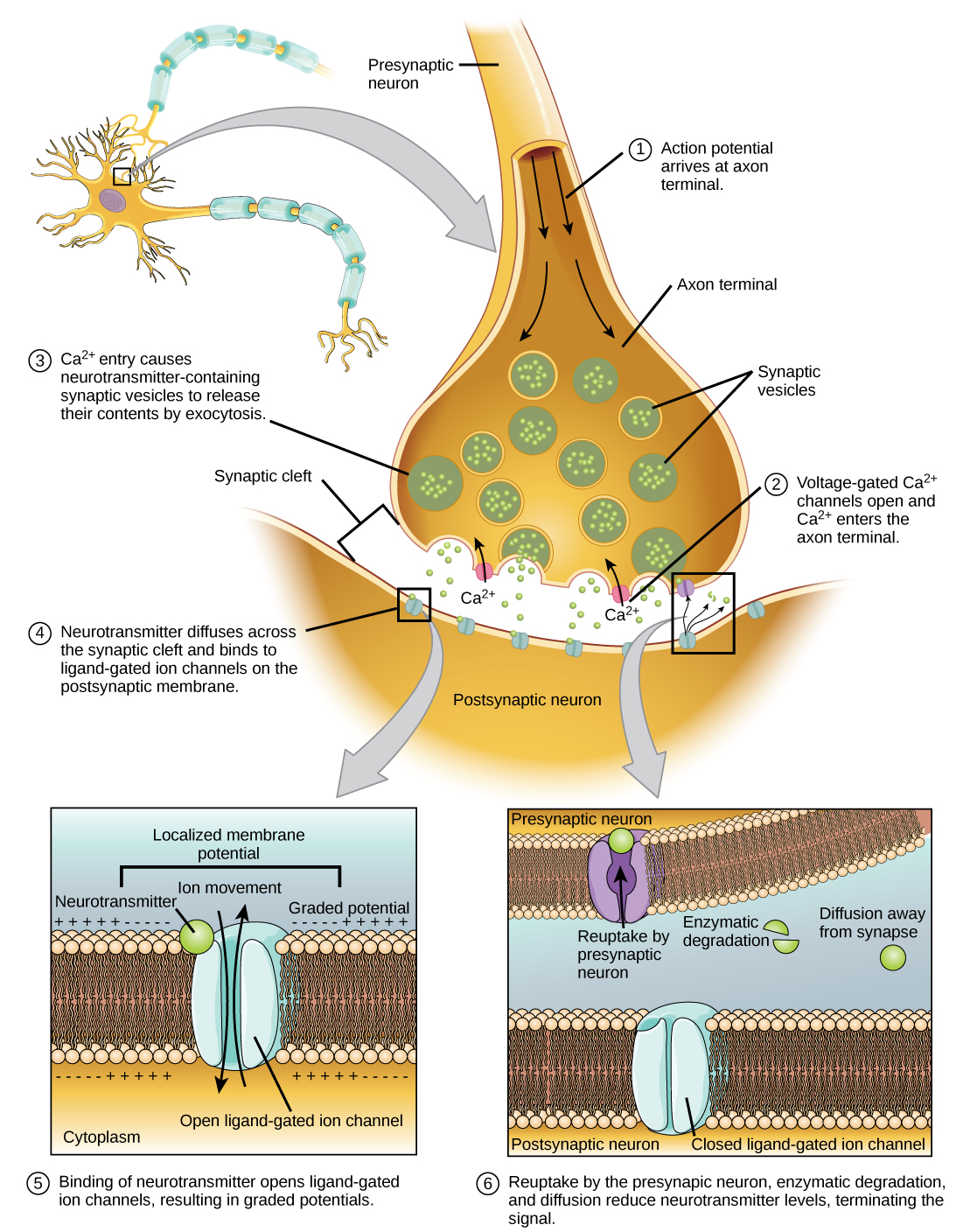
La liaison d'un neurotransmetteur spécifique provoque l'ouverture de certains canaux ioniques, en l'occurrence des canaux dépendants des ligands, sur la membrane postsynaptique. Les neurotransmetteurs peuvent avoir des effets excitateurs ou inhibiteurs sur la membrane postsynaptique, comme indiqué dans le tableau ci-dessous. Par exemple, lorsque l'acétylcholine est libérée au niveau de la synapse entre un nerf et un muscle (appelée jonction neuromusculaire) par un neurone présynaptique, elle provoque l'ouverture de canaux Na+ postsynaptiques. Le Na + pénètre dans la cellule postsynaptique et provoque la dépolarisation de la membrane postsynaptique. Cette dépolarisation est appelée potentiel post-synaptique excitateur (EPSP) et rend le neurone postsynaptique plus susceptible de déclencher un potentiel d'action. La libération de neurotransmetteurs au niveau des synapses inhibitrices provoque des potentiels postsynaptiques inhibiteurs (IPSP), une hyperpolarisation de la membrane présynaptique. Par exemple, lorsque le neurotransmetteur GABA (acide gamma-aminobutyrique) est libéré par un neurone présynaptique, il se lie aux canaux Cl et les ouvre. Les ions Cl pénètrent dans la cellule et hyperpolarisent la membrane, ce qui rend le neurone moins susceptible de déclencher un potentiel d'action.
Une fois la neurotransmission survenue, le neurotransmetteur doit être retiré de la fente synaptique afin que la membrane postsynaptique puisse « se réinitialiser » et être prête à recevoir un autre signal. Cela peut se faire de trois manières : le neurotransmetteur peut diffuser loin de la fente synaptique, il peut être dégradé par les enzymes présentes dans la fente synaptique ou il peut être recyclé (parfois appelé recapture) par le neurone présynaptique. Plusieurs médicaments agissent à ce stade de la neurotransmission. Par exemple, certains médicaments administrés aux patients atteints de la maladie d'Alzheimer agissent en inhibant l'acétylcholinestérase, l'enzyme qui dégrade l'acétylcholine. Cette inhibition de l'enzyme augmente essentiellement la neurotransmission au niveau des synapses qui libèrent de l'acétylcholine. Une fois libérée, l'acétylcholine reste dans la fente et peut se lier et se détacher continuellement des récepteurs postsynaptiques.
| Neurotransmetteur | Exemple | Endroit |
|---|---|---|
| Acétylcholine | — | CNS et/ou PNS |
| Amine biogénique | Dopamine, sérotonine, norépinéphrine | CNS et/ou PNS |
| Acide aminé | Glycine, glutamate, aspartate, acide gamma-aminobutyrique | SNC |
| Neuropeptide | Substance P, endorphines | CNS et/ou PNS |
Synapse électrique
Bien que les synapses électriques soient moins nombreuses que les synapses chimiques, elles sont présentes dans tous les systèmes nerveux et jouent des rôles importants et uniques. Le mode de neurotransmission dans les synapses électriques est très différent de celui des synapses chimiques. Dans une synapse électrique, les membranes présynaptique et postsynaptique sont très rapprochées et sont en fait physiquement connectées par des protéines de canal formant des jonctions lacunaires. Les jonctions lacunaires permettent au courant de passer directement d'une cellule à la suivante. Outre les ions qui transportent ce courant, d'autres molécules, comme l'ATP, peuvent diffuser à travers les pores de la jonction à grands espaces.
Il existe des différences fondamentales entre les synapses chimiques et électriques. Comme les synapses chimiques dépendent de la libération de molécules de neurotransmetteurs par les vésicules synaptiques pour transmettre leur signal, il existe un délai d'environ une milliseconde entre le moment où le potentiel axonal atteint le terminal présynaptique et le moment où le neurotransmetteur entraîne l'ouverture des canaux ioniques postsynaptiques. . De plus, cette signalisation est unidirectionnelle. La signalisation dans les synapses électriques, en revanche, est pratiquement instantanée (ce qui est important pour les synapses impliquées dans les réflexes clés), et certaines synapses électriques sont bidirectionnelles. Les synapses électriques sont également plus fiables car elles sont moins susceptibles d'être bloquées et elles sont importantes pour synchroniser l'activité électrique d'un groupe de neurones. Par exemple, on pense que les synapses électriques du thalamus régulent le sommeil lent, et la perturbation de ces synapses peut provoquer des crises d'épilepsie.
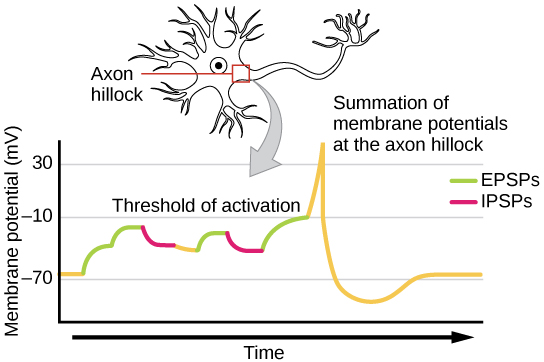
Sommation du signal
Parfois, un seul EPSP est suffisamment puissant pour induire un potentiel d'action dans le neurone postsynaptique, mais souvent, plusieurs entrées présynaptiques doivent créer des EPSP à peu près au même moment pour que le neurone postsynaptique soit suffisamment dépolarisé pour déclencher un potentiel d'action. Ce processus est appelé sommation et se produit au niveau de la butte axonale, comme illustré sur la figure\(\PageIndex{8}\). De plus, un neurone reçoit souvent des entrées provenant de nombreux neurones présynaptiques, certains excitateurs et d'autres inhibiteurs, de sorte que les IPSP peuvent annuler les ePSP et vice versa. C'est la variation nette de la tension de la membrane postsynaptique qui détermine si la cellule postsynaptique a atteint le seuil d'excitation nécessaire pour déclencher un potentiel d'action. Ensemble, la sommation synaptique et le seuil d'excitation agissent comme un filtre afin que le « bruit » aléatoire dans le système ne soit pas transmis en tant qu'information importante.
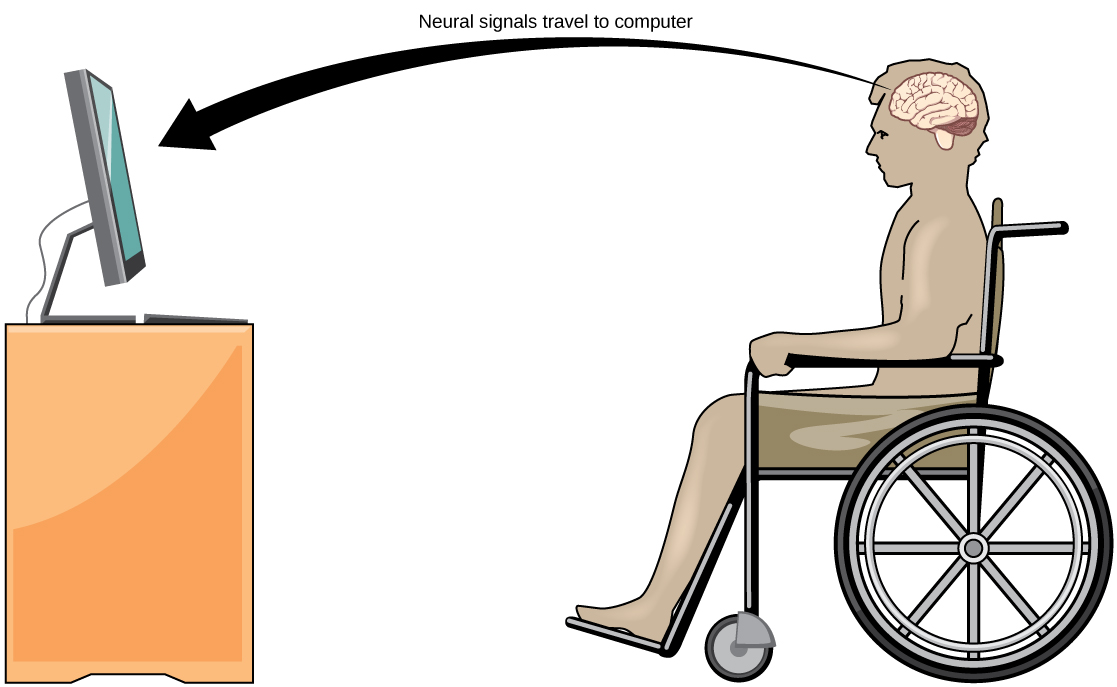
Connexion quotidienne : interface cerveau-ordinateur
La sclérose latérale amyotrophique (SLA, également appelée maladie de Lou Gehrig) est une maladie neurologique caractérisée par la dégénérescence des motoneurones qui contrôlent les mouvements volontaires. La maladie commence par un affaiblissement musculaire et un manque de coordination et finit par détruire les neurones qui contrôlent la parole, la respiration et la déglutition ; à la fin, la maladie peut entraîner une paralysie. À ce stade, les patients ont besoin de l'assistance de machines pour pouvoir respirer et communiquer. Plusieurs technologies spéciales ont été développées pour permettre aux patients « confinés » de communiquer avec le reste du monde. Une technologie, par exemple, permet aux patients de taper des phrases en secouant leur joue. Ces phrases peuvent ensuite être lues à haute voix par un ordinateur.
Un domaine de recherche relativement nouveau visant à aider les patients paralysés, y compris ceux atteints de SLA, à communiquer et à conserver un certain degré d'autonomie est appelé technologie d'interface cerveau-ordinateur (BCI) et est illustré à la figure\(\PageIndex{9}\). Cette technologie ressemble à de la science-fiction : elle permet à des patients paralysés de contrôler un ordinateur en utilisant uniquement leurs pensées. Il existe plusieurs formes de BCI. Certaines formes utilisent des enregistrements EEG à partir d'électrodes collées sur le crâne. Ces enregistrements contiennent des informations provenant de grandes populations de neurones qui peuvent être décodées par un ordinateur. D'autres formes de BCI nécessitent l'implantation d'un réseau d'électrodes plus petites qu'un timbre-poste dans la région du bras et de la main du cortex moteur. Cette forme de BCI, bien que plus invasive, est très puissante car chaque électrode peut enregistrer les potentiels d'action réels d'un ou de plusieurs neurones. Ces signaux sont ensuite envoyés à un ordinateur, qui a été entraîné à décoder le signal et à le transmettre à un outil, tel qu'un curseur sur un écran d'ordinateur. Cela signifie qu'un patient atteint de SLA peut utiliser le courrier électronique, lire Internet et communiquer avec d'autres personnes en pensant à bouger sa main ou son bras (même si le patient paralysé ne peut pas faire ce mouvement corporel). De récents progrès ont permis à une patiente paralysée enfermée qui a subi un accident vasculaire cérébral il y a 15 ans de contrôler un bras robotique et même de se donner du café à l'aide de la technologie BCI.
Malgré les avancées étonnantes de la technologie BCI, elle présente également des limites. La technologie peut nécessiter de nombreuses heures de formation et de longues périodes de concentration intense pour le patient ; elle peut également nécessiter une chirurgie du cerveau pour implanter les dispositifs.
Lien vers l'apprentissage
Regardez cette vidéo dans laquelle une femme paralysée utilise un bras robotique contrôlé par le cerveau pour apporter un verre à sa bouche, entre autres images de la technologie d'interface cerveau-ordinateur en action.
Plasticité synaptique
Les synapses ne sont pas des structures statiques. Ils peuvent être affaiblis ou renforcés. Ils peuvent être cassés et de nouvelles synapses peuvent être créées. La plasticité synaptique permet ces changements, qui sont tous nécessaires au bon fonctionnement du système nerveux. En fait, la plasticité synaptique est à la base de l'apprentissage et de la mémoire. Deux processus en particulier, la potentialisation à long terme (LTP) et la dépression à long terme (LTD) sont des formes importantes de plasticité synaptique qui se produisent dans les synapses de l'hippocampe, une région du cerveau impliquée dans le stockage des souvenirs.
Potentialisation à long terme (LTP)
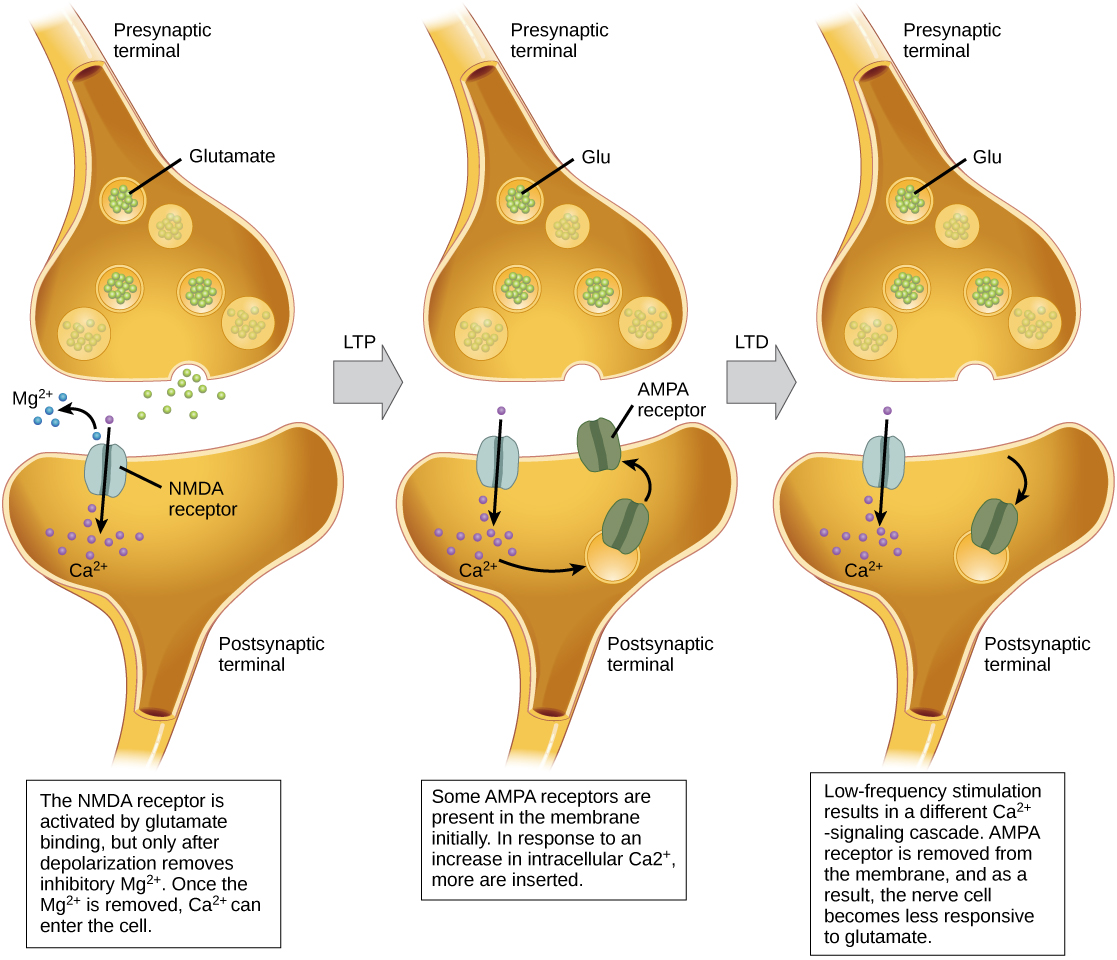
La potentialisation à long terme (LTP) est un renforcement persistant d'une connexion synaptique. Le LTP est basé sur le principe Hebbian : des cellules qui se déclenchent ensemble sont connectées entre elles. Différents mécanismes, dont aucun n'est complètement compris, sont à l'origine du renforcement synaptique observé avec la LTP. Un mécanisme connu implique un type de récepteur postsynaptique du glutamate, appelé récepteurs NMDA (N-méthyl-D-aspartate), illustré à la figure\(\PageIndex{10}\). Ces récepteurs sont normalement bloqués par des ions magnésium ; toutefois, lorsque le neurone postsynaptique est dépolarisé rapidement par de multiples entrées présynaptiques (provenant d'un neurone ou de plusieurs neurones), les ions magnésium sont expulsés, ce qui permet aux ions Ca de passer dans la cellule postsynaptique. Ensuite, les ions Ca 2+ qui pénètrent dans la cellule déclenchent une cascade de signalisation qui provoque l'insertion d'un type différent de récepteur du glutamate, appelés récepteurs AMPA (acide α-amino-3-hydroxy-5-méthyl-4-isoxazolepropionique), dans la membrane postsynaptique, puisque les récepteurs AMPA activés permettent aux ions positifs d'entrer la cellule. Ainsi, la prochaine fois que le glutamate sera libéré de la membrane présynaptique, il aura un effet excitateur plus important (EPSP) sur la cellule postsynaptique, car la liaison du glutamate à ces récepteurs AMPA permettra à un plus grand nombre d'ions positifs d'entrer dans la cellule. L'insertion de récepteurs AMPA supplémentaires renforce la synapse et signifie que le neurone postsynaptique est plus susceptible de se déclencher en réponse à la libération de neurotransmetteurs présynaptiques. Certaines drogues consommées cooptent avec la voie du LTP, et ce renforcement synaptique peut entraîner une dépendance.
Dépression à long terme (LTD)
La dépression à long terme (LTD) est essentiellement l'inverse de la LTP : il s'agit d'un affaiblissement à long terme d'une connexion synaptique. Un mécanisme connu pour provoquer la LTD implique également les récepteurs AMPA. Dans cette situation, le calcium qui entre par les récepteurs NMDA déclenche une cascade de signalisation différente, ce qui entraîne l'élimination des récepteurs AMPA de la membrane postsynaptique, comme illustré à la Figure\(\PageIndex{10}\). La diminution des récepteurs AMPA dans la membrane rend le neurone postsynaptique moins sensible au glutamate libéré par le neurone présynaptique. Bien que cela puisse sembler contre-intuitif, le LTD peut être tout aussi important pour l'apprentissage et la mémoire que le LTP. L'affaiblissement et l'élagage des synapses inutilisées entraînent la perte de connexions sans importance et rendent les synapses qui ont subi une LTP encore plus solides en comparaison.
Résumé
Les neurones ont des membranes chargées parce qu'il existe différentes concentrations d'ions à l'intérieur et à l'extérieur de la cellule. Les canaux ioniques dépendants de la tension contrôlent le mouvement des ions à l'intérieur et à l'extérieur d'un neurone. Lorsqu'une membrane neuronale est dépolarisée au moins jusqu'au seuil d'excitation, un potentiel d'action est déclenché. Le potentiel d'action se propage ensuite le long d'un axone myélinisé jusqu'aux terminaisons axonales. Dans une synapse chimique, le potentiel d'action provoque la libération de molécules de neurotransmetteurs dans la fente synaptique. En se liant aux récepteurs postsynaptiques, le neurotransmetteur peut provoquer des potentiels postsynaptiques excitateurs ou inhibiteurs en dépolarisant ou en hyperpolarisant, respectivement, la membrane postsynaptique. Dans les synapses électriques, le potentiel d'action est directement communiqué à la cellule postsynaptique par des jonctions lacunaires, c'est-à-dire des protéines à grands canaux qui relient les membranes présynaptique et postsynaptique. Les synapses ne sont pas des structures statiques et peuvent être renforcées et affaiblies. Deux mécanismes de plasticité synaptique sont la potentialisation à long terme et la dépression à long terme.
Connexions artistiques
Figure\(\PageIndex{3}\) : Les inhibiteurs des canaux potassiques, tels que l'amiodarone et le procaïnamide, utilisés pour traiter l'activité électrique anormale du cœur, appelée dysrythmie cardiaque, entravent le mouvement du K + à travers les canaux K + dépendants de la tension. Sur quelle partie du potentiel d'action pensez-vous que les canaux potassiques devraient affecter ?
- Réponse
-
Les inhibiteurs des canaux potassiques ralentissent la phase de repolarisation, mais n'ont aucun effet sur la dépolarisation.
Lexique
- potentiel d'action
- modification momentanée auto-propagée du potentiel électrique d'une membrane neuronale (ou musculaire)
- dépolarisation
- changement du potentiel de la membrane à une valeur moins négative
- potentiel post-synaptique excitateur (EPSP)
- dépolarisation d'une membrane postsynaptique provoquée par des molécules de neurotransmetteurs libérées par une cellule présynaptique
- hyperpolarisation
- changement du potentiel de la membrane vers une valeur plus négative
- potentiel postsynaptique inhibiteur (IPSP)
- hyperpolarisation d'une membrane postsynaptique causée par des molécules de neurotransmetteurs libérées par une cellule présynaptique
- dépression à long terme (LTD)
- diminution prolongée du couplage synaptique entre une cellule pré et postsynaptique
- potentialisation à long terme (LTP)
- augmentation prolongée du couplage synaptique entre une cellule pré-synaptique et une cellule postsynaptique
- potentiel membranaire
- différence de potentiel électrique entre l'intérieur et l'extérieur d'une cellule
- période réfractaire
- période après un potentiel d'action lorsqu'il est plus difficile ou impossible de déclencher un potentiel d'action ; causée par l'inactivation des canaux sodiques et l'activation de canaux potassiques supplémentaires de la membrane
- conduction saltatoire
- « saut » d'un potentiel d'action le long d'un axone d'un nœud de Ranvier à l'autre
- sommation
- processus de multiples entrées présynaptiques créant des ePSP à peu près au même moment pour que le neurone postsynaptique soit suffisamment dépolarisé pour déclencher un potentiel d'action
- fente synaptique
- espace entre les membranes présynaptique et postsynaptique
- vésicule synaptique
- structure sphérique contenant un neurotransmetteur
- seuil d'excitation
- niveau de dépolarisation requis pour qu'un potentiel d'action se déclenche


