20.2 : Alcools et éthers
- Page ID
- 193897
- Décrire la structure et les propriétés des alcools
- Décrire la structure et les propriétés des éthers
- Nommer et dessiner des structures pour les alcools et les éthers
Dans cette section, nous en apprendrons davantage sur les alcools et les éthers.
Alcools
L'incorporation d'un atome d'oxygène dans des molécules contenant du carbone et de l'hydrogène donne naissance à de nouveaux groupes fonctionnels et à de nouvelles familles de composés. Lorsque l'atome d'oxygène est attaché par des liaisons simples, la molécule est soit un alcool, soit un éther.
Les alcools sont des dérivés d'hydrocarbures dans lesquels un groupe —OH a remplacé un atome d'hydrogène. Bien que tous les alcools possèdent un ou plusieurs groupes fonctionnels hydroxyle (—OH), ils ne se comportent pas comme des bases telles que NaOH et KOH. Le NaOH et le KOH sont des composés ioniques qui contiennent des ions OH —. Les alcools sont des molécules covalentes ; le groupe —OH d'une molécule d'alcool est lié à un atome de carbone par une liaison covalente.
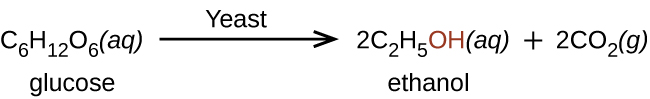
L'éthanol, CH 3 CH 2 OH, également appelé alcool éthylique, est un alcool particulièrement important pour l'usage humain. L'éthanol est l'alcool produit par certaines espèces de levure que l'on trouve dans le vin, la bière et les boissons distillées. Il a longtemps été préparé par l'homme en exploitant les efforts métaboliques des levures pour faire fermenter divers sucres :
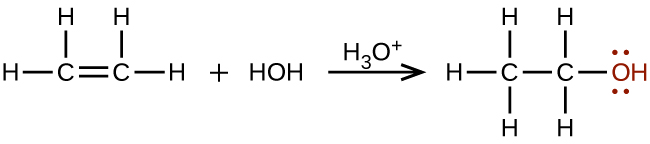
De grandes quantités d'éthanol sont synthétisées à partir de la réaction d'addition d'eau avec de l'éthylène en utilisant un acide comme catalyseur :
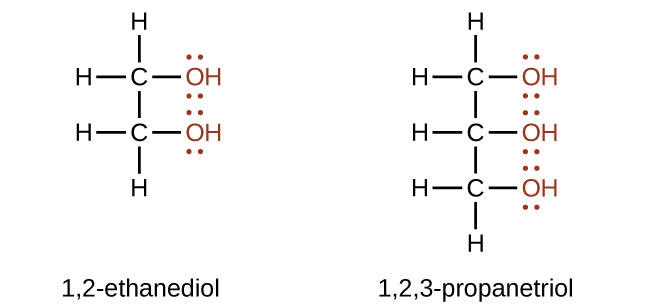
Des alcools contenant au moins deux groupes hydroxyle peuvent être fabriqués. Les exemples incluent le 1,2-éthanediol (éthylène glycol, utilisé dans l'antigel) et le 1,2,3-propanétriol (glycérine, utilisée comme solvant pour les cosmétiques et les médicaments) :
Dénomination des alcools
Le nom d'un alcool vient de l'hydrocarbure dont il est dérivé. Le dernier -e du nom de l'hydrocarbure est remplacé par -ol, et l'atome de carbone auquel le groupe —OH est lié est indiqué par un chiffre placé avant le nom. 1
Prenons l'exemple suivant. Comment devrait-on le nommer ?
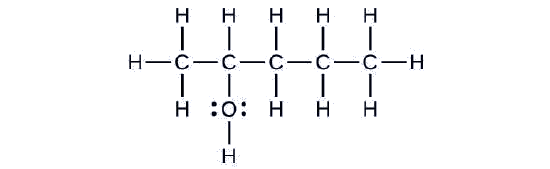
Solution
La chaîne carbonée contient cinq atomes de carbone. Si le groupe hydroxyle n'était pas présent, nous aurions nommé cette molécule pentane. Pour remédier à la présence du groupe hydroxyle, nous changeons la fin du nom en -ol. Dans ce cas, puisque le —OH est attaché au carbone 2 de la chaîne, nous appellerons cette molécule 2-pentanol.
Nommez la molécule suivante :
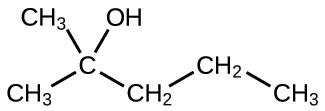
- Réponse
-
2-méthyl-2-pentanol
Éthers
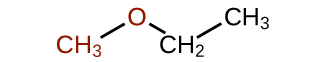
Les éthers sont des composés qui contiennent le groupe fonctionnel —O—. Les éthers n'ont pas de suffixe désigné comme les autres types de molécules que nous avons nommés jusqu'à présent. Dans le système IUPAC, l'atome d'oxygène et la plus petite branche carbonée sont nommés comme substituant alcoxy et le reste de la molécule comme chaîne de base, comme dans les alcanes. Comme le montre le composé suivant, les symboles rouges représentent le plus petit groupe alkyle et l'atome d'oxygène, qui serait appelé « méthoxy ». La plus grande branche carbonée serait l'éthane, ce qui ferait de la molécule le méthoxyéthane. De nombreux éthers sont désignés par des noms communs au lieu des noms du système IUPAC. Pour les noms courants, les deux branches reliées à l'atome d'oxygène sont nommées séparément et suivies d' « éther ». Le nom usuel du composé indiqué ci-dessous est l'éthylméthyléther :
Indiquez l'UICPA et le nom usuel de l'éther illustré ici :
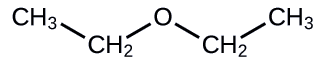
Solution
- Nom IUPAC : La molécule est constituée d'un groupe éthoxy attaché à une chaîne éthane, de sorte que le nom IUPAC serait éthoxyéthane.
- Nom commun : Les groupes attachés à l'atome d'oxygène sont tous deux des groupes éthyle, de sorte que le nom commun serait éther diéthylique.
Indiquez l'UICPA et le nom usuel de l'éther indiqué :
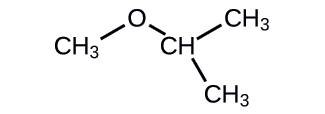
- Réponse
-
UICPA : 2-méthoxypropane ; fréquent : éther isopropylméthylique
Les éthers peuvent être obtenus à partir d'alcools par élimination d'une molécule d'eau de deux molécules de l'alcool. Par exemple, lorsque l'éthanol est traité avec une quantité limitée d'acide sulfurique et chauffé à 140 °C, de l'éther diéthylique et de l'eau se forment :
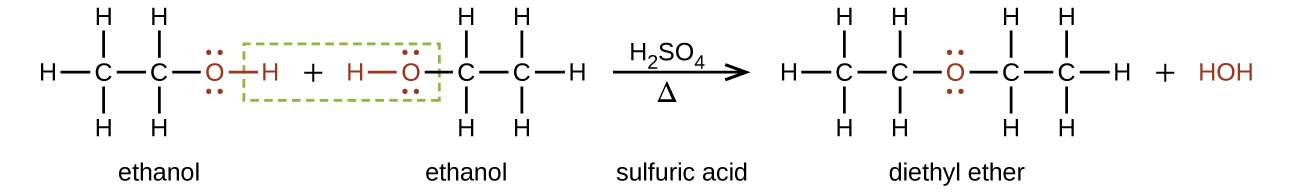
Dans la formule générale des éthers, R— O —R, les groupes hydrocarbonés (R) peuvent être identiques ou différents. L'éther diéthylique, le composé le plus largement utilisé de cette classe, est un liquide volatil incolore hautement inflammable. Il a été utilisé pour la première fois en 1846 comme anesthésique, mais de meilleurs anesthésiques ont maintenant largement pris sa place. L'éther diéthylique et d'autres éthers sont actuellement utilisés principalement comme solvants pour les gommes, les graisses, les cires et les résines. L'éther butylique et méthylique tertiaire, C 4 H 9 OCH 3 (en abrégé MTBE — les parties des noms en italiques ne sont pas comptées dans le classement alphabétique des groupes ; le butyle passe donc avant le méthyle dans le nom usuel), est utilisé comme additif pour l'essence. Le MTBE appartient à un groupe de produits chimiques appelés composés oxygénés en raison de leur capacité à augmenter la teneur en oxygène de l'essence.
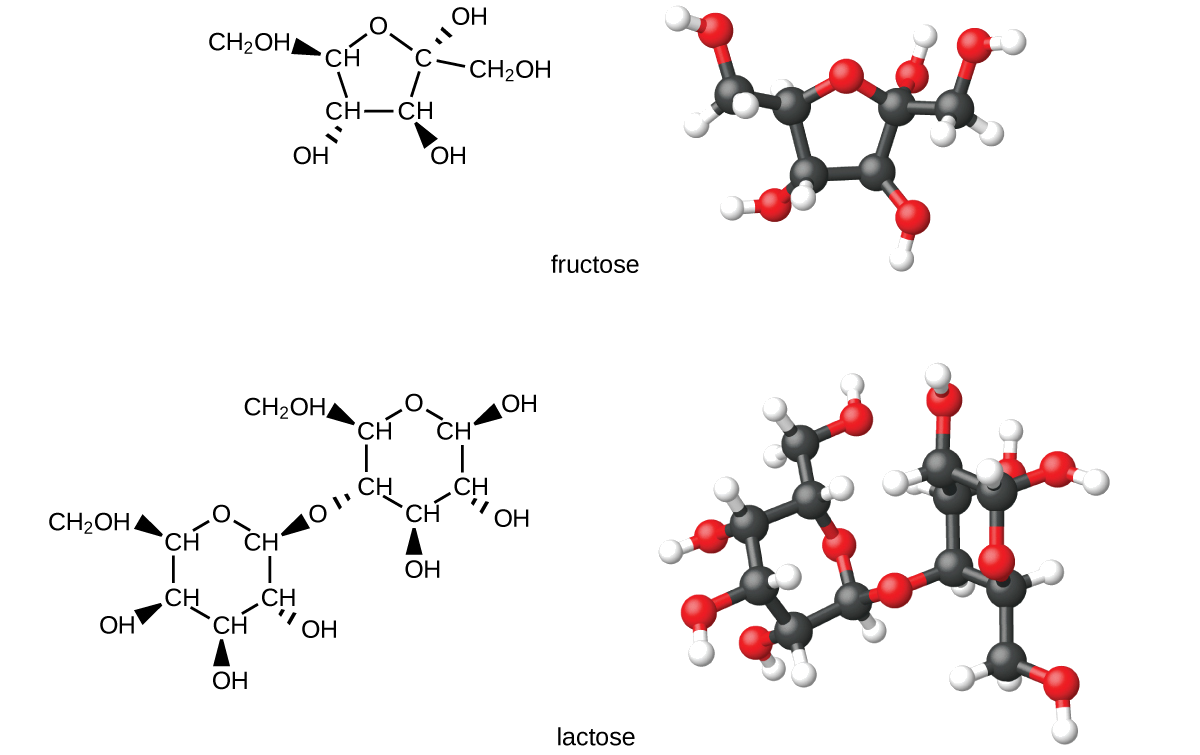
Les glucides sont de grandes biomolécules composées de carbone, d'hydrogène et d'oxygène. Les formes alimentaires de glucides sont des aliments riches en ces types de molécules, comme les pâtes, le pain et les bonbons. Le nom « hydrate de carbone » vient de la formule des molécules, que l'on peut décrire par la formule générale C m (H 2 O) n, qui montre qu'elles sont en quelque sorte « carbone et eau » ou « hydrates de carbone ». Dans de nombreux cas, m et n ont la même valeur, mais ils peuvent être différents. Les glucides les plus petits sont généralement appelés « sucres ». Le terme biochimique désignant ce groupe de molécules est « saccharide », du mot grec désignant le sucre (Figure\(\PageIndex{1}\)). Selon le nombre d'unités de sucre réunies, elles peuvent être classées en monosaccharides (une unité de sucre), en disaccharides (deux unités de sucre), en oligosaccharides (quelques sucres) ou en polysaccharides (la version polymère des sucres) ; les polymères ont été décrits dans l'encadré de caractéristiques plus tôt dans ce chapitre sur le recyclage plastiques). Les noms scientifiques des sucres peuvent être reconnus par le suffixe -ose à la fin du nom (par exemple, le sucre des fruits est un monosaccharide appelé « fructose » et le sucre du lait est un disaccharide appelé lactose composé de deux monosaccharides, glucose et galactose, liés entre eux). Les sucres contiennent certains des groupes fonctionnels dont nous avons parlé : Notez les groupes alcools présents dans les structures et la façon dont les unités monosaccharides sont liées pour former un disaccharide par la formation d'un éther.
Les organismes utilisent les glucides pour diverses fonctions. Les glucides peuvent emmagasiner de l'énergie, comme les polysaccharides, le glycogène chez les animaux ou l'amidon chez les plantes. Ils fournissent également un support structurel, tel que la cellulose polysaccharidique dans les plantes et le polysaccharide modifié chitine chez les champignons et les animaux. Les sucres ribose et désoxyribose sont des composants des squelettes de l'ARN et de l'ADN, respectivement. D'autres sucres jouent un rôle clé dans le fonctionnement du système immunitaire, dans la reconnaissance des cellules et dans de nombreux autres rôles biologiques.
Le diabète est un groupe de maladies métaboliques dans lesquelles une personne a une forte concentration de sucre dans le sang (Figure\(\PageIndex{2}\)). Le diabète peut être causé par une production insuffisante d'insuline par le pancréas ou par une réponse insuffisante des cellules de l'organisme à l'insuline produite. Chez une personne en bonne santé, l'insuline est produite lorsqu'elle est nécessaire et sert à transporter le glucose du sang vers les cellules où il peut être utilisé comme source d'énergie. Les complications à long terme du diabète peuvent inclure une perte de la vue, des maladies cardiaques et une insuffisance rénale.
En 2013, on a estimé qu'environ 3,3 % de la population mondiale (environ 380 millions de personnes) souffrait de diabète, entraînant plus d'un million de décès par an. La prévention consiste à adopter une alimentation saine, à faire beaucoup d'exercice et à maintenir un poids corporel normal. Le traitement implique toutes ces habitudes de vie et peut nécessiter des injections d'insuline.
Résumé
De nombreux composés organiques qui ne sont pas des hydrocarbures peuvent être considérés comme des dérivés d'hydrocarbures. Un dérivé d'hydrocarbure peut être formé en remplaçant un ou plusieurs atomes d'hydrogène d'un hydrocarbure par un groupe fonctionnel, qui contient au moins un atome d'un élément autre que le carbone ou l'hydrogène. Les propriétés des dérivés d'hydrocarbures sont déterminées en grande partie par le groupe fonctionnel. Le groupe —OH est le groupe fonctionnel d'un alcool. Le groupe —R—O—R— est le groupe fonctionnel d'un éther.
Notes
- L'IUPAC a adopté de nouvelles directives de nomenclature en 2013 qui exigent que ce numéro soit placé en tant qu' « infixe » plutôt qu'en tant que préfixe. Par exemple, le nouveau nom du 2-propanol serait propan-2-ol. L'adoption généralisée de cette nouvelle nomenclature prendra un certain temps, et les étudiants sont invités à se familiariser avec les anciens et les nouveaux protocoles de dénomination.
Lexique
- alcool
- composé organique avec un groupe hydroxyle (-OH) lié à un atome de carbone
- éther
- composé organique avec un atome d'oxygène lié à deux atomes de carbone


