20.1 : Hydrocarbures
- Page ID
- 193893
- Expliquer l'importance des hydrocarbures et la raison de leur diversité
- Nommez les hydrocarbures saturés et insaturés et les molécules qui en dérivent
- Décrire les réactions caractéristiques des hydrocarbures saturés et insaturés
- Identifier les isomères structuraux et géométriques des hydrocarbures
La plus grande base de données 1 de composés organiques répertorie environ 10 millions de substances, dont des composés provenant d'organismes vivants et ceux synthétisés par des chimistes. Le nombre de composés organiques potentiels a été estimé à 2 à 10 60, un chiffre astronomiquement élevé. L'existence d'un si grand nombre de molécules organiques est une conséquence de la capacité des atomes de carbone à former jusqu'à quatre liaisons fortes avec d'autres atomes de carbone, ce qui donne des chaînes et des anneaux de tailles, de formes et de complexités différentes.
Les composés organiques les plus simples ne contiennent que les éléments carbone et hydrogène et sont appelés hydrocarbures. Même s'ils ne sont composés que de deux types d'atomes, il existe une grande variété d'hydrocarbures, car ils peuvent être constitués de chaînes, de chaînes ramifiées et de cycles d'atomes de carbone de différentes longueurs, ou de combinaisons de ces structures. De plus, les hydrocarbures peuvent différer quant aux types de liaisons carbone-carbone présentes dans leurs molécules. De nombreux hydrocarbures se trouvent dans les plantes, les animaux et leurs fossiles ; d'autres hydrocarbures ont été préparés en laboratoire. Nous utilisons des hydrocarbures tous les jours, principalement comme carburants, tels que le gaz naturel, l'acétylène, le propane, le butane et les principaux composants de l'essence, du diesel et du mazout de chauffage. Les plastiques familiers (polyéthylène, polypropylène et polystyrène) sont également des hydrocarbures. On peut distinguer plusieurs types d'hydrocarbures par les différences de liaison entre les atomes de carbone. Cela entraîne des différences de géométries et d'hybridation des orbitales du carbone.
Alcanes
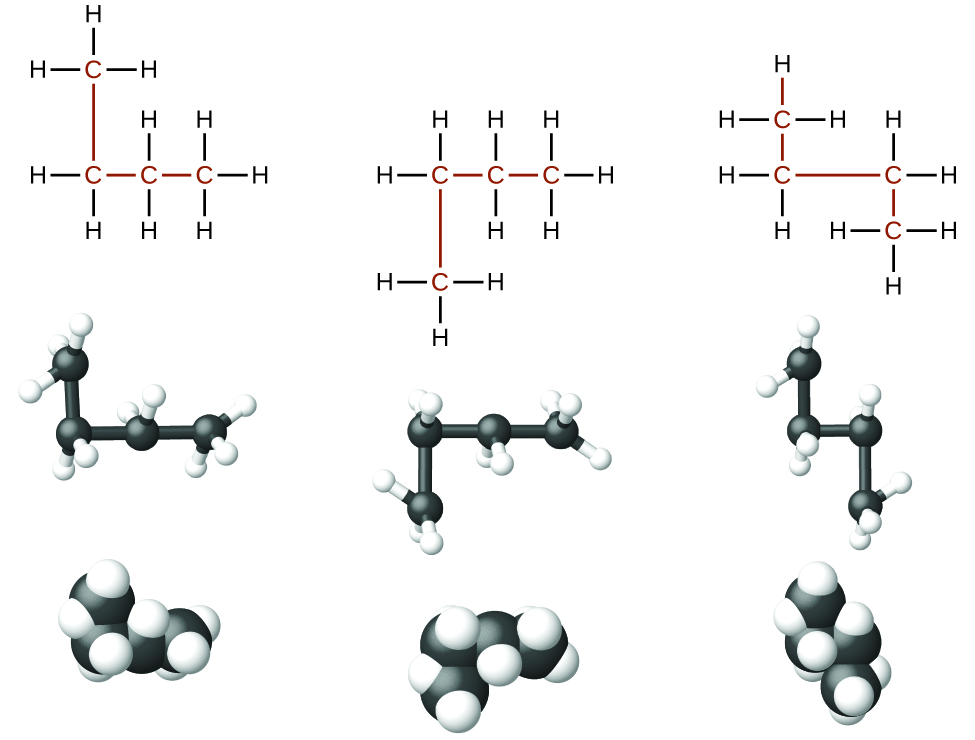
Les alcanes, ou hydrocarbures saturés, ne contiennent que des liaisons covalentes simples entre les atomes de carbone. Chacun des atomes de carbone d'un alcane possède des orbitales hybrides sp 3 et est lié à quatre autres atomes, chacun étant du carbone ou de l'hydrogène. Les structures de Lewis et les modèles du méthane, de l'éthane et du pentane sont illustrés sur la figure\(\PageIndex{1}\). Les chaînes de carbone sont généralement tracées sous forme de lignes droites dans les structures de Lewis, mais il ne faut pas oublier que les structures de Lewis ne sont pas destinées à indiquer la géométrie des molécules. Notez que les atomes de carbone dans les modèles structuraux (modèles à bille et à bâton et modèles de remplissage d'espace) de la molécule de pentane ne se situent pas en ligne droite. En raison de l'hybridation sp 3, les angles de liaison dans les chaînes de carbone sont proches de 109,5°, ce qui donne à ces chaînes dans un alcane une forme en zigzag.
Les structures des alcanes et d'autres molécules organiques peuvent également être représentées de manière moins détaillée par des formules structurales condensées (ou simplement des formules condensées). Au lieu du format habituel des formules chimiques dans lequel chaque symbole d'élément n'apparaît qu'une seule fois, une formule condensée est écrite pour suggérer la liaison dans la molécule. Ces formules ont l'apparence d'une structure de Lewis dont la plupart ou la totalité des symboles de liaison ont été supprimés. Les formules structurales condensées pour l'éthane et le pentane sont présentées au bas de la figure\(\PageIndex{1}\), et plusieurs exemples supplémentaires sont fournis dans les exercices à la fin de ce chapitre.
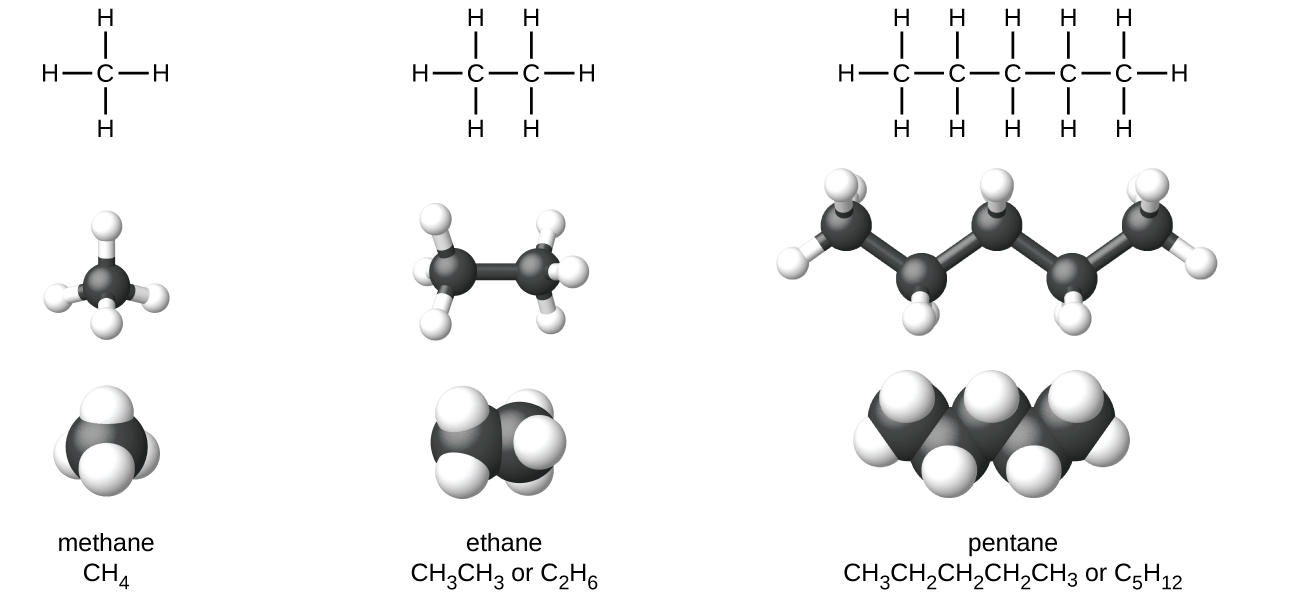
Une méthode couramment utilisée par les chimistes organiques pour simplifier les dessins de molécules plus grosses consiste à utiliser une structure squelettique (également appelée structure à angle linéaire). Dans ce type de structure, les atomes de carbone ne sont pas symbolisés par un C, mais représentés par chaque extrémité d'une ligne ou courbe d'une ligne. Les atomes d'hydrogène ne sont pas dessinés s'ils sont attachés à un carbone. Outre le carbone et l'hydrogène, d'autres atomes sont représentés par leurs symboles élémentaires. La figure\(\PageIndex{2}\) montre trois manières différentes de dessiner la même structure.
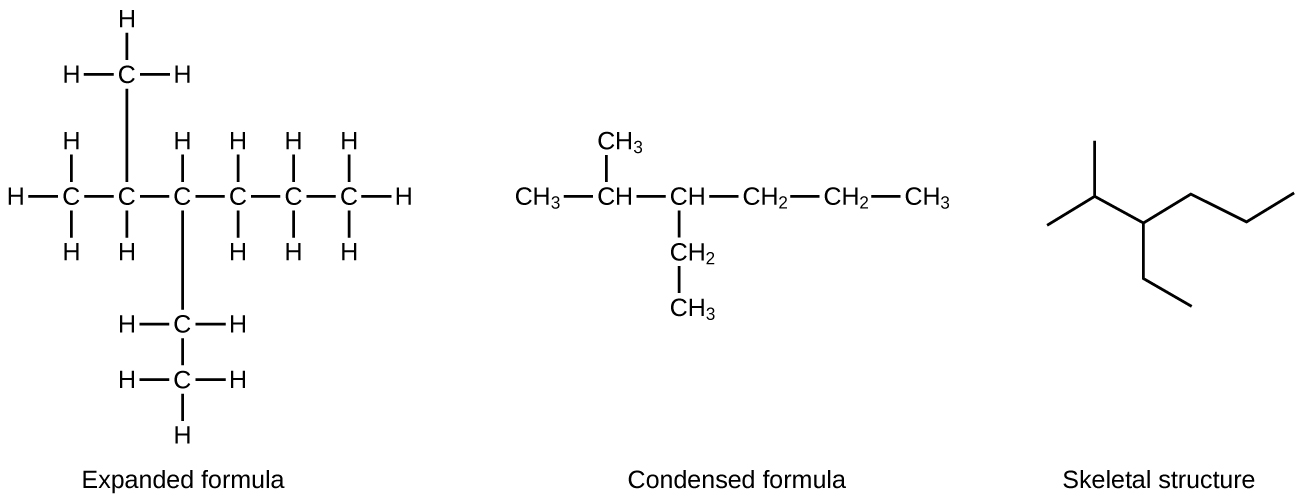
Dessiner les structures squelettiques Dessinez les structures squelettiques de ces deux molécules :
Solution
Chaque atome de carbone est converti à l'extrémité d'une ligne ou à l'endroit où les lignes se croisent. Tous les atomes d'hydrogène attachés aux atomes de carbone sont exclus de la structure (même si nous devons tout de même reconnaître leur présence) :
Dessinez les structures squelettiques de ces deux molécules :

- Réponse
-

Dans a, un hexagone avec un sommet en haut est représenté. Le sommet situé juste à droite est attaché à un segment de ligne qui s'étend vers le haut et vers la droite. En b, un motif en zigzag est représenté dans lequel les segments de ligne montent, descendent, montent, descendent et montent se déplacent de gauche à droite.
Interprétation des structures squelettiques Identifiez la formule chimique de la molécule représentée ici :
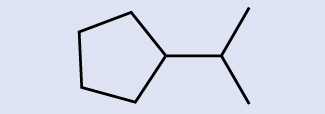
Solution
Il y a huit endroits où les lignes se croisent ou se terminent, ce qui signifie qu'il y a huit atomes de carbone dans la molécule. Comme nous savons que les atomes de carbone ont tendance à former quatre liaisons, chaque atome de carbone aura le nombre d'atomes d'hydrogène requis pour quatre liaisons. Ce composé contient 16 atomes d'hydrogène pour une formule moléculaire de C 8 H 16.
Localisation des atomes d'hydrogène :
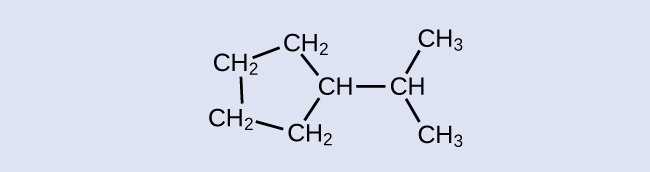
Identifiez la formule chimique de la molécule représentée ici :
- Réponse
-
C 9 H 20
Tous les alcanes sont composés d'atomes de carbone et d'hydrogène et ont des liaisons, des structures et des formules similaires ; les alcanes non cycliques ont tous la formule C n H 2n +2. Le nombre d'atomes de carbone présents dans un alcane n'a pas de limite. L'augmentation du nombre d'atomes dans les molécules se traduira par des attractions intermoléculaires plus fortes (forces de dispersion) et, par conséquent, par des propriétés physiques différentes des molécules. Les propriétés telles que le point de fusion et le point d'ébullition (tableau\(\PageIndex{1}\)) changent généralement de manière régulière et prévisible à mesure que le nombre d'atomes de carbone et d'hydrogène dans les molécules change.
| Alcane | Formule moléculaire | Point de fusion (°C) | Point d'ébullition (°C) | Phase à l'étape 4 | Nombre d'isomères structuraux |
|---|---|---|---|---|---|
| méthane | CH 4 | —182,5 | —161,5 | gaz | 1 |
| éthane | C 2 H 6 | —183,3 | —8,6 | gaz | 1 |
| propane | C 3 H 8 | —187,7 | —42,1 | gaz | 1 |
| butane | C 4 H 10 | —138,3 | —0,5 | gaz | 2 |
| pentane | C 5 H 12 | —129,7 | 36,1 | liquide | 3 |
| hexane | C 6 H 14 | —95,3 | 68,7 | liquide | 5 |
| heptane | C 7 H 16 | —90,6 | 98,4 | liquide | 9 |
| octane | C 8 H 18 | —56,8 | 125,7 | liquide | 18 |
| nonane | C 9 H 20 | —53,6 | 150,8 | liquide | 35 |
| décane | C 10 H 22 | —29,7 | 174,0 | liquide | 75 |
| tétradécane | C 14 H 30 | 5,9 | 253,5 | solide | 1858 |
| octadécane | C 18 H 38 | 28,2 | 316,1 | solide | 60 523 |
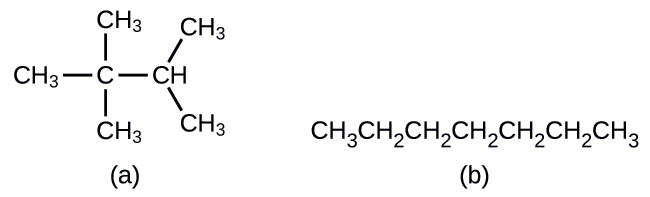
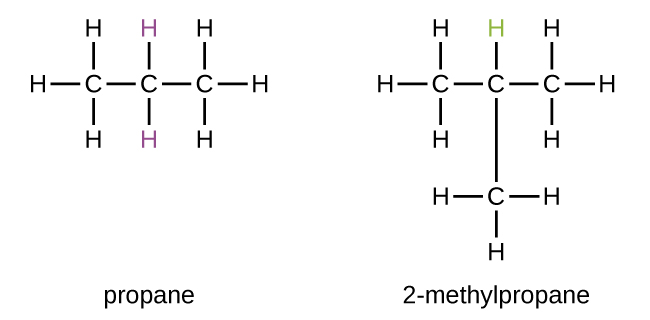
Les hydrocarbures ayant la même formule, y compris les alcanes, peuvent avoir des structures différentes. Par exemple, deux alcanes ont la formule C 4 H 10 : ils sont appelés n-butane et 2-méthylpropane (ou isobutane), et présentent les structures de Lewis suivantes :
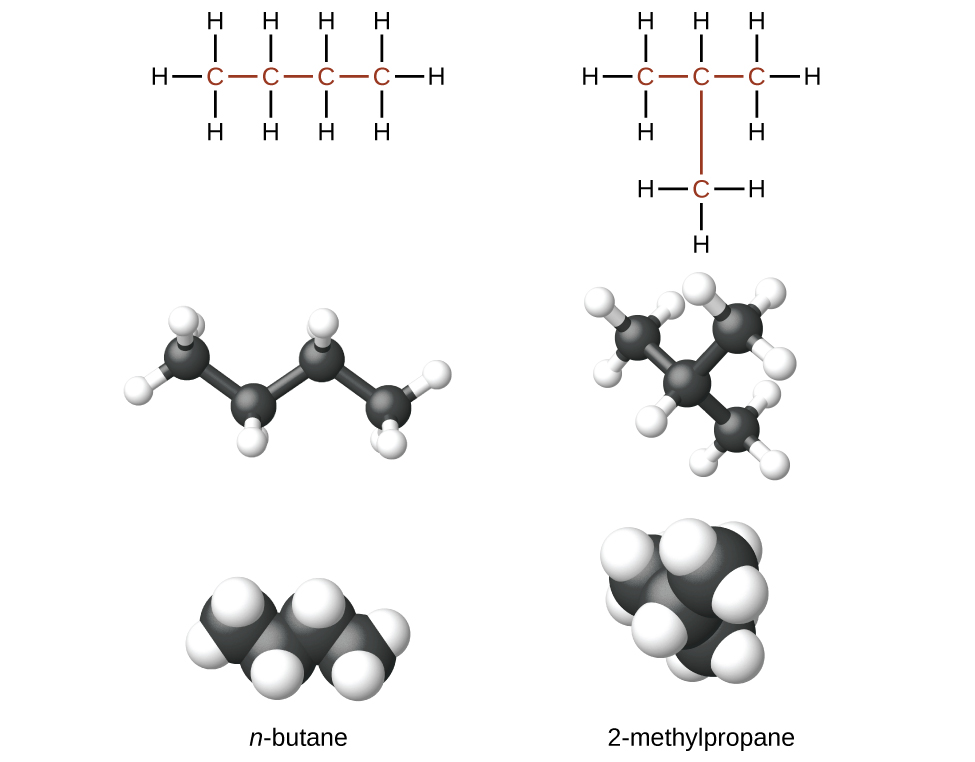
Les composés n-butane et 2-méthylpropane sont des isomères structuraux (le terme isomères constitutionnels est également couramment utilisé). Les isomères constitutionnels ont la même formule moléculaire mais des arrangements spatiaux différents des atomes de leurs molécules. La molécule de n-butane contient une chaîne non ramifiée, ce qui signifie qu'aucun atome de carbone n'est lié à plus de deux autres atomes de carbone. Nous utilisons le terme normal, ou le préfixe n, pour désigner une chaîne d'atomes de carbone sans ramification. Le composé 2-méthylpropane possède une chaîne ramifiée (l'atome de carbone au centre de la structure de Lewis est lié à trois autres atomes de carbone)
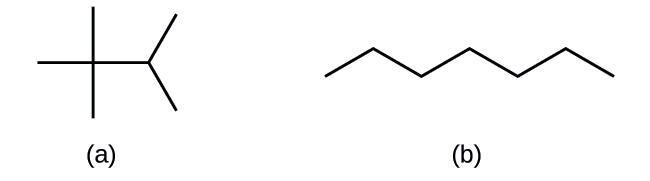
L'identification des isomères à partir des structures de Lewis n'est pas aussi simple qu'il y paraît. Les structures de Lewis qui ont une apparence différente peuvent en fait représenter les mêmes isomères. Par exemple, les trois structures de la figure représentent\(\PageIndex{3}\) toutes la même molécule, le n-butane, et ne sont donc pas des isomères différents. Ils sont identiques car chacun contient une chaîne non ramifiée de quatre atomes de carbone.
Les bases de la nomenclature organique : dénomination des alcanes
L'Union internationale de chimie pure et appliquée (IUPAC) a conçu un système de nomenclature qui commence par les noms des alcanes et peut être ajusté à partir de là pour tenir compte de structures plus complexes. La nomenclature des alcanes repose sur deux règles :
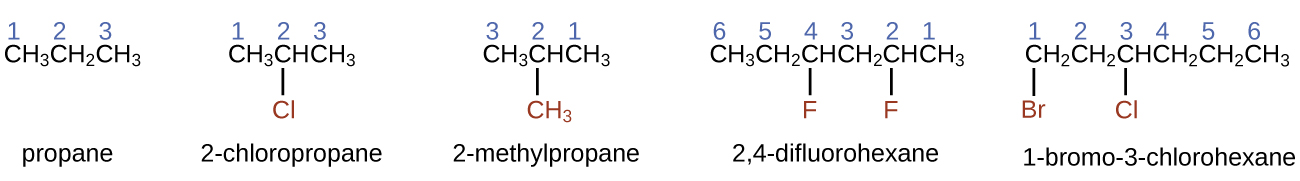
- Pour nommer un alcane, identifiez d'abord la plus longue chaîne d'atomes de carbone de sa structure. Une chaîne à deux carbones est appelée éthane ; une chaîne à trois carbones, le propane ; et une chaîne à quatre carbones, le butane. Les chaînes plus longues sont nommées comme suit : pentane (chaîne à cinq carbones), hexane (6), heptane (7), octane (8), nonane (9) et décane (10). Ces préfixes peuvent être vus dans les noms des alcanes décrits dans le tableau\(\PageIndex{1}\).
- Ajoutez des préfixes au nom de la chaîne la plus longue pour indiquer les positions et les noms des substituants. Les substituants sont des branches ou des groupes fonctionnels qui remplacent les atomes d'hydrogène d'une chaîne. La position d'un substituant ou d'une branche est identifiée par le numéro de l'atome de carbone auquel il est lié dans la chaîne. Nous numérotons les atomes de carbone de la chaîne en les comptant à partir de l'extrémité de la chaîne la plus proche des substituants. Les substituants multiples sont nommés individuellement et placés par ordre alphabétique au début du nom.
Lorsque plusieurs substituants sont présents, soit sur le même atome de carbone, soit sur des atomes de carbone différents, les substituants sont listés par ordre alphabétique. Comme la numérotation des atomes de carbone commence à l'extrémité la plus proche d'un substituant, la chaîne d'atomes de carbone la plus longue est numérotée de manière à produire le plus petit nombre de substituants. La terminaison -o remplace -ide à la fin du nom d'un substituant électronégatif (dans les composés ioniques, l'ion chargé négativement se termine par un chlorure de type -ide ; dans les composés organiques, ces atomes sont traités comme des substituants et la terminaison -o est utilisée). Le nombre de substituants du même type est indiqué par les préfixes di- (deux), tri- (trois), tétra- (quatre), etc. (par exemple, difluoro- indique deux substituants fluorés).
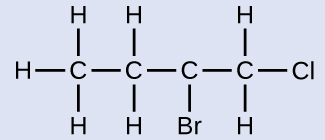
Nommez la molécule dont la structure est indiquée ici :
Solution
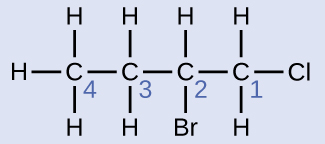
La chaîne à quatre carbones est numérotée à partir de la fin par l'atome de chlore. Cela place les substituants sur les positions 1 et 2 (une numérotation à partir de l'autre extrémité placerait les substituants sur les positions 3 et 4). Quatre atomes de carbone signifient que le nom de base de ce composé sera butane. Le brome en position 2 sera décrit en ajoutant du 2-bromo- ; cela apparaîtra au début du nom, puisque le bromo- vient avant le chloro- par ordre alphabétique. Le chlore en position 1 sera décrit en ajoutant du 1-chloro-, ce qui fait que le nom de la molécule est 2-bromo-1-chlorobutane.
Nommez la molécule suivante :
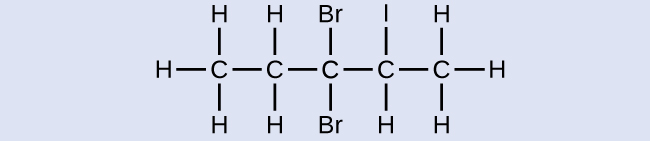
- Réponse
-
3,3-dibromo-2-iodopentane
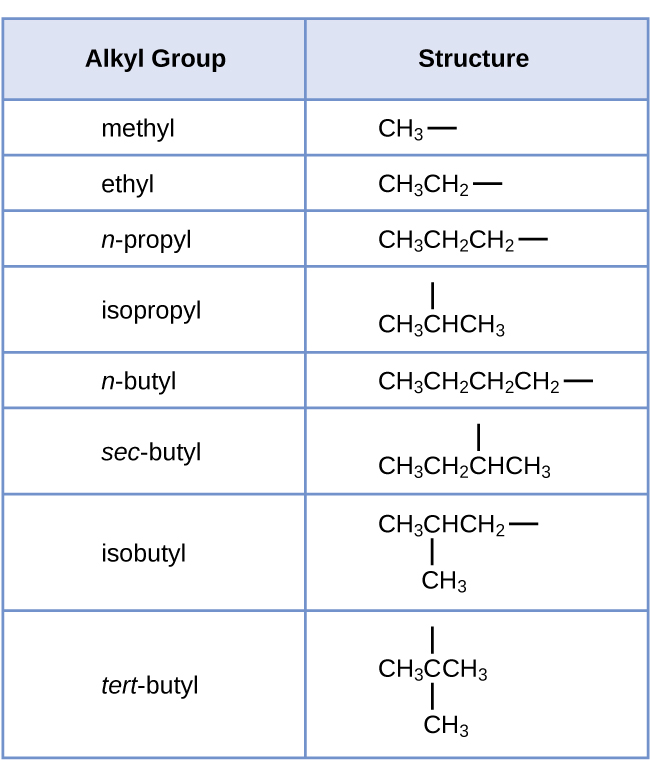
Nous appelons groupe alkyle un substituant qui contient un hydrogène de moins que l'alcane correspondant. Le nom d'un groupe alkyle est obtenu en supprimant le suffixe -ane du nom de l'alcane et en ajoutant -yl :
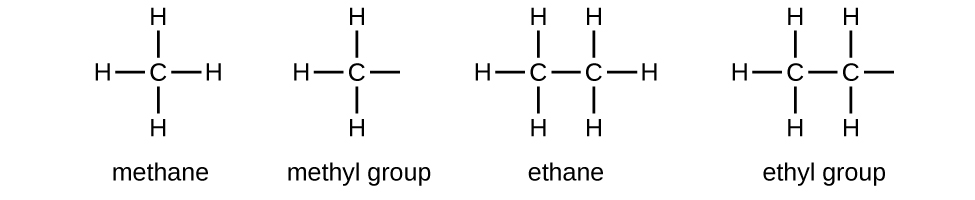
Les liaisons ouvertes dans les groupes méthyle et éthyle indiquent que ces groupes alkyles sont liés à un autre atome.
Nommez la molécule dont la structure est indiquée ici :
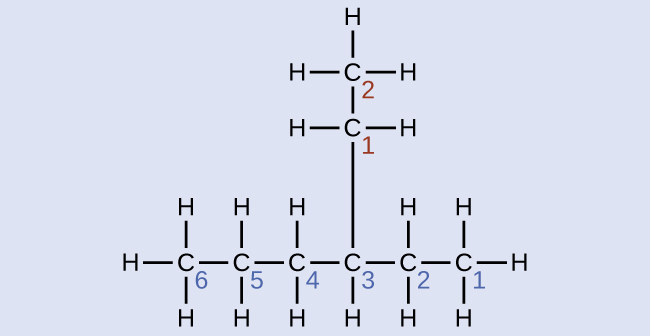
Solution
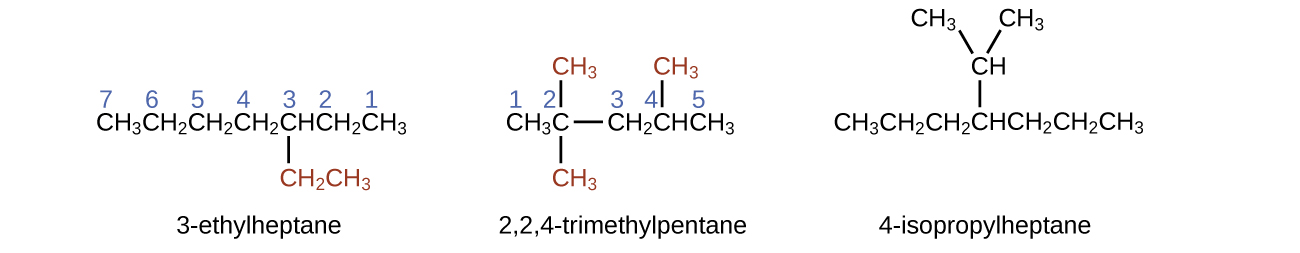
La plus longue chaîne de carbone s'étend horizontalement sur la page et contient six atomes de carbone (cela constitue la base du nom hexane, mais nous devrons également intégrer le nom de la branche). Dans ce cas, nous voulons numéroter de droite à gauche (comme le montrent les chiffres bleus) afin que la branche soit connectée au carbone 3 (imaginez les nombres de gauche à droite, cela placerait la branche sur le carbone 4, en violation de nos règles). La branche attachée à la position 3 de notre chaîne contient deux atomes de carbone (numérotés en rouge). Nous prenons donc notre nom pour deux carbones eth- et attachons -yl à la fin pour signifier que nous décrivons une branche. En rassemblant toutes les pièces, cette molécule est le 3-éthylhexane.
Nommez la molécule suivante :

- Réponse
-
4-propyloctane
Certains hydrocarbures peuvent former plus d'un type de groupe alkyle lorsque les atomes d'hydrogène qui seraient retirés ont des « environnements » différents dans la molécule. Cette diversité de groupes alkyles possibles peut être identifiée de la manière suivante : Les quatre atomes d'hydrogène d'une molécule de méthane sont équivalents ; ils ont tous le même environnement. Ils sont équivalents car chacun est lié à un atome de carbone (le même atome de carbone) qui est lié à trois atomes d'hydrogène. (Il peut être plus facile de voir l'équivalence entre les modèles à bille et à bâton sur la figure\(\PageIndex{3}\). L'élimination de l'un des quatre atomes d'hydrogène du méthane forme un groupe méthyle. De même, les six atomes d'hydrogène de l'éthane sont équivalents et l'élimination de l'un quelconque de ces atomes d'hydrogène produit un groupe éthyle. Chacun des six atomes d'hydrogène est lié à un atome de carbone qui est lié à deux autres atomes d'hydrogène et à un atome de carbone. Cependant, tant dans le propane que dans le 2-méthylpropane, il existe des atomes d'hydrogène dans deux environnements différents, qui se distinguent par les atomes ou groupes d'atomes adjacents :
Notez que les groupes alkyles n'existent pas en tant qu'entités indépendantes stables. Ils font toujours partie d'une molécule plus grosse. La localisation d'un groupe alkyle sur une chaîne hydrocarbonée est indiquée de la même manière que tout autre substituant :
Les alcanes sont des molécules relativement stables, mais la chaleur ou la lumière activent des réactions impliquant la rupture de liaisons simples C—H ou C—C. La combustion est l'une de ces réactions :
\[\ce{CH4}(g)+\ce{2O2}(g)⟶\ce{CO2}(g)+\ce{2H2O}(g) \nonumber \]
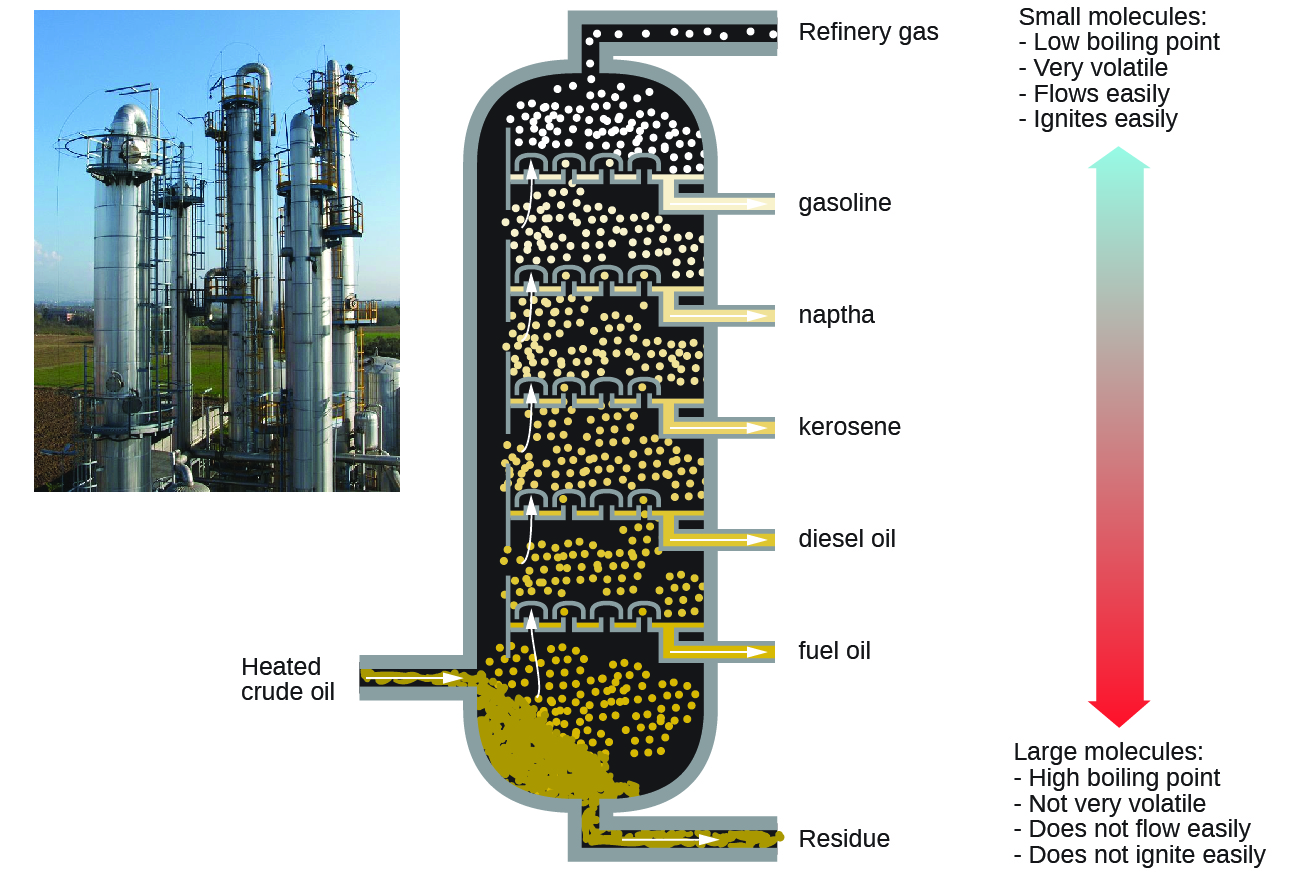
Les alcanes brûlent en présence d'oxygène, une réaction d'oxydoréduction hautement exothermique qui produit du dioxyde de carbone et de l'eau. Par conséquent, les alcanes sont d'excellents carburants. Par exemple, le méthane, le CH 4, est le principal composant du gaz naturel. Le butane, C 4 H 10, utilisé dans les réchauds et les briquets de camping est un alcane. L'essence est un mélange liquide d'alcanes à chaîne continue et à chaîne ramifiée, contenant chacun de cinq à neuf atomes de carbone, ainsi que divers additifs destinés à améliorer ses performances en tant que carburant. Le kérosène, le gazole et le mazout sont principalement des mélanges d'alcanes de masse moléculaire plus élevée. La principale source de ces combustibles alcanes liquides est le pétrole brut, un mélange complexe qui est séparé par distillation fractionnée. La distillation fractionnée tire parti des différences de points d'ébullition des composants du mélange (Figure\(\PageIndex{5}\)). Vous vous souvenez peut-être que le point d'ébullition est fonction des interactions intermoléculaires, ce qui a été discuté dans le chapitre sur les solutions et les colloïdes.
Dans une réaction de substitution, une autre réaction typique des alcanes, un ou plusieurs atomes d'hydrogène de l'alcane sont remplacés par un atome ou un groupe d'atomes différent. Aucune liaison carbone-carbone n'est rompue lors de ces réactions, et l'hybridation des atomes de carbone ne change pas. Par exemple, la réaction entre l'éthane et le chlore moléculaire décrite ici est une réaction de substitution :
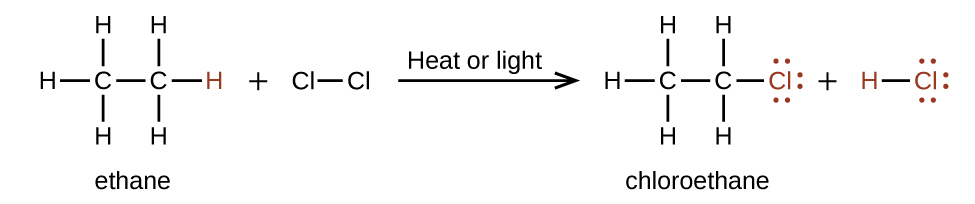
La partie C—Cl de la molécule de chloroéthane est un exemple de groupe fonctionnel, partie ou fraction d'une molécule qui confère une réactivité chimique spécifique. Les types de groupes fonctionnels présents dans une molécule organique sont des déterminants majeurs de ses propriétés chimiques et sont utilisés pour classer les composés organiques comme détaillé dans les autres sections de ce chapitre.
Alcènes
Les composés organiques qui contiennent une ou plusieurs liaisons doubles ou triples entre des atomes de carbone sont décrits comme insaturés. Vous avez probablement entendu parler des graisses insaturées. Il s'agit de molécules organiques complexes dotées de longues chaînes d'atomes de carbone, qui contiennent au moins une double liaison entre les atomes de carbone. Les molécules d'hydrocarbures insaturés qui contiennent une ou plusieurs doubles liaisons sont appelées alcènes. Les atomes de carbone liés par une double liaison sont liés entre eux par deux liaisons, une liaison σ et une liaison π. Les liaisons doubles et triples donnent lieu à une géométrie différente autour de l'atome de carbone qui y participe, ce qui entraîne des différences importantes dans la forme et les propriétés moléculaires. Les différentes géométries sont responsables des propriétés différentes des graisses insaturées par rapport aux graisses saturées.
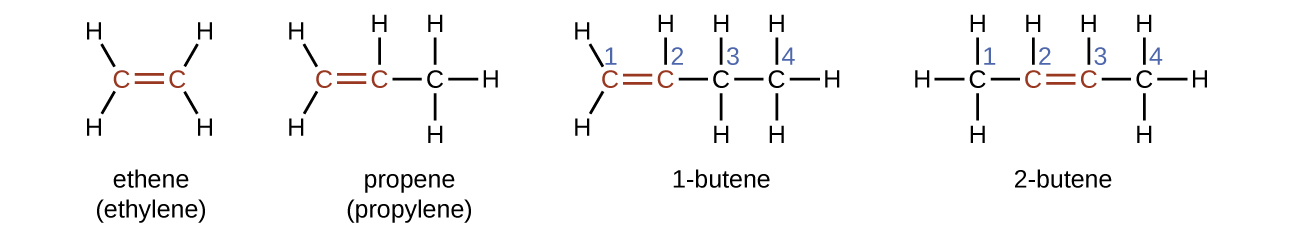
L'éthène, C 2 H 4, est l'alcène le plus simple. Chaque atome de carbone de l'éthylène, communément appelé éthylène, possède une structure plane trigonale. Le deuxième élément de la série est le propène (propylène) (Figure\(\PageIndex{6}\)) ; les isomères du butène suivent dans la série. Quatre atomes de carbone dans la chaîne du butène permettent la formation d'isomères en fonction de la position de la double liaison, ainsi qu'une nouvelle forme d'isomérie.
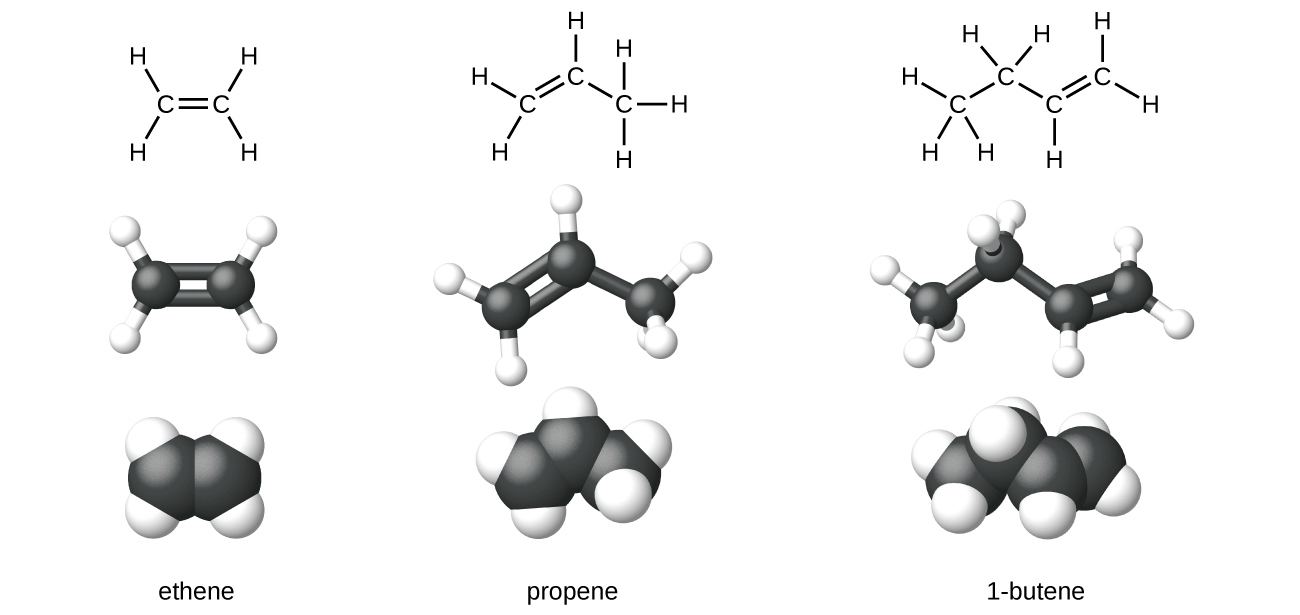
L'éthylène (nom industriel commun de l'éthylène) est une matière première de base pour la production de polyéthylène et d'autres composés importants. Plus de 135 millions de tonnes d'éthylène ont été produites dans le monde en 2010 pour être utilisées dans les industries des polymères, de la pétrochimie et des plastiques. L'éthylène est produit industriellement selon un processus appelé craquage, au cours duquel les longues chaînes d'hydrocarbures d'un mélange de pétrole sont brisées en molécules plus petites.
Recyclage des
Les polymères (du grec poly signifiant « plusieurs » et mer signifiant « parties ») sont de grosses molécules constituées d'unités répétitives, appelées monomères. Les polymères peuvent être naturels (l'amidon est un polymère de résidus de sucre et les protéines sont des polymères d'acides aminés) ou synthétiques [comme le polyéthylène, le polychlorure de vinyle (PVC) et le polystyrène]. La variété des structures des polymères se traduit par un large éventail de propriétés et d'utilisations qui les font partie intégrante de notre vie quotidienne. L'ajout de groupes fonctionnels à la structure d'un polymère peut entraîner des propriétés très différentes (voir la discussion sur le Kevlar plus loin dans ce chapitre).
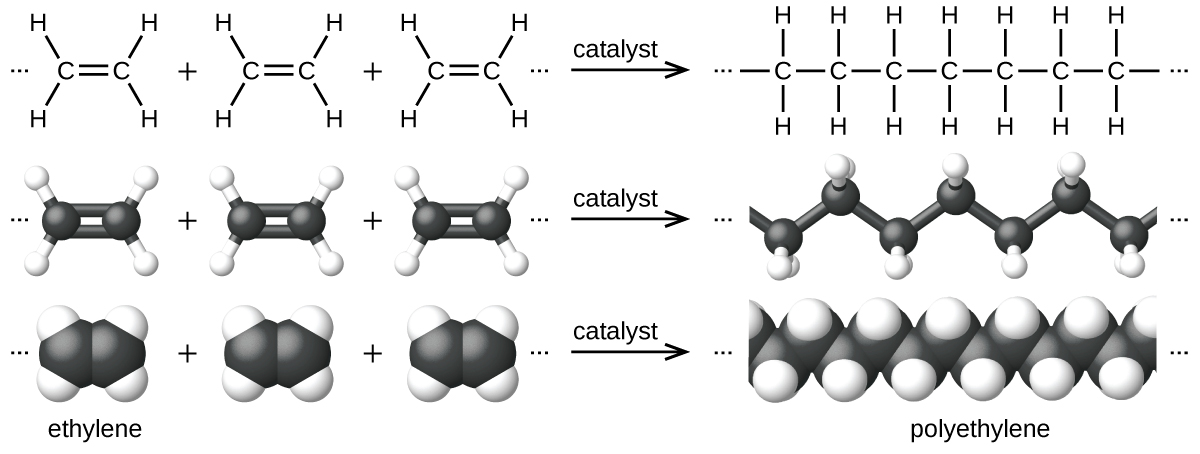
Un exemple de réaction de polymérisation est illustré sur la figure\(\PageIndex{7}\). Le monomère éthylène (C 2 H 4) est un gaz à température ambiante, mais lorsqu'il est polymérisé à l'aide d'un catalyseur à base de métal de transition, il est transformé en un matériau solide composé de longues chaînes d'unités -CH 2 — appelées polyéthylène. Le polyéthylène est un plastique de base utilisé principalement pour les emballages (sacs et films).
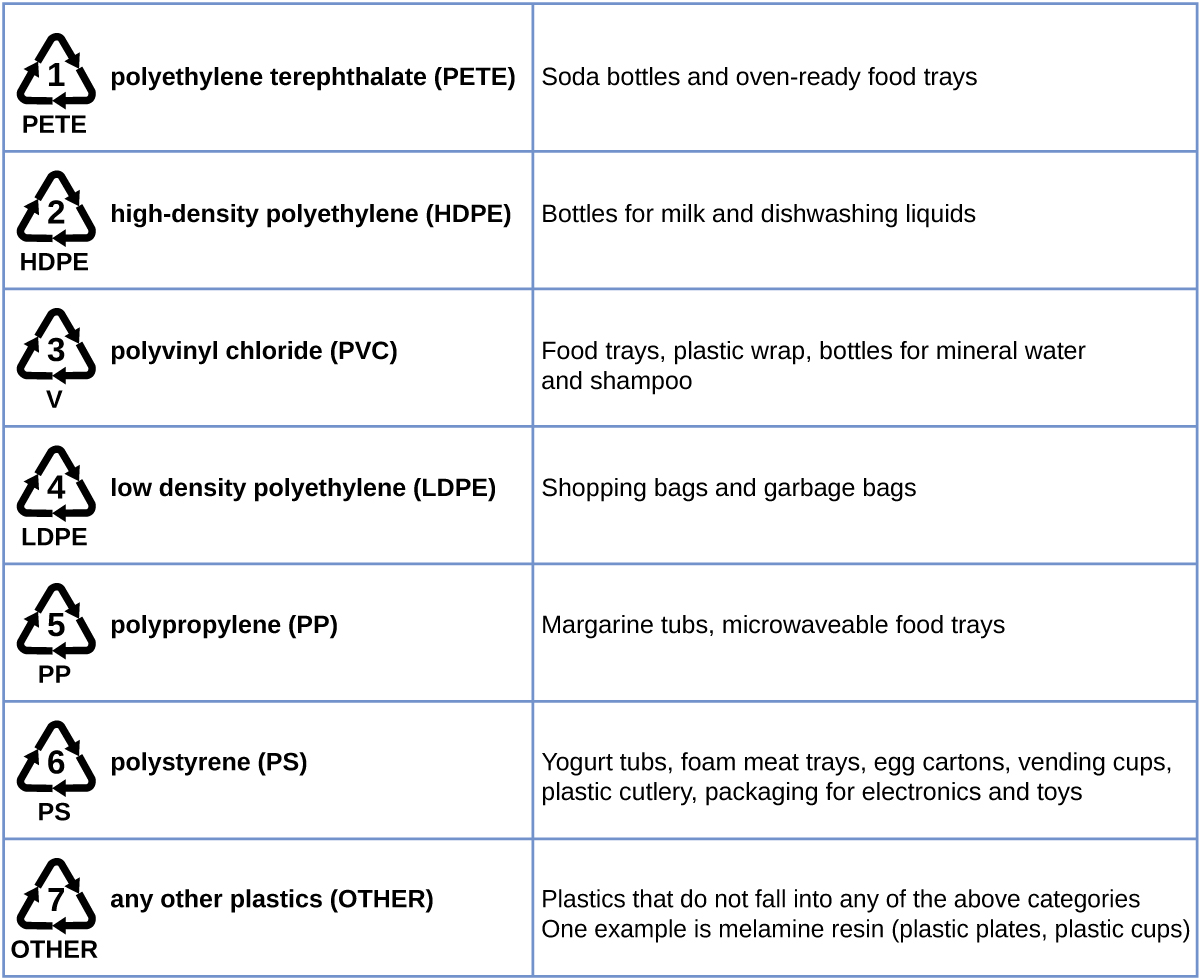
Le polyéthylène fait partie d'un sous-ensemble de polymères synthétiques classés dans la catégorie des plastiques. Les plastiques sont des solides organiques synthétiques qui peuvent être moulés ; ce sont généralement des polymères organiques à masse moléculaire élevée. La plupart des monomères qui entrent dans la composition des plastiques courants (éthylène, propylène, chlorure de vinyle, styrène et éthylène téréphtalate) sont dérivés de la pétrochimie et ne sont pas très biodégradables, ce qui en fait des matériaux candidats au recyclage. Le recyclage des plastiques permet de minimiser la nécessité d'utiliser davantage de fournitures pétrochimiques et de minimiser les dommages environnementaux causés par le rejet de ces matériaux non biodégradables.
Le recyclage du plastique est le processus qui consiste à récupérer les déchets, les déchets ou les plastiques usagés, et à retraiter le matériau en produits utiles. Par exemple, le polyéthylène téréphtalate (bouteilles de boissons gazeuses) peut être fondu et utilisé pour les meubles en plastique, les tapis ou pour d'autres applications. D'autres plastiques, tels que le polyéthylène (sacs) et le polypropylène (gobelets, récipients alimentaires en plastique), peuvent être recyclés ou retraités pour être réutilisés. De nombreuses régions du pays ont des programmes de recyclage qui se concentrent sur un ou plusieurs plastiques de base auxquels un code de recyclage a été attribué (Figure\(\PageIndex{8}\)). Ces opérations sont en vigueur depuis les années 1970 et ont fait de la production de certains plastiques l'une des opérations industrielles les plus efficaces aujourd'hui.
Le nom d'un alcène est dérivé du nom de l'alcane ayant le même nombre d'atomes de carbone. La présence de la double liaison est indiquée en remplaçant le suffixe -ane par le suffixe -ene. L'emplacement de la double liaison est identifié en nommant le plus petit des nombres d'atomes de carbone participant à la double liaison :
Isomères des alcènes
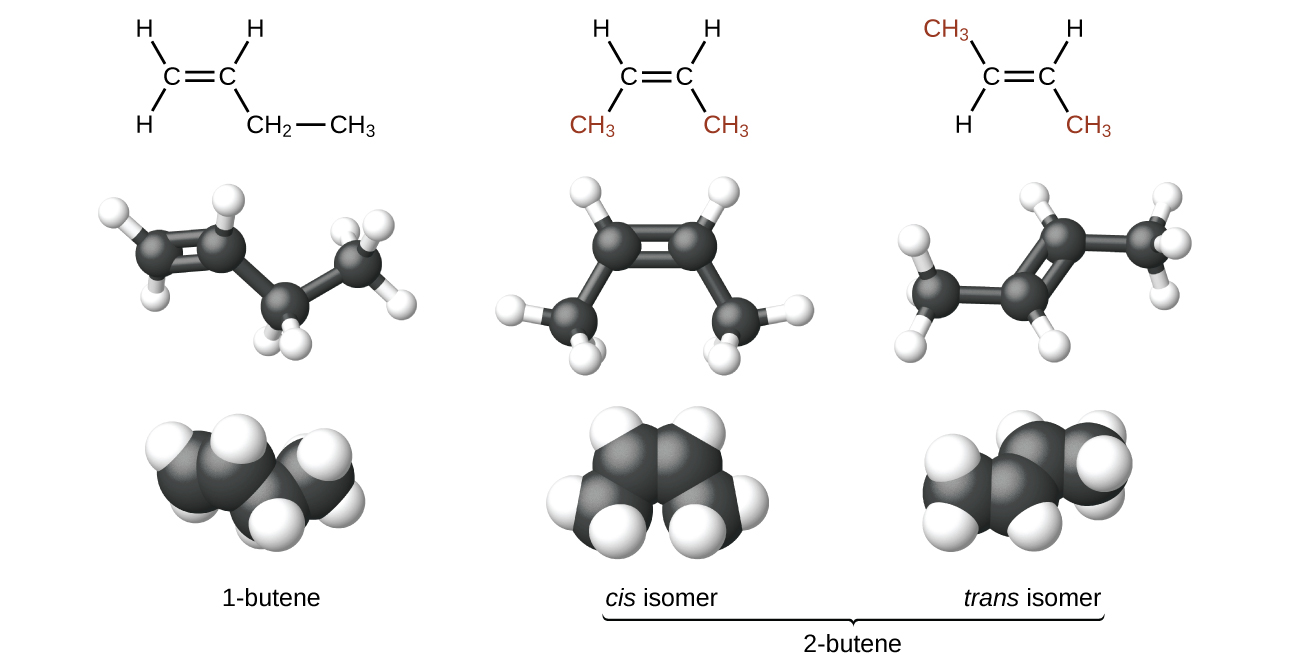
Les molécules du butène-1 et du butène-2 sont des isomères structuraux ; la disposition des atomes dans ces deux molécules est différente. À titre d'exemple de différences d'arrangement, le premier atome de carbone du butène-1 est lié à deux atomes d'hydrogène ; le premier atome de carbone du butène-2 est lié à trois atomes d'hydrogène.
Le composé 2-butène et certains autres alcènes forment également un second type d'isomère appelé isomère géométrique. Dans un ensemble d'isomères géométriques, les mêmes types d'atomes sont liés les uns aux autres dans le même ordre, mais les géométries des deux molécules diffèrent. Les isomères géométriques des alcènes diffèrent quant à l'orientation des groupes situés de part et d'autre d'une\(\mathrm{C=C}\) liaison.
Les atomes de carbone sont libres de tourner autour d'une simple liaison, mais pas autour d'une double liaison ; une double liaison est rigide. Cela permet d'avoir deux isomères du 2-butène, l'un avec les deux groupes méthyle du même côté de la double liaison et l'autre avec les groupes méthyle sur les côtés opposés. Lorsque les structures du butène sont tracées avec des angles de liaison de 120° autour des atomes de carbone hybrides sp 2 participant à la double liaison, les isomères sont apparents. L'isomère du 2-butène dans lequel les deux groupes méthyle se trouvent sur le même côté est appelé isomère cis ; celui dans lequel les deux groupes méthyle se trouvent sur des côtés opposés est appelé isomère trans (Figure\(\PageIndex{9}\)). Les différentes géométries produisent différentes propriétés physiques, telles que le point d'ébullition, qui peuvent rendre possible la séparation des isomères :
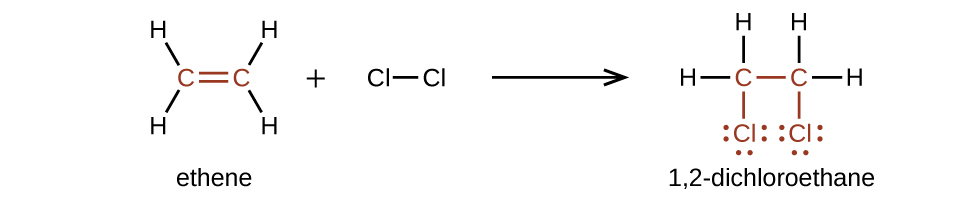
Les alcènes sont beaucoup plus réactifs que les alcanes car la\(\mathrm{C=C}\) fraction est un groupe fonctionnel réactif. Une liaison π, étant une liaison plus faible, est perturbée beaucoup plus facilement qu'une liaison σ. Ainsi, les alcènes subissent une réaction caractéristique au cours de laquelle la liaison π est rompue et remplacée par deux liaisons σ. Cette réaction est appelée réaction d'addition. L'hybridation des atomes de carbone dans la double liaison d'un alcène passe de sp 2 à sp 3 au cours d'une réaction d'addition. Par exemple, les halogènes s'ajoutent à la double liaison d'un alcène au lieu de remplacer l'hydrogène, comme c'est le cas dans un alcane :
Indiquez les noms IUPAC du réactif et du produit de la réaction d'halogénation présentés ici :
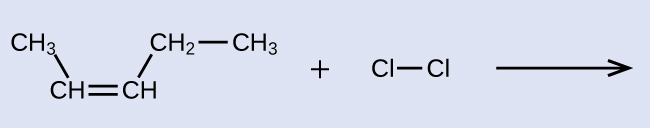
Solution
Le réactif est une chaîne à cinq carbones qui contient une double liaison carbone-carbone, de sorte que le nom de base sera pentène. Nous commençons à compter à l'extrémité de la chaîne la plus proche de la double liaison, dans ce cas, à partir de la gauche. La double liaison couvre les carbones 2 et 3, de sorte que le nom devient 2-pentène. Comme deux groupes contenant du carbone sont attachés aux deux atomes de carbone de la double liaison, et qu'ils se trouvent du même côté de la double liaison, cette molécule est l'isomère cis, d'où le nom de l'alcène de départ cis -2-pentène. Le produit de la réaction d'halogénation aura deux atomes de chlore attachés aux atomes de carbone qui faisaient partie de la double liaison carbone-carbone :
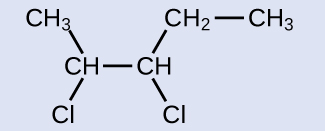
Cette molécule est maintenant un alcane substitué et sera nommée ainsi. La base du nom sera le pentane. Nous compterons à partir de la fin, les atomes de carbone auxquels les atomes de chlore sont attachés sous forme de 2 et 3, d'où le nom du produit 2,3-dichloropentane.
Donnez le nom du réactif et du produit de la réaction indiquée :
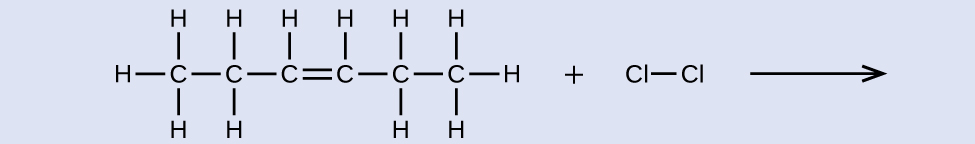
- Réponse
-
réactif : cis-3-hexène, produit : 3,4-dichlorohexane
Alcynes
Les molécules d'hydrocarbures comportant une ou plusieurs liaisons triples sont appelées alcynes ; elles constituent une autre série d'hydrocarbures insaturés. Deux atomes de carbone reliés par une triple liaison sont liés ensemble par une liaison σ et deux liaisons π. Les carbones hybrides sp impliqués dans la triple liaison ont des angles de liaison de 180°, ce qui donne à ces types de liaisons une forme linéaire en forme de bâtonnet.
Le membre le plus simple de la série des alcynes est l'éthyne, C 2 H 2, communément appelé acétylène. La structure de Lewis de l'éthyne, une molécule linéaire, est la suivante :
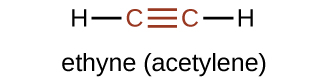
La nomenclature IUPAC pour les alcynes est similaire à celle des alcènes, sauf que le suffixe -yne est utilisé pour indiquer une triple liaison dans la chaîne. Par exemple,\(\mathrm{CH_3CH_2C≡CH}\) est appelé 1-butyne.
Décrivez la géométrie et l'hybridation des atomes de carbone dans la molécule suivante :
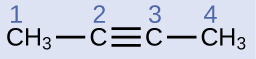
Solution
Les atomes de carbone 1 et 4 possèdent quatre liaisons simples et sont donc tétraédriques avec hybridation sp 3. Les atomes de carbone 2 et 3 sont impliqués dans la triple liaison, ils ont donc des géométries linéaires et seraient classés comme des hybrides sp.
Identifiez les angles d'hybridation et de liaison au niveau des atomes de carbone de la molécule présentée :
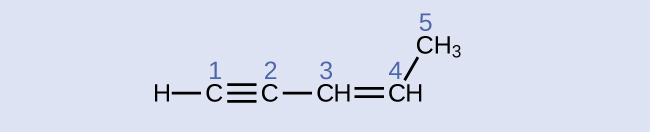
- Réponse
-
carbone 1 : sp, 180° ; carbone 2 : sp, 180° ; carbone 3 : sp 2, 120° ; carbone 4 : sp 2, 120° ; carbone 5 : sp 3, 109,5°
Chimiquement, les alcynes sont similaires aux alcènes. Comme le groupe\(\mathrm{C≡C}\) fonctionnel possède deux liaisons π, les alcynes réagissent généralement encore plus facilement et réagissent avec deux fois plus de réactif en plus de réactions. La réaction de l'acétylène avec le brome en est un exemple typique :
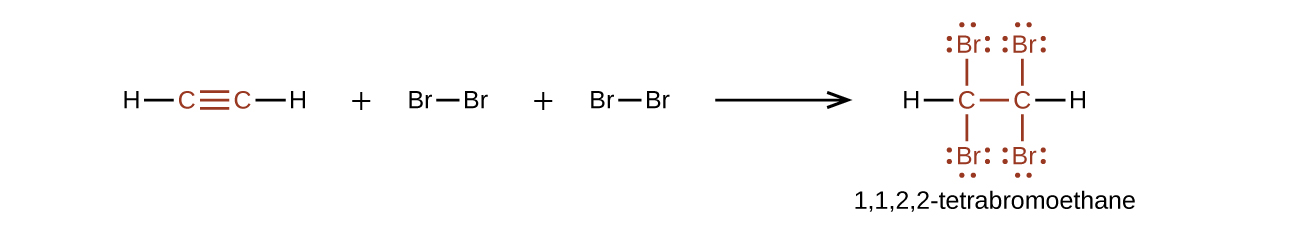
L'acétylène et les autres alcynes brûlent également facilement. Une torche à acétylène tire parti de la chaleur de combustion élevée de l'acétylène.
Hydrocarbures aromatiques
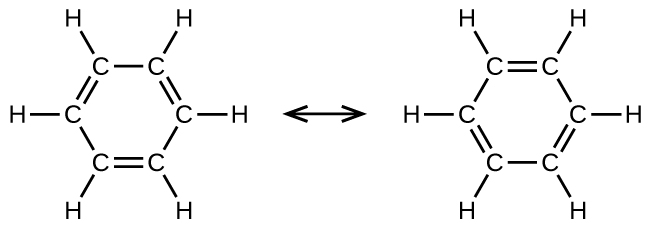
Le benzène, C 6 H 6, est le membre le plus simple d'une grande famille d'hydrocarbures, appelés hydrocarbures aromatiques. Ces composés contiennent des structures cycliques et présentent des liaisons qui doivent être décrites à l'aide du concept hybride de résonance de la théorie des liaisons de valence ou du concept de délocalisation de la théorie des orbitales moléculaires. (Pour passer en revue ces concepts, reportez-vous aux chapitres précédents sur les liaisons chimiques). Les structures de résonance du benzène, C 6 H 6, sont les suivantes :

Il existe de nombreux dérivés du benzène. Les atomes d'hydrogène peuvent être remplacés par de nombreux substituants différents. Les composés aromatiques subissent plus facilement des réactions de substitution que des réactions d'addition ; le remplacement de l'un des atomes d'hydrogène par un autre substituant laissera intactes les doubles liaisons délocalisées. Voici des exemples typiques de dérivés du benzène substitués :
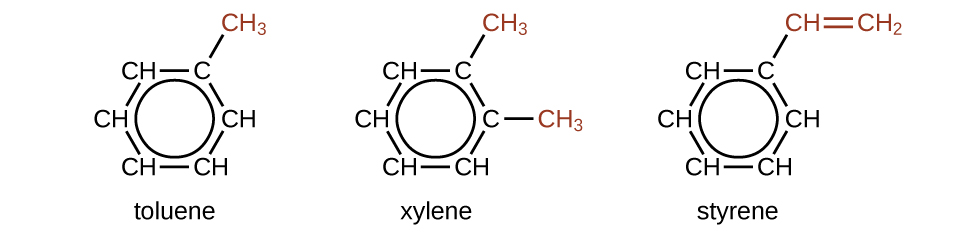
Le toluène et le xylène sont des solvants et des matières premières importants dans l'industrie chimique. Le styrène est utilisé pour produire le polystyrène polymère.
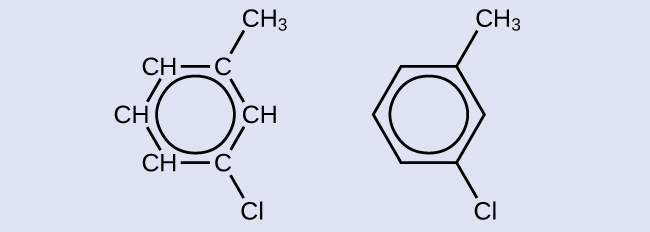
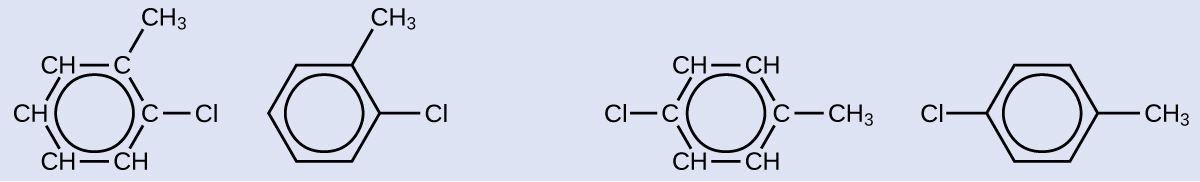
Un isomère possible créé par une réaction de substitution qui remplace un atome d'hydrogène lié au cycle aromatique du toluène par un atome de chlore est présenté ici. Dessinez deux autres isomères possibles dans lesquels l'atome de chlore remplace un atome d'hydrogène différent attaché au cycle aromatique :
Solution
Comme le cycle à six carbones avec des liaisons doubles alternées est nécessaire pour que la molécule soit classée comme aromatique, les isomères appropriés ne peuvent être produits qu'en modifiant la position du substituant chlore par rapport au substituant méthyle :
Dessiner trois isomères d'un composé cyclique aromatique à six chaînons substitué par deux bromes.
- Réponse
-
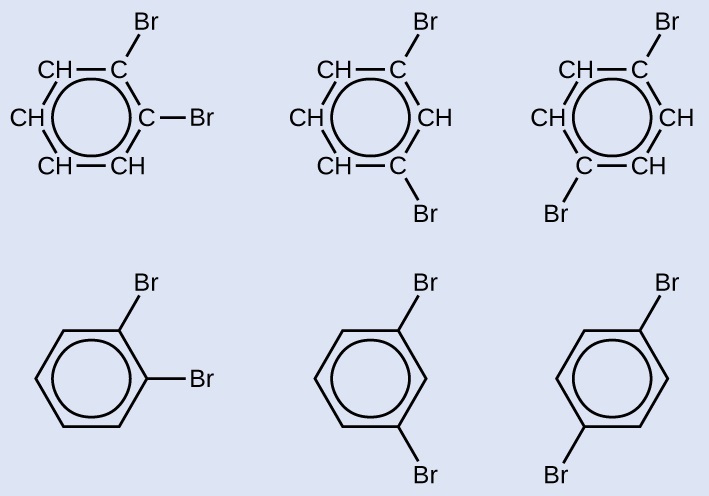
Trois paires de formules structurelles sont présentées. Le premier possède un cycle hydrocarboné à six carbones dans lequel quatre des atomes de C sont chacun liés à un seul atome H. En haut à droite et à droite du cycle, les deux atomes C qui n'ont pas d'atomes H liés ont un atome B r lié chacun. Un cercle se trouve au centre de l'anneau. Sous cette structure, une structure similaire est représentée, avec un hexagone avec un cercle à l'intérieur. À partir des sommets de l'hexagone en haut à droite et à droite, des atomes B r uniques sont attachés. Le second possède un cycle hydrocarboné à six carbones dans lequel quatre des atomes de C sont chacun liés à un seul atome de H. En haut à droite et en bas à droite du cycle, les deux atomes C qui n'ont pas d'atomes H liés ont un seul atome B r lié chacun. Un cercle se trouve au centre de l'anneau. Sous cette structure, une structure similaire est représentée, avec un hexagone avec un cercle à l'intérieur. À partir des sommets de l'hexagone en haut à droite et en bas à droite, des atomes B r uniques sont attachés. Le troisième possède un cycle hydrocarboné à six carbones dans lequel quatre des atomes de C sont chacun liés à un seul atome de H. En haut à droite et en bas à gauche du cycle, les deux atomes C qui n'ont pas d'atomes H liés ont des atomes B r liés. Un cercle se trouve au centre de l'anneau. Sous cette structure, une structure similaire est représentée, avec un hexagone avec un cercle à l'intérieur. À partir des sommets de l'hexagone en haut à droite et en bas à gauche, des atomes B r uniques sont attachés.
Résumé
Des liaisons solides et stables entre les atomes de carbone produisent des molécules complexes contenant des chaînes, des branches et des cycles. La chimie de ces composés est appelée chimie organique. Les hydrocarbures sont des composés organiques composés uniquement de carbone et d'hydrogène. Les alcanes sont des hydrocarbures saturés, c'est-à-dire des hydrocarbures qui ne contiennent que des liaisons simples. Les alcènes contiennent une ou plusieurs doubles liaisons carbone-carbone. Les alcynes contiennent une ou plusieurs liaisons triples carbone-carbone. Les hydrocarbures aromatiques contiennent des structures cycliques avec des systèmes d'électrons π délocalisés.
Notes
- Il s'agit de la base de données Beilstein, désormais disponible sur le site Reaxys (www.elsevier.com/online-tools/reaxys).
- Peplow, Mark. « Synthèse organique : le robo-chimiste », Nature 512 (2014) : 20—2.
- Les propriétés physiques du C 4 H 10 et des molécules plus lourdes sont celles de l'isomère normal, du n-butane, du n-pentane, etc.
- STP indique une température de 0 °C et une pression de 1 atm.
Lexique
- réaction d'addition
- réaction dans laquelle une double liaison carbone-carbone forme une liaison carbone-carbone unique par addition d'un réactif. Réaction typique pour un alcène.
- alcane
- molécule composée uniquement d'atomes de carbone et d'hydrogène reliés par des liaisons simples (σ)
- alcène
- molécule constituée de carbone et d'hydrogène contenant au moins une double liaison carbone-carbone
- groupe alkyle
- substituant, constitué d'un alcane dépourvu d'un atome d'hydrogène, attaché à une structure plus grande
- alcyne
- molécule constituée de carbone et d'hydrogène contenant au moins une triple liaison carbone-carbone
- hydrocarbure aromatique
- molécule cyclique composée de carbone et d'hydrogène avec des liaisons simples et doubles alternées carbone-carbone délocalisées, résultant en une stabilité accrue
- groupe fonctionnel
- partie d'une molécule organique qui confère à la molécule une réactivité chimique spécifique
- composé organique
- composé naturel ou synthétique contenant du carbone
- hydrocarbure saturé
- molécule contenant du carbone et de l'hydrogène qui ne possède que des liaisons simples entre les atomes de carbone
- structure squelettique
- méthode abrégée pour dessiner des molécules organiques dans laquelle les atomes de carbone sont représentés par les extrémités des lignes et les courbes entre les lignes, et les atomes d'hydrogène attachés aux atomes de carbone ne sont pas représentés (mais sont considérés comme étant présents selon le contexte de la structure)
- substituant
- branche ou groupe fonctionnel qui remplace les atomes d'hydrogène dans une plus grande chaîne hydrocarbonée
- réaction de substitution
- réaction dans laquelle un atome en remplace un autre dans une molécule


