18.9 : Présence, préparation et composés de l'oxygène
- Page ID
- 193963
- Décrire les propriétés, la préparation et les composés de l'oxygène
- Décrire la préparation, les propriétés et les utilisations de certains oxydes, peroxydes et hydroxydes métalliques représentatifs
L'oxygène est l'élément le plus abondant de la croûte terrestre. La surface de la Terre est composée de la croûte, de l'atmosphère et de l'hydrosphère. Environ 50 % de la masse de la croûte terrestre est constituée d'oxygène (combiné à d'autres éléments, principalement du silicium). L'oxygène se présente sous forme de molécules d'O 2 et, dans une moindre mesure, de molécules d'O 3 (ozone) dans l'air. Il forme environ 20 % de la masse de l'air. Environ 89 % de l'eau en masse est constituée d'oxygène combiné. Combiné au carbone, à l'hydrogène et à l'azote, l'oxygène constitue une partie importante des plantes et des animaux.
L'oxygène est un gaz incolore, inodore et insipide à des températures ordinaires. Il est légèrement plus dense que l'air. Bien qu'il ne soit que légèrement soluble dans l'eau (49 ml de gaz se dissolvent dans 1 L au STP), la solubilité de l'oxygène est très importante pour la vie aquatique.
La majeure partie de l'oxygène isolé commercialement provient de l'air et le reste de l'électrolyse de l'eau. La séparation de l'oxygène de l'air commence par le refroidissement et la compression de l'air jusqu'à ce qu'il se liquéfie. Lorsque l'air liquide se réchauffe, l'oxygène dont le point d'ébullition est le plus élevé (90 K) se sépare de l'azote, dont le point d'ébullition est plus bas (77 K). Il est possible de séparer les autres composants de l'air en même temps en fonction des différences de leurs points d'ébullition.
L'oxygène est essentiel dans les processus de combustion tels que la combustion de combustibles. Les plantes et les animaux utilisent l'oxygène de l'air pour respirer. L'administration d'air enrichi en oxygène est une pratique médicale importante lorsqu'un patient ne reçoit pas suffisamment d'oxygène en raison d'un choc, d'une pneumonie ou d'une autre maladie.
L'industrie chimique utilise l'oxygène pour oxyder de nombreuses substances. Une quantité importante d'oxygène produite commercialement joue un rôle important dans l'élimination du carbone du fer lors de la production d'acier. De grandes quantités d'oxygène pur sont également nécessaires à la fabrication des métaux ainsi qu'à la découpe et au soudage des métaux à l'aide de torches à oxyhydrogène et à oxyacétylène.
L'oxygène liquide est important pour l'industrie spatiale. C'est un agent oxydant dans les moteurs-fusées. C'est également la source d'oxygène gazeux nécessaire à la vie dans l'espace.
Comme nous le savons, l'oxygène est très important pour la vie. L'énergie nécessaire au maintien des fonctions normales de l'organisme chez l'homme et chez d'autres organismes provient de l'oxydation lente des composés chimiques. L'oxygène est le dernier agent oxydant de ces réactions. Chez l'homme, l'oxygène passe des poumons dans le sang, où il se combine à l'hémoglobine, produisant de l'oxyhémoglobine. Sous cette forme, le sang transporte l'oxygène vers les tissus, où il est transféré vers les tissus. Les produits ultimes sont le dioxyde de carbone et l'eau. Le sang transporte le dioxyde de carbone par les veines jusqu'aux poumons, où le sang libère le dioxyde de carbone et recueille une autre réserve d'oxygène. La digestion et l'assimilation des aliments régénèrent les matières consommées par oxydation dans l'organisme ; l'énergie libérée est la même que si les aliments brûlent à l'extérieur du corps.
Les plantes vertes reconstituent continuellement l'oxygène de l'atmosphère par un processus appelé photosynthèse. Les produits de la photosynthèse peuvent varier, mais, en général, le processus convertit le dioxyde de carbone et l'eau en glucose (un sucre) et en oxygène en utilisant l'énergie de la lumière :
\ [\ begin {alignat} {3}
& \ ce {6CO2} (g) \ :+ \ : && \ ce {6H2O} (l)
\ : \ mathrm {\ underset {light} {\ flèche droite {chlorophylle}}} \ :
&& \ ce {C6H12O6} (aq) \ :+ \ : && \ ce {6O2} (g) \
& \ mathrm {carbone \ \ dioxyde} && \ ce {eau} && \ ce { glucose} && \ ce {oxygène}
\ end {alignat} \ nonnumber \]
Ainsi, l'oxygène qui est devenu du dioxyde de carbone et de l'eau par les processus métaboliques des plantes et des animaux retourne dans l'atmosphère par photosynthèse.
Lorsque de l'oxygène sec passe entre deux plaques chargées électriquement, de l'ozone (O 3, illustré sur la figure\(\PageIndex{1}\)), un allotrope d'oxygène possédant une odeur particulière, se forme. La formation d'ozone à partir de l'oxygène est une réaction endothermique dans laquelle l'énergie provient d'une décharge électrique, de la chaleur ou de la lumière ultraviolette :
\[\ce{3O2}(g)\xrightarrow{\ce{electric\: discharge}}\ce{2O3}(g) \hspace{20px} ΔH°=\mathrm{287\: kJ} \nonumber \]
L'odeur forte associée aux étincelles des équipements électriques est due, en partie, à l'ozone.
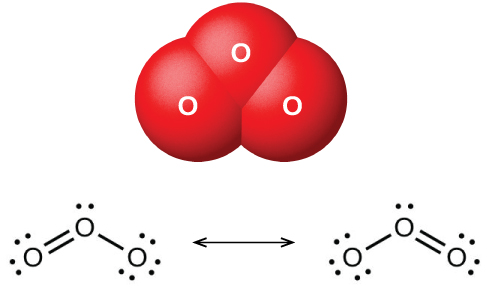
L'ozone se forme naturellement dans la haute atmosphère sous l'action de la lumière ultraviolette du soleil sur l'oxygène qui s'y trouve. La majeure partie de l'ozone atmosphérique se trouve dans la stratosphère, une couche de l'atmosphère s'étendant d'environ 10 à 50 kilomètres au-dessus de la surface de la Terre. Cet ozone agit comme une barrière contre les rayons ultraviolets nocifs du soleil en l'absorbant par une réaction de décomposition chimique :
\[\ce{O3}(g)\xrightarrow{\ce{ultraviolet\: light}}\ce{O}(g)+\ce{O2}(g) \nonumber \]
Les atomes d'oxygène réactifs se recombinent avec l'oxygène moléculaire pour terminer le cycle de l'ozone. La présence d'ozone stratosphérique réduit la fréquence des cancers de la peau et d'autres effets nocifs des rayons ultraviolets. Il a été clairement démontré que les chlorofluorocarbures, les CFC (connus dans le commerce sous le nom de fréons), qui étaient présents sous forme de propulseurs d'aérosol dans les bombes aérosols et de réfrigérants, entraînaient l'appauvrissement de la couche d'ozone dans la stratosphère. Cela s'est produit parce que la lumière ultraviolette provoque également la décomposition des CFC, produisant du chlore atomique. Les atomes de chlore réagissent avec les molécules d'ozone, ce qui entraîne une élimination nette des molécules d'O 3 de la stratosphère. Ce processus est exploré en détail dans notre couverture de la cinétique chimique. Des efforts sont déployés à l'échelle mondiale pour réduire la quantité de CFC utilisés à des fins commerciales, et la taille du trou dans la couche d'ozone commence déjà à diminuer à mesure que les concentrations atmosphériques de chlore atomique diminuent. Alors que l'ozone de la stratosphère contribue à nous protéger, l'ozone de la troposphère est un problème. Cet ozone est un composant toxique du smog photochimique.
Les utilisations de l'ozone dépendent de sa réactivité avec d'autres substances. Il peut être utilisé comme agent de blanchiment pour les huiles, les cires, les tissus et l'amidon : il oxyde les composés colorés de ces substances en composés incolores. C'est une alternative au chlore comme désinfectant pour l'eau.
Réactions
L'oxygène élémentaire est un agent oxydant puissant. Il réagit avec la plupart des autres éléments et de nombreux composés.
Réaction avec les éléments
L'oxygène réagit directement à température ambiante ou à des températures élevées avec tous les autres éléments, à l'exception des gaz rares, des halogènes et de quelques métaux de transition de deuxième et troisième rangées à faible réactivité (ceux dont le potentiel de réduction est supérieur à celui du cuivre). La rouille est un exemple de réaction de l'oxygène avec le fer. Les métaux les plus actifs forment des peroxydes ou des superoxydes. Les métaux moins actifs et les non-métaux produisent des oxydes. Voici deux exemples de ces réactions :
\[\ce{2Mg}(s)+\ce{O2}(g)⟶\ce{2MgO}(s) \nonumber \]
\[\ce{P4}(s)+\ce{5O2}(g)⟶\ce{P4O10}(s) \nonumber \]
Les oxydes d'halogènes, au moins l'un des gaz rares et les métaux ayant un potentiel de réduction supérieur à celui du cuivre ne se forment pas par action directe des éléments avec l'oxygène.
Réaction avec des composés
L'oxygène élémentaire réagit également avec certains composés. S'il est possible d'oxyder l'un des éléments d'un composé donné, une oxydation supplémentaire par l'oxygène peut se produire. Par exemple, le sulfure d'hydrogène, H 2 S, contient du soufre avec un état d'oxydation de 2−. Comme le soufre ne présente pas son état d'oxydation maximal, on peut s'attendre à ce que l'H 2 S réagisse avec l'oxygène. C'est le cas, produisant de l'eau et du dioxyde de soufre. La réaction est la suivante :
\[\ce{2H2S}(g)+\ce{3O2}(g)⟶\ce{2H2O}(l)+\ce{2SO2}(g) \nonumber \]
Il est également possible d'oxyder des oxydes tels que le CO et le P 4 O 6 qui contiennent un élément présentant un état d'oxydation inférieur. La facilité avec laquelle l'oxygène élémentaire capte les électrons se reflète dans la difficulté d'éliminer les électrons de l'oxygène de la plupart des oxydes. Parmi les éléments, seul le fluor très réactif peut oxyder les oxydes pour former de l'oxygène gazeux.
Oxydes, peroxydes et hydroxydes
Les composés des métaux représentatifs avec de l'oxygène se répartissent en trois catégories : (1) les oxydes contenant des ions oxydes, O 2 − ; (2) les peroxydes, contenant des ions peroxydes\(\ce{O2^2-}\), avec des liaisons simples covalentes oxygène-oxygène et un nombre très limité de superoxydes, contenant des ions superoxydes\(\ce{O2-}\), avec des liaisons covalentes oxygène-oxygène ayant un ordre de liaison de\(\frac{3}{2}\), En outre, il existe (3) des hydroxydes contenant des ions hydroxyde, OH −. Tous les métaux représentatifs forment des oxydes. Certains des métaux du groupe 2 forment également des peroxydes, MO 2, et les métaux du groupe 1 forment également des peroxydes, M 2 O 2, et des superoxydes, MO 2.
oxydes
Il est possible de produire les oxydes des métaux les plus représentatifs en chauffant les hydroxydes (formant l'oxyde et l'eau gazeuse) ou les carbonates (formant l'oxyde et le CO 2 gazeux) correspondants. Les équations, par exemple les réactions, sont
\[\ce{2Al(OH)3}(s)\xrightarrow{Δ}\ce{Al2O3}(s)+\ce{3H2O}(g) \nonumber \]
\[\ce{CaCO3}(s)\xrightarrow{Δ}\ce{CaO}(s)+\ce{CO2}(g) \nonumber \]
Cependant, les sels de métaux alcalins sont généralement très stables et ne se décomposent pas facilement lorsqu'ils sont chauffés. Les oxydes de métaux alcalins résultent des réactions d'oxydoréduction créées par le chauffage de nitrates ou d'hydroxydes avec les métaux. Les équations pour les réactions des échantillons sont :
\[\ce{2KNO3}(s)+\ce{10K}(s)\xrightarrow{Δ}\ce{6K2O}(s)+\ce{N2}(g) \nonumber \]
\[\ce{2LiOH}(s)+\ce{2Li}(s)\xrightarrow{Δ}\ce{2Li2O}(s)+\ce{H2}(g) \nonumber \]
À l'exception de l'oxyde de mercure (II), il est possible de produire les oxydes des métaux des groupes 2 à 15 en brûlant le métal correspondant dans l'air. Le membre le plus lourd de chaque groupe, celui pour lequel l'effet de paire inerte est le plus prononcé, forme un oxyde dans lequel l'état d'oxydation de l'ion métallique est inférieur de deux à l'état d'oxydation du groupe (effet de paire inerte). Ainsi, le Tl 2 O, le PbO et le Bi 2 O 3 se forment lors de la combustion du thallium, du plomb et du bismuth, respectivement. Les oxydes des membres les plus légers de chaque groupe présentent l'état d'oxydation du groupe. Par exemple, le SnO 2 se forme en brûlant de l'étain. L'oxyde de mercure (II), HgO, se forme lentement lorsque le mercure est chauffé à moins de 500 °C ; il se décompose à des températures plus élevées.
La combustion des membres des groupes 1 et 2 dans l'air n'est pas une méthode appropriée pour former les oxydes de ces éléments. Ces métaux sont suffisamment réactifs pour se combiner à l'azote de l'air, de sorte qu'ils forment des mélanges d'oxydes et de nitrures ioniques. Plusieurs forment également des peroxydes ou des superoxydes lorsqu'ils sont chauffés à l'air.
Les oxydes ioniques contiennent tous l'ion oxyde, un très puissant accepteur d'ions hydrogène. À l'exception de l'oxyde d'aluminium très insoluble, Al 2 O 3, de l'étain (IV), du SnO 2 et du plomb (IV), PbO 2, les oxydes des métaux représentatifs réagissent avec les acides pour former des sels. Voici quelques équations pour ces réactions :
\[\ce{Na2O}+\ce{2HNO3}(aq)⟶\ce{2NaNO3}(aq)+\ce{H2O}(l) \nonumber \]
\[\ce{CaO}(s)+\ce{2HCL}(aq)⟶\ce{CaCl2}(aq)+\ce{H2O}(l) \nonumber \]
\[\ce{SnO}(s)+\ce{2HClO4}(aq)⟶\ce{Sn(ClO4)2}(aq)+\ce{H2O}(l) \nonumber \]
Les oxydes des métaux des groupes 1 et 2 et de l'oxyde de thallium (I) réagissent avec l'eau et forment des hydroxydes. Voici des exemples de telles réactions :
\[\ce{Na2O}(s)+\ce{H2O}(l)⟶\ce{NaOH}(aq) \nonumber \]
\[\ce{CaO}(s)+\ce{H2O}(l)⟶\ce{Ca(OH)2}(aq) \nonumber \]
\[\ce{Tl2O}(s)+\ce{H2O}(aq)⟶\ce{2TlOH}(aq) \nonumber \]
Les oxydes des métaux alcalins ont peu d'utilité industrielle, contrairement à l'oxyde de magnésium, à l'oxyde de calcium et à l'oxyde d'aluminium. L'oxyde de magnésium joue un rôle important dans la fabrication de briques réfractaires, de creusets, de revêtements de fournaise et d'isolation thermique, des applications qui nécessitent une stabilité chimique et thermique. L'oxyde de calcium, parfois appelé chaux vive ou chaux sur le marché industriel, est très réactif et ses principales utilisations reflètent sa réactivité. L'oxyde de calcium pur émet une lumière blanche intense lorsqu'il est chauffé à haute température (comme illustré dans la Figure\(\PageIndex{2}\):). Des blocs d'oxyde de calcium chauffés par des flammes de gaz servaient de lampes de scène dans les cinémas avant que l'électricité ne soit disponible C'est la source de l'expression « sous les feux de la rampe ».
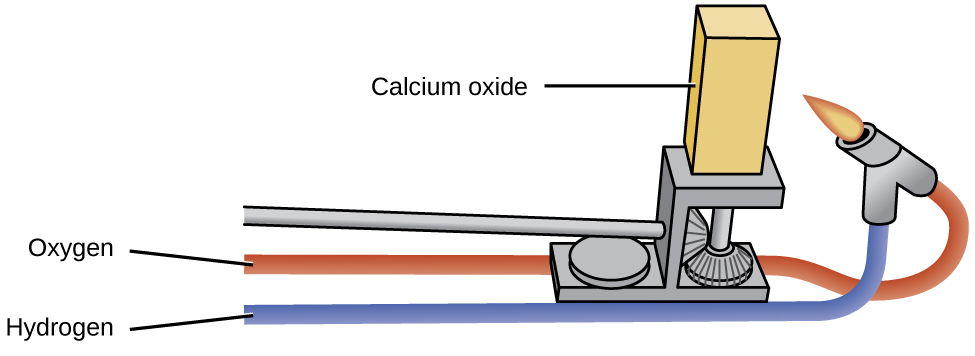
L'oxyde de calcium et l'hydroxyde de calcium sont des bases peu coûteuses largement utilisées dans le traitement chimique, bien que la plupart des produits utiles préparés à partir de ceux-ci ne contiennent pas de calcium. L'oxyde de calcium, CaO, est fabriqué en chauffant du carbonate de calcium, CaCO 3, qui est largement et peu coûteux sous forme de calcaire ou de coquilles d'huîtres :
\[\ce{CaCO3}(s)⟶\ce{CaO}(s)+\ce{CO2}(g) \nonumber \]
Bien que cette réaction de décomposition soit réversible, il est possible d'obtenir un rendement de 100 % en CaO en laissant le CO 2 s'échapper. Il est possible de préparer de l'hydroxyde de calcium par la réaction acide-base habituelle d'un oxyde métallique soluble avec de l'eau :
\[\ce{CaO}(s)+\ce{H2O}(l)⟶\ce{Ca(OH)2}(s) \nonumber \]
Le CaO et le Ca (OH) 2 sont tous deux utiles comme bases ; ils acceptent les protons et neutralisent les acides.
L'alumine (Al 2 O 3) est présente dans la nature sous forme de corindon minéral, une substance très dure utilisée comme abrasif pour le meulage et le polissage. Le corindon est important pour le commerce des bijoux au même titre que le rubis et le saphir. La couleur du rubis est due à la présence d'une petite quantité de chrome ; d'autres impuretés produisent la grande variété de couleurs possible pour les saphirs. Les rubis et saphirs artificiels sont maintenant fabriqués en faisant fondre de l'oxyde d'aluminium (point de fusion = 2050 °C) avec de petites quantités d'oxydes pour produire les couleurs souhaitées et en refroidissant la masse fondue de manière à produire de gros cristaux. Les lasers à rubis utilisent des cristaux synthétiques.
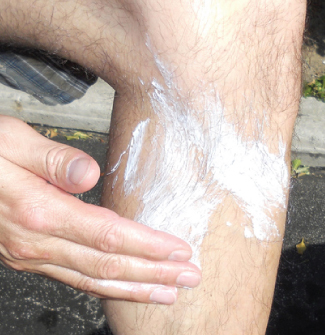
L'oxyde de zinc, ZnO, était un pigment utile pour la peinture blanche ; toutefois, les polluants ont tendance à décolorer le composé. Le composé joue également un rôle important dans la fabrication de pneus automobiles et d'autres articles en caoutchouc, ainsi que dans la préparation de pommades médicinales. Par exemple, les écrans solaires à base d'oxyde de zinc, comme le montre la figure\(\PageIndex{3}\), aident à prévenir les coups de soleil. L'oxyde de zinc contenu dans ces écrans solaires est présent sous forme de très petits grains appelés nanoparticules. Le dioxyde de plomb est un constituant des batteries de stockage au plomb chargées. Le plomb (IV) tend à redevenir l'ion plomb (II), plus stable, en gagnant deux électrons. Le dioxyde de plomb est donc un puissant agent oxydant.
Peroxydes et superoxydes
Les peroxydes et les superoxydes sont de puissants oxydants et jouent un rôle important dans les processus chimiques. Le peroxyde d'hydrogène, H 2 O 2, préparé à partir de peroxydes métalliques, est un agent de blanchiment et un désinfectant importants. Les peroxydes et les superoxydes se forment lorsque le métal ou les oxydes métalliques des groupes 1 et 2 réagissent avec l'oxygène pur à des températures élevées. Le peroxyde de sodium et les peroxydes de calcium, de strontium et de baryum se forment en chauffant le métal ou l'oxyde métallique correspondant dans de l'oxygène pur :
\[\ce{2Na}(s)+\ce{O2}(g)\xrightarrow{Δ}\ce{Na2O2}(s) \nonumber \]
\[\ce{2Na2O}(s)+\ce{O2}(g)\xrightarrow{Δ}\ce{2Na2O2}(s) \nonumber \]
\[\ce{2SrO}(s)+\ce{O2}(g)\xrightarrow{Δ}\ce{2SrO2}(s) \nonumber \]
Les peroxydes de potassium, de rubidium et de césium peuvent être préparés en chauffant le métal ou son oxyde dans une quantité d'oxygène soigneusement contrôlée :
\[\ce{2K}(s)+\ce{O2}(g)⟶\ce{K2O2}(s) \hspace{20px} \mathrm{(2\:mol\: K\: per\: mol\: O_2)} \nonumber \]
Avec un excès d'oxygène, les superoxydes KO 2, RbO 2 et CsO 2 se forment. Par exemple :
\[\ce{K}(s)+\ce{O2}(g)⟶\ce{KO2}(s) \hspace{20px} \ce{(1\: mol\: K\: per\: mol\: O_2)} \nonumber \]
La stabilité des peroxydes et des superoxydes des métaux alcalins augmente à mesure que la taille du cation augmente.
Hydroxydes
Les hydroxydes sont des composés qui contiennent l'ion OH −. Il est possible de préparer ces composés par deux types généraux de réactions. Des hydroxydes métalliques solubles peuvent être produits par réaction du métal ou de l'oxyde métallique avec de l'eau. Des hydroxydes métalliques insolubles se forment lorsqu'une solution d'un sel soluble du métal se combine à une solution contenant des ions hydroxyde.
À l'exception du béryllium et du magnésium, les métaux des groupes 1 et 2 réagissent avec l'eau pour former des hydroxydes et de l'hydrogène gazeux. Des exemples de telles réactions incluent :
\[\ce{2Li}(s)+\ce{2H2O}(l)⟶\ce{2LiOH}(aq)+\ce{H2}(g) \nonumber \]
\[\ce{Ca}(s)+\ce{2H2O}(l)⟶\ce{Ca(OH)2}(aq)+\ce{H2}(g) \nonumber \]
Cependant, ces réactions peuvent être violentes et dangereuses ; il est donc préférable de produire des hydroxydes métalliques solubles par réaction de l'oxyde concerné avec de l'eau :
\[\ce{Li2O}(s)+\ce{H2O}(l)⟶\ce{2LiOH}(aq) \nonumber \]
\[\ce{CaO}(s)+\ce{H2O}(l)⟶\ce{Ca(OH)2}(aq) \nonumber \]
La plupart des oxydes métalliques sont des anhydrides de base. Cela est évident pour les oxydes solubles car ils forment des hydroxydes métalliques. La plupart des autres oxydes métalliques sont insolubles et ne forment pas d'hydroxydes dans l'eau ; toutefois, ils restent des anhydrides basiques car ils réagissent avec les acides.
Il est possible de préparer les hydroxydes insolubles de béryllium, de magnésium et d'autres métaux représentatifs en ajoutant de l'hydroxyde de sodium à une solution d'un sel du métal concerné. Les équations ioniques nettes pour les réactions impliquant un sel de magnésium, un sel d'aluminium et un sel de zinc sont les suivantes :
\[\ce{Mg^2+}(aq)+\ce{2OH-}(aq)⟶\ce{Mg(OH)2}(s) \nonumber \]
\[\ce{Al^3+}(aq)+\ce{3OH-}(aq)⟶\ce{Al(OH)3}(s) \nonumber \]
\[\ce{Zn^2+}(aq)+\ce{2OH-}(aq)⟶\ce{Zn(OH)2}(s) \nonumber \]
Un excès d'hydroxyde doit être évité lors de la préparation des hydroxydes d'aluminium, de gallium, de zinc et d'étain (II), sinon les hydroxydes se dissoudront avec la formation des ions complexes correspondants :\(\ce{Al(OH)4-}\)\(\ce{Ga(OH)4-}\)\(\ce{Zn(OH)4^2-}\),, et\(\ce{Sn(OH)3-}\) (Figure\(\PageIndex{4}\)). L'aspect important des ions complexes pour ce chapitre est qu'ils se forment par une réaction acide-base de Lewis, le métal étant l'acide de Lewis.

L'industrie utilise de grandes quantités d'hydroxyde de sodium comme base solide et bon marché. Le chlorure de sodium est le matériau de départ pour la production de NaOH, car le NaCl est un matériau de départ moins cher que l'oxyde. L'hydroxyde de sodium figure parmi les 10 principaux produits chimiques produits aux États-Unis, et cette production a été presque entièrement réalisée par électrolyse de solutions de chlorure de sodium. Ce procédé est le procédé chlore-alcali, et c'est la principale méthode de production de chlore.
L'hydroxyde de sodium est un composé ionique qui fond sans se décomposer. Il est très soluble dans l'eau, dégage beaucoup de chaleur et forme des solutions très basiques : 40 grammes d'hydroxyde de sodium se dissolvent dans seulement 60 grammes d'eau à 25 °C. L'hydroxyde de sodium est utilisé dans la production d'autres composés du sodium et est utilisé pour neutraliser les solutions acides lors de la production de d'autres produits chimiques tels que les produits pétrochimiques et les polymères.
De nombreuses applications des hydroxydes concernent la neutralisation d'acides (comme l'antiacide illustré sur la figure\(\PageIndex{5}\)) et la préparation d'oxydes par décomposition thermique. Une suspension aqueuse d'hydroxyde de magnésium constitue le lait antiacide de magnésie. En raison de sa disponibilité immédiate (résultant de la réaction de l'eau avec de l'oxyde de calcium préparé par décomposition du calcaire, CaCO 3), de son faible coût et de son activité, l'hydroxyde de calcium est largement utilisé dans les applications commerciales nécessitant une base solide et bon marché. La réaction des hydroxydes avec les acides appropriés est également utilisée pour préparer des sels.

Le procédé chlore-alcali
Bien qu'ils soient très différents sur le plan chimique, il existe un lien entre le chlore et l'hydroxyde de sodium, car il existe un important processus électrochimique qui produit les deux produits simultanément. Le procédé connu sous le nom de procédé chlore-alcali utilise du chlorure de sodium, qui se trouve dans de grands gisements dans de nombreuses régions du monde. Il s'agit d'un processus électrochimique qui permet d'oxyder l'ion chlorure en chlore et de générer de l'hydroxyde de sodium.
Le passage d'un courant continu d'électricité à travers une solution de NaCl provoque la migration des ions chlorure vers l'électrode positive, où l'oxydation en chlore gazeux se produit lorsque l'ion transmet un électron à l'électrode :
\[\ce{2Cl-}(aq)⟶\ce{Cl2}(g)+\ce{2e-} \hspace{20px} \textrm{(at the positive electrode)} \nonumber \]
Les électrons produits traversent le circuit électrique extérieur jusqu'à l'électrode négative. Bien que les ions sodium positifs migrent vers cette électrode négative, le sodium métallique ne se forme pas car les ions sodium sont trop difficiles à réduire dans les conditions utilisées. (Rappelez-vous que le sodium métallique est suffisamment actif pour réagir avec l'eau et que, par conséquent, même s'il est produit, il réagirait immédiatement avec l'eau pour produire à nouveau des ions sodium.) Au lieu de cela, les molécules d'eau captent les électrons de l'électrode et subissent une réduction pour former de l'hydrogène gazeux et des ions hydroxyde :
\[\ce{2H2O}(l)+\ce{2e-}\textrm{ (from the negative electrode)}⟶\ce{H2}(g)+\ce{2OH-}(aq) \nonumber \]
Le résultat global est la conversion de la solution aqueuse de NaCl en une solution aqueuse de NaOH, de Cl 2 gazeux et de H 2 gazeux :
\[\ce{2Na+}(aq)+\ce{2Cl-}(aq)+\ce{2H2O}(l)\xrightarrow{\ce{electrolysis}}\ce{2Na+}(aq)+\ce{2OH-}(aq)+\ce{Cl2}(g)+\ce{H2}(g) \nonumber \]
Composés oxygénés non métalliques
La plupart des substances non métalliques réagissent avec l'oxygène pour former des oxydes non métalliques. Selon les états d'oxydation disponibles pour l'élément, divers oxydes peuvent se former. Le fluor se combine à l'oxygène pour former des fluorures tels que l'OF 2, où l'oxygène possède un état d'oxydation 2+.
Composés soufrés
Les deux oxydes de soufre courants sont le dioxyde de soufre, SO 2, et le trioxyde de soufre, SO 3. L'odeur du soufre brûlant provient du dioxyde de soufre. Le dioxyde de soufre, illustré à la figure\(\PageIndex{6}\), est présent dans les gaz volcaniques et dans l'atmosphère à proximité des installations industrielles qui brûlent des combustibles contenant des composés soufrés.
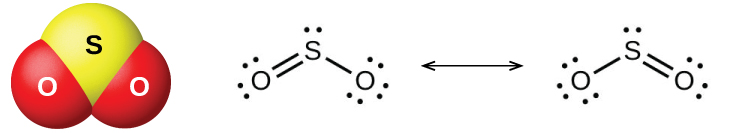
La production commerciale de dioxyde de soufre provient de la combustion de soufre ou de la torréfaction de minerais sulfurés tels que le ZnS, le FeS 2 et le Cu 2 S dans l'air. (La torréfaction, qui forme l'oxyde métallique, est la première étape de la séparation de nombreux métaux de leurs minerais.) Une méthode pratique pour préparer du dioxyde de soufre en laboratoire consiste à faire agir un acide fort soit sur les sels de sulfite contenant l'\(\ce{SO3^2-}\)ion, soit sur les sels de sulfite d'hydrogène contenant\(\ce{HSO3-}\). L'acide sulfureux, H 2 SO 3, se forme d'abord, mais se décompose rapidement en dioxyde de soufre et en eau. Le dioxyde de soufre se forme également lorsque de nombreux agents réducteurs réagissent avec de l'acide sulfurique chaud et concentré. Le trioxyde de soufre se forme lentement lors du chauffage du dioxyde de soufre et de l'oxygène, et la réaction est exothermique :
\[\ce{2SO2}(g)+\ce{O2}(g)⟶\ce{2SO3}(g) \hspace{20px} ΔH°=\mathrm{−197.8\:kJ} \nonumber \]
Le dioxyde de soufre est un gaz à température ambiante et la molécule de SO 2 est courbée. Le trioxyde de soufre fond à 17 °C et bout à 43 °C. À l'état de vapeur, ses molécules sont des unités de SO 3 uniques (Figure\(\PageIndex{7}\)), mais à l'état solide, le SO 3 existe sous plusieurs formes polymères.
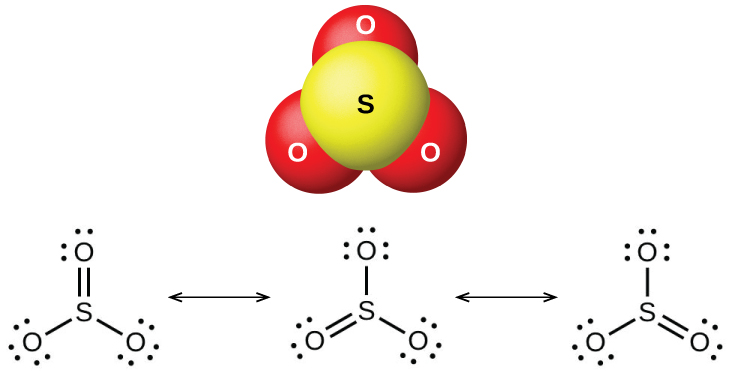
Les oxydes de soufre réagissent comme des acides de Lewis avec de nombreux oxydes et hydroxydes dans les réactions acide-base de Lewis, avec la formation de sulfites ou d'hydrogénosulfites et de sulfates ou d'hydrogénosulfates, respectivement.
Composés halogénés
Les halogènes ne réagissent pas directement avec l'oxygène, mais il est possible de préparer des composés binaires oxygène-halogène par les réactions des halogènes avec des composés contenant de l'oxygène. Les composés oxygénés contenant du chlore, du brome et de l'iode sont des oxydes parce que l'oxygène est l'élément le plus électronégatif de ces composés. D'autre part, les composés fluorés contenant de l'oxygène sont des fluorures car le fluor est l'élément le plus électronégatif.
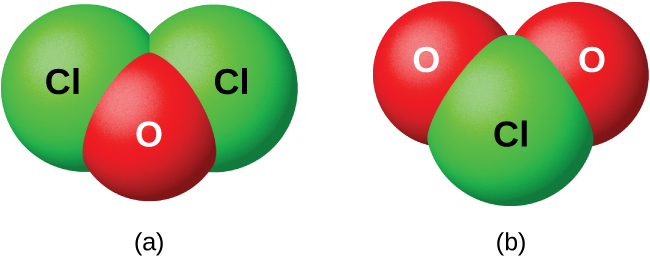
En tant que classe, les oxydes sont extrêmement réactifs et instables, et leur chimie a peu d'importance pratique. L'oxyde de dichlore, officiellement appelé monoxyde de dichlore, et le dioxyde de chlore, tous deux illustrés sur la figure\(\PageIndex{8}\), sont les seuls composés commercialement importants. Ils sont importants en tant qu'agents de blanchiment (à utiliser avec de la pâte et de la farine) et pour le traitement de l'eau.
Oxyacides non métalliques et leurs sels
Les oxydes non métalliques forment des acides lorsqu'on les laisse réagir avec l'eau ; il s'agit d'anhydrides d'acides. Les oxyanions qui en résultent peuvent former des sels avec divers ions métalliques.
Oxyacides et sels d'azote
Le pentaoxyde d'azote, le N 2 O 5 et le NO 2 réagissent avec l'eau pour former de l'acide nitrique, HNO 3. Dès le VIIIe siècle, les alchimistes connaissaient l'acide nitrique (illustré sur la figure\(\PageIndex{9}\)) sous le nom d'aqua fortis (qui signifie « eau forte »). L'acide était utile pour séparer l'or de l'argent car il dissout l'argent mais pas l'or. Des traces d'acide nitrique se retrouvent dans l'atmosphère après les orages, et ses sels sont largement distribués dans la nature. Il existe d'énormes gisements de salpêtre chilien, NaNO 3, dans la région désertique près de la frontière entre le Chili et le Pérou. Le salpêtre du Bengale, KNO 3, est présent en Inde et dans d'autres pays d'Extrême-Orient.
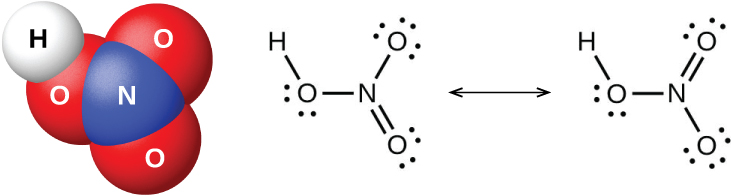
En laboratoire, il est possible de produire de l'acide nitrique en chauffant un sel de nitrate (tel que le nitrate de sodium ou de potassium) avec de l'acide sulfurique concentré :
\[\ce{NaNO3}(s)+\ce{H2SO4}(l)\xrightarrow{Δ}\ce{NaHSO4}(s)+\ce{HNO3}(g) \nonumber \]
Le procédé O stwald est la méthode commerciale de production d'acide nitrique. Ce processus implique l'oxydation de l'ammoniac en oxyde nitrique, NO ; l'oxydation de l'oxyde nitrique en dioxyde d'azote, NO 2 ; et une oxydation et une hydratation supplémentaires du dioxyde d'azote pour former de l'acide nitrique :
\[\ce{4NH3}(g)+\ce{5O2}(g)⟶\ce{4NO}(g)+\ce{6H2O}(g) \nonumber \]
\[\ce{2NO}(g)+\ce{O2}(g)⟶\ce{2NO2}(g) \nonumber \]
\[\ce{3NO2}(g)+\ce{H2O}(l)⟶\ce{2HNO3}(aq)+\ce{NO}(g) \nonumber \]
ou
\[\ce{4NO2}(g)+\ce{O2}(g)+\ce{2H2O}(g)⟶\ce{4HNO3}(l) \nonumber \]
L'acide nitrique pur est un liquide incolore. Cependant, il est souvent de couleur jaune ou brune car le NO 2 se forme lorsque l'acide se décompose. L'acide nitrique est stable en solution aqueuse ; les solutions contenant 68 % de l'acide sont de l'acide nitrique concentré disponible dans le commerce. C'est à la fois un agent oxydant puissant et un acide fort.
L'action de l'acide nitrique sur un métal produit rarement de l'H 2 (par réduction de H +) en plus que de petites quantités. Au lieu de cela, la réduction de l'azote se produit. Les produits formés dépendent de la concentration de l'acide, de l'activité du métal et de la température. Normalement, un mélange de nitrates, d'oxydes d'azote et de divers produits de réduction se forme. Les métaux moins actifs tels que le cuivre, l'argent et le plomb réduisent l'acide nitrique concentré principalement en dioxyde d'azote. La réaction de l'acide nitrique dilué avec le cuivre produit du NO. Dans chaque cas, les sels de nitrate des métaux cristallisent lors de l'évaporation des solutions résultantes.
Les éléments non métalliques, tels que le soufre, le carbone, l'iode et le phosphore, sont oxydés par l'acide nitrique concentré en oxydes ou oxyacides, avec formation de NO 2 :
\[\ce{S}(s)+\ce{6HNO3}(aq)⟶\ce{H2SO4}(aq)+\ce{6NO2}(g)+\ce{2H2O}(l) \nonumber \]
\[\ce{C}(s)+\ce{4HNO3}(aq)⟶\ce{CO2}(g)+\ce{4NO2}(g)+\ce{2H2O}(l) \nonumber \]
L'acide nitrique oxyde de nombreux composés ; par exemple, l'acide nitrique concentré oxyde facilement l'acide chlorhydrique en chlore et en dioxyde de chlore. Un mélange d'une partie d'acide nitrique concentré et de trois parties d'acide chlorhydrique concentré (appelé aqua regia, qui signifie eau royale) réagit vigoureusement avec les métaux. Ce mélange est particulièrement utile pour dissoudre l'or, le platine et d'autres métaux plus difficiles à oxyder que l'hydrogène. Voici une équation simplifiée pour représenter l'action de l'aqua regia sur l'or :
\[\ce{Au}(s)+\ce{4HCl}(aq)+\ce{3HNO3}(aq)⟶\ce{HAuCl4}(aq)+\ce{3NO2}(g)+\ce{3H2O}(l) \nonumber \]
Vidéo\(\PageIndex{1}\) : Bien que l'or ne soit généralement pas réactif, vous pouvez regarder une vidéo montrant le mélange complexe de composés présents dans l'aqua regia qui le dissout en solution.
Les nitrates, sels d'acide nitrique, se forment lorsque des métaux, des oxydes, des hydroxydes ou des carbonates réagissent avec l'acide nitrique. La plupart des nitrates sont solubles dans l'eau ; en effet, l'une des principales utilisations de l'acide nitrique est de préparer des nitrates métalliques solubles.
L'acide nitrique est largement utilisé en laboratoire et dans les industries chimiques en tant qu'acide fort et agent oxydant fort. Il joue un rôle important dans la fabrication d'explosifs, de colorants, de plastiques et de médicaments. Les sels d'acide nitrique (nitrates) sont précieux comme engrais. La poudre à canon est un mélange de nitrate de potassium, de soufre et de charbon de bois.
La réaction du N 2 O 3 avec l'eau donne une solution bleu pâle d'acide nitreux, HNO 2. Cependant, le HNO 2 (illustré sur la figure\(\PageIndex{10}\)) est plus facile à préparer en ajoutant un acide à une solution de nitrite ; l'acide nitreux est un acide faible, de sorte que l'ion nitrite est basique en solution aqueuse :
\[\ce{NO2-}(aq)+\ce{H3O+}(aq)⟶\ce{HNO2}(aq)+\ce{H2O}(l) \nonumber \]
L'acide nitreux est très instable et n'existe qu'en solution. Il se disproportionne lentement à température ambiante (rapidement lorsqu'il est chauffé) en acide nitrique et en oxyde nitrique. L'acide nitreux est un agent oxydant actif avec des agents réducteurs puissants, et les agents oxydants puissants l'oxydent en acide nitrique.
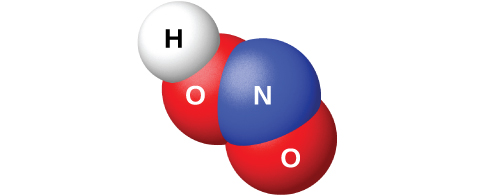
Le nitrite de sodium, NaNO 2, est un additif aux viandes telles que les hot-dogs et les charcuteries. L'ion nitrite a deux fonctions. Il limite la croissance des bactéries qui peuvent provoquer des intoxications alimentaires et prolonge la rétention de la couleur rouge de la viande. L'ajout de nitrite de sodium aux produits de viande est controversé car l'acide nitreux réagit avec certains composés organiques pour former une classe de composés appelés nitrosamines. Les nitrosamines provoquent le cancer chez les animaux de laboratoire. Cela a incité la FDA à limiter la quantité de NaNO 2 dans les aliments.
Les nitrites sont beaucoup plus stables que l'acide, mais les nitrites, comme les nitrates, peuvent exploser. Les nitrites, comme les nitrates, sont également solubles dans l'eau (l'AgNO 2 n'est que légèrement soluble).
Oxyacides et sels de phosphore
L'acide orthophosphorique pur, H 3 PO 4 (Figure\(\PageIndex{11}\)), forme des cristaux déliquescents incolores qui fondent à 42 °C. Le nom usuel de ce composé est acide phosphorique et est disponible dans le commerce sous la forme d'une solution visqueuse à 82 % appelée acide phosphorique sirupeux. L'acide phosphorique est notamment utilisé comme additif à de nombreuses boissons gazeuses.
Une méthode commerciale de préparation de l'acide orthophosphorique consiste à traiter la roche de phosphate de calcium avec de l'acide sulfurique concentré :
\[\ce{Ca3(PO4)2}(s)+\ce{3H2SO4}(aq)⟶\ce{2H3PO4}(aq)+\ce{3CaSO4}(s) \nonumber \]
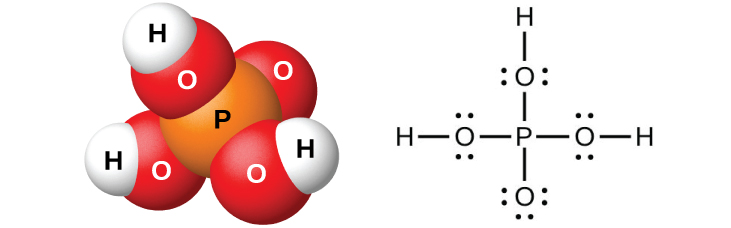
La dilution des produits avec de l'eau, suivie d'une filtration pour éliminer le sulfate de calcium, donne une solution acide diluée contaminée par du dihydrogénophosphate de calcium, du Ca (H 2 PO 4) 2 et d'autres composés associés à la roche de phosphate de calcium. Il est possible de préparer de l'acide orthophosphorique pur en dissolvant du P 4 O 10 dans de l'eau.
L'action de l'eau sur le P 4 O 6, le PCl 3, le PBr 3 ou le PI 3 forme de l'acide phosphoreux, H 3 PO 3 (illustré sur la figure\(\PageIndex{12}\)). La meilleure méthode pour préparer de l'acide phosphoreux pur consiste à hydrolyser le trichlorure de phosphore :
\[\ce{PCl3}(l)+\ce{3H2O}(l)⟶\ce{H3PO3}(aq)+\ce{3HCl}(g) \nonumber \]
Le chauffage de la solution résultante expulse le chlorure d'hydrogène et entraîne l'évaporation de l'eau. Lorsque suffisamment d'eau s'évapore, des cristaux blancs d'acide phosphoreux apparaissent lors du refroidissement. Les cristaux sont déliquescents, très solubles dans l'eau et ont une odeur similaire à celle de l'ail. Le solide fond à 70,1 °C et se décompose à environ 200 °C par dismutation en phosphine et en acide orthophosphorique :
\[\ce{4H3PO3}(l)⟶\ce{PH3}(g)+\ce{3H3PO4}(l) \nonumber \]
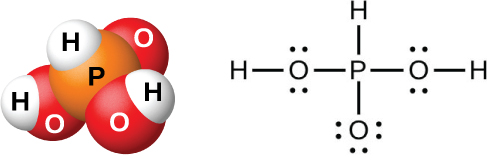
L'acide phosphoreux ne forme que deux séries de sels, qui contiennent respectivement l'ion phosphite dihydrogéné ou l'ion phosphate d'hydrogène.\(\ce{H2PO3-}\)\(\ce{HPO3^2-}\) Il n'est pas possible de remplacer le troisième atome d'hydrogène car il n'est pas très acide, car il n'est pas facile d'ioniser la liaison P-H.
Oxyacides et sels de soufre
La préparation de l'acide sulfurique, H 2 SO 4 (Figure\(\PageIndex{13}\)), commence par l'oxydation du soufre en trioxyde de soufre, puis par la conversion du trioxyde en acide sulfurique. L'acide sulfurique pur est un liquide huileux incolore qui gèle à 10,5 °C. Il s'échappe lorsqu'il est chauffé car l'acide se décompose en eau et en trioxyde de soufre. Le processus de chauffage entraîne la perte de plus de trioxyde de soufre que d'eau, jusqu'à atteindre une concentration d'acide de 98,33 %. L'acide de cette concentration bout à 338 °C sans autre changement de concentration (solution à ébullition constante) et est du H 2 SO 4 concentré commercialement. La quantité d'acide sulfurique utilisée dans l'industrie est supérieure à celle de tout autre composé manufacturé.
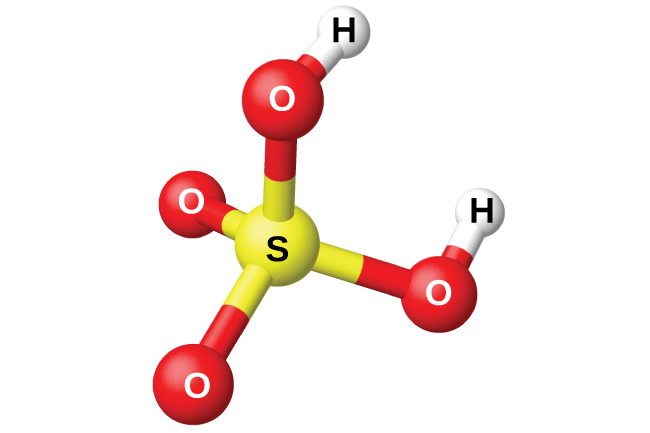
La forte affinité de l'acide sulfurique concentré pour l'eau en fait un bon agent déshydratant. Il est possible de sécher des gaz et des liquides non miscibles qui ne réagissent pas avec l'acide en les faisant passer à travers l'acide.
L'acide sulfurique est un acide diprotique puissant qui s'ionise en deux étapes. En solution aqueuse, la première étape est pratiquement terminée. L'ionisation secondaire n'est pas aussi complète et\(\ce{HSO4-}\) est un acide modérément fort (environ 25 % ionisé en solution d'un\(\ce{HSO4-}\) sel : K a = 1,2 × 10 −2).
Étant un acide diprotique, l'acide sulfurique forme à la fois des sulfates, tels que le Na 2 SO 4, et des sulfates d'hydrogène, tels que le NaHSO 4. La plupart des sulfates sont solubles dans l'eau ; toutefois, les sulfates de baryum, de strontium, de calcium et de plomb ne sont que légèrement solubles dans l'eau.
Parmi les sulfates importants figurent le Na 2 SO 4 ⋅10H 2 O et les sels d'Epsom, le MgSO 4 ⋅7H 2 O. Comme l'\(\ce{HSO4-}\)ion est un acide, les sulfates d'hydrogène, tels que le NaHSO 4, présentent un comportement acide, et ce composé est l'ingrédient principal de certains nettoyants ménagers.
L'acide sulfurique chaud et concentré est un agent oxydant. En fonction de sa concentration, de la température et de la force de l'agent réducteur, l'acide sulfurique oxyde de nombreux composés et, au cours du processus, subit une réduction en SO 2\(\ce{HSO3-}\)\(\ce{SO3^2-}\),,, S, H 2 S ou S 2 −.
Le dioxyde de soufre se dissout dans l'eau pour former une solution d'acide sulfureux, comme prévu pour l'oxyde d'un non-métal. L'acide sulfureux est instable et il n'est pas possible d'isoler le H 2 SO 3 anhydre. Le chauffage d'une solution d'acide sulfureux permet d'expulser le dioxyde de soufre. Comme les autres acides diprotiques, l'acide sulfureux s'ionise en deux étapes : l'ion sulfite d'hydrogène et l'ion sulfite se forment.\(\ce{HSO3-}\)\(\ce{SO3^2-}\) L'acide sulfureux est un acide modérément fort. L'ionisation est d'environ 25 % dans la première étape, mais elle est beaucoup moins importante dans la seconde (K a1 = 1,2 × 10 −2 et K a2 = 6,2 × 10 −8).
Pour préparer des sels solides de sulfite et de sulfite d'hydrogène, il est nécessaire d'ajouter une quantité stœchiométrique d'une base à une solution d'acide sulfureux, puis d'évaporer l'eau. Ces sels se forment également à la suite de la réaction du SO 2 avec des oxydes et des hydroxydes. Le chauffage d'hydrogénosulfite de sodium solide forme du sulfite de sodium, du dioxyde de soufre et de l'eau :
\[\ce{2NaHSO3}(s)\xrightarrow{Δ}\ce{Na2SO3}(s)+\ce{SO2}(g)+\ce{H2O}(l) \nonumber \]
Les agents oxydants puissants peuvent oxyder l'acide sulfureux. L'oxygène de l'air l'oxyde lentement en acide sulfurique plus stable :
\[\ce{2H2SO3}(aq)+\ce{O2}(g)+\ce{2H2O}(l)\xrightarrow{Δ}\ce{2H3O+}(aq)+\ce{2HSO4-}(aq) \nonumber \]
Les solutions de sulfites sont également très sensibles à l'oxydation de l'air pour produire des sulfates. Ainsi, les solutions de sulfites contiennent toujours des sulfates après exposition à l'air.
Oxyacides halogénés et leurs sels
Les composés HXO, HXO 2, HXO 3 et HXO 4, où X représente Cl, Br ou I, sont les acides hypohaleux, haleux, halique et perhalique, respectivement. La force de ces acides augmente à partir des acides hypohaleux, qui sont des acides très faibles, jusqu'aux acides perhaliques, qui sont très forts. Le tableau\(\PageIndex{1}\) répertorie les acides connus et, lorsqu'ils sont connus, leurs valeurs de pK a sont indiquées entre parenthèses.
| Nom | Fluor | chlore | Brome | Iode |
|---|---|---|---|---|
| hypohaleux | HOF | HOCl (7,5) | HobR (8.7) | HOÏ (11) |
| halous | Chloé (2,0) | |||
| halique | Chloé III | Frère 3 | HIO (30,8) | |
| perhalique | Chloé 4 | Frère 4 | HIO (41.6) | |
| paraperhalique | HP 5 IO 6 (1,6) |
Le seul oxyacide du fluor connu est l'acide hypofluoreux très instable, HOF, qui est préparé par réaction du fluor gazeux avec de la glace :
\[\ce{F2}(g)+\ce{H2O}(s)⟶\ce{HOF}(g)+\ce{HF}(g) \nonumber \]
Le composé est très instable et se décompose au-dessus de −40 °C. Il ne s'ionise pas dans l'eau et il n'existe aucun sel connu. Il n'est pas certain que le nom acide hypofluoreux soit même approprié pour le HOF ; un nom plus approprié pourrait être hypofluorite d'hydrogène.
Les réactions du chlore et du brome avec l'eau sont analogues à celles du fluor avec la glace, mais ces réactions ne se terminent pas et il en résulte des mélanges de l'halogène et des acides hypohalogénés et hydrohaliques respectifs. Hormis le HOF, les acides hypohaleux n'existent qu'en solution. Les acides hypohaleux sont tous des acides très faibles ; toutefois, le HOCl est un acide plus fort que le HOBr, qui, à son tour, est plus fort que le HOI.
L'addition de base à des solutions d'acides hypohaleux produit des solutions de sels contenant les ions hypohalites basiques, OX -. Il est possible d'isoler ces sels sous forme de solides. Tous les hypohalites sont instables par rapport à la disproportion en solution, mais la réaction est lente pour l'hypochlorite. Hypobromite et hypoiodite se disproportionnent rapidement, même par temps froid :
\[\ce{3XO-}(aq)⟶\ce{2X-}(aq)+\ce{XO3-}(aq) \nonumber \]
L'hypochlorite de sodium est un agent de blanchiment (Clorox) et un germicide peu coûteux. La préparation commerciale implique l'électrolyse de solutions aqueuses froides de chlorure de sodium diluées dans des conditions où les ions chlore et hydroxyde obtenus peuvent réagir. La réaction nette est la suivante :
\[\ce{Cl-}(aq)+\ce{H2O}(l)\xrightarrow{\ce{electrical\: energy}}\ce{ClO-}(aq)+\ce{H2}(g) \nonumber \]
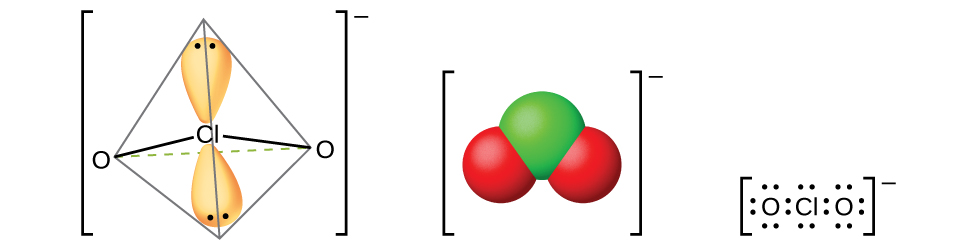
Le seul acide haleux définitivement connu est l'acide chloreux, HClO 2, obtenu par réaction du chlorite de baryum avec de l'acide sulfurique dilué :
\[\ce{Ba(ClO2)2}(aq)+\ce{H2SO4}(aq)⟶\ce{BaSO4}(s)+\ce{2HClO2}(aq) \nonumber \]
La filtration du sulfate de baryum insoluble laisse une solution de HClO 2. L'acide chloreux n'est pas stable ; il se décompose lentement en solution pour produire du dioxyde de chlore, de l'acide chlorhydrique et de l'eau. L'acide chloreux réagit avec les bases pour donner des sels contenant l'ion chlorite (illustré à la figure\(\PageIndex{14}\)). Le chlorite de sodium trouve une application étendue dans le blanchiment du papier car il s'agit d'un agent oxydant puissant qui n'endommage pas le papier.
L'acide chlorique, HClO 3, et l'acide bromique, HBrO 3, ne sont stables qu'en solution. La réaction de l'iode avec l'acide nitrique concentré produit de l'acide iodé blanc stable, HIO 3 :
\[\ce{I2}(s)+\ce{10HNO3}(aq)⟶\ce{2HIO3}(s)+\ce{10NO2}(g)+\ce{4H2O}(l) \nonumber \]
Il est possible d'obtenir les acides halogénés plus légers à partir de leurs sels de baryum par réaction avec de l'acide sulfurique dilué. La réaction est analogue à celle utilisée pour préparer l'acide chloreux. Tous les acides halogénés sont des acides forts et des agents oxydants très actifs. Les acides réagissent avec les bases pour former des sels contenant des ions chlorate (illustré sur la figure\(\PageIndex{15}\)). Une autre méthode de préparation est l'oxydation électrochimique d'une solution chaude d'un halogénure métallique pour former les chlorates métalliques appropriés. Le chlorate de sodium est un désherbant ; le chlorate de potassium est utilisé comme agent oxydant.
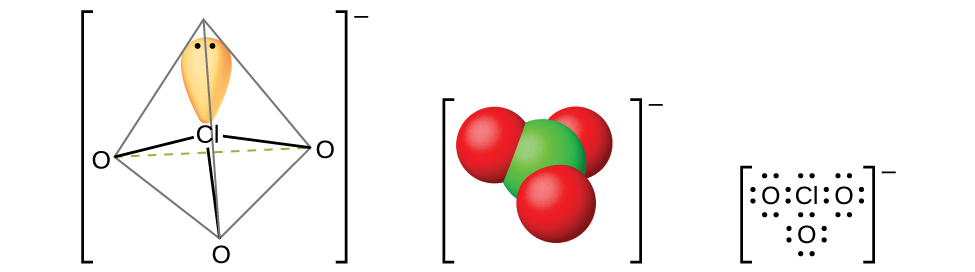
L'acide perchlorique, HClO 4, se forme lors du traitement d'un perchlorate, tel que le perchlorate de potassium, avec de l'acide sulfurique sous pression réduite. Le HClO 4 peut être distillé à partir du mélange :
\[\ce{KClO4}(s)+\ce{H2SO4}(aq)⟶\ce{HClO4}(g)+\ce{KHSO4}(s) \nonumber \]
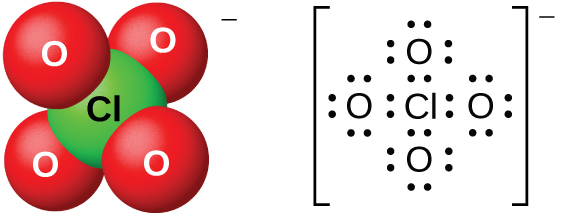
Les solutions aqueuses diluées d'acide perchlorique sont assez stables thermiquement, mais des concentrations supérieures à 60 % sont instables et dangereuses. L'acide perchlorique et ses sels sont de puissants agents oxydants, car le chlore, très électronégatif, est plus stable à un état d'oxydation inférieur à celui du 7+. De graves explosions se sont produites lors du chauffage de solutions concentrées contenant des substances facilement oxydables. Cependant, ses réactions en tant qu'agent oxydant sont lentes lorsque l'acide perchlorique est froid et dilué. L'acide est l'un des plus forts de tous les acides. La plupart des sels contenant l'ion perchlorate (Figure\(\PageIndex{16}\)) sont solubles. Il est possible de les préparer à partir de réactions de bases avec l'acide perchlorique et, commercialement, par électrolyse de solutions chaudes de leurs chlorures.
Les sels de perbromate sont difficiles à préparer et les meilleures synthèses impliquent actuellement l'oxydation des bromates en solution basique avec du fluor gazeux suivie d'une acidification. Les utilisations commerciales de cet acide ou de ses sels sont peu nombreuses, voire inexistantes.
Il existe plusieurs acides contenant de l'iode à l'état d'oxydation 7+ ; il s'agit notamment de l'acide métapériodique, HIO 4, et de l'acide parapériodique, H 5 IO 6. Ces acides sont des agents oxydants puissants qui réagissent avec les bases pour former les sels appropriés.
Résumé
L'oxygène est l'un des éléments les plus réactifs. Cette réactivité, associée à son abondance, rend la chimie de l'oxygène très riche et bien comprise. Les composés des métaux représentatifs avec de l'oxygène se répartissent en trois catégories (1) les oxydes, (2) les peroxydes et les superoxydes et (3) les hydroxydes. Le chauffage des hydroxydes, nitrates ou carbonates correspondants est la méthode la plus courante pour produire des oxydes. Le chauffage du métal ou de l'oxyde métallique dans l'oxygène peut entraîner la formation de peroxydes et de superoxydes. Les oxydes solubles se dissolvent dans l'eau pour former des solutions d'hydroxydes. La plupart des oxydes de métaux sont des anhydrides de base et réagissent avec les acides. Les hydroxydes des métaux représentatifs réagissent avec les acides lors de réactions acido-basiques pour former des sels et de l'eau. Les hydroxydes ont de nombreuses utilisations commerciales.
Tous les éléments non métalliques, sauf le fluor, forment de multiples oxydes. Presque tous les oxydes non métalliques sont des anhydrides d'acides. L'acidité des oxyacides nécessite que les atomes d'hydrogène se lient aux atomes d'oxygène de la molécule plutôt qu'à l'autre atome non métallique. Généralement, la force de l'oxyacide augmente avec le nombre d'atomes d'oxygène liés à l'atome non métallique et non à un hydrogène.
Lexique
- anhydride de base
- oxyde métallique qui se comporte comme une base vis-à-vis des acides
- procédé chlore-alcali
- procédé d'électrolyse pour la synthèse de chlore et d'hydroxyde de sodium
- sulfate d'hydrogène
- \(\ce{HSO4-}\)ion
- sulfite d'hydrogène
- \(\ce{HSO3-}\)ion
- hydroxyde
- composé d'un métal avec l'ion hydroxyde OH - ou le groupe -OH
- nitrate
- \(\ce{NO3-}\)ion ; sel d'acide nitrique
- Procédé d'Ostwald
- procédé industriel utilisé pour convertir l'ammoniac en acide nitrique
- oxyde
- composé binaire d'oxygène avec un autre élément ou groupe, contenant typiquement des ions O 2− ou le groupe -O— ou =O
- ozone
- allotrope de l'oxygène ; O 3
- peroxyde
- une molécule contenant deux atomes d'oxygène liés entre eux ou sous forme d'anion,\(\ce{O2^2-}\)
- photosynthèse
- processus par lequel l'énergie lumineuse favorise la réaction de l'eau et du dioxyde de carbone pour former des glucides et de l'oxygène ; cela permet aux organismes photosynthétiques de stocker de l'énergie
- sulfate
- \(\ce{SO4^2-}\)ion
- sulfite
- \(\ce{SO3^2-}\)ion
- superoxyde
- oxyde contenant l'anion\(\ce{O2-}\)


