18.8 : Présence, préparation et propriétés du phosphore
- Page ID
- 193966
- Décrire les propriétés, la préparation et les utilisations du phosphore
La préparation industrielle du phosphore consiste à chauffer du phosphate de calcium, obtenu à partir de roches phosphatées, avec du sable et du coke :
\[\ce{2Ca3(PO4)2}(s)+\ce{6SiO2}(s)+\ce{10C}(s) \xrightarrow{Δ} \ce{6CaSiO3}(l)+\ce{10CO}(g)+\ce{P4}(g) \nonumber \]
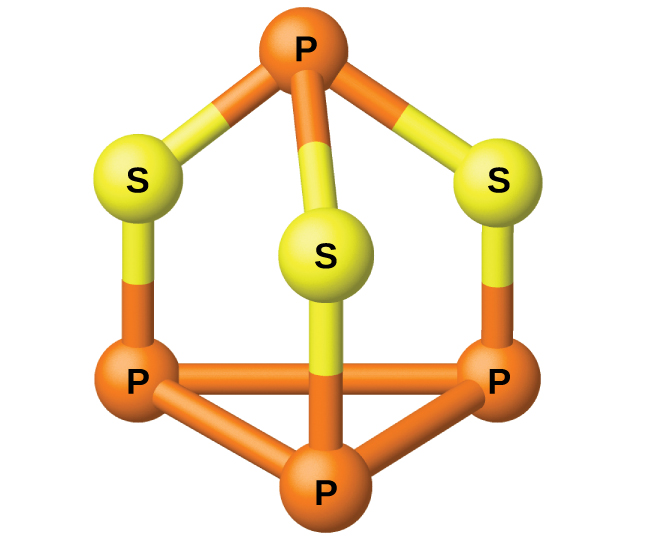
Le phosphore sort du four par distillation et est condensé en un solide ou brûlé pour former du P 4 O 10. La préparation de nombreux autres composés phosphorés commence par le P 4 O 10. Les acides et les phosphates sont utiles comme engrais et dans l'industrie chimique. D'autres utilisations concernent la fabrication d'alliages spéciaux tels que le ferrophosphore et le bronze phosphoreux. Le phosphore joue un rôle important dans la fabrication des pesticides, des allumettes et de certains plastiques. Le phosphore est un non-métal actif. Dans les composés, le phosphore se présente généralement à des états d'oxydation de 3−, 3+ et 5+. Le phosphore présente des nombres d'oxydation inhabituels pour un élément du groupe 15 dans les composés contenant des liaisons phosphore-phosphore ; les exemples incluent le tétrahydride diphosphoré, H 2 P-PH 2, et le trisulfure tétraphosphoré, P 4 S 3, illustrés à la figure\(\PageIndex{1}\).
Composés oxygénés
Le phosphore forme deux oxydes courants, l'oxyde de phosphore (III) (ou hexaoxyde de tétraphosphore), P 4 O 6, et l'oxyde de phosphore (V) (ou décaoxyde de tétraphosphore), P 4 O 10, tous deux illustrés sur la figure\(\PageIndex{2}\). L'oxyde de phosphore (III) est un solide cristallin blanc à l'odeur d'ail. Sa vapeur est très toxique. Il s'oxyde lentement dans l'air et s'enflamme lorsqu'il est chauffé à 70 °C, formant du P 4 O 10. L'oxyde de phosphore (III) se dissout lentement dans l'eau froide pour former de l'acide phosphoreux, H 3 PO 3.
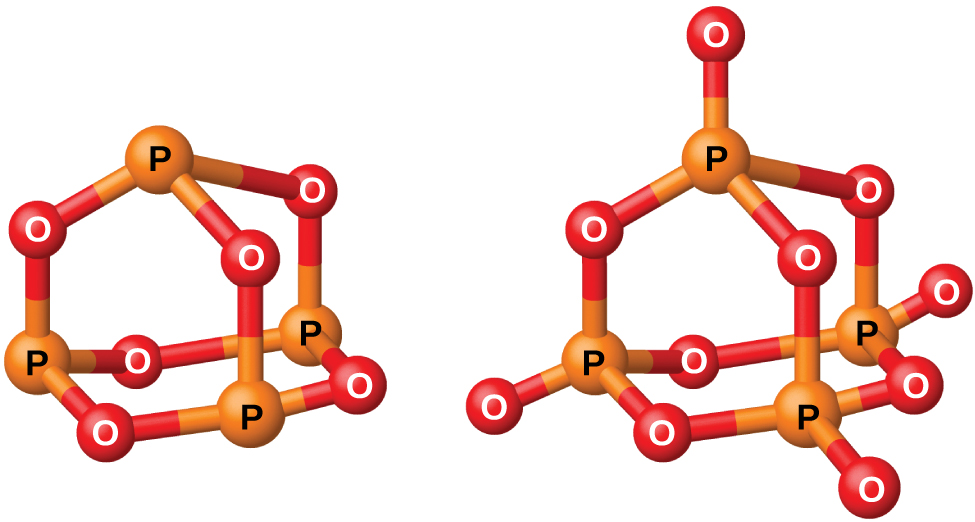
L'oxyde de phosphore (V), P 4 O 10, est une poudre blanche préparée en brûlant du phosphore dans un excès d'oxygène. Son enthalpie de formation est très élevée (-2984 kJ), il est assez stable et constitue un très mauvais agent oxydant. Le fait de laisser tomber du P 4 O 10 dans l'eau produit un sifflement, de la chaleur et de l'acide orthophosphorique :
\[\ce{P4O10}(s)+\ce{6H2O}(l)⟶\ce{4H3PO4}(aq) \nonumber \]
En raison de sa grande affinité pour l'eau, l'oxyde de phosphore (V) est un excellent agent desséchant pour les gaz et les solvants et pour éliminer l'eau de nombreux composés.
Composés halogénés
Le phosphore réagira directement avec les halogènes, formant des trihalogénures, PX 3, et des pentahalides, PX 5. Les trihalogénures sont beaucoup plus stables que les trihalogénures d'azote correspondants ; les pentahalides d'azote ne se forment pas en raison de l'incapacité de l'azote à former plus de quatre liaisons.
Les chlorures PCl 3 et PCl 5, tous deux représentés sur la figure\(\PageIndex{3}\), sont les halogénures les plus importants du phosphore. Le trichlorure de phosphore est un liquide incolore préparé en faisant passer du chlore sur du phosphore fondu. Le pentachlorure de phosphore est un solide blanc cassé préparé en oxydant le trichlorure avec un excès de chlore. Le pentachlorure se sublime lorsqu'il est chauffé et forme un équilibre avec le trichlorure et le chlore lorsqu'il est chauffé.
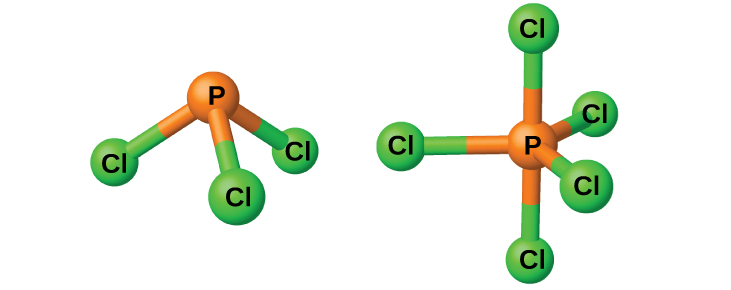
Comme la plupart des autres halogénures non métalliques, les deux chlorures de phosphore réagissent avec un excès d'eau et produisent du chlorure d'hydrogène et un oxyacide : le PCl 3 donne de l'acide phosphoreux H 3 PO 3 et le PCl 5 donne de l'acide phosphorique, H 3 PO 4.
Les pentahalides du phosphore sont des acides de Lewis en raison de la valence vide des orbitales d du phosphore. Ces composés réagissent facilement avec les ions halogénures (bases de Lewis) pour donner l'anion\(\ce{PX6-}\). Alors que le pentafluorure de phosphore est un composé moléculaire dans tous les états, les études aux rayons X montrent que le pentachlorure de phosphore solide est un composé ionique\(\ce{[PCl4+][PCl6- ]}\), tout comme le pentabromure de phosphore,\(\ce{[PBr4+]}\) [Br −], et le pentaiodure de phosphore,\(\ce{[PI4+]}\) [I −].
Résumé
Le phosphore (groupe 15) présente généralement des états d'oxydation de 3− avec les métaux actifs et de 3+ et 5+ avec des non-métaux plus électronégatifs. Les halogènes et l'oxygène oxyderont le phosphore. Les oxydes sont l'oxyde de phosphore (V), P 4 O 10, et l'oxyde de phosphore (III), P 4 O 6. Les deux méthodes courantes de préparation de l'acide orthophosphorique, H 3 PO 4, sont soit la réaction d'un phosphate avec de l'acide sulfurique, soit la réaction de l'eau avec de l'oxyde de phosphore (V). L'acide orthophosphorique est un acide triprotique qui forme trois types de sels.


