18.10 : Présence, préparation et propriétés du soufre
- Page ID
- 193970
- Décrire les propriétés, la préparation et les utilisations du soufre
Le soufre existe dans la nature sous forme de dépôts élémentaires, de sulfures de fer, de zinc, de plomb et de cuivre et de sulfates de sodium, de calcium, de baryum et de magnésium. Le sulfure d'hydrogène est souvent un composant du gaz naturel et se trouve dans de nombreux gaz volcaniques, comme ceux illustrés sur la figure\(\PageIndex{1}\). Le soufre est un constituant de nombreuses protéines et est essentiel à la vie.

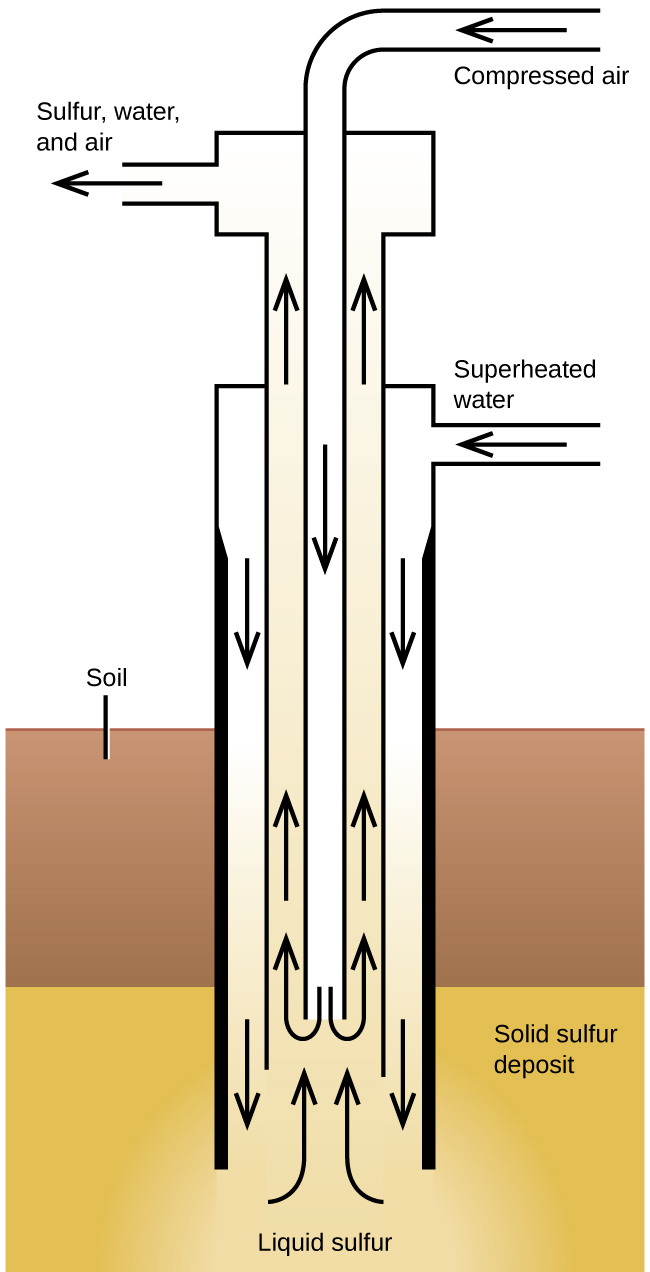
Le procédé de Frasch, illustré dans la figure\(\PageIndex{2}\), est important pour l'extraction du soufre libre provenant d'énormes gisements souterrains au Texas et en Louisiane. De l'eau surchauffée (170 °C et pression de 10 atm) est expulsée vers le gisement souterrain par la plus extérieure de trois conduites concentriques. L'eau chaude fait fondre le soufre. Le tuyau situé le plus à l'intérieur conduit l'air comprimé dans le soufre liquide. L'air force le soufre liquide, mélangé à l'air, à s'écouler par le tuyau de sortie. Le transfert du mélange dans de grandes cuves de décantation permet au soufre solide de se séparer lors du refroidissement. Ce soufre est pur de 99,5 % à 99,9 % et ne nécessite aucune purification pour la plupart des utilisations.
De plus grandes quantités de soufre proviennent également du sulfure d'hydrogène récupéré lors de la purification du gaz naturel.
Le soufre existe sous plusieurs formes allotropiques. La forme stable à température ambiante contient des cycles à huit chaînons, de sorte que la vraie formule est S 8. Cependant, les chimistes utilisent couramment S pour simplifier les coefficients des équations chimiques ; nous suivrons cette pratique dans ce livre.
Comme l'oxygène, qui fait également partie du groupe 16, le soufre présente un comportement nettement non métallique. Il oxyde les métaux, donnant une variété de sulfures binaires dans lesquels le soufre présente un état d'oxydation négatif (2−). Le soufre élémentaire oxyde moins de non-métaux électronégatifs, et un plus grand nombre de non-métaux électronégatifs, tels que l'oxygène et les halogènes, l'oxyderont. D'autres agents oxydants puissants oxydent également le soufre. Par exemple, l'acide nitrique concentré oxyde le soufre en ion sulfate, avec la formation concomitante d'oxyde d'azote (IV) :
\[\ce{S}(s)+\ce{6HNO3}(aq)⟶\ce{2H3O+}(aq)+\ce{SO4^2-}(aq)+\ce{6NO2}(g) \nonumber \]
La chimie du soufre avec un état d'oxydation de 2− est similaire à celle de l'oxygène. Contrairement à l'oxygène, le soufre forme de nombreux composés dans lesquels il présente des états d'oxydation positifs.
Résumé
Le soufre (groupe 16) réagit avec presque tous les métaux et forme facilement l'ion sulfure, S 2−, dans lequel il a un état d'oxydation de 2−. Le soufre réagit avec la plupart des substances non métalliques.
Lexique
- Procédé Frasch
- important pour l'extraction de soufre libre provenant d'énormes gisements souterrains


