18.3 : Structure et propriétés générales des métalloïdes
- Page ID
- 193954
- Décrire la préparation générale, les propriétés et les utilisations des métalloïdes
- Décrire la préparation, les propriétés et les composés du bore et du silicium
Une série de six éléments appelés métalloïdes sépare les métaux des non-métaux dans le tableau périodique. Les métalloïdes sont le bore, le silicium, le germanium, l'arsenic, l'antimoine et le tellure. Ces éléments semblent métalliques ; cependant, ils ne conduisent pas l'électricité aussi bien que les métaux, ce sont donc des semi-conducteurs. Ce sont des semi-conducteurs parce que leurs électrons sont plus étroitement liés à leur noyau que ceux des conducteurs métalliques. Leur comportement chimique se situe entre celui des métaux et celui des non-métaux. Par exemple, les métalloïdes purs forment des cristaux covalents comme les non-métaux, mais comme les métaux, ils ne forment généralement pas d'anions monatomiques. Ce comportement intermédiaire est dû en partie à leurs valeurs intermédiaires d'électronégativité. Dans cette section, nous aborderons brièvement le comportement chimique des métalloïdes et traiterons plus en détail de deux de ces éléments, le bore et le silicium.
Le bore métalloïde présente de nombreuses similitudes avec son voisin carboné et son voisin diagonal, le silicium. Les trois éléments forment des composés covalents. Cependant, le bore présente une différence distincte en ce sens que sa structure électronique externe 2 s 2 2 p 1 lui confère un électron de valence de moins que ses orbitales de valence. Bien que le bore présente un état d'oxydation de 3+ dans la plupart de ses composés stables, cette déficience électronique confère au bore la capacité de former d'autres états d'oxydation, parfois fractionnés, qui se produisent, par exemple, dans les hydrures de bore.
Le silicium a la configuration électronique de la couche de valence 3 s 2 3 p 2, et il forme généralement des structures tétraédriques dans lesquelles il est hybridé sp 3 avec un état d'oxydation formel de 4+. Les principales différences entre la chimie du carbone et du silicium proviennent de la force relative de la liaison carbone-carbone, de la capacité du carbone à former des liaisons stables avec lui-même et de la présence d'orbitales vides à couche de valence 3D dans le silicium. Les orbitales d vides du silicium et l'orbitale p vide du bore permettent aux composés de silicium tétraédriques et aux composés de bore planaires trigonaux d'agir comme des acides de Lewis. Le carbone, quant à lui, n'a pas d'orbitales de couche de valence disponibles ; les composés carbonés tétraédriques ne peuvent pas agir comme des acides de Lewis. Le comportement chimique du germanium est très similaire au silicium.
L'arsenic et l'antimoine forment généralement des composés présentant un état d'oxydation de 3+ ou 5+ ; cependant, l'arsenic peut former des arséniures ayant un état d'oxydation de 3−. Ces éléments ne ternissent que légèrement à l'air sec mais s'oxydent facilement lorsqu'ils sont chauffés.
Le tellure se combine directement avec la plupart des éléments. Les composés du tellure les plus stables sont les tellurures, des sels de Te 2− formés avec des métaux actifs et des lanthanides, et les composés contenant de l'oxygène, du fluor et du chlore, dans lesquels le tellure présente normalement un état d'oxydation 2+ ou 4+. Bien que les composés du tellure (VI) soient connus (par exemple, le TeF 6), ils présentent une résistance marquée à l'oxydation à cet état d'oxydation maximal du groupe.
Structures des métalloïdes
La liaison covalente est la clé des structures cristallines des métalloïdes. À cet égard, ces éléments ressemblent à des non-métaux dans leur comportement.
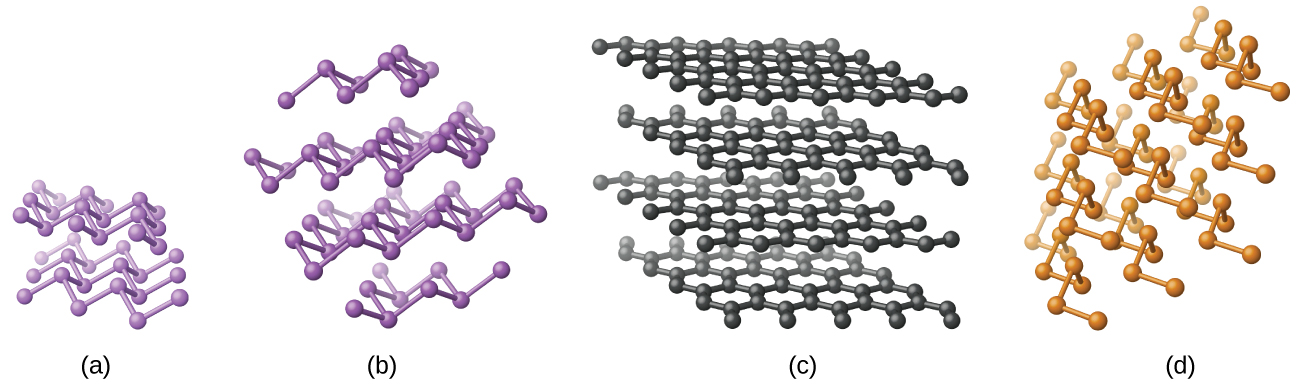
Le silicium élémentaire, le germanium, l'arsenic, l'antimoine et le tellure sont des solides brillants d'apparence métallique. Le silicium et le germanium cristallisent avec une structure diamantée. Chaque atome du cristal possède des liaisons covalentes avec quatre atomes voisins situés aux coins d'un tétraèdre ordinaire. Les monocristaux de silicium et de germanium sont des molécules géantes tridimensionnelles. Il existe plusieurs allotropes de l'arsenic, les plus stables étant en forme de couche et contenant des feuilles plissées d'atomes d'arsenic. Chaque atome d'arsenic forme des liaisons covalentes avec trois autres atomes de la feuille. La structure cristalline de l'antimoine est similaire à celle de l'arsenic, toutes deux illustrées sur la figure\(\PageIndex{1}\). Les structures de l'arsenic et de l'antimoine sont similaires à celles du graphite, abordées plus loin dans ce chapitre. Le tellure forme des cristaux qui contiennent des chaînes spirales infinies d'atomes de tellure. Chaque atome de la chaîne est lié à deux autres atomes.
Vidéo\(\PageIndex{1}\) : Découvrez la structure cristalline d'un diamant cubique.
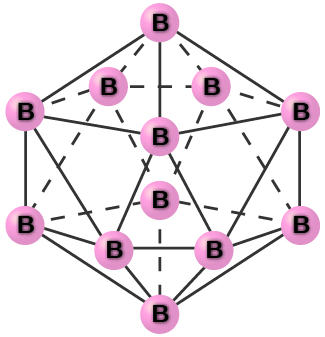
Le bore cristallin pur est transparent. Les cristaux sont constitués d'icosaèdres, comme le montre la figure\(\PageIndex{2}\), avec un atome de bore à chaque coin. Dans la forme la plus courante de bore, les icosaèdres s'assemblent de la même manière que les sphères cubiques les plus proches. Toutes les liaisons bore-bore au sein de chaque icosaèdre sont identiques et mesurent environ 176pm de longueur. Dans les différentes formes de bore, il existe différents arrangements et connexions entre les icosaèdres.
Le nom silicium est dérivé du mot latin pour silex, silex. Le silicium métalloïde forme facilement des composés contenant des liaisons Si-O-Si, qui revêtent une importance capitale dans le monde minéral. Cette capacité de liaison contraste avec le carbone non métallique, dont la capacité à former des liaisons carbone-carbone lui confère une importance primordiale dans les mondes végétal et animal.
Présence, préparation et composés du bore et du silicium
Le bore représente moins de 0,001 % en poids de la croûte terrestre. Dans la nature, il ne se trouve que dans des composés contenant de l'oxygène. Le bore est largement répandu dans les régions volcaniques sous forme d'acide borique, B (OH) 3, et dans les régions lacustres sèches, y compris les zones désertiques de Californie, sous forme de borates et de sels d'oxyacides de bore, tels que le borax, Na 2 B 4 O 7 ⋅10H 2 O.
Le bore élémentaire est chimiquement inerte à température ambiante et réagit uniquement avec le fluor et l'oxygène pour former du trifluorure de bore, BF 3, et de l'oxyde borique, B 2 O 3, respectivement. À des températures plus élevées, le bore réagit avec tous les éléments non métalliques, à l'exception du tellure et des gaz rares, et avec presque tous les métaux ; il s'oxyde en B 2 O 3 lorsqu'il est chauffé avec de l'acide nitrique ou sulfurique concentré. Le bore ne réagit pas avec les acides non oxydants. De nombreux composés du bore réagissent facilement avec l'eau pour donner de l'acide borique, B (OH) 3 (parfois appelé H 3 BO 3).
La réduction de l'oxyde borique avec de la poudre de magnésium forme du bore (pur à 95 à 98,5 %) sous forme de poudre brune et amorphe :
\[\ce{B2O3}(s)+\ce{3Mg}(s)⟶\ce{2B}(s)+\ce{3MgO}(s) \nonumber \]
Une substance amorphe est un matériau qui semble solide, mais qui n'a pas d'ordre à long terme comme un vrai solide. Le traitement à l'acide chlorhydrique élimine l'oxyde de magnésium. La purification ultérieure du bore commence par la conversion du bore impur en trichlorure de bore. L'étape suivante consiste à chauffer un mélange de trichlorure de bore et d'hydrogène :
\[\ce{2BCl3}(g)+\ce{3H2}(g)\:\mathrm{\xrightarrow{1500\:°C}}\:\ce{2B}(s)+\ce{6HCl}(g) \hspace{20px} ΔH°=\mathrm{253.7\: kJ} \nonumber \]
Le silicium représente près d'un quart de la masse de la croûte terrestre, juste derrière l'oxygène en abondance. La croûte est composée presque entièrement de minéraux dans lesquels les atomes de silicium sont au centre du tétraèdre silicium-oxygène, qui se connectent de différentes manières pour produire, entre autres, des chaînes, des couches et des structures tridimensionnelles. Ces minéraux constituent la majeure partie des roches, des sols et des argiles les plus courants. De plus, des matériaux tels que les briques, les céramiques et les verres contiennent des composés de silicium.
Il est possible de produire du silicium par réduction à haute température du dioxyde de silicium avec des agents réducteurs puissants, tels que le carbone et le magnésium :
\[\ce{SiO2}(s)+\ce{2C}(s)\xrightarrow{Δ}\ce{Si}(s)+\ce{2CO}(g) \nonumber \]
\[\ce{SiO2}(s)+\ce{2Mg}(s)\xrightarrow{Δ}\ce{Si}(s)+\ce{2MgO}(s) \nonumber \]
Du silicium extrêmement pur est nécessaire à la fabrication de dispositifs électroniques à semi-conducteurs. Ce processus commence par la conversion du silicium impur en tétrahalogénures de silicium, ou silane (SiH 4), suivie d'une décomposition à haute température. L'affinage par zone, illustré à la figure\(\PageIndex{3}\), complète la purification. Dans ce procédé, un barreau de silicium est chauffé à une extrémité par une source de chaleur qui produit une fine section transversale de silicium fondu. En abaissant lentement la tige à travers la source de chaleur, la zone fondue se déplace d'une extrémité à l'autre de la tige. Lorsque cette mince région fondue se déplace, les impuretés présentes dans le silicium se dissolvent dans le silicium liquide et se déplacent avec la région fondue. Finalement, les impuretés se déplacent vers une extrémité de la tige, qui est ensuite coupée.
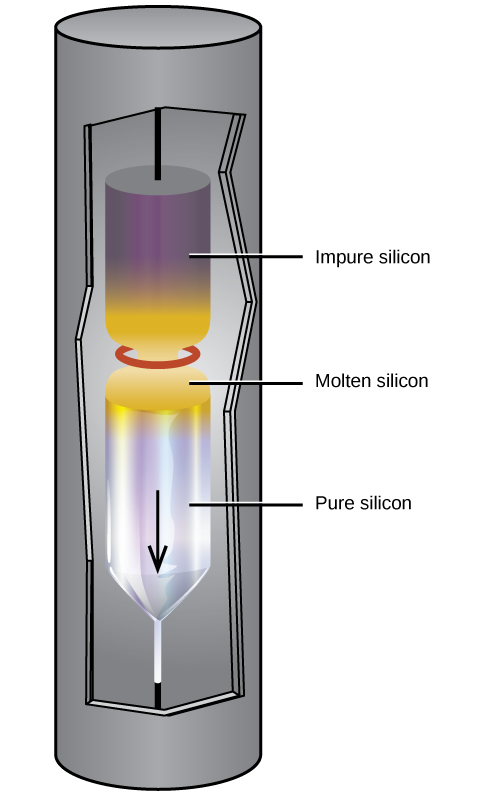
Ce silicium hautement purifié, ne contenant pas plus d'une partie d'impureté par million de parties de silicium, est l'élément le plus important de l'industrie informatique. Le silicium pur est nécessaire dans les dispositifs électroniques à semi-conducteurs tels que les transistors, les puces informatiques et les cellules solaires.
Comme certains métaux, la passivation du silicium se produit en raison de la formation d'un film d'oxyde très fin (principalement du dioxyde de silicium, SiO 2). Le dioxyde de silicium est soluble dans une base aqueuse chaude ; ainsi, les bases fortes détruisent la passivation. Le retrait de la couche de passivation permet à la base de dissoudre le silicium, formant de l'hydrogène gazeux et des anions silicatés. Par exemple :
\[\ce{Si}(s)+\ce{4OH-}(aq)⟶\ce{SiO4^4-}(aq)+\ce{2H2}(g) \nonumber \]
Le silicium réagit avec les halogènes à haute température, formant des tétrahalogénures volatils, tels que le SiF 4.
Contrairement au carbone, le silicium ne forme pas facilement des liaisons doubles ou triples. Les composés de silicium de formule générale SiX 4, où X est un groupe hautement électronégatif, peuvent agir comme des acides de Lewis pour former du silicium à six coordonnées. Par exemple, le tétrafluorure de silicium, SiF 4, réagit avec le fluorure de sodium pour produire du Na 2 [SiF 6], qui contient l'\(\ce{[SiF6]^2-}\)ion octaédrique dans lequel le silicium est hybridé sp 3 d 2 :
\[\ce{2NaF}(s)+\ce{SiF4}(g)⟶\ce{Na2SiF6}(s) \nonumber \]
L'antimoine réagit facilement avec des quantités stœchiométriques de fluor, de chlore, de brome ou d'iode, produisant des trihalogénures ou, avec un excès de fluor ou de chlore, formant les pentahalides SbF 5 et SbCl 5. Selon la stœchiométrie, il forme du sulfure d'antimoine (III), du Sb 2 S 3 ou du sulfure d'antimoine (V) lorsqu'il est chauffé au soufre. Comme prévu, la nature métallique de l'élément est supérieure à celle de l'arsenic, qui se trouve juste au-dessus de celui-ci dans le groupe 15.
Halogénures de bore et de silicium
Les trihalogénures de bore (BF 3, BCl 3, BBr 3 et BI 3) peuvent être préparés par réaction directe des éléments. Ces molécules non polaires contiennent du bore avec une hybridation sp 2 et une géométrie moléculaire plane trigonale. Les composés de fluorure et de chlorure sont des gaz incolores, le bromure est un liquide et l'iodure est un solide cristallin blanc.
À l'exception du trifluorure de bore, les trihalogénures de bore s'hydrolysent facilement dans l'eau pour former de l'acide borique et l'acide halogénhydrique correspondant. Le trichlorure de bore réagit selon l'équation :
\[\ce{BCl3}(g)+\ce{3H2O}(l)⟶\ce{B(OH)3}(aq)+\ce{3HCl}(aq) \nonumber \]
Le trifluorure de bore réagit avec l'acide fluorhydrique pour donner une solution d'acide fluoroborique, HBF 4 :
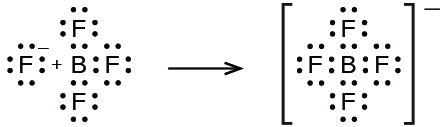
\[\ce{BF3}(aq)+\ce{HF}(aq)+\ce{H2O}(l)⟶\ce{H3O+}(aq)+\ce{BF4-}(aq) \nonumber \]
Dans cette réaction, la molécule BF 3 agit comme l'acide de Lewis (accepteur de paires d'électrons) et accepte une paire d'électrons provenant d'un ion fluorure :
Tous les tétrahalogénures de silicium, SiX 4, ont été préparés. Le tétrachlorure de silicium peut être préparé par chloration directe à des températures élevées ou en chauffant du dioxyde de silicium avec du chlore et du carbone :
\[\ce{SiO2}(s)+\ce{2C}(s)+\ce{2Cl2}(g)\xrightarrow{Δ}\ce{SiCl4}(g)+\ce{2CO}(g) \nonumber \]
Le tétrachlorure de silicium est une molécule tétraédrique covalente, qui est un liquide non polaire, incolore et à point d'ébullition bas (57 °C). Il est possible de préparer du tétrafluorure de silicium par réaction du dioxyde de silicium avec de l'acide fluorhydrique :
\[\ce{SiO2}(s)+\ce{4HF}(g)⟶\ce{SiF4}(g)+\ce{2H2O}(l) \hspace{20px} ΔH°=\mathrm{−191.2\: kJ} \nonumber \]
L'acide fluorhydrique est le seul acide commun qui réagit avec le dioxyde de silicium ou les silicates. Cette réaction se produit parce que la liaison silicium-fluor est la seule liaison formée par le silicium qui soit plus forte que la liaison silicium-oxygène. Pour cette raison, il est possible de stocker tous les acides courants, autres que l'acide fluorhydrique, dans des récipients en verre.
À l'exception du tétrafluorure de silicium, les halogénures de silicium sont extrêmement sensibles à l'eau. Lorsqu'il est exposé à l'eau, le SiCl 4 réagit rapidement avec les groupes hydroxydes, remplaçant les quatre atomes de chlore pour produire de l'acide orthosilicique instable, le Si (OH) 4 ou le H 4 SiO 4, qui se décompose lentement en SiO 2.
Oxydes et dérivés de bore et de silicium
Le bore brûle à 700 °C dans l'oxygène, formant de l'oxyde borique, B 2 O 3. L'oxyde borique est nécessaire à la production de verre borosilicaté résistant à la chaleur, comme celui représenté sur la figure\(\PageIndex{4}\) et de certains verres optiques. L'oxyde borique se dissout dans l'eau chaude pour former de l'acide borique, B (OH) 3 :
\[\ce{B2O3}(s)+\ce{3H2O}(l)⟶\ce{2B(OH)3}(aq) \nonumber \]

L'atome de bore de B (OH) 3 est hybridé sp 2 et est situé au centre d'un triangle équilatéral avec des atomes d'oxygène aux angles. Dans le solide B (OH) 3, la liaison hydrogène maintient ces unités triangulaires ensemble. L'acide borique, illustré sur la figure\(\PageIndex{5}\), est un acide très faible qui n'agit pas comme un donneur de protons mais plutôt comme un acide de Lewis, acceptant une paire d'électrons non partagée de la base de Lewis OH − :
\[\ce{B(OH)3}(aq)+\ce{2H2O}(l)⇌\ce{B(OH)4-}(aq)+\ce{H3O+}(aq) \hspace{20px} K_\ce{a}=5.8×10^{−10} \nonumber \]
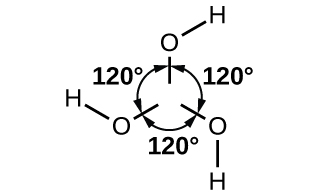
Le chauffage de l'acide borique à 100 °C provoque la division des molécules d'eau entre des paires de groupes —OH adjacents pour former de l'acide métaborique, HBO 2. À environ 150 °C, des liaisons B-O-B supplémentaires se forment, reliant les groupes BO 3 aux atomes d'oxygène communs pour former l'acide tétraborique, H 2 B 4 O 7. La perte complète d'eau, à des températures encore plus élevées, entraîne la formation d'oxyde borique.
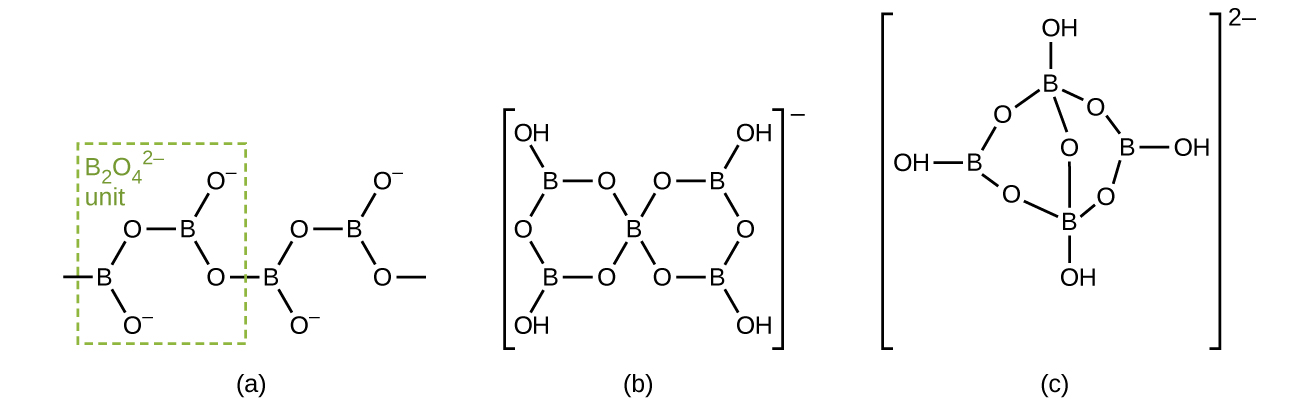
Les borates sont des sels des oxyacides du bore. Les borates résultent des réactions d'une base avec un oxyacide ou de la fusion de l'acide borique ou de l'oxyde borique avec un oxyde ou un hydroxyde métallique. Les anions borate vont du simple\(\ce{BO3^3-}\) ion planaire trigonal à des espèces complexes contenant des chaînes et des cycles d'atomes de bore coordonnés à trois et quatre. Les structures des anions présentes dans CaB 2 O 4, K [B 5 O 6 (OH) 4] ⋅2H 2 O (communément écrit KB 5 O 8 ⋅4H 2 O) et Na 2 [B 4 O 5 (OH) 4] ⋅8H 2 O (communément appelé Na 2 B 4 O 7 ⋅10H 2 O) sont représentés sur la figure\(\PageIndex{6}\). Sur le plan commercial, le borate le plus important est le borax, Na 2 [B 4 O 5 (OH) 4] ⋅8H 2 O, qui est un composant important de certains détergents à lessive. La majeure partie de l'approvisionnement en borax provient directement de lacs secs, tels que le lac Searles en Californie, ou est préparée à partir de kérnite, Na 2 B 4 O 7 ⋅4H 2 O.
Le dioxyde de silicium, la silice, se présente à la fois sous forme cristalline et amorphe. La forme cristalline habituelle du dioxyde de silicium est le quartz, un solide dur, fragile, clair et incolore. Il est utile de nombreuses manières : pour les décorations architecturales, les bijoux semi-précieux et le contrôle de fréquence dans les émetteurs radio. La silice prend de nombreuses formes cristallines, ou polymorphes, dans la nature. Des traces de Fe 3+ dans le quartz donnent à l'améthyste sa couleur violette caractéristique. Le terme quartz est également utilisé pour des articles tels que des tubes et des lentilles fabriqués à partir de silice amorphe. L'opale est une forme naturelle de silice amorphe.
Le contraste de structure et de propriétés physiques entre le dioxyde de silicium et le dioxyde de carbone est intéressant, comme l'illustre la figure\(\PageIndex{7}\). Le dioxyde de carbone solide (neige carbonique) contient des molécules de CO 2 uniques dont chacun des deux atomes d'oxygène est lié à l'atome de carbone par des liaisons doubles. De très faibles forces intermoléculaires maintiennent les molécules ensemble dans le cristal. La volatilité de la glace sèche reflète ces faibles forces entre les molécules. En revanche, le dioxyde de silicium est un solide réseau covalent. Dans le dioxyde de silicium, chaque atome de silicium est lié à quatre atomes d'oxygène par des liaisons simples dirigées vers les coins d'un tétraèdre normal, et les tétraèdres de SiO 4 partagent des atomes d'oxygène. Cette disposition donne un réseau tridimensionnel continu de silicium et d'oxygène. Un cristal de quartz est une macromolécule de dioxyde de silicium. La différence entre ces deux composés réside dans la capacité des éléments du groupe 14 à former de fortes liaisons π. Les éléments de la seconde période, tels que le carbone, forment de très fortes liaisons π, c'est pourquoi le dioxyde de carbone forme de petites molécules dotées de fortes doubles liaisons. Les éléments inférieurs à la deuxième période, tels que le silicium, ne forment pas de liaisons π aussi facilement que les éléments de seconde période, et lorsqu'ils se forment, les liaisons π sont plus faibles que celles formées par les éléments de seconde période. Pour cette raison, le dioxyde de silicium ne contient pas de liaisons π mais uniquement des liaisons σ.

À 1600 °C, le quartz fond pour produire un liquide visqueux. Lorsque le liquide se refroidit, il ne cristallise pas facilement mais se refroidit généralement et forme un verre, également appelé silice. Les tétraèdres de SiO 4 contenus dans la silice vitreuse ont une disposition aléatoire caractéristique des liquides surrefroidis, et le verre possède des propriétés très utiles. La silice est très transparente à la lumière visible et à la lumière ultraviolette. Pour cette raison, il est important dans la fabrication de lampes émettant un rayonnement riche en lumière ultraviolette et dans certains instruments optiques fonctionnant avec de la lumière ultraviolette. Le coefficient de dilatation du verre de silice est très faible ; par conséquent, les changements rapides de température ne provoquent pas de rupture. CorningWare et d'autres ustensiles de cuisine en céramique contiennent de la silice amorphe.
Les silicates sont des sels contenant des anions composés de silicium et d'oxygène. Dans presque tous les silicates, des atomes de silicium hybrides sp 3 se trouvent au centre des tétraèdres et de l'oxygène aux angles. Il existe une variation du rapport silicium/oxygène parce que les tétraèdres silicium-oxygène peuvent exister sous forme d'unités distinctes et indépendantes ou peuvent partager des atomes d'oxygène aux angles de différentes manières. De plus, la présence de divers cations donne naissance à un grand nombre de minéraux silicatés. De nombreuses céramiques sont composées de silicates. En incluant de petites quantités d'autres composés, il est possible de modifier les propriétés physiques des matériaux silicatés afin de produire des céramiques présentant des caractéristiques utiles.
Résumé
Les éléments bore, silicium, germanium, arsenic, antimoine et tellure séparent les métaux des non-métaux du tableau périodique. Ces éléments, appelés métalloïdes ou parfois semi-métalliques, présentent des propriétés caractéristiques à la fois des métaux et des non-métaux. Les structures de ces éléments sont similaires à bien des égards à celles des éléments non métalliques, mais les éléments sont des semi-conducteurs électriques.
Lexique
- amorphe
- un matériau solide tel qu'un verre dont la structure tridimensionnelle ne comporte pas de composant répétitif régulier ; un solide mais pas un cristal
- borate
- composé contenant des liaisons bore-oxygène, généralement avec des agrégats ou des chaînes comme partie de la structure chimique
- polymorphe
- variation de la structure cristalline qui se traduit par des propriétés physiques différentes pour le composé obtenu
- silicate
- composé contenant des liaisons silicium-oxygène, avec des tétraèdres silicatés connectés en anneaux, en feuilles ou en réseaux tridimensionnels, en fonction des autres éléments impliqués dans la formation des composés


