18.4 : Structure et propriétés générales des éléments non métalliques
- Page ID
- 193958
- Décrire la structure et les propriétés des éléments non métalliques
Les éléments non métalliques sont des éléments situés dans la partie supérieure droite du tableau périodique. Leurs propriétés et leur comportement sont très différents de ceux des métaux du côté gauche. Dans des conditions normales, plus de la moitié des produits non métalliques sont des gaz, l'un est un liquide et le reste contient certains des solides les plus mous et les plus durs. Les substances non métalliques présentent une grande variété de comportements chimiques. Ils comprennent les éléments les plus réactifs et les moins réactifs, et ils forment de nombreux composés ioniques et covalents différents. Cette section présente un aperçu des propriétés et des comportements chimiques des éléments non métalliques, ainsi que de la chimie d'éléments spécifiques. Nombre de ces substances non métalliques jouent un rôle important dans les systèmes biologiques.
Dans de nombreux cas, les tendances de l'électronégativité nous permettent de prédire le type de liaison et les états physiques des composés impliquant des éléments non métalliques. Nous savons que l'électronégativité diminue lorsque nous descendons dans un groupe donné et augmente lorsque nous nous déplaçons de gauche à droite sur une période donnée. Les éléments non métalliques ont des électronégativités supérieures à celles des métaux, et les composés formés entre les métaux et les non-métaux sont généralement de nature ionique en raison des grandes différences d'électronégativité entre eux. Les métaux forment des cations, les non-métaux forment des anions et les composés qui en résultent sont des solides dans des conditions normales. D'autre part, les composés formés entre deux ou plusieurs non-métaux présentent de petites différences d'électronégativité entre les atomes, ce qui entraîne une liaison covalente, c'est-à-dire un partage d'électrons. Ces substances ont tendance à être de nature moléculaire et sont des gaz, des liquides ou des solides volatils à température et pression ambiantes.
Dans les processus chimiques normaux, les substances non métalliques ne forment pas d'ions positifs (cations) monoatomiques car leurs énergies d'ionisation sont trop élevées. Tous les ions non métalliques monatomiques sont des anions ; les exemples incluent l'ion chlorure, Cl −, l'ion nitrure, N 3−, et l'ion séléniure, Se 2 −. Les états d'oxydation courants que présentent les non-métaux dans leurs composés ioniques et covalents sont illustrés sur la figure\(\PageIndex{1}\). Rappelez-vous qu'un élément présente un état d'oxydation positif lorsqu'il est combiné à un élément plus électronégatif et qu'il présente un état d'oxydation négatif lorsqu'il est combiné à un élément moins électronégatif.
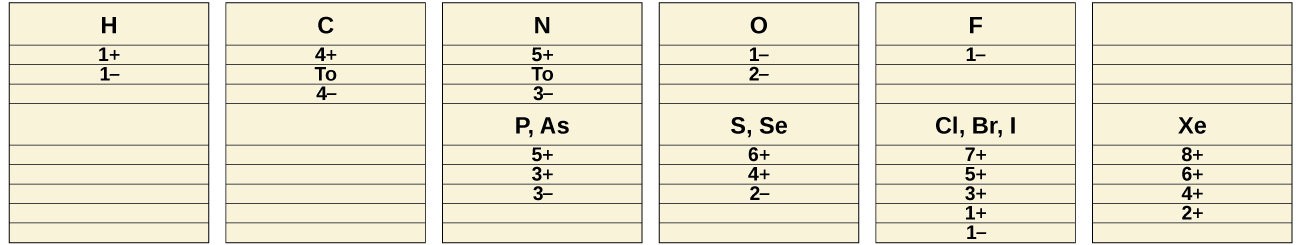
Le premier membre de chaque groupe non métallique présente des comportements différents, à de nombreux égards, de ceux des autres membres du groupe. Cela s'explique notamment par une taille plus petite, une énergie d'ionisation plus importante et (surtout) le fait que le premier membre de chaque groupe n'a que quatre orbitales de valence (une 2 s et trois 2 p) disponibles pour la liaison, tandis que les autres membres du groupe ont des orbitales d vides dans leur des couches de valence, rendant possible cinq, six ou même plus de liaisons autour de l'atome central. Par exemple, l'azote ne forme que du NF 3, alors que le phosphore forme à la fois du PF 3 et du PF 5.
Rappelez-vous qu'un élément présente un état d'oxydation positif lorsqu'il est combiné à un élément plus électronégatif et qu'il présente un état d'oxydation négatif lorsqu'il est combiné à un élément moins électronégatif.
Une autre différence entre le premier membre du groupe et les membres suivants est la plus grande capacité du premier membre à former des liaisons π. Cela est principalement dû à la taille plus petite du premier membre de chaque groupe, ce qui permet un meilleur chevauchement des orbitales atomiques. Les éléments non métalliques, autres que le premier membre de chaque groupe, forment rarement des liaisons π avec des éléments non métalliques qui constituent le premier membre d'un groupe. Par exemple, les liaisons π soufre-oxygène sont bien connues, alors que le soufre ne forme normalement pas de liaisons π stables avec lui-même.
La variété des états d'oxydation présentés par la plupart des produits non métalliques signifie que nombre de leurs réactions chimiques impliquent des modifications de l'état d'oxydation par des réactions d'oxydoréduction. La chimie d'oxydoréduction comporte cinq aspects généraux :
- Les substances non métalliques oxydent la plupart des métaux. L'état d'oxydation du métal devient positif lorsqu'il subit une oxydation et celui du non-métal devient négatif lorsqu'il subit une réduction. Par exemple :
\[4 \underset{0}{\ce{Fe}} \left( s \right) + 3 \underset{0}{\ce{O_2}} \left( g \right) \rightarrow 2 \underset{+3}{\ce{Fe_2}} \underset{-2}{\ce{O_3}} \left( s \right) \nonumber \] - À l'exception de l'azote et du carbone, qui sont de mauvais agents oxydants, un non-métal plus électronégatif oxyde un non-métal moins électronégatif ou l'anion du non-métal :
\[\underset{0}{\ce{S}} \left( s \right) + \underset{0}{\ce{O_2}} \left( g \right) \rightarrow 2 \underset{+4}{\ce{S}} \underset{-2}{\ce{O_2}} \left( s \right) \nonumber \]
\[\underset{0}{\ce{Cl_2}} \left( g \right) + 2 \ce{I^-} \left( aq \right) \rightarrow \underset{0}{\ce{I_2}} \left( s \right) + 2 \ce{Cl^-} \left( aq \right) \nonumber \]
- Le fluor et l'oxygène sont les agents oxydants les plus puissants au sein de leurs groupes respectifs ; chacun oxyde tous les éléments situés en dessous dans le groupe. Au cours d'une période donnée, l'agent oxydant le plus puissant se trouve dans le groupe 17. Un élément non métallique oxyde souvent un élément situé à sa gauche au cours de la même période. Par exemple :
\[2 \underset{0}{\ce{As}} \left( s \right) + 3 \underset{0}{\ce{Br_2}} \left( l \right) \rightarrow 2 \underset{+3}{\ce{As}} \underset{-1}{\ce{Br_3}} \left( s \right) \nonumber \]
- Plus un non-métal est fort en tant qu'agent oxydant, plus il est difficile d'oxyder l'anion formé par le non-métal. Cela signifie que les ions négatifs les plus stables sont formés par les éléments situés au sommet du groupe ou dans le groupe 17 de la période.
- Le fluor et l'oxygène sont les éléments oxydants les plus puissants connus. Le fluor ne forme pas de composés dans lesquels il présente des états d'oxydation positifs ; l'oxygène présente un état d'oxydation positif uniquement lorsqu'il est combiné au fluor. Par exemple :\[2 \underset{0}{\ce{F_2}} \left( g \right) + 2 \ce{OH^-} \left( aq \right) \rightarrow \underset{+2}{\ce{O}} \underset{-1}{\ce{F_2}} \left( g \right) + 2 \ce{F^-} \left( aq \right) + \ce{H_2O} \left( l \right) \nonumber \]
À l'exception de la plupart des gaz rares, tous les non-métaux forment des composés avec l'oxygène, produisant des oxydes covalents. La plupart de ces oxydes sont acides, c'est-à-dire qu'ils réagissent avec l'eau pour former des oxyacides. Rappelons dans le chapitre acide-base qu'un oxyacide est un acide composé d'hydrogène, d'oxygène et d'un autre élément. Les exceptions notables sont le monoxyde de carbone, le CO, le protoxyde d'azote, N 2 O, et l'oxyde nitrique, NO. Ces oxydes acides présentent trois caractéristiques :
- Les oxydes tels que le SO 2 et le N 2 O 5, dans lesquels le non-métal présente l'un de ses états d'oxydation courants, sont des anhydrides acides qui réagissent avec l'eau pour former des acides sans changement d'état d'oxydation. Le produit est un oxyacide. Par exemple :\[\ce{SO2}(g)+\ce{H2O}(l)⟶\ce{H2SO3}(aq) \nonumber \]\[\ce{N2O5}(s)+\ce{H2O}(l)⟶\ce{2HNO3}(aq) \nonumber \]
- Les oxydes tels que le NO 2 et le ClO 2, dans lesquels le non-métal ne présente pas l'un de ses états d'oxydation courants, réagissent également avec l'eau. Dans ces réactions, le non-métal est à la fois oxydé et réduit. Par exemple : les\[3 \underset{+4}{\ce{N}} \ce{O_2} \left( g \right) + \ce{H_2O} \left( l \right) \rightarrow 2 \ce{H} \underset{+5}{\ce{N}} \ce{O_3} \left( aq \right) + \underset{+2}{\ce{N}} \ce{O} \left( g \right) \nonumber \] réactions dans lesquelles le même élément est à la fois oxydé et réduit sont appelées réactions de disproportionation.
- La force acide augmente à mesure que l'électronégativité de l'atome central augmente. Pour en savoir plus, voir la discussion dans le chapitre sur la chimie acido-basique.
Les composés d'hydrogène binaires des éléments non métalliques présentent également un comportement acide dans l'eau, bien que seuls le HCl, le HBr et le HI soient des acides forts. La force acide des composés hydrogénés non métalliques augmente de gauche à droite au cours d'une période et vers le bas d'un groupe. Par exemple, l'ammoniac, NH 3, est un acide plus faible que l'eau, H 2 O, qui est plus faible que le fluorure d'hydrogène, HF. L'eau, H 2 O, est également un acide plus faible que le sulfure d'hydrogène, H 2 S, qui est plus faible que le séléniure d'hydrogène, H 2 Se. Un caractère acide plus faible implique un caractère basique plus élevé.
Structures des éléments non métalliques
Les structures des éléments non métalliques sont très différentes de celles des métaux. Les métaux cristallisent en réseaux serrés qui ne contiennent ni molécules ni liaisons covalentes. Les structures non métalliques contiennent des liaisons covalentes, et de nombreux produits non métalliques sont constitués de molécules individuelles. Les électrons des éléments non métalliques sont localisés dans des liaisons covalentes, alors que dans un métal, il y a délocalisation des électrons dans tout le solide.
Les gaz rares sont tous monoatomiques, tandis que les autres gaz non métalliques (hydrogène, azote, oxygène, fluor et chlore) existent normalement sous forme de molécules diatomiques H 2, N 2, O 2, F 2 et Cl 2. Les autres halogènes sont également diatomiques ; le Br 2 est un liquide et l'I 2 existe sous forme solide dans des conditions normales. Les changements d'état au fur et à mesure que l'on descend dans la famille des halogènes constituent d'excellents exemples de l'intensité croissante des forces intermoléculaires de Londres avec l'augmentation de la masse moléculaire et de la polarisabilité.
L'oxygène possède deux allotropes : O 2, dioxygène, et O 3, ozone. Le phosphore possède trois allotropes communs, communément désignés par leurs couleurs : blanc, rouge et noir. Le soufre possède plusieurs allotropes. Il existe également de nombreux allotropes carbonés. La plupart des gens connaissent le diamant, le graphite et le charbon de bois, mais moins de gens connaissent la récente découverte de fullerènes, de nanotubes de carbone et de graphène.
Les propriétés physiques de trois substances non métalliques caractéristiques des solides moléculaires sont décrites ci-dessous.
Carbone
Le carbone est présent à l'état non combiné (élémentaire) sous de nombreuses formes, telles que le diamant, le graphite, le charbon de bois, le coke, le noir de carbone, le graphène et le fullerène.
Le diamant, illustré sur la figure\(\PageIndex{2}\), est un matériau cristallin très dur qui est incolore et transparent lorsqu'il est pur. Chaque atome forme quatre liaisons simples avec quatre autres atomes aux coins d'un tétraèdre (hybridation sp 3) ; cela fait du diamant une molécule géante. Les liaisons simples carbone-carbone sont très fortes et, comme elles s'étendent à travers le cristal pour former un réseau tridimensionnel, les cristaux sont très durs et ont des points de fusion élevés (~4400 °C).

Le graphite, également illustré sur la figure\(\PageIndex{2}\), est un solide noir grisâtre doux et glissant qui conduit l'électricité. Ces propriétés se rapportent à sa structure, qui est constituée de couches d'atomes de carbone, chaque atome étant entouré de trois autres atomes de carbone selon un arrangement plan trigonal. Chaque atome de carbone du graphite forme trois liaisons σ, une vers chacun de ses voisins les plus proches, au moyen d'orbitales hybrides sp 2. L'orbitale p non hybridée de chaque atome de carbone chevauchera les orbitales non hybridées des atomes de carbone adjacents de la même couche pour former des liaisons π. De nombreuses formes de résonance sont nécessaires pour décrire la structure électronique d'une couche de graphite ; la figure\(\PageIndex{3}\) illustre deux de ces formes.
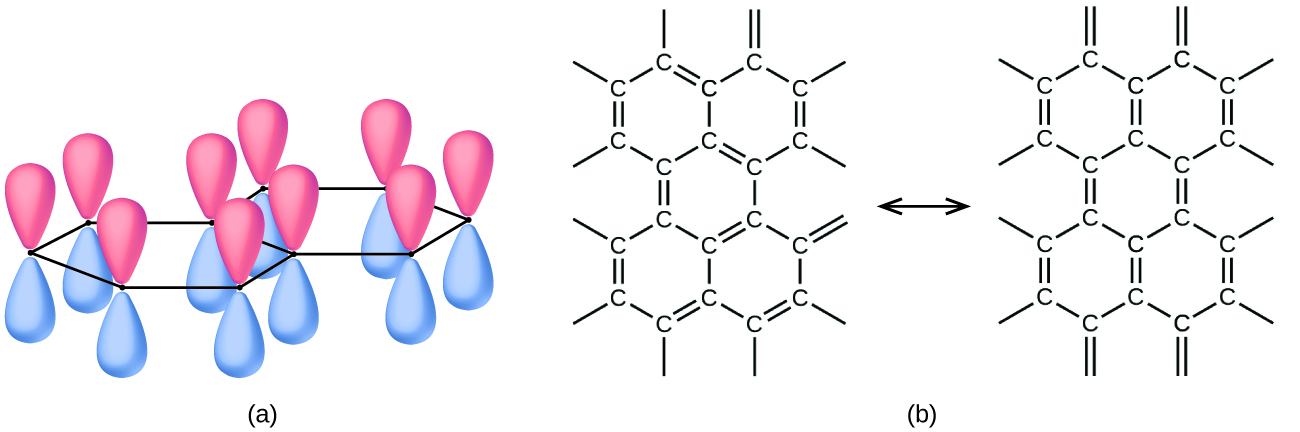
Les atomes d'une couche de graphite sont étroitement liés entre eux par les liaisons σ et π ; cependant, les forces entre les couches sont faibles. Les forces de dispersion de Londres maintiennent les couches ensemble. Pour en savoir plus, voir la discussion sur ces forces faibles dans le chapitre sur les liquides et les solides. Les faibles forces entre les couches confèrent au graphite son caractère doux et squameux qui le rend utile comme « plomb » dans les crayons et son caractère glissant qui le rend utile comme lubrifiant. Les électrons lâches contenus dans les liaisons π résonnantes peuvent se déplacer dans tout le solide et sont responsables de la conductivité électrique du graphite.
Les autres formes de carbone élémentaire incluent le noir de carbone, le charbon de bois et le coke. Le noir de carbone est une forme amorphe de carbone préparée par la combustion incomplète du gaz naturel, le CH 4. Il est possible de produire du charbon de bois et du coke en chauffant du bois et du charbon, respectivement, à des températures élevées en l'absence d'air.
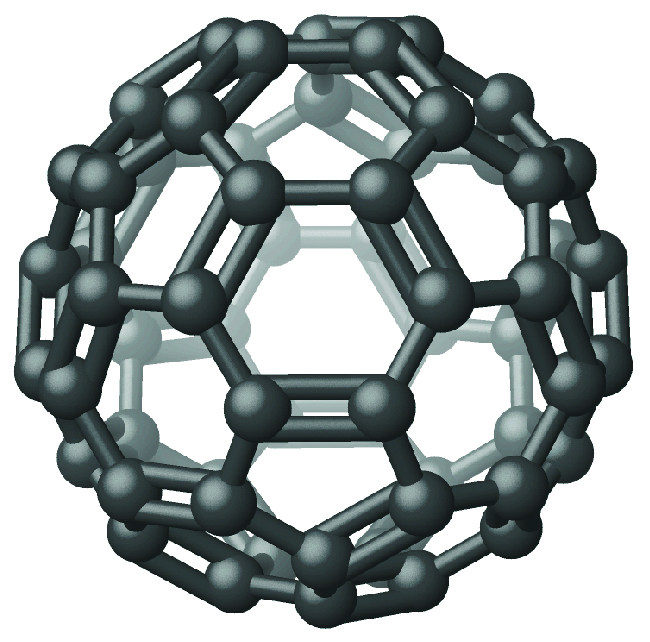
Récemment, de nouvelles formes de molécules de carbone élémentaire ont été identifiées dans la suie générée par une flamme enfumée et dans la vapeur produite lorsque le graphite est chauffé à de très hautes températures sous vide ou dans de l'hélium. L'une de ces nouvelles formes, isolée pour la première fois par le professeur Richard Smalley et ses collègues de l'université Rice, consiste en des molécules icosaédriques (en forme de ballon de football) contenant 60 atomes de carbone, le C 60. Il s'agit du buckminsterfullerène (souvent appelé bucky balls) d'après l'architecte Buckminster Fuller, qui a conçu des structures en forme de dôme, qui ont une apparence similaire (Figure\(\PageIndex{4}\)).
Nanotubes et graphène
Le graphène et les nanotubes de carbone sont deux allotropes du carbone récemment découverts. Les deux formes ont une certaine relation avec le graphite. Le graphène est une couche unique de graphite (un atome d'épaisseur), comme illustré à la figure\(\PageIndex{2}\) d, tandis que les nanotubes de carbone enroulent la couche en un petit tube, comme illustré sur la figure\(\PageIndex{5}\).

Le graphène est un conducteur de chaleur et d'électricité très solide, léger et efficace découvert en 2003. Comme dans le graphite, les atomes de carbone forment une couche de cycles à six chaînons avec des atomes de carbone hybrides au sp 2 aux angles. La résonance stabilise le système et conduit à sa conductivité. Contrairement au graphite, il n'y a pas d'empilement des couches pour donner une structure tridimensionnelle. Andre Geim et Kostya Novoselov de l'université de Manchester ont remporté le prix Nobel de physique 2010 pour leurs travaux novateurs sur la caractérisation du graphène.
La procédure la plus simple pour préparer du graphène consiste à utiliser un morceau de ruban adhésif pour retirer une seule couche de graphène de la surface d'un morceau de graphite. Cette méthode fonctionne parce qu'il n'y a que de faibles forces de dispersion de Londres entre les couches de graphite. D'autres méthodes consistent à déposer une seule couche d'atomes de carbone à la surface d'un autre matériau (ruthénium, iridium ou cuivre) ou à la synthétiser à la surface du carbure de silicium par sublimation du silicium.
Il n'existe actuellement aucune application commerciale du graphène. Cependant, ses propriétés inhabituelles, telles que la mobilité électronique élevée et la conductivité thermique, devraient le rendre adapté à la fabrication de nombreux dispositifs électroniques avancés et aux applications de gestion thermique.
Les nanotubes de carbone sont des allotropes de carbone qui ont une structure cylindrique. Comme le graphite et le graphène, les nanotubes sont constitués de cycles d'atomes de carbone hybrides au sp 2. Contrairement au graphite et au graphène, qui se présentent sous forme de couches, les couches s'enroulent dans un tube et se lient ensemble pour produire une structure stable. Les parois du tube peuvent avoir une épaisseur d'un atome ou de plusieurs atomes.
Les nanotubes de carbone sont des matériaux extrêmement résistants et plus durs que le diamant. Selon la forme du nanotube, il peut s'agir d'un conducteur ou d'un semi-conducteur. Pour certaines applications, la forme conductrice est préférable, tandis que d'autres applications utilisent la forme semi-conductrice.
La base de la synthèse des nanotubes de carbone est la génération d'atomes de carbone dans le vide. Il est possible de produire des atomes de carbone par une décharge électrique à travers le graphite, par vaporisation du graphite au laser et par décomposition d'un composé carboné.
La résistance des nanotubes de carbone finira par déboucher sur certaines de leurs applications les plus intéressantes, car un fil produit à partir de plusieurs nanotubes supportera un poids énorme. Cependant, les applications actuelles n'utilisent que des nanotubes massifs. L'ajout de nanotubes aux polymères améliore les propriétés mécaniques, thermiques et électriques du matériau en vrac. Il y a actuellement des nanotubes dans certaines pièces de vélo, skis, battes de baseball, cannes à pêche et planches de surf.
phosphore
Le nom phosphore vient des mots grecs qui signifient apporter de la lumière. Lorsque le phosphore a été isolé pour la première fois, les scientifiques ont remarqué qu'il brillait dans l'obscurité et brûlait lorsqu'il était exposé à l'air. Le phosphore est le seul membre de son groupe qui n'existe pas à l'état non combiné dans la nature ; il existe sous de nombreuses formes allotropiques. Nous examinerons deux de ces formes : le phosphore blanc et le phosphore rouge.
Le phosphore blanc est un solide blanc cireux qui fond à 44,2 °C et bout à 280 °C. Il est insoluble dans l'eau, est très soluble dans le disulfure de carbone et prend feu dans l'air. Sous forme solide, liquide, gazeuse et en solution, le phosphore blanc existe sous forme de molécules de P 4 avec quatre atomes de phosphore aux coins d'un tétraèdre ordinaire (Figure\(\PageIndex{5}\)). Chaque atome de phosphore se lie de manière covalente aux trois autres atomes de la molécule par des liaisons covalentes simples. Le phosphore blanc est l'allotrope le plus réactif et il est très toxique.

Le chauffage du phosphore blanc à 270—300 °C en l'absence d'air produit du phosphore rouge. Le phosphore rouge est plus dense, possède un point de fusion plus élevé (~600 °C), est beaucoup moins réactif, est essentiellement non toxique et est plus facile et plus sûr à manipuler que le phosphore blanc. Sa structure est hautement polymère et semble contenir des réseaux tridimensionnels de tétraèdres P 4 reliés par des liaisons simples P-P. Le phosphore rouge est insoluble dans les solvants qui dissolvent le phosphore blanc. Lorsque le phosphore rouge est chauffé, les molécules de P 4 se subliment à partir du solide.
Soufre
L'allotropie du soufre est bien plus grande et complexe que celle de tout autre élément. Le soufre est le soufre auquel il est fait référence dans la Bible et ailleurs, et des références au soufre sont présentes tout au long de l'histoire, jusqu'à la découverte relativement récente selon laquelle il est un composant de l'atmosphère de Vénus et d'Io, une lune de Jupiter. L'allotrope du soufre le plus courant et le plus stable est le soufre jaune rhombique, ainsi nommé en raison de la forme de ses cristaux. Le soufre rhombique est la forme vers laquelle tous les autres allotropes reprennent à température ambiante. Les cristaux de soufre rhombique fondent à 113 °C. En refroidissant ce liquide, on obtient de longues aiguilles de soufre monoclinique. Cette forme est stable entre 96 °C et le point de fusion, 119 °C. À température ambiante, elle reprend progressivement la forme rhombique.
Le soufre rhombique et le soufre monoclinique contiennent des molécules de S 8 dans lesquelles les atomes forment des anneaux plissés à huit chaînons qui ressemblent à des couronnes (Figure\(\PageIndex{6}\)). Chaque atome de soufre est lié à chacun de ses deux voisins dans le cycle par des liaisons simples S-S covalentes.
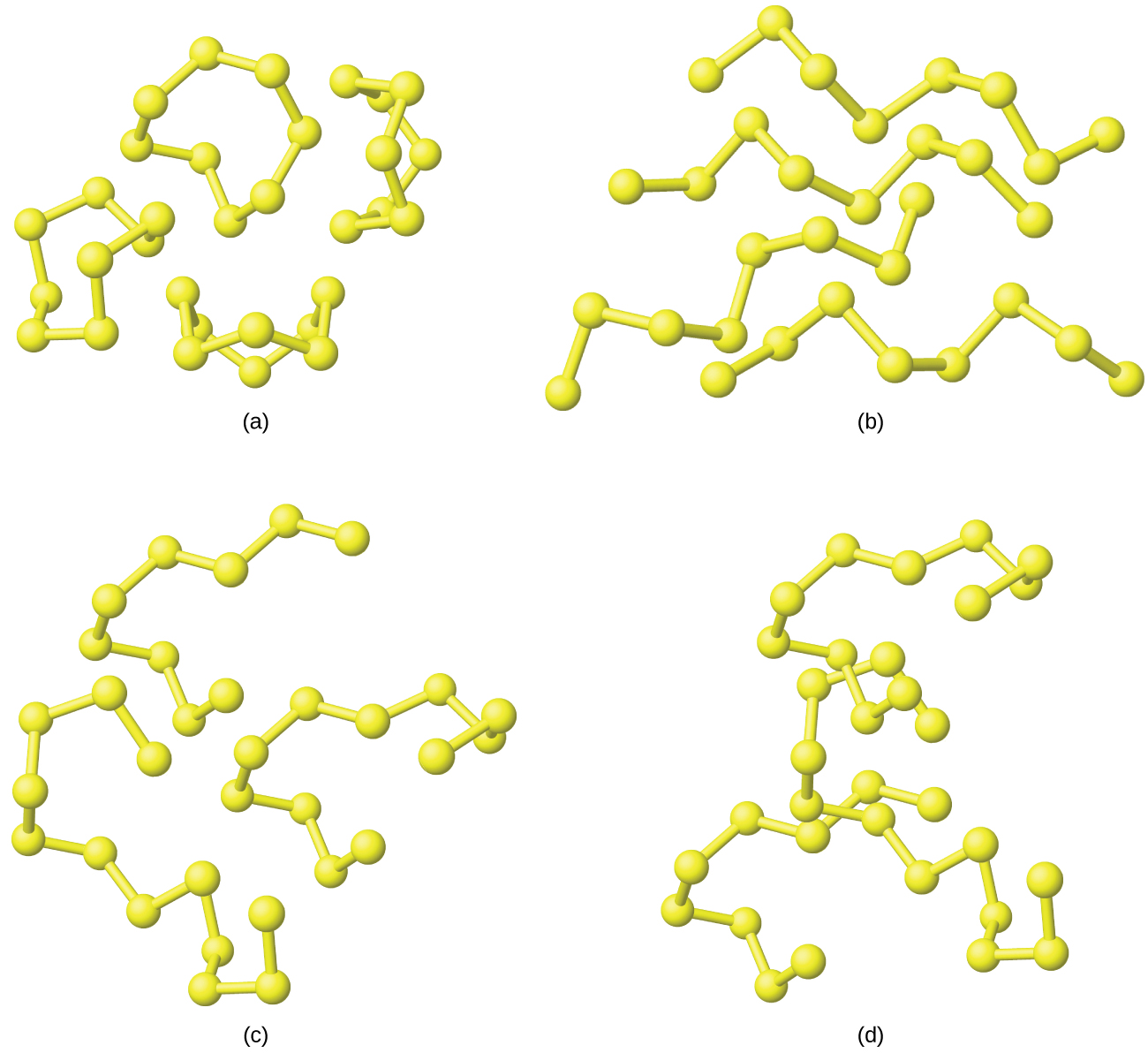
Lorsque le soufre rhombique fond, le liquide de couleur paille est assez mobile ; sa viscosité est faible car les molécules de S 8 sont essentiellement sphériques et offrent relativement peu de résistance lorsqu'elles se croisent. Lorsque la température augmente, les liaisons S-S dans les cycles se brisent et des chaînes polymères d'atomes de soufre se forment. Ces chaînes se combinent bout à bout, formant des chaînes encore plus longues qui s'emmêlent les unes aux autres. Le liquide prend progressivement de la couleur et devient si visqueux qu'il finit par ne pas couler facilement (à environ 230 °C). Les atomes pendants aux extrémités des chaînes d'atomes de soufre sont responsables de la couleur rouge foncé car leur structure électronique diffère de celle des atomes de soufre liés à deux atomes de soufre adjacents. Cela les amène à absorber la lumière différemment et à obtenir une couleur visible différente. Le refroidissement du liquide produit rapidement une masse amorphe semblable au caoutchouc, appelée soufre plastique.
Le soufre bout à 445 °C et forme une vapeur composée de molécules S 2, S 6 et S 8 ; à environ 1000 °C, la densité de vapeur correspond à la formule S 2, qui est une molécule paramagnétique comme l'O 2 avec une structure électronique similaire et une faible teneur en soufre double liaison de soufre.
Comme on l'a vu dans cette discussion, une caractéristique importante du comportement structurel des éléments non métalliques est que les éléments se présentent généralement avec huit électrons dans leur couche de valence. Si nécessaire, les éléments forment suffisamment de liaisons covalentes pour compléter les électrons déjà présents pour posséder un octet. Par exemple, les membres du groupe 15 possèdent cinq électrons de valence et n'ont besoin que de trois électrons supplémentaires pour remplir leur couche de valence. Ces éléments forment trois liaisons covalentes à l'état libre : des liaisons triples dans la molécule de N 2 ou des liaisons simples à trois atomes différents dans l'arsenic et le phosphore. Les éléments du groupe 16 ne nécessitent que deux électrons supplémentaires. L'oxygène forme une double liaison dans la molécule d'O 2, et le soufre, le sélénium et le tellure forment deux liaisons simples dans divers cycles et chaînes. Les halogènes forment des molécules diatomiques dans lesquelles chaque atome n'est impliqué que dans une seule liaison. Cela fournit l'électron nécessaire pour compléter l'octet sur l'atome d'halogène. Les gaz rares ne forment pas de liaisons covalentes avec d'autres atomes de gaz rares car leur enveloppe extérieure est déjà remplie.
Résumé
Les structures non métalliques sont très différentes de celles des métaux, principalement parce qu'ils ont une électronégativité supérieure et que les électrons sont plus étroitement liés aux atomes individuels. La plupart des oxydes non métalliques sont des anhydrides acides, c'est-à-dire qu'ils réagissent avec l'eau pour former des solutions acides. Les structures moléculaires sont communes à la plupart des substances non métalliques, et plusieurs d'entre elles possèdent de multiples allotropes aux propriétés physiques variables.
Lexique
- anhydride d'acide
- composé qui réagit avec l'eau pour former un acide ou une solution acide
- réaction de dismutation
- réaction chimique dans laquelle un seul réactif est simultanément réduit et oxydé ; il s'agit à la fois de l'agent réducteur et de l'agent oxydant


