18.2 : Présence et préparation des métaux représentatifs
- Page ID
- 193950
- Identifier les sources naturelles de métaux représentatifs
- Décrire les procédés de réduction électrolytique et chimique utilisés pour préparer ces éléments à partir de sources naturelles
En raison de leur réactivité, nous ne trouvons pas les métaux les plus représentatifs en tant qu'éléments libres dans la nature. Cependant, les composés qui contiennent des ions de la plupart des métaux représentatifs sont abondants. Dans cette section, nous examinerons les deux techniques couramment utilisées pour isoler les métaux de ces composés : l'électrolyse et la réduction chimique.
Ces métaux se trouvent principalement dans les minéraux, le lithium se trouvant dans les minéraux silicatés ou phosphatés, et le sodium et le potassium se trouvent dans les dépôts de sel provenant de l'évaporation des mers anciennes et dans les silicates. Les métaux alcalino-terreux se présentent sous forme de silicates et, à l'exception du béryllium, sous forme de carbonates et de sulfates. Le béryllium se présente sous la forme d'un béryl minéral, Be 3 Al 2 Si 6 O 18, qui, avec certaines impuretés, peut être soit l'émeraude, soit l'aigue-marine. Le magnésium se trouve dans l'eau de mer et, avec les métaux alcalino-terreux plus lourds, se présente sous forme de silicates, de carbonates et de sulfates. L'aluminium est présent en abondance dans de nombreux types d'argile et dans la bauxite, un hydroxyde d'oxyde d'aluminium impur. Le principal minerai d'étain est l'oxyde de cassitérite, SnO 2, et les principaux minerais de plomb et de thallium sont les sulfures ou les produits de l'altération des sulfures. Les autres métaux représentatifs sont présents sous forme d'impuretés dans les minerais de zinc ou d'aluminium.
Électrolyse
Les ions des métaux des groupes 1 et 2, ainsi que l'aluminium, sont très difficiles à réduire ; il est donc nécessaire de préparer ces éléments par électrolyse, un processus important discuté dans le chapitre sur l'électrochimie. En bref, l'électrolyse implique l'utilisation de l'énergie électrique pour mener à terme des réactions chimiques défavorables ; elle est utile pour isoler les métaux réactifs sous leurs formes pures. Le sodium, l'aluminium et le magnésium en sont des exemples typiques.
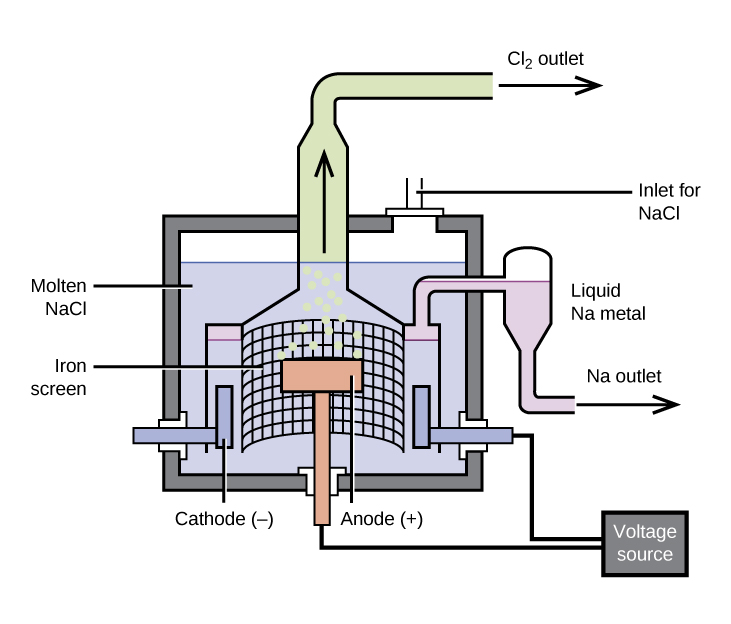
La préparation du sodium
La méthode la plus importante pour la production de sodium est l'électrolyse du chlorure de sodium fondu ; le montage est une cellule Downs, illustrée à la figure\(\PageIndex{1}\). La réaction impliquée dans ce processus est la suivante :
\[\ce{2NaCl}(l)\:\mathrm{\underset{600\:°C}{\xrightarrow{electrolysis}}}\:\ce{2Na}(l)+\ce{Cl2}(g) \nonumber \]
La cellule d'électrolyse contient du chlorure de sodium fondu (point de fusion de 801 °C), auquel du chlorure de calcium a été ajouté pour abaisser le point de fusion à 600 °C (effet colligatif). Le passage d'un courant continu à travers la cellule provoque la migration des ions sodium vers la cathode chargée négativement et captent des électrons, réduisant ainsi les ions en sodium métallique. Les ions chlorure migrent vers l'anode chargée positivement, perdent des électrons et s'oxydent en chlore gazeux. La réaction cellulaire globale provient de l'ajout des réactions suivantes :
\ [\ begin {align}
& \ textrm {à la cathode :} \ ce {2Na+} + \ ce {2e-} ⟶ \ ce {2Na} (l) \ \
& \ textrm {à l'anode :} \ ce {2Cl-} ⟶ \ ce {Cl2} (g) + \ ce {2e-} \ \
& \ textrm {changement global :} \ ce {2Cl-} Na+} + \ ce {2Cl-} ⟶ \ ce {2Na} (l) + \ ce {Cl2} (g)
\ end {align} \ nonnumber \]
La séparation du sodium et du chlore fondus empêche la recombinaison. Le sodium liquide, qui est moins dense que le chlorure de sodium fondu, flotte à la surface et s'écoule dans un collecteur. Le chlore gazeux est acheminé vers les réservoirs de stockage. Le chlore est également un produit précieux.
La préparation de l'aluminium
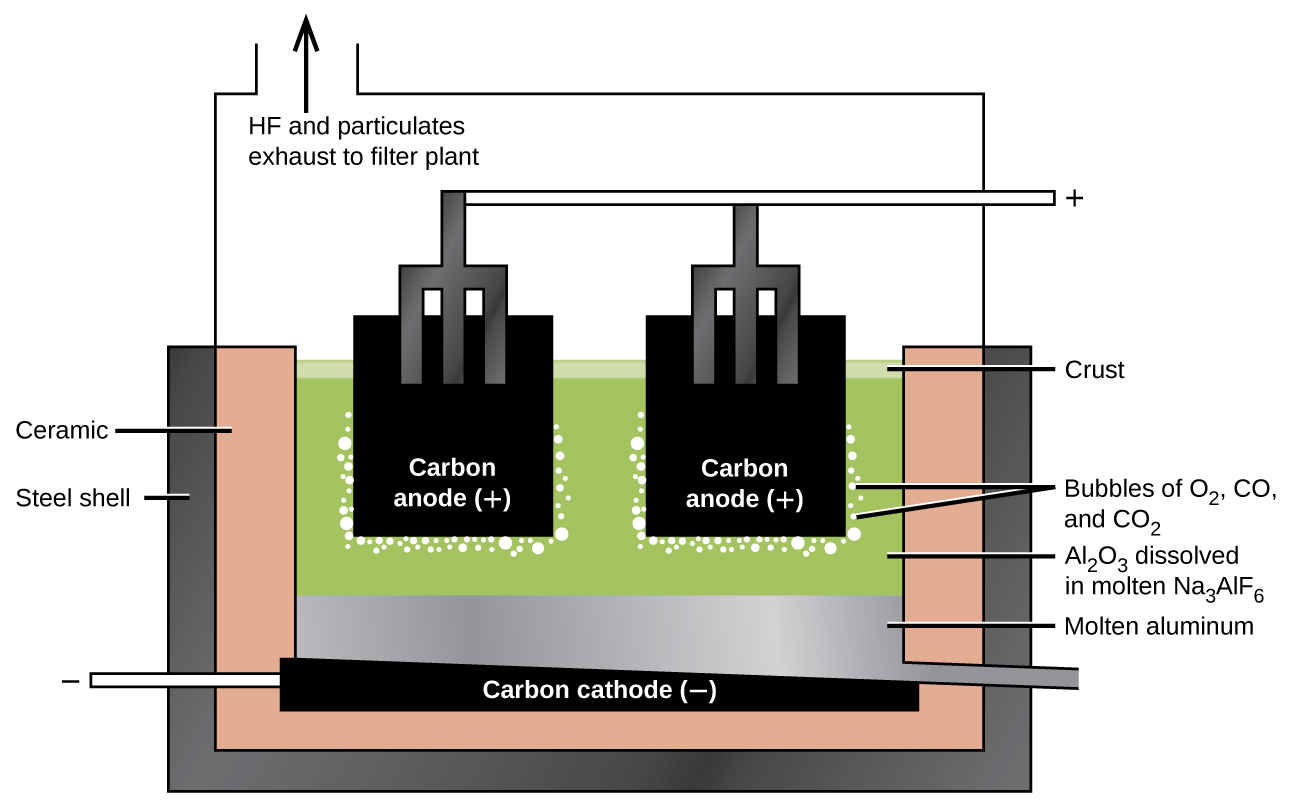
La préparation de l'aluminium utilise un procédé inventé en 1886 par Charles M. Hall, qui a commencé à travailler sur le problème alors qu'il était étudiant à l'Oberlin College en Ohio. Paul L. T. Héroult a découvert le processus de manière indépendante un mois ou deux plus tard en France. En l'honneur des deux inventeurs, cette cellule d'électrolyse est connue sous le nom de cellule Hall—Héroult. La cellule Hall—Héroult est une cellule d'électrolyse pour la production d'aluminium. La figure\(\PageIndex{2}\) illustre la cellule Hall—Héroult.
La production d'aluminium commence par la purification de la bauxite, la source d'aluminium la plus courante. La réaction de la bauxite, AlO (OH), avec l'hydroxyde de sodium chaud forme de l'aluminate de sodium soluble, tandis que l'argile et les autres impuretés restent non dissoutes :
\[\ce{AlO(OH)}(s)+\ce{NaOH}(aq)+\ce{H2O}(l)⟶\ce{Na[Al(OH)4]}(aq) \nonumber \]
Après élimination des impuretés par filtration, l'ajout d'acide à l'aluminate entraîne la reprécipitation de l'hydroxyde d'aluminium :
\[\ce{Na[Al(OH)4]}(aq)+\ce{H3O+}(aq)⟶\ce{Al(OH)3}(s)+\ce{Na+}(aq)+\ce{2H2O}(l) \nonumber \]
L'étape suivante consiste à éliminer l'hydroxyde d'aluminium précipité par filtration. Le chauffage de l'hydroxyde produit de l'oxyde d'aluminium, Al 2 O 3, qui se dissout dans un mélange fondu de cryolite, Na 3 AlF 6, et de fluorure de calcium, CaF 2. L'électrolyse de cette solution a lieu dans une cellule telle que celle illustrée à la figure\(\PageIndex{2}\). La réduction des ions aluminium vers le métal se produit à la cathode, tandis que de l'oxygène, du monoxyde de carbone et du dioxyde de carbone se forment à l'anode.
La préparation du magnésium
Le magnésium est l'autre métal isolé en grande quantité par électrolyse. L'eau de mer, qui contient environ 0,5 % de chlorure de magnésium, est la principale source de magnésium. L'addition d'hydroxyde de calcium à l'eau de mer précipite l'hydroxyde de magnésium. L'addition d'acide chlorhydrique à l'hydroxyde de magnésium, suivie de l'évaporation de la solution aqueuse résultante, laisse du chlorure de magnésium pur. L'électrolyse du chlorure de magnésium fondu forme du magnésium liquide et du chlore gazeux :
\[\ce{MgCl2}(aq)+\ce{Ca(OH)2}(aq)⟶\ce{Mg(OH)2}(s)+\ce{CaCl2}(aq) \nonumber \]
\[\ce{Mg(OH)2}(s)+\ce{2HCl}(aq)⟶\ce{MgCl2}(aq)+\ce{2H2O}(l) \nonumber \]
\[\ce{MgCl2}(l)⟶\ce{Mg}(l)+\ce{Cl2}(g) \nonumber \]
Certaines installations de production ont complètement abandonné l'électrolyse. Dans la section suivante, nous verrons comment le procédé Pidgeon conduit à la réduction chimique du magnésium.
Réduction des produits chimiques
Il est possible d'isoler de nombreux métaux représentatifs par réduction chimique en utilisant d'autres éléments comme agents réducteurs. En général, la réduction chimique est beaucoup moins coûteuse que l'électrolyse, et c'est pourquoi la réduction chimique est la méthode de choix pour isoler ces éléments. Par exemple, il est possible de produire du potassium, du rubidium et du césium par réduction chimique, car il est possible de réduire les chlorures fondus de ces métaux avec du sodium métallique. Cela peut être surprenant étant donné que ces métaux sont plus réactifs que le sodium ; toutefois, les métaux formés sont plus volatils que le sodium et peuvent être distillés pour être collectés. L'élimination de la vapeur métallique entraîne un changement d'équilibre pour produire plus de métal (selon le principe de Le Chatelier). La production de magnésium, de zinc et d'étain fournit d'autres exemples de réduction chimique.
La préparation du magnésium
Le procédé Pidgeon implique la réaction de l'oxyde de magnésium avec du silicium élémentaire à des températures élevées pour former du magnésium pur :
\[\ce{Si}(s)+\ce{2MgO}(s)\xrightarrow{Δ}\ce{SiO2}(s)+\ce{2Mg}(g) \nonumber \]
Bien que cette réaction soit défavorable en termes de thermodynamique, l'élimination de la vapeur de magnésium produite tire parti du principe du Chatelier pour poursuivre la progression de la réaction. Plus de 75 % de la production mondiale de magnésium, principalement en Chine, provient de ce procédé.
La préparation du zinc
Les minerais de zinc contiennent généralement du sulfure, de l'oxyde de zinc ou du carbonate de zinc. Après séparation de ces composés des minerais, le chauffage à l'air transforme le minerai en oxyde de zinc par l'une des réactions suivantes :
\[\ce{2ZnS}(s)+\ce{3O2}(g)\xrightarrow{Δ}\ce{2ZnO}(s)+\ce{2SO2}(g) \nonumber \]
\[\ce{ZnCO3}(s)\xrightarrow{Δ}\ce{ZnO}(s)+\ce{CO2}(g) \nonumber \]
Le carbone, sous forme de charbon, réduit l'oxyde de zinc pour former de la vapeur de zinc :
\[\ce{ZnO}(s)+\ce{C}(s)⟶\ce{Zn}(g)+\ce{CO}(g) \nonumber \]
Le zinc peut être distillé (point d'ébullition 907 °C) et condensé. Ce zinc contient des impuretés de cadmium (767 °C), de fer (2862 °C), de plomb (1750 °C) et d'arsenic (613 °C). Une redistillation minutieuse produit du zinc pur. L'arsenic et le cadmium sont distillés à partir du zinc parce qu'ils ont des points d'ébullition plus bas. À des températures plus élevées, le zinc est distillé à partir des autres impuretés, principalement du plomb et du fer.
La préparation de l'étain
La réduction rapide de l'oxyde d'étain (IV) par les charbons ardents d'un feu de camp explique les connaissances sur l'étain dans le monde antique. Dans le procédé moderne, la torréfaction des minerais d'étain contenant du SnO 2 élimine les contaminants tels que l'arsenic et le soufre sous forme d'oxydes volatils. Le traitement du matériau restant avec de l'acide chlorhydrique élimine les oxydes des autres métaux. Le chauffage du minerai purifié avec du charbon à une température supérieure à 1000 °C produit de l'étain :
\[\ce{SnO2}(s)+\ce{2C}(s)\xrightarrow{Δ}\ce{Sn}(s)+\ce{2CO}(g) \nonumber \]
L'étain fondu s'accumule au fond du four, est soutiré et coulé en blocs.
Résumé
En raison de leur réactivité chimique, il est nécessaire de produire les métaux représentatifs sous leur forme pure par réduction à partir de composés naturels. L'électrolyse joue un rôle important dans la production de sodium, de potassium et d'aluminium. La réduction chimique est la principale méthode d'isolation du magnésium, du zinc et de l'étain. Des procédures similaires sont importantes pour les autres métaux représentatifs.
Lexique
- réduction chimique
- procédé de préparation d'un métal représentatif à l'aide d'un agent réducteur
- Cellule Down
- cellule électrochimique utilisée pour la préparation commerciale de sodium métallique (et de chlore) à partir de chlorure de sodium fondu
- Cellule de Hall—Héroult
- appareil d'électrolyse utilisé pour isoler l'aluminium pur d'une solution d'alumine dans de la cryolite fondue
- Procédé Pidgeon
- procédé de réduction chimique utilisé pour produire du magnésium par réaction thermique de l'oxyde de magnésium avec du silicium


