18.1 : Périodicité
- Page ID
- 193956
- Classer les éléments
- Faire des prédictions sur les propriétés de périodicité des éléments représentatifs
Nous commençons cette section en examinant les comportements des métaux représentatifs par rapport à leur position dans le tableau périodique. Cette section portera principalement sur l'application de la périodicité aux métaux représentatifs.
Il est possible de diviser les éléments en groupes en fonction de leurs configurations électroniques. Les éléments représentatifs sont des éléments où les orbitales s et p se remplissent. Les éléments de transition sont des éléments où les orbitales d (groupes 3 à 11 du tableau périodique) se remplissent, et les métaux de transition internes sont les éléments où les orbitales f se remplissent. Les orbitales d se remplissent des éléments du groupe 11 ; par conséquent, les éléments du groupe 12 sont considérés comme des éléments représentatifs parce que le dernier électron entre sur une orbitale s. Les métaux parmi les éléments représentatifs sont les métaux représentatifs. Le caractère métallique résulte de la capacité d'un élément à perdre ses électrons de valence externe et se traduit par une conductivité thermique et électrique élevée, entre autres propriétés physiques et chimiques. Il existe 20 métaux représentatifs non radioactifs dans les groupes 1, 2, 3, 12, 13, 14 et 15 du tableau périodique (les éléments ombrés en jaune sur la figure\(\PageIndex{1}\)). Les éléments radioactifs que sont le copernicium, le flerovium, le polonium et le livermorium sont également des métaux mais n'entrent pas dans le cadre de ce chapitre.
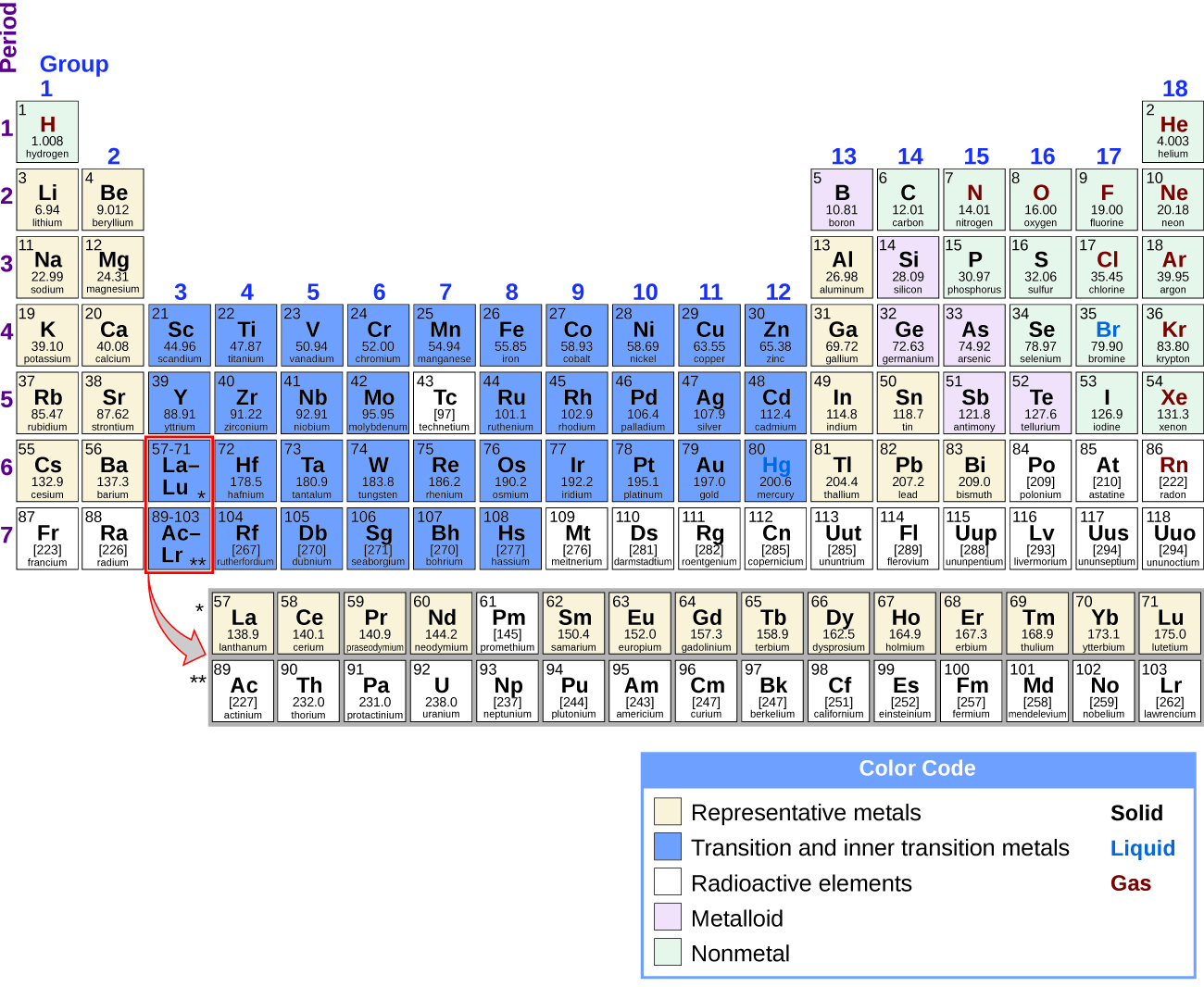
Outre les métaux représentatifs, certains des éléments représentatifs sont des métalloïdes. Un métalloïde est un élément dont les propriétés se situent entre celles des métaux et des non-métaux ; ces éléments sont généralement des semi-conducteurs. Les autres éléments représentatifs sont des éléments non métalliques. Contrairement aux métaux, qui forment généralement des cations et des composés ioniques (contenant des liaisons ioniques), les non-métaux ont tendance à former des anions ou des composés moléculaires. En général, la combinaison d'un métal et d'un non-métal produit un sel. Un sel est un composé ionique composé de cations et d'anions.
Un sel est un composé ionique composé de cations et d'anions.
La plupart des métaux représentatifs ne sont pas naturellement présents à l'état non combiné, car ils réagissent facilement avec l'eau et l'oxygène de l'air. Cependant, il est possible d'isoler le béryllium, le magnésium, le zinc, le cadmium, le mercure, l'aluminium, l'étain et le plomb élémentaires de leurs minéraux naturels et de les utiliser car ils réagissent très lentement avec l'air. L'une des raisons pour lesquelles ces éléments réagissent lentement est qu'ils réagissent avec l'air pour former un revêtement protecteur. La formation de ce revêtement protecteur est une passivation. Le revêtement est un film non réactif d'oxyde ou d'un autre composé. Le magnésium élémentaire, l'aluminium, le zinc et l'étain jouent un rôle important dans la fabrication de nombreux articles familiers, notamment du fil métallique, des ustensiles de cuisine, du papier aluminium et de nombreux objets domestiques et personnels. Bien que le béryllium, le cadmium, le mercure et le plomb soient facilement disponibles, leur utilisation est limitée en raison de leur toxicité.
Groupe 1 : Les métaux alcalins
Les métaux alcalins lithium, sodium, potassium, rubidium, césium et francium constituent le groupe 1 du tableau périodique. Bien que l'hydrogène fasse partie du groupe 1 (et également du groupe 17), il s'agit d'un produit non métallique qui mérite d'être examiné séparément plus loin dans ce chapitre. Le nom métal alcalin fait référence au fait que ces métaux et leurs oxydes réagissent avec l'eau pour former des solutions (alcalines) très basiques.
Les propriétés des métaux alcalins sont similaires les unes aux autres, comme on peut s'y attendre pour les éléments de la même famille. Les métaux alcalins ont les rayons atomiques les plus grands et la plus faible énergie de première ionisation de leurs périodes. Cette combinaison permet de retirer très facilement l'électron unique dans la couche la plus externe (valence) de chacun d'entre eux. La perte facile de cet électron de valence signifie que ces métaux forment facilement des cations stables avec une charge de 1+. Leur réactivité augmente avec l'augmentation du numéro atomique en raison de la facilité de perte de l'électron de valence unique (diminution de l'énergie d'ionisation). Comme l'oxydation est si facile, l'inverse, la réduction, est difficile, ce qui explique pourquoi il est difficile d'isoler les éléments. Les métaux alcalins solides sont très mous ; le lithium, illustré sur la figure\(\PageIndex{2}\), a la densité la plus faible de tous les métaux (0,5 g/cm 3).

Les métaux alcalins réagissent tous vigoureusement avec l'eau pour former de l'hydrogène gazeux et une solution basique d'hydroxyde métallique. Cela signifie qu'ils sont plus faciles à oxyder que l'hydrogène. À titre d'exemple, la réaction du lithium avec l'eau est :
\[\ce{2Li}(s)+\ce{2H2O}(l)⟶\ce{2LiOH}(aq)+\ce{H2}(g) \nonumber \]
Les métaux alcalins réagissent directement avec tous les éléments non métalliques (sauf les gaz rares) pour produire des composés ioniques binaires contenant des ions métalliques 1+. Ces métaux sont si réactifs qu'il est nécessaire d'éviter tout contact avec l'humidité et l'oxygène de l'air. Par conséquent, ils sont stockés dans des récipients scellés sous huile minérale, comme indiqué sur la figure\(\PageIndex{3}\), pour éviter tout contact avec l'air et l'humidité. Les métaux purs n'existent jamais à l'état libre (non combinés) dans la nature en raison de leur grande réactivité. De plus, cette forte réactivité oblige à préparer les métaux par électrolyse de composés de métaux alcalins.

Contrairement à de nombreux autres métaux, la réactivité et la douceur des métaux alcalins rendent ces métaux impropres à des applications structurales. Cependant, il existe des applications où la réactivité des métaux alcalins est un avantage. Par exemple, la production de métaux tels que le titane et le zirconium dépend, en partie, de la capacité du sodium à réduire les composés de ces métaux. La fabrication de nombreux composés organiques, y compris certains colorants, médicaments et parfums, utilise la réduction par le lithium ou le sodium.
Le sodium et ses composés confèrent une couleur jaune vif à une flamme, comme le montre la figure\(\PageIndex{4}\). Le passage d'une décharge électrique à travers de la vapeur de sodium produit également cette couleur. Dans les deux cas, il s'agit d'un exemple de spectre d'émission tel que discuté dans le chapitre sur la structure électronique. Les lampadaires utilisent parfois des lampes à vapeur de sodium parce que la vapeur de sodium pénètre mieux dans le brouillard que la plupart des autres lampes. Cela est dû au fait que le brouillard ne diffuse pas autant de lumière jaune que de lumière blanche. Les autres métaux alcalins et leurs sels donnent également de la couleur à une flamme. Le lithium crée une couleur pourpre brillante, tandis que les autres créent une couleur violette pâle.
Vidéo\(\PageIndex{1}\) : Cette vidéo montre les réactions des métaux alcalins avec l'eau.
Groupe 2 : Les métaux alcalino-terreux
Les métaux alcalino-terreux (béryllium, magnésium, calcium, strontium, baryum et radium) constituent le groupe 2 du tableau périodique. Le nom de métal alcalin vient du fait que les oxydes des membres les plus lourds du groupe réagissent avec l'eau pour former des solutions alcalines. La charge nucléaire augmente lorsque l'on passe du groupe 1 au groupe 2. En raison de cette augmentation de charge, les atomes des métaux alcalino-terreux sont plus petits et ont des énergies de première ionisation plus élevées que les métaux alcalins au cours de la même période. L'énergie d'ionisation plus élevée rend les métaux alcalino-terreux moins réactifs que les métaux alcalins ; cependant, ce sont toujours des éléments très réactifs. Leur réactivité augmente, comme prévu, à mesure que leur taille augmente et que l'énergie d'ionisation diminue. Lors de réactions chimiques, ces métaux perdent facilement leurs deux électrons de valence pour former des composés dans lesquels ils présentent un état d'oxydation de 2+. En raison de leur grande réactivité, il est courant de produire les métaux alcalino-terreux, comme les métaux alcalins, par électrolyse. Même si les énergies d'ionisation sont faibles, les deux métaux présentant les énergies d'ionisation les plus élevées (béryllium et magnésium) forment des composés qui présentent certains caractères covalents. Comme les métaux alcalins, les métaux alcalino-terreux plus lourds donnent de la couleur à une flamme. Comme dans le cas des métaux alcalins, cela fait partie du spectre d'émission de ces éléments. Le calcium et le strontium produisent des nuances de rouge, tandis que le baryum produit une couleur verte.
Le magnésium est un métal blanc argenté qui est malléable et ductile à haute température. La passivation diminue la réactivité du magnésium métallique. Lors de l'exposition à l'air, une couche d'oxycarbonate de magnésium adhérente se forme à la surface du métal et empêche toute réaction ultérieure. (Le carbonate provient de la réaction du dioxyde de carbone dans l'atmosphère.) Le magnésium est le plus léger des métaux de structure largement utilisés, c'est pourquoi la majeure partie de la production de magnésium est destinée aux alliages légers.
Le magnésium (Figure\(\PageIndex{5}\)), le calcium, le strontium et le baryum réagissent avec l'eau et l'air. À température ambiante, c'est le baryum qui réagit le plus vigoureusement. Les produits de la réaction avec l'eau sont l'hydrogène et l'hydroxyde métallique. La formation de gaz hydrogène indique que les métaux alcalino-terreux plus lourds sont de meilleurs agents réducteurs (plus facilement oxydés) que l'hydrogène. Comme prévu, ces métaux réagissent à la fois avec les acides et les non-métaux pour former des composés ioniques. Contrairement à la plupart des sels de métaux alcalins, de nombreux sels courants des métaux alcalino-terreux sont insolubles dans l'eau en raison des énergies de réseau élevées de ces composés, qui contiennent un ion métallique bivalent.

Le puissant pouvoir réducteur du magnésium chaud est utile pour préparer certains métaux à partir de leurs oxydes. En effet, l'affinité du magnésium pour l'oxygène est si grande que la combustion du magnésium réagit avec le dioxyde de carbone, produisant du carbone élémentaire :
\[\ce{2Mg}(s)+\ce{CO2}(g)⟶\ce{2MgO}(s)+\ce{C}(s) \nonumber \]
Pour cette raison, un extincteur au CO 2 n'éteindra pas un feu au magnésium. De plus, la lumière blanche brillante émise par la combustion du magnésium le rend utile pour les fusées éclairantes et les feux d'artifice.
Métaux du groupe 12
Les éléments du groupe 12 sont des éléments de transition ; cependant, le dernier électron ajouté n'est pas un électron d, mais un électron s. Puisque le dernier électron ajouté est un électron s, ces éléments sont considérés comme des métaux représentatifs ou des métaux post-transition. Les éléments du groupe 12 se comportent davantage comme les métaux alcalino-terreux que comme les métaux de transition. Le groupe 12 contient les quatre éléments zinc, cadmium, mercure et copernicium. Chacun de ces éléments possède deux électrons dans sa coque extérieure (ns 2). Lorsque les atomes de ces métaux forment des cations d'une charge de 2+, où les deux électrons extérieurs sont perdus, ils présentent des configurations d'électrons de gaz pseudo-nobles. Le mercure fait parfois exception car il présente également un état d'oxydation de 1+ dans les composés contenant un\(\ce{Hg2^2+}\) ion diatomique. Sous leurs formes élémentaires et dans leurs composés, le cadmium et le mercure sont tous deux toxiques.
Le zinc est le plus réactif du groupe 12 et le mercure le moins réactif. (Il s'agit de l'inverse de la tendance de réactivité des métaux des groupes 1 et 2, dans laquelle la réactivité augmente vers le bas d'un groupe. L'augmentation de la réactivité avec l'augmentation du numéro atomique ne se produit que pour les métaux des groupes 1 et 2.) La diminution de la réactivité est due à la formation d'ions présentant une configuration de gaz pseudo-nobles et à d'autres facteurs qui dépassent le cadre de cette discussion. Les comportements chimiques du zinc et du cadmium sont assez similaires mais diffèrent de ceux du mercure.
Le zinc et le cadmium ont des potentiels de réduction inférieurs à ceux de l'hydrogène et, comme les métaux alcalins et alcalino-terreux, ils produisent de l'hydrogène gazeux lorsqu'ils réagissent avec les acides. La réaction du zinc avec l'acide chlorhydrique, illustrée sur la figure\(\PageIndex{6}\), est la suivante :

Le zinc est un métal argenté qui se ternit rapidement pour prendre un aspect bleu-gris. Ce changement de couleur est dû à un revêtement adhérent d'un carbonate basique, Zn 2 (OH) 2 CO 3, qui passive le métal pour empêcher toute corrosion ultérieure. Les piles sèches et alcalines contiennent une anode en zinc. Le laiton (Cu et Zn) et une partie du bronze (Cu, Sn et parfois Zn) sont des alliages de zinc importants. Environ la moitié de la production de zinc sert à protéger le fer et les autres métaux de la corrosion. Cette protection peut prendre la forme d'une anode sacrificielle (également appelée anode galvanique, qui est un moyen de fournir une protection cathodique pour divers métaux) ou d'une fine couche sur le métal protégé. L'acier galvanisé est un acier avec un revêtement protecteur en zinc.
Anodes sacrificielles
Une anode sacrificielle, ou anode galvanique, est un moyen de fournir une protection cathodique de divers métaux. La protection cathodique fait référence à la prévention de la corrosion en convertissant le métal corrodé en cathode. En tant que cathode, le métal résiste à la corrosion, qui est un processus d'oxydation. La corrosion se produit à l'anode sacrificielle plutôt qu'à la cathode.
La construction d'un tel système commence par la fixation d'un métal plus actif (potentiel de réduction plus négatif) au métal à protéger. La fixation peut être directe ou par fil. Pour compléter le circuit, un pont de sel est nécessaire. Ce pont salé est souvent constitué d'eau de mer ou d'eau souterraine. Une fois le circuit terminé, l'oxydation (corrosion) se produit à l'anode et non à la cathode.
Les anodes sacrificielles couramment utilisées sont le magnésium, l'aluminium et le zinc. Le magnésium possède le potentiel de réduction le plus négatif des trois et fonctionne mieux lorsque le pont salin est moins efficace en raison d'une faible concentration d'électrolytes, comme dans l'eau douce. Le zinc et l'aluminium fonctionnent mieux dans l'eau salée que le magnésium. L'aluminium est plus léger que le zinc et possède une capacité supérieure ; toutefois, un revêtement d'oxyde peut passiver l'aluminium. Dans des cas particuliers, d'autres matériaux sont utiles. Par exemple, le fer protégera le cuivre.
Le mercure est très différent du zinc et du cadmium. Le mercure est le seul métal liquide à 25 °C. De nombreux métaux se dissolvent dans le mercure, formant des solutions appelées amalgames (voir la section sur les amalgames), qui sont des alliages de mercure avec un ou plusieurs autres métaux. Le mercure, illustré à la figure\(\PageIndex{7}\), est un élément non réactif qui est plus difficile à oxyder que l'hydrogène. Ainsi, il ne déplace pas l'hydrogène des acides ; cependant, il réagit avec des acides oxydants puissants, tels que l'acide nitrique :
\[\ce{Hg}(l)+\ce{HCl}(aq)⟶\textrm{no reaction} \nonumber \]
\[\ce{3Hg}(l)+\ce{8HNO3}(aq)⟶\ce{3Hg(NO3)2}(aq)+\ce{4H2O}(l)+\ce{2NO}(g) \nonumber \]
Le NO clair initialement formé subit rapidement une oxydation supplémentaire en NO 2 brun rougeâtre.

La plupart des composés du mercure se décomposent lorsqu'on les chauffe La plupart des composés du mercure contiennent du mercure à l'état d'oxydation 2+. Lorsqu'il y a un excès important de mercure, il est possible de former des composés contenant l'\(\ce{Hg2^2+}\)ion. Tous les composés du mercure sont toxiques et il est nécessaire de faire preuve de beaucoup de prudence dans leur synthèse.
Un amalgame est un alliage de mercure avec un ou plusieurs autres métaux. Cela revient à considérer l'acier comme un alliage de fer avec d'autres métaux. La plupart des métaux forment un amalgame avec le mercure, à l'exception du fer, du platine, du tungstène et du tantale. En raison des problèmes de toxicité liés au mercure, il y a eu une diminution significative de l'utilisation d'amalgames. Historiquement, les amalgames jouaient un rôle important dans les cellules d'électrolyse et dans l'extraction de l'or. Les amalgames de métaux alcalins sont toujours utilisés car ce sont des agents réducteurs puissants et plus faciles à manipuler que les métaux alcalins purs. Les prospecteurs ont eu un problème lorsqu'ils ont découvert de l'or finement divisé. Ils ont appris que l'ajout de mercure à leurs casseroles permettait de récupérer l'or contenu dans le mercure pour former un amalgame qui faciliterait la collecte. Malheureusement, les pertes de petites quantités de mercure au fil des ans ont pollué de nombreux cours d'eau de Californie. Les dentistes utilisent des amalgames contenant de l'argent et d'autres métaux pour combler les caries. Il existe plusieurs raisons d'utiliser un amalgame, notamment son faible coût, sa facilité de manipulation et sa longévité par rapport à d'autres matériaux. Les amalgames dentaires contiennent environ 50 % de mercure en poids, ce qui est devenu préoccupant ces dernières années en raison de la toxicité du mercure.
Après avoir examiné les meilleures données disponibles, la Food and Drug Administration (FDA) considère que les obturations à base d'amalgames sont sans danger pour les adultes et les enfants de plus de six ans. Même avec de multiples obturations, les niveaux de mercure chez les patients restent bien en deçà des niveaux les plus bas associés à des effets nocifs. Les études cliniques n'ont révélé aucun lien entre les amalgames dentaires et les problèmes de santé. Les problèmes de santé peuvent ne pas être les mêmes chez les enfants de moins de six ans ou chez les femmes enceintes. Les conclusions de la FDA sont conformes aux avis de l'Agence de protection de l'environnement (EPA) et des Centers for Disease Control (CDC). Le seul problème de santé noté est que certaines personnes sont allergiques à l'amalgame ou à l'un de ses composants.
Groupe 13
Le groupe 13 contient le bore métalloïde et les métaux aluminium, gallium, indium et thallium. L'élément le plus léger, le bore, est semi-conducteur et ses composés binaires ont tendance à être covalents et non ioniques. Les autres éléments du groupe sont des métaux, mais leurs oxydes et hydroxydes changent de caractère. Les oxydes et hydroxydes d'aluminium et de gallium présentent des comportements à la fois acides et basiques. Une substance, comme celles-ci, qui réagit à la fois avec les acides et les bases est amphotère. Cette caractéristique illustre la combinaison des comportements non métalliques et métalliques de ces deux éléments. Les oxydes et hydroxydes d'indium et de thallium ne présentent qu'un comportement basique, conformément au caractère clairement métallique de ces deux éléments. Le point de fusion du gallium est anormalement bas (environ 30 °C) et il fondra dans votre main.
L'aluminium est amphotère car il réagit à la fois avec les acides et les bases. Une réaction typique avec un acide est la suivante :
\[\ce{2Al}(s)+\ce{6HCl}(aq)⟶\ce{2AlCl3}(aq)+\ce{3H2}(g) \nonumber \]
Les produits de la réaction de l'aluminium avec une base dépendent des conditions de réaction, l'une des possibilités étant les suivantes :
\[\ce{2Al}(s)+\ce{2NaOH}(aq)+\ce{6H2O}(l)⟶\ce{2Na[Al(OH)4]}(aq)+\ce{3H2}(g) \nonumber \]
Avec les acides et les bases, la réaction avec l'aluminium génère de l'hydrogène gazeux.
Les éléments du groupe 13 ont une configuration électronique de couche de valence de ns 2 np 1. L'aluminium utilise normalement tous ses électrons de valence lorsqu'il réagit, donnant des composés dans lesquels il a un état d'oxydation de 3+. Bien que bon nombre de ces composés soient covalents, d'autres, tels que AlF 3 et Al 2 (SO 4) 3, sont ioniques. Les solutions aqueuses de sels d'aluminium contiennent le cation\(\ce{[Al(H2O)6]^3+}\), abrégé en Al 3 + (aq). Le gallium, l'indium et le thallium forment également des composés ioniques contenant des ions M 3+. Ces trois éléments présentent non seulement l'état d'oxydation attendu de 3+ pour les trois électrons de valence, mais également un état d'oxydation (dans ce cas, 1+) inférieur de deux à la valeur attendue. Ce phénomène, l'effet de paire inerte, fait référence à la formation d'un ion stable dont l'état d'oxydation est inférieur de deux à celui attendu pour le groupe. La paire d'électrons est l'orbitale de valence de ces éléments. En général, l'effet de paire inerte est important pour les éléments du bloc p inférieur. Dans une solution aqueuse, l'ion Tl + (aq) est plus stable que le Tl 3 + (aq). En général, ces métaux réagissent avec l'air et l'eau pour former des ions 3+ ; toutefois, le thallium réagit pour donner des dérivés du thallium (I). Les métaux du groupe 13 réagissent tous directement avec des éléments non métalliques tels que le soufre, le phosphore et les halogènes, formant des composés binaires.
Les métaux du groupe 13 (Al, Ga, In et Tl) sont tous réactifs. Cependant, la passivation se produit lorsqu'un film mince, dur et résistant d'oxyde métallique se forme lorsqu'il est exposé à l'air. La rupture de ce film peut contrecarrer la passivation et permettre au métal de réagir. L'un des moyens de perturber le film consiste à exposer le métal passivé au mercure. Une partie du métal se dissout dans le mercure pour former un amalgame qui élimine la couche d'oxyde protectrice et expose le métal à une réaction ultérieure. La formation d'un amalgame permet au métal de réagir avec l'air et l'eau.
Vidéo\(\PageIndex{2}\) : Bien que l'aluminium s'oxyde facilement, la passivation de l'aluminium le rend très utile en tant que matériau de construction solide et léger. En raison de la formation d'un amalgame, le mercure est corrosif pour les matériaux structuraux en aluminium. Cette vidéo montre comment l'intégrité d'un faisceau d'aluminium peut être détruite par l'ajout d'une petite quantité de mercure élémentaire.
L'aluminium est principalement utilisé dans les industries de la construction et du transport, ainsi que dans la fabrication de canettes et de feuilles d'aluminium. Ces utilisations dépendent de la légèreté, de la ténacité et de la résistance du métal, ainsi que de sa résistance à la corrosion. L'aluminium étant un excellent conducteur de chaleur et résistant à la corrosion, il est utile dans la fabrication d'ustensiles de cuisine.
L'aluminium est un très bon agent réducteur et peut remplacer d'autres agents réducteurs pour isoler certains métaux de leurs oxydes. Bien que plus coûteux que la réduction par le carbone, l'aluminium joue un rôle important dans l'isolation du Mo, du W et du Cr de leurs oxydes.
Groupe 14
Les éléments métalliques du groupe 14 sont l'étain, le plomb et le flérovium. Le carbone est un non-métal typique. Les autres éléments du groupe, le silicium et le germanium, sont des exemples de semi-métaux ou de métalloïdes. L'étain et le plomb forment les cations divalents stables, Sn 2 + et Pb 2 +, dont les états d'oxydation sont deux inférieurs à l'état d'oxydation du groupe, qui est 4+. La stabilité de cet état d'oxydation est une conséquence de l'effet de paire inerte. L'étain et le plomb forment également des composés covalents présentant un état d'oxydation 4+ formel. Par exemple, le SnCl 4 et le PBCl 4 sont des liquides covalents à bas point d'ébullition.

L'étain réagit facilement avec les éléments non métalliques et les acides pour former des composés de l'étain (II) (indiquant qu'il s'oxyde plus facilement que l'hydrogène) et avec des éléments non métalliques pour former des composés d'étain (II) ou d'étain (IV) (Figure\(\PageIndex{8}\)), selon la stœchiométrie et les conditions de réaction. Le plomb est moins réactif. Il n'est que légèrement plus facile à oxyder que l'hydrogène, et l'oxydation nécessite normalement un acide concentré chaud.
Nombre de ces éléments existent sous forme d'allotropes. Les allotropes sont deux ou plusieurs formes du même élément dans le même état physique avec des propriétés chimiques et physiques différentes. Il existe deux allotropes courants de l'étain. Ces allotropes sont l'étain gris (fragile) et l'étain blanc. Comme pour les autres allotropes, la différence entre ces formes d'étain réside dans la disposition des atomes. L'étain blanc est stable au-dessus de 13,2 °C et est malléable comme les autres métaux. À basse température, l'étain gris est la forme la plus stable. L'étain gris est fragile et a tendance à se décomposer en poudre. Par conséquent, les articles en étain se désintégreront par temps froid, en particulier si la vague de froid est longue. Le changement progresse lentement à partir du point d'origine, et l'étain gris qui se forme pour la première fois catalyse d'autres changements. D'une certaine manière, cet effet est similaire à la propagation d'une infection dans le corps d'une plante ou d'un animal, ce qui amène les gens à appeler ce processus maladie de l'étain ou ravageur de l'étain.
L'étain est principalement utilisé dans le revêtement de l'acier pour former de la tôle d'étain, qui constitue l'étain dans les boîtes de conserve. Les principaux alliages d'étain sont le bronze (Cu et Sn) et la soudure (Sn et Pb). Le plomb joue un rôle important dans les accumulateurs au plomb des automobiles.
Groupe 15
Le bismuth, le membre le plus lourd du groupe 15, est un métal moins réactif que les autres métaux représentatifs. Il cède facilement trois de ses cinq électrons de valence à des non-métaux actifs pour former l'ion tripositif, Bi 3 +. Il forme des composés dont l'état d'oxydation du groupe est 5+ uniquement lorsqu'il est traité avec des agents oxydants puissants. La stabilité de l'état d'oxydation 3+ est un autre exemple de l'effet de paire inerte.
Résumé
Cette section se concentre sur la périodicité des éléments représentatifs. Ce sont les éléments par lesquels les électrons entrent dans les orbitales s et p. Les éléments représentatifs se trouvent dans les groupes 1, 2 et 12 à 18. Ces éléments sont des métaux, des métalloïdes et des éléments non métalliques représentatifs. Les métaux alcalins (groupe 1) sont très réactifs, forment facilement des ions avec une charge de 1+ pour former des composés ioniques généralement solubles dans l'eau, et réagissent vigoureusement avec l'eau pour former de l'hydrogène gazeux et une solution basique d'hydroxyde métallique. Les électrons les plus externes des métaux alcalino-terreux (groupe 2) sont plus difficiles à éliminer que les électrons externes des métaux alcalins, ce qui fait que les métaux du groupe 2 sont moins réactifs que ceux du groupe 1. Ces éléments forment facilement des composés dans lesquels les métaux présentent un état d'oxydation de 2+. Le zinc, le cadmium et le mercure (groupe 12) présentent généralement l'état d'oxydation du groupe 2+ (bien que le mercure présente également un état d'oxydation de 1+ dans les composés qui en contiennent\(\ce{Hg2^2+}\)). L'aluminium, le gallium, l'indium et le thallium (groupe 13) sont plus faciles à oxyder que l'hydrogène. L'aluminium, le gallium et l'indium présentent un état d'oxydation 3+ (cependant, le thallium se présente également couramment sous forme d'ion Tl +). L'étain et le plomb forment des cations divalents stables et des composés covalents dans lesquels les métaux présentent l'état d'oxydation 4+.
Lexique
- métal alcalinoterreux
- n'importe lequel des métaux (béryllium, magnésium, calcium, strontium, baryum et radium) du groupe 2 du tableau périodique ; ce sont des métaux bivalents réactifs qui forment des oxydes basiques
- allotropes
- deux ou plusieurs formes du même élément, dans le même état physique, avec des structures chimiques différentes
- bismuth
- membre le plus lourd du groupe 15 ; un métal moins réactif que les autres métaux représentatifs
- métal (représentatif)
- atomes des éléments métalliques des groupes 1, 2, 12, 13, 14, 15 et 16, qui forment des composés ioniques en perdant des électrons de leurs orbitales extérieures s ou p
- métalloïde
- élément dont les propriétés se situent entre celles des métaux et des non-métaux ; ces éléments sont généralement des semi-conducteurs
- passivation
- métaux dotés d'un film protecteur non réactif d'oxyde ou d'un autre composé qui crée une barrière aux réactions chimiques ; l'élimination physique ou chimique du film de passivation permet aux métaux de démontrer leur réactivité chimique attendue
- élément représentatif
- élément où les orbitales s et p se remplissent
- métal représentatif
- métal parmi les éléments représentatifs


