17.6 : Corrosion
- Page ID
- 193918
- Définir la corrosion
- Énumérer certaines des méthodes utilisées pour prévenir ou ralentir la corrosion
La corrosion est généralement définie comme la dégradation des métaux due à un processus électrochimique. La formation de rouille sur le fer, le ternissement de l'argent et la patine bleu-vert qui se développe sur le cuivre sont autant d'exemples de corrosion. Le coût total de la corrosion aux États-Unis est important, avec des estimations supérieures à 500 milliards de dollars par an.
La Statue de la Liberté est un monument que tous les Américains reconnaissent. La Statue de la Liberté est facilement identifiable par sa hauteur, sa position et sa couleur bleu-vert unique. Lorsque cette statue a été livrée pour la première fois de France, son apparence n'était pas verte. Il était brun, de la couleur de sa « peau » cuivrée. Alors, comment la Statue de la Liberté a-t-elle changé de couleur ? Le changement d'apparence était le résultat direct de la corrosion. Le cuivre qui est le composant principal de la statue s'est lentement oxydé dans l'air. Les réactions d'oxydoréduction du cuivre métallique dans l'environnement se déroulent en plusieurs étapes. Le cuivre métallique est oxydé en oxyde de cuivre (I\(\ce{Cu_2O}\)) (), qui est rouge, puis en oxyde de cuivre (II), qui est noir.
\[\ce{2Cu(s)} +\ce{1/2O2(g)} \rightarrow \underset{\text{red}}{\ce{Cu2O(s)}} \nonumber \]
\[\ce{Cu2O(s)} +\ce{1/2O2(g)} \rightarrow \underset{\text{black}}{\ce{2CuO(s)}} \nonumber \]
Le charbon, souvent riche en soufre, a été largement brûlé au début du siècle dernier. En conséquence, le trioxyde de soufre, le dioxyde de carbone et l'eau ont tous réagi avec le\(\ce{CuO}\).
\[\ce{2CuO(s)}+\ce{CO2(g)} + \ce{H2O(l)} \rightarrow \underset{\text{green}}{\ce{Cu_2CO3(OH)2(s)}} \nonumber \]
\[\ce{3CuO(s)}+\ce{2CO2(g)}+\ce{H2O(l)} \rightarrow \underset{\text{blue}}{\ce{Cu_2(CO_3)_2(OH)2(s)}} \nonumber \]
\[\ce{4CuO(s)}+\ce{SO3(g)}+\ce{3H2O(l)} \rightarrow \underset{\text{green}}{\ce{Cu_4SO_4(OH)6(s)}} \nonumber \]
Ces trois composés sont responsables de la patine bleu-vert caractéristique que l'on observe aujourd'hui. Heureusement, la formation de la patine a créé une couche protectrice sur la surface, empêchant ainsi toute corrosion supplémentaire de la peau en cuivre. La formation de la couche protectrice est une forme de passivation, dont il sera question plus loin dans un chapitre ultérieur.
L'exemple de corrosion le plus connu est peut-être la formation de rouille sur le fer. Le fer rouille lorsqu'il est exposé à l'oxygène et à l'eau. Les principales étapes de la rouille du fer semblent être les suivantes. Une fois exposé à l'atmosphère, le fer s'oxyde rapidement.
\[\textrm{anode: }\ce{Fe}_{(s)} \rightarrow \ce{Fe^{2+}}_{(aq)}+\ce{2e^-}\;\;\; E^\circ_{\ce{Fe^{2+}/Fe}}=\mathrm{−0.44\: V} \nonumber \]
Les électrons réduisent l'oxygène de l'air dans les solutions acides.
\[\textrm{cathode: }\ce{O}_{2(g)}+\ce{4H^+}_{(aq)}+\ce{4e^-} \rightarrow \ce{2H_2O}_{(l)}\;\; E^\circ_{\ce{O_2/O_2}}=\mathrm{+1.23\; V} \nonumber \]
\[\textrm{overall: }\ce{2Fe}_{(s)}+\ce{O}_{2(g)}+\ce{4H^+}_{(aq)} \rightarrow \ce{2Fe^{2+}}_{(aq)}+\ce{2H_2O}_{(l)} \;\;\;E^\circ_\ce{cell}=\mathrm{+1.67\; V} \nonumber \]
Ce que nous appelons la rouille est l'oxyde de fer (III) hydraté, qui se forme lorsque les ions fer (II) réagissent davantage avec l'oxygène.
\[\ce{4Fe^{2+}}_{(aq)}+\ce{O}_{2(g)}+(4+2x)\ce{H_2O}_{(l)} \rightarrow \ce{2Fe_2O_3} \cdot x\ce{H_2O}_{(s)}+\ce{8H^+}_{(aq)} \nonumber \]
Le nombre de molécules d'eau étant variable, il est représenté par x. Contrairement à la patine sur le cuivre, la formation de rouille ne crée pas de couche protectrice. La corrosion du fer se poursuit alors que la rouille s'écaille et expose le fer frais à l'atmosphère.
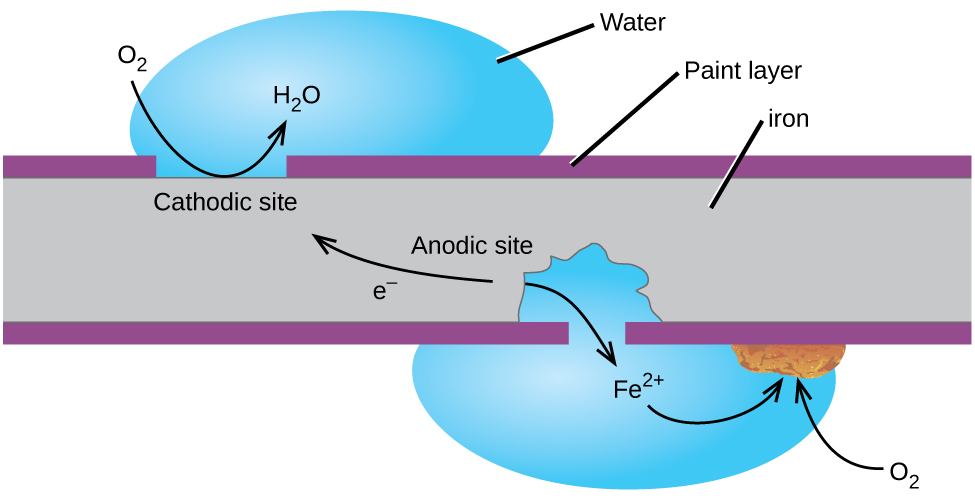
L'un des moyens d'empêcher le fer de se corroder est de le peindre. La couche de peinture empêche l'eau et l'oxygène nécessaires à la formation de rouille d'entrer en contact avec le fer à repasser. Tant que la peinture reste intacte, le fer est protégé de la corrosion.
D'autres stratégies consistent à allier le fer à d'autres métaux. Par exemple, l'acier inoxydable est principalement du fer avec un peu de chrome. Le chrome a tendance à s'accumuler près de la surface, où il forme une couche d'oxyde qui protège le fer.
Le fer zingué ou galvanisé utilise une stratégie différente. Le zinc s'oxyde plus facilement que le fer car le zinc a un potentiel de réduction plus faible. Comme le zinc a un potentiel de réduction plus faible, il s'agit d'un métal plus actif. Ainsi, même si le revêtement de zinc est rayé, le zinc s'oxydera toujours avant le fer. Cela suggère que cette approche devrait fonctionner avec d'autres métaux actifs.

Un autre moyen important de protéger le métal est d'en faire la cathode d'une cellule galvanique. Il s'agit d'une protection cathodique qui peut être utilisée pour des métaux autres que le fer. Par exemple, la rouille des réservoirs et des tuyaux de stockage souterrains en fer peut être empêchée ou considérablement réduite en les connectant à un métal plus actif tel que le zinc ou le magnésium. Ceci est également utilisé pour protéger les pièces métalliques des chauffe-eau. Les métaux les plus actifs (potentiel de réduction plus faible) sont appelés anodes sacrificielles car, lorsqu'ils s'épuisent, ils se corrodent (s'oxydent) au niveau de l'anode. Le métal à protéger sert de cathode et ne s'oxyde pas (ne se corrode donc pas). Lorsque les anodes sont correctement surveillées et remplacées périodiquement, la durée de vie utile du réservoir de stockage de fer peut être considérablement prolongée.
Résumé
La corrosion est la dégradation d'un métal provoquée par un processus électrochimique. D'importantes sommes d'argent sont dépensées chaque année pour réparer les effets de la corrosion ou la prévenir. Certains métaux, tels que l'aluminium et le cuivre, forment une couche protectrice lorsqu'ils se corrodent dans l'air. La fine couche qui se forme à la surface du métal empêche l'oxygène d'entrer en contact avec un plus grand nombre d'atomes métalliques et « protège » ainsi le métal restant d'une corrosion ultérieure. Le fer se corrode (rouille) lorsqu'il est exposé à l'eau et à l'oxygène. La rouille qui se forme sur le métal en fer s'écaille, exposant le métal frais, qui se corrode également. L'un des moyens de prévenir ou de ralentir la corrosion consiste à revêtir le métal. Le revêtement empêche l'eau et l'oxygène d'entrer en contact avec le métal. La peinture ou d'autres revêtements ralentissent la corrosion, mais ils ne sont pas efficaces une fois rayés. Le fer zingué ou galvanisé exploite le fait que le zinc est plus susceptible de s'oxyder que le fer. Tant que le revêtement restera en place, même s'il est rayé, le zinc s'oxydera avant le fer. Une autre méthode de protection des métaux est la protection cathodique. Dans ce procédé, un métal facilement oxydé et peu coûteux, souvent du zinc ou du magnésium (l'anode sacrificielle), est connecté électriquement au métal à protéger. Le métal le plus actif est l'anode sacrificielle, qui est l'anode d'une cellule galvanique. Le métal « protégé » est la cathode et reste non oxydé. L'un des avantages de la protection cathodique est que l'anode sacrificielle peut être surveillée et remplacée si nécessaire.
Lexique
- protection cathodique
- procédé de protection du métal en utilisant une anode sacrificielle et en fabriquant efficacement le métal qui doit protéger la cathode, empêchant ainsi son oxydation
- corrosion
- dégradation du métal par un processus électrochimique
- fer galvanisé
- méthode pour protéger le fer en le recouvrant de zinc, qui s'oxydera avant le fer ; fer zingué
- anode sacrificielle
- métal plus actif et peu coûteux utilisé comme anode dans la protection cathodique ; souvent fabriqué à partir de magnésium ou de zinc


