17.7 : Électrolyse
- Page ID
- 193907
- Décrire les cellules électrolytiques et leur relation avec les cellules galvaniques
- Effectuer divers calculs liés à l'électrolyse
Dans les cellules galvaniques, l'énergie chimique est convertie en énergie électrique. L'inverse est vrai pour les cellules électrolytiques. Dans les cellules électrolytiques, l'énergie électrique provoque des réactions non spontanées dans le cadre d'un processus connu sous le nom d'électrolyse. La batterie électrique de recharge montre l'un de ces processus. L'énergie électrique est convertie en énergie chimique dans la batterie lorsqu'elle est chargée. Une fois chargée, la batterie peut être utilisée pour alimenter l'automobile. Les mêmes principes sont impliqués dans les cellules électrolytiques que dans les cellules galvaniques. Nous examinerons trois cellules électrolytiques et les aspects quantitatifs de l'électrolyse.
L'électrolyse du chlorure de sodium fondu
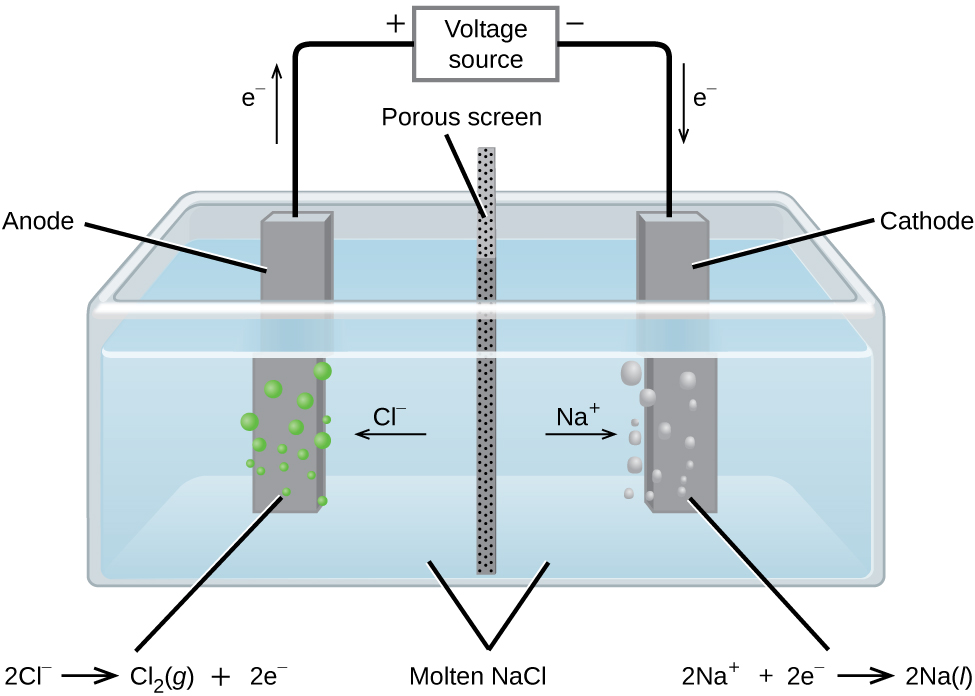
Dans le chlorure de sodium fondu, les ions peuvent migrer librement vers les électrodes d'une cellule électrolytique. Un schéma simplifié de la cellule utilisée commercialement pour produire du sodium métallique et du chlore gazeux est présenté à la figure\(\PageIndex{1}\). Le sodium est un puissant agent réducteur et le chlore est utilisé pour purifier l'eau. Il est utilisé dans les antiseptiques et dans la production de papier. Les réactions sont
\ [\ begin {align}
& \ textrm {anode :} \ ce {2Cl-} (l) ⟶ \ ce {Cl2} (g) + \ ce {2e-} \ hspace {20s} E^ \ circ_ {\ ce {Cl2/Cl-}} = \ mathrm {+1,3 \ : V} \ \
& \ textrm {cathode :} \ ce {Na+} (l) + \ ce {e-} ⟶ \ ce {Na} (l) \ hspace {1080p} E^ \ circ_ {\ ce {Na+/Na}} = \ mathrm {−2,7 \ : V} \ \
& \ overline {\ textrm {global :} \ ce {2Na+} (l) + \ ce {2Cl-} (l) ⟶ \ ce {2Na} (l) + \ ce {Cl2} (g) \ hspace {20e} E^ \ circ_ \ ce {cell} = \ mathrm {−4.0 \ : V}}
\ end {align} \ nonumber \]
L'alimentation (batterie) doit fournir un minimum de 4 V, mais, dans la pratique, les tensions appliquées sont généralement plus élevées en raison de l'inefficacité du processus lui-même.
L'électrolyse de l'eau
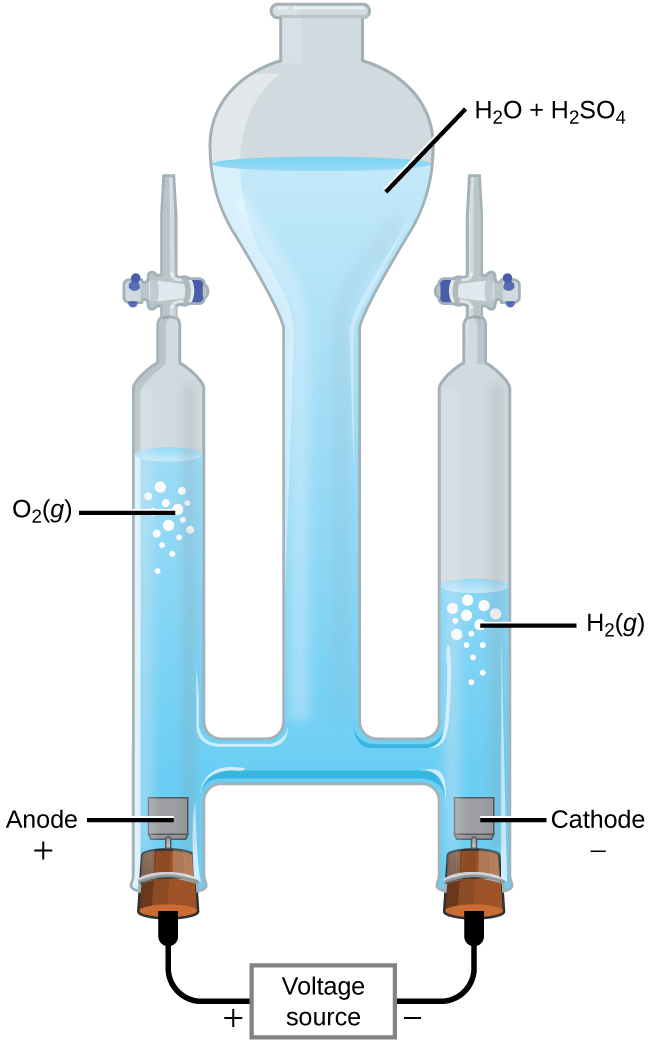
Il est possible de séparer l'eau en hydrogène et en oxygène gazeux par électrolyse. Les acides sont généralement ajoutés pour augmenter la concentration d'ions hydrogène dans la solution (Figure\(\PageIndex{2}\)). Les réactions sont
\ [\ begin {align}
& \ textrm {anode :} \ ce {2H2O} (l) ⟶ \ ce {O2} (g) + \ ce {4H+} (aq) + \ ce {4e-} \ hspace {1080p} E^ \ circ_ \ ce {anode} = \ mathrm {+1,229 \ : V} \ \
& \ textrm {cathode :} \ ce {2H+} (aq) + \ ce {2e-} ⟶ \ ce {H2} (g) \ hspace {1080p} E^ \ circ_ \ ce {cathode} = \ mathrm {0 \ : V} \ \
& \ overline {\ textrm { globalement :} \ ce {2H2O} (l) ⟶ \ ce {2H2} (g) + \ ce {O2} (g) \ hspace {1080p} E^ \ circ_ \ ce {cell} = \ mathrm {−1.229 \ : V}}
\ end {align} \ nonumber \]
Il est à noter que l'acide sulfurique n'est pas consommé et que le volume d'hydrogène produit est le double du volume d'oxygène gazeux produit. La tension minimale appliquée est de 1,229 V.
L'électrolyse du chlorure de sodium aqueux
L'électrolyse du chlorure de sodium aqueux est l'exemple le plus courant d'électrolyse car plusieurs espèces peuvent être oxydées et réduites. En considérant d'abord l'anode, les réactions possibles sont les suivantes :
\ [\ begin {align}
& \ textrm {(i)} \ ce {2Cl-} (aq) ⟶ \ ce {Cl2} (g) + \ ce {2e-} \ hspace {20e} E^ \ circ_ \ ce {anode} = \ mathrm {+1,35827 \ : V} \ \
& \ textrm {(ii)} \ ce {2H2O} (l) ⟶ \ ce {O2} (g) + \ ce {4H+} (aq) + \ ce {4e-} \ hspace {1080p} E^ \ circ_ \ ce {anode} = \ mathrm {+1,229 \ : V}
\ end {align} \ nonnumber \]
Ces valeurs suggèrent que l'eau devrait être oxydée à l'anode car un potentiel plus faible serait nécessaire ; l'utilisation de la réaction (ii) pour l'oxydation donnerait un potentiel cellulaire moins négatif. Lorsque l'expérience est réalisée, il s'avère que du chlore, et non de l'oxygène, est produit à l'anode. Ce processus inattendu est si courant en électrochimie qu'on lui a donné le nom de surpotentiel. La surtension est la différence entre la tension théorique de la cellule et la tension réelle nécessaire pour provoquer l'électrolyse. Il s'avère que le surpotentiel en oxygène est assez élevé et rend effectivement le potentiel de réduction plus positif. Par conséquent, dans des conditions normales, c'est du chlore gazeux qui se forme réellement à l'anode.
Maintenant, considérez la cathode. Trois réductions pourraient se produire :
\ [\ begin {align}
& \ textrm {(iii)} \ ce {2H+} (aq) + \ ce {2e-} ⟶ \ ce {H2} (g) \ hspace {20e} E^ \ circ_ \ ce {cathode} = \ mathrm {0 \ : V} \ \
& \ textrm {(iv)} \ ce {2H2O} (l) \ ce {2e-} ⟶ \ ce {H2} (g) + \ ce {2OH-} (aq) \ hspace {1080p} E^ \ circ_ \ ce {cathode} = \ mathrm {−0,8277 \ :V} \ \
& \ textrm {(v)} \ ce {Na+ } (aq) + \ ce {e-} ⟶ \ ce {Na} (s) \ hspace {1080p} E^ \ circ_ \ ce {cathode} = \ mathrm {−2,71 \ : V}
\ end {align} \ nonumber \]
La réaction (v) est exclue en raison de son potentiel de réduction négatif. Dans des conditions d'état standard, la réaction (iii) serait préférée à la réaction (iv). Cependant, le pH d'une solution de chlorure de sodium est de 7, de sorte que la concentration en ions hydrogène n'est que de 1 × 10 −7 M. À de si faibles concentrations, la réaction (iii) est peu probable et la réaction (iv) se produit. La réaction globale est alors
\[\textrm{overall: }\ce{2H2O}(l)+\ce{2Cl-}(aq)⟶\ce{H2}(g)+\ce{Cl2}(g)+\ce{2OH-}(aq) \hspace{20px} E^\circ_\ce{cell}=\mathrm{−2.186\: V} \nonumber \]
Au fur et à mesure de la réaction, les ions hydroxyde remplacent les ions chlorure en solution Ainsi, l'hydroxyde de sodium peut être obtenu en évaporant l'eau une fois l'électrolyse terminée. L'hydroxyde de sodium est précieux en soi et est utilisé pour des produits tels que le nettoyant pour four, l'ouvre-drain et pour la production de papier, de tissus et de savon.
Galvanoplastie
Une utilisation importante des cellules électrolytiques est la galvanoplastie. La galvanoplastie produit une fine couche d'un métal au-dessus d'une surface conductrice. Les raisons de la galvanoplastie incluent le fait de rendre l'objet plus résistant à la corrosion, de renforcer la surface, de produire une finition plus attrayante ou de purifier le métal. Les métaux couramment utilisés en galvanoplastie sont le cadmium, le chrome, le cuivre, l'or, le nickel, l'argent et l'étain. Les produits de consommation courants incluent la vaisselle en métal argenté ou doré, les pièces automobiles chromées et les bijoux. Nous pouvons nous faire une idée de la façon dont cela fonctionne en étudiant comment la vaisselle en métal argenté est produite (Figure\(\PageIndex{3}\)).
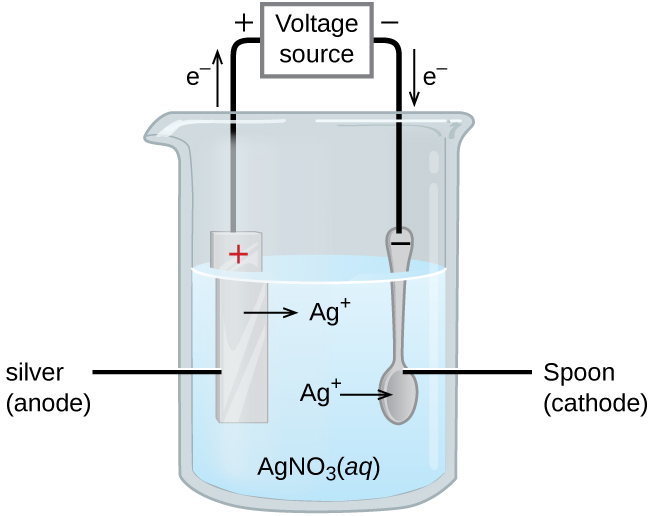
Sur la figure, l'anode est constituée d'une électrode en argent, illustrée à gauche. La cathode est située sur la droite et constitue la cuillère, fabriquée à partir de métal peu coûteux. Les deux électrodes sont immergées dans une solution de nitrate d'argent. À mesure que le potentiel augmente, le courant circule. Le métal argenté est perdu à l'anode lorsqu'il entre en solution.
\[\textrm{anode: }\ce{Ag}(s)⟶\ce{Ag+}(aq)+\ce{e-} \nonumber \]
La masse de la cathode augmente à mesure que les ions argent de la solution se déposent sur la cuillère
\[\textrm{cathode: }\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s) \nonumber \]
Le résultat net est le transfert de métal argenté de l'anode à la cathode. La qualité de l'objet est généralement déterminée par l'épaisseur de l'argent déposé et la vitesse de dépôt.
Aspects quantitatifs de l'électrolyse
La quantité de courant qui peut circuler dans une cellule électrolytique est liée au nombre de moles d'électrons. Le nombre de moles d'électrons peut être lié aux réactifs et aux produits par stoechiométrie. Rappelons que l'unité SI pour le courant (I) est l'ampère (A), qui équivaut à 1 coulomb par seconde (1 A =\(\mathrm{1\: \dfrac{C}{s}}\)). La charge totale (Q, en coulombs) est donnée par
\[Q=I×t=n×F \nonumber \]
où
- t est le temps en secondes,
- n le nombre de moles d'électrons, et
- F est la constante de Faraday.
Les moles d'électrons peuvent être utilisées dans les problèmes de stœchiométrie. Le temps nécessaire pour déposer une quantité spécifiée de métal peut également être demandé, comme dans le second des exemples suivants.
Dans un procédé utilisé pour la galvanoplastie d'argent, un courant de 10,23 A a été passé à travers une cellule électrolytique pendant exactement 1 heure. Combien de moles d'électrons ont traversé la cellule ? Quelle masse d'argent s'est déposée à la cathode à partir de la solution de nitrate d'argent ?
Solution
La constante de Faraday peut être utilisée pour convertir la charge (Q) en moles d'électrons (n). La charge est le courant (I) multiplié par le temps
\[n=\dfrac{Q}{F}=\mathrm{\dfrac{\dfrac{10.23\: C}{s}×1\: hr×\dfrac{60\: min}{hr}×\dfrac{60\:s}{min}}{96,485\: C/mol\: e^-}=\dfrac{36,830\: C}{96,485\: C/mol\:e^-}=0.3817\: mol\: e^-} \nonumber \]
Du fait du problème, la solution contient de l'AgNO 3, de sorte que la réaction à la cathode implique 1 mole d'électrons pour chaque mole d'argent
\[\textrm{cathode: }\ce{Ag+}(aq)+\ce{e-}⟶\ce{Ag}(s) \nonumber \]
La masse atomique de l'argent est de 107,9 g/mol, donc
\[\mathrm{mass\: Ag=0.3817\: mol\: e^-×\dfrac{1\: mol\: Ag}{1\: mol\: e^-}×\dfrac{107.9\: g\: Ag}{1\: mol\: Ag}=41.19\: g\: Ag} \nonumber \]
Vérifiez votre réponse : à partir de la stœchiométrie, 1 mole d'électrons produirait 1 mole d'argent. Moins d'une demi-mole d'électrons a été impliquée et moins d'une demi-mole d'argent a été produite.
L'aluminium métallique peut être fabriqué à partir d'ions aluminium par électrolyse. Qu'est-ce que la demi-réaction à la cathode ? Quelle masse d'aluminium serait récupérée si un courant de 2,50 × 10 3 A traversait la solution pendant 15 minutes ? Supposons que le rendement soit de 100 %.
- Réponse
-
\(\ce{Al^3+}(aq)+\ce{3e-}⟶\ce{Al}(s)\); 7,77 mol Al = 210,0 g Al.
Lors d'une application, une couche de chrome de 0,010 mm doit être déposée sur une pièce d'une surface totale de 3,3 m 2 à partir d'une solution contenant des ions chrome (III). Combien de temps faudrait-il pour déposer la couche de chrome si le courant était de 33,46 A ? La densité du chrome (métal) est de 7,19 g/cm 3.
Solution Ce problème soulève un certain nombre de sujets abordés précédemment. Voici un aperçu de ce qui doit être fait :
- Si la charge totale peut être déterminée, le temps requis est simplement la charge divisée par le courant
- La charge totale peut être obtenue à partir de la quantité de Cr nécessaire et de la stœchiométrie
- La quantité de Cr peut être obtenue en utilisant la densité et le volume de Cr requis
- Le volume (Cr) requis est l'épaisseur multipliée par la surface.
En résolvant par étapes et en prenant soin des unités, le volume de Cr requis est
\[\mathrm{volume=\left(0.010\: mm×\dfrac{1\: cm}{10\: mm}\right)×\left(3.3\:m^2×\left(\dfrac{10,000\:cm^2}{1\:m^2}\right)\right)=33\: cm^3} \nonumber \]
Les centimètres cubes ont été utilisés parce qu'ils correspondent à l'unité de volume utilisée pour la densité. La quantité de Cr est alors
\[\mathrm{mass=volume×density=33\cancel{cm^3}×\dfrac{7.19\: g}{\cancel{cm^3}}=237\: g\: Cr} \nonumber \]
\[\mathrm{mol\: Cr=237\: g\: Cr×\dfrac{1\: mol\: Cr}{52.00\: g\: Cr}=4.56\: mol\: Cr} \nonumber \]
Comme la solution contient des ions chrome (III), 3 moles d'électrons sont nécessaires par mole de Cr. La charge totale est alors
\[Q=\mathrm{4.56\: mol\: Cr×\dfrac{3\:mol\: e^-}{1\: mol\: Cr}×\dfrac{96485\: C}{mol\: e^-}=1.32×10^6\:C} \nonumber \]
Le temps requis est alors
\[t=\dfrac{Q}{I}=\mathrm{\dfrac{1.32×10^6\:C}{33.46\: C/s}=3.95×10^4\:s=11.0\: hr} \nonumber \]
Vérifiez votre réponse : Dans un problème aussi long que celui-ci, une seule vérification ne suffit probablement pas. Chacune des étapes donne un chiffre raisonnable, donc les choses sont probablement correctes. Portez une attention particulière aux conversions d'unités et à la stœchiométrie.
Quelle masse de zinc est nécessaire pour galvaniser le dessus d'une feuille de fer de 3,00 m × 5,50 m jusqu'à une épaisseur de 0,100 mm de zinc ? Si le zinc provient d'une solution de Zn (NO 3) 2 et que le courant est de 25,5 A, combien de temps faudra-t-il pour galvaniser la partie supérieure du fer ? La densité du zinc est de 7,140 g/cm 3.
- Réponse
-
231 g de Zn ont nécessité 23 000 minutes.
Résumé
L'utilisation de l'électricité pour forcer un processus non spontané à se produire est l'électrolyse. Les cellules électrolytiques sont des cellules électrochimiques avec des potentiels cellulaires négatifs (c'est-à-dire une énergie libre de Gibbs positive) et ne sont donc pas spontanées. L'électrolyse peut se produire dans les cellules électrolytiques en introduisant une alimentation électrique qui fournit l'énergie nécessaire pour forcer les électrons à circuler dans la direction non spontanée. L'électrolyse se fait dans des solutions qui contiennent suffisamment d'ions pour que le courant puisse circuler. Si la solution ne contient qu'un seul matériau, comme l'électrolyse du chlorure de sodium fondu, il est facile de déterminer ce qui est oxydé et ce qui est réduit. Dans des systèmes plus complexes, tels que l'électrolyse du chlorure de sodium aqueux, plusieurs espèces peuvent être oxydées ou réduites et les potentiels de réduction standard sont utilisés pour déterminer l'oxydation (la demi-réaction ayant le potentiel de réduction standard [le plus positif] le plus élevé) et la réduction (le demi-réaction avec le plus petit potentiel de réduction standard [le moins positif]). Parfois, des demi-réactions inattendues se produisent en raison d'un surpotentiel. La surtension est la différence entre le potentiel de réduction théorique de la demi-réaction et la tension réelle requise. Lorsqu'il est présent, le potentiel appliqué doit être augmenté, ce qui permet à une réaction différente de se produire dans la cellule d'électrolyse. La charge totale, Q, qui traverse une cellule électrolytique peut être exprimée sous forme de courant (I) multiplié par le temps (Q = It) ou de moles d'électrons (n) multipliées par la constante de Faraday (Q = nF). Ces relations peuvent être utilisées pour déterminer des éléments tels que la quantité de matériau utilisée ou générée pendant l'électrolyse, la durée de la réaction ou la valeur du courant requise.
Résumé
- électrolyse
- procédé utilisant de l'énergie électrique pour provoquer la survenue d'un processus non spontané
- cellule électrolytique
- cellule électrochimique dans laquelle l'électrolyse est utilisée ; cellule électrochimique à potentiels de cellule négatifs
- galvanoplastie
- déposer une fine couche d'un métal au-dessus d'une surface conductrice
- surpotentiel
- différence entre le potentiel théorique et le potentiel réel dans une cellule électrolytique ; tension « supplémentaire » requise pour provoquer une réaction électrochimique non spontanée


