17.5 : Batteries et piles à combustible
- Page ID
- 193914
- Classer les batteries en tant que batteries primaires ou secondaires
- Énumérez certaines des caractéristiques et des limites des batteries
- Fournir une description générale d'une pile à combustible
Une batterie est une cellule électrochimique ou une série de cellules qui produit un courant électrique. En principe, n'importe quelle cellule galvanique peut être utilisée comme batterie. Une batterie idéale ne tomberait jamais en panne, produirait une tension constante et serait capable de résister aux températures et à l'humidité extrêmes de l'environnement. Les batteries réelles trouvent un équilibre entre caractéristiques idéales et limites pratiques. Par exemple, la masse d'une batterie de voiture est d'environ 18 kg, soit environ 1 % de la masse d'une voiture ou d'un camion léger moyen. Ce type de batterie fournirait une énergie quasi illimitée s'il était utilisé dans un smartphone, mais serait refusé pour cette application en raison de sa masse. Ainsi, aucune batterie n'est « meilleure » et les batteries sont sélectionnées pour une application particulière, en tenant compte de facteurs tels que la masse de la batterie, son coût, sa fiabilité et sa capacité actuelle. Il existe deux types de batteries de base : les batteries primaires et les batteries secondaires. Quelques batteries de chaque type sont décrites ci-après.
Visitez ce site pour en savoir plus sur les batteries.
Batteries principales
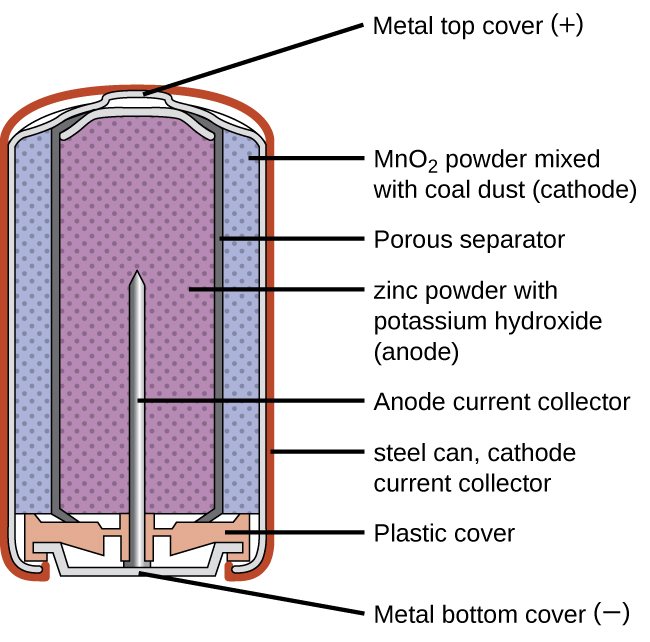
Les batteries primaires sont des batteries à usage unique car elles ne peuvent pas être rechargées. Une batterie principale courante est la pile sèche (Figure\(\PageIndex{1}\)). La pile sèche est une batterie au zinc-carbone. Le bidon de zinc sert à la fois de récipient et d'électrode négative. L'électrode positive est une tige en carbone entourée d'une pâte d'oxyde de manganèse (IV), de chlorure de zinc, de chlorure d'ammonium, de poudre de carbone et d'une petite quantité d'eau. La réaction à l'anode peut être représentée comme l'oxydation ordinaire du zinc :
\[\ce{Zn}(s)⟶\ce{Zn^2+}(aq)+\ce{2e-} \hspace{20px} E^\circ_{\ce{Zn^2+/Zn}}=\mathrm{−0.7618\: V} \nonumber \]
La réaction à la cathode est plus compliquée, en partie parce que plusieurs réactions se produisent. La série de réactions qui se produit à la cathode est d'environ
\[\ce{2MnO2}(s)+\ce{2NH4Cl}(aq)+\ce{2e-}⟶\ce{Mn2O3}(s)+\ce{2NH3}(aq)+\ce{H2O}(l)+\ce{2Cl-} \nonumber \]
La réaction globale de la batterie zinc—carbone peut être représentée comme
\[\ce{2MnO2}(s) + \ce{2NH4Cl}(aq) + \ce{Zn}(s) ⟶ \ce{Zn^2+}(aq) + \ce{Mn2O3}(s) + \ce{2NH3}(aq) + \ce{H2O}(l) + \ce{2Cl-} \nonumber \]
avec un potentiel global de la cellule qui est initialement d'environ 1,5 V, mais qui diminue à mesure que la batterie est utilisée. Il est important de se rappeler que la tension délivrée par une batterie est la même quelle que soit la taille de la batterie. Pour cette raison, les piles D, C, A, AA et AAA ont toutes la même tension nominale. Cependant, les batteries plus grandes peuvent fournir plus de moles d'électrons. Lorsque le réservoir de zinc s'oxyde, son contenu finit par s'échapper. Ce type de batterie ne doit donc pas être laissé dans un appareil électrique pendant de longues périodes.

Piles alcalines (Figure\(\PageIndex{2}\)) were developed in the 1950s partly to address some of the performance issues with zinc–carbon dry cells. They are manufactured to be exact replacements for zinc-carbon dry cells. As their name suggests, these types of batteries use alkaline electrolytes, often potassium hydroxide. The reactions are
\[\begin{align*} &\textrm{anode: }\ce{Zn}(s)+\ce{2OH-}(aq)⟶\ce{ZnO}(s)+\ce{H2O}(l)+\ce{2e-} \hspace{40px} E^\circ_\ce{anode}=\mathrm{−1.28\: V}\\ &\underline{\textrm{cathode: }\ce{2MnO2}(s)+\ce{H2O}(l)+\ce{2e-}⟶\ce{Mn2O3}(s)+\ce{2OH-}(aq) \hspace{40px} E^\circ_\ce{cathode}=\mathrm{+0.15\: V}}\\ &\textrm{overall: }\ce{Zn}(s)+\ce{2MnO2}(s)⟶\ce{ZnO}(s)+\ce{Mn2O3}(s) \hspace{40px} E^\circ_\ce{cell}=\mathrm{+1.43\: V} \end{align*} \nonumber \]
Une pile alcaline peut fournir environ trois à cinq fois l'énergie d'une pile sèche au zinc-carbone de taille similaire. Les piles alcalines sont susceptibles de fuir de l'hydroxyde de potassium, elles doivent donc également être retirées des appareils pour un stockage à long terme. Certaines piles alcalines sont rechargeables, mais la plupart ne le sont pas. Les tentatives de recharge d'une batterie alcaline non rechargeable entraînent souvent une rupture de la batterie et une fuite de l'électrolyte d'hydroxyde de potassium.
Batteries secondaires
Les batteries secondaires sont rechargeables. Ce sont les types de batteries que l'on trouve dans des appareils tels que les smartphones, les tablettes électroniques et les automobiles.
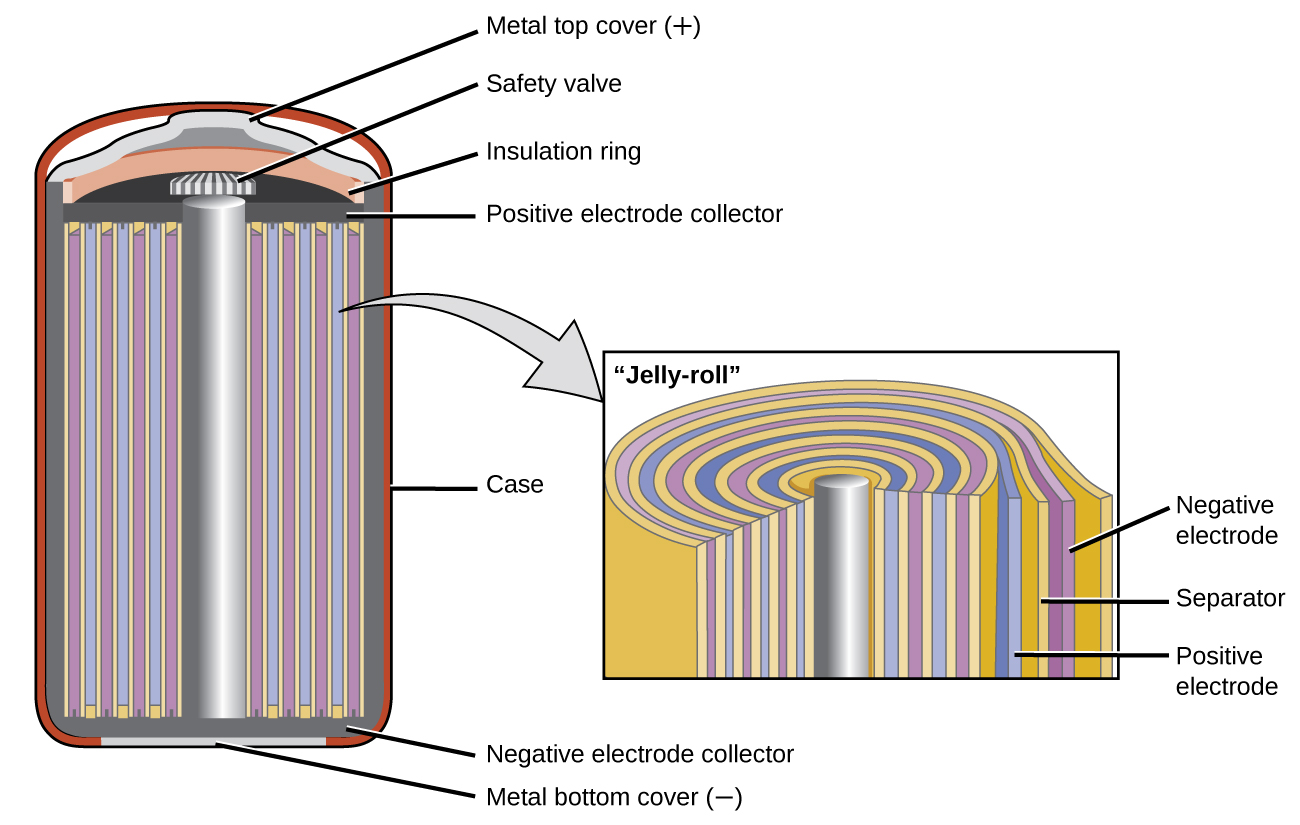
Les batteries au nickel-cadmium, ou NiCd, (Figure\(\PageIndex{3}\)) se composent d'une cathode nickelée, d'une anode cadmiée et d'une électrode à hydroxyde de potassium. Les plaques positive et négative, qui sont empêchées de court-circuiter par le séparateur, sont enroulées ensemble et placées dans le boîtier. Il s'agit d'un modèle « gely-roll » qui permet à la pile NiCd de fournir beaucoup plus de courant qu'une pile alcaline de taille similaire. Les réactions sont
\ [\ begin {align*}
& \ textrm {anode :} \ ce {Cd} (s) + \ ce {2OH-} (aq) ⟶ \ ce {Cd (OH) 2} (s) + \ ce {2e-} \ \
& \ souligner {\ textrm {cathode :} \ ce {NiO2} (s) + \ ce {2H2O} (l) + \ ce {2e }-} ⟶ \ ce {Ni (OH) 2} (s) + \ ce {2OH-} (aq)} \ \
& \ textrm {globalement :} \ ce {Cd} (s) + \ ce {NiO2} (s) + \ ce {2H2O} (l) ⟶ \ ce {Cd (OH) 2} (s) + \ ce {Ni (OH) 2} (s) \ end {align*} \ nonnumber \]
La tension est d'environ 1,2 V à 1,25 V lorsque la batterie se décharge. Lorsqu'elle est correctement traitée, une batterie NiCd peut être rechargée environ 1000 fois. Le cadmium étant un métal lourd toxique, les batteries NiCd ne doivent jamais être ouvertes ni jetées à la poubelle.
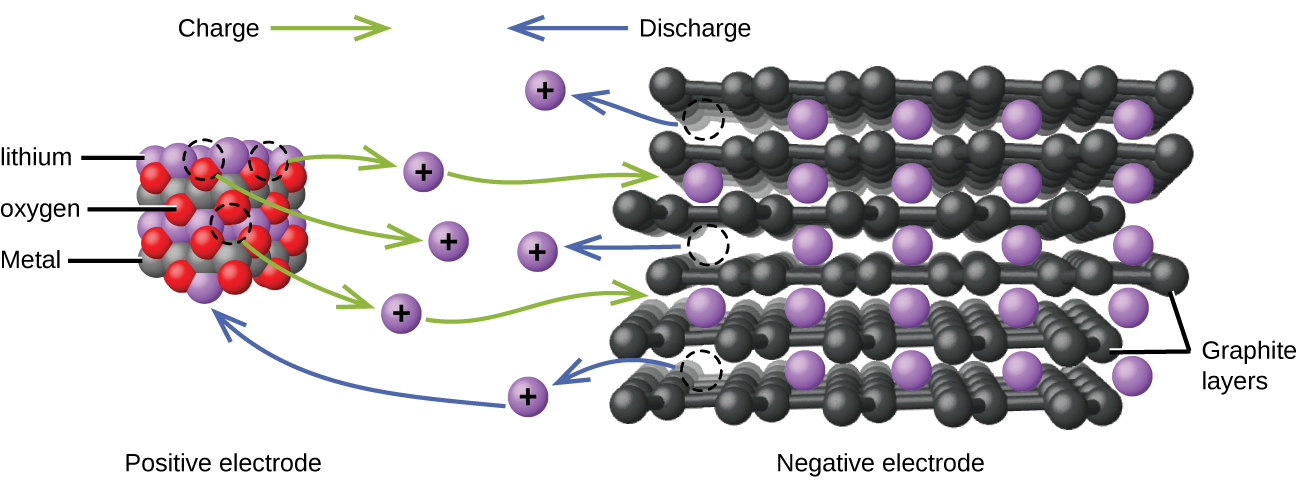
Les batteries au lithium-ion (Figure\(\PageIndex{4}\)) font partie des batteries rechargeables les plus populaires et sont utilisées dans de nombreux appareils électroniques portables. Les réactions sont
\[\begin{align*} &\textrm{anode: }\ce{LiCoO2}⇌\ce{Li}_{1-x}\ce{CoO2}+x\ce{Li+}+x\ce{e-}\\ &\textrm{cathode: }x\ce{Li+}+x\ce{e-}+x\ce{C6}⇌x\ce{LiC6}\\ &\overline{\textrm{overall: }\ce{LiCoO2}+x\ce{C6}⇌\ce{Li}_{1-x}\ce{CoO2}+x\ce{LiC6}} \end{align*} \nonumber \]
Les coefficients représentant les moles, x ne dépasse pas environ 0,5 mole. La tension de la batterie est d'environ 3,7 V. Les batteries au lithium sont populaires parce qu'elles peuvent fournir une grande quantité de courant, sont plus légères que les batteries comparables d'autres types, produisent une tension presque constante lorsqu'elles se déchargent et ne perdent leur charge que lentement lorsqu'elles sont stockées.
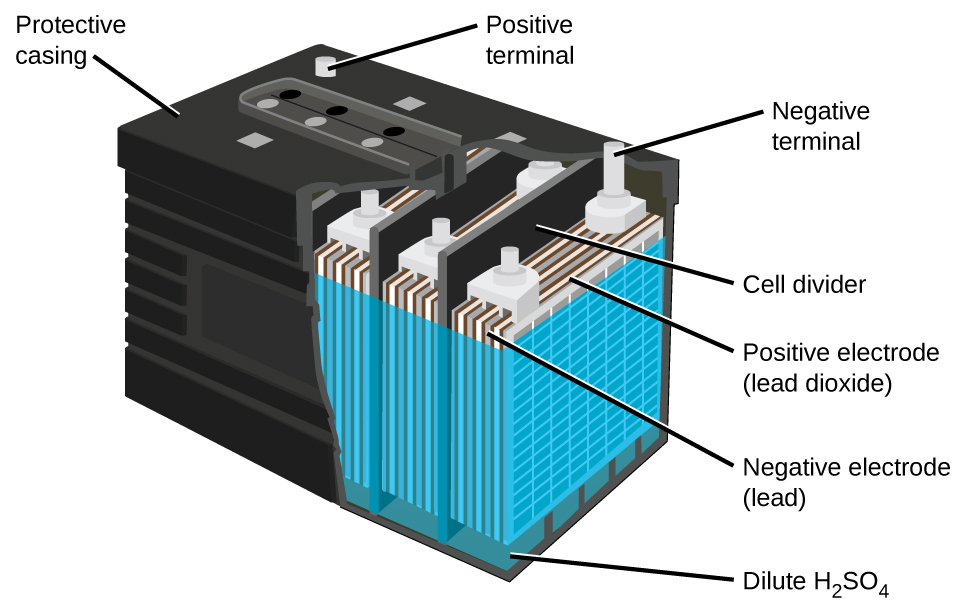
La batterie au plomb (Figure\(\PageIndex{5}\)) est le type de batterie secondaire utilisée dans votre automobile. Il est peu coûteux et capable de produire le courant élevé requis par les démarreurs automobiles. Les réactions pour une batterie au plomb sont
\[\begin{align*} &\textrm{anode: }\ce{Pb}(s)+\ce{HSO4-}(aq)⟶\ce{PbSO4}(s)+\ce{H+}(aq)+\ce{2e-}\\ &\underline{\textrm{cathode: } \ce{PbO2}(s)+\ce{HSO4-}(aq)+\ce{3H+}(aq)+\ce{2e-}⟶\ce{PbSO4}(s)+\ce{2H2O}(l)}\\ &\textrm{overall: }\ce{Pb}(s)+\ce{PbO2}(s)+\ce{2H2SO4}(aq)⟶\ce{2PbSO4}(s)+\ce{2H2O}(l) \end{align*} \nonumber \]
Chaque cellule produit 2 V, donc six cellules sont connectées en série pour produire une batterie de voiture de 12 V. Les batteries au plomb sont lourdes et contiennent un électrolyte liquide caustique, mais restent souvent la batterie de choix en raison de leur densité de courant élevée. Comme ces batteries contiennent une quantité importante de plomb, elles doivent toujours être éliminées correctement.
Piles à combustible
Une pile à combustible est un dispositif qui convertit l'énergie chimique en énergie électrique. Les piles à combustible sont similaires aux batteries mais nécessitent une source de combustible continue, souvent de l'hydrogène. Ils continueront à produire de l'électricité tant que du combustible sera disponible. Des piles à combustible à hydrogène ont été utilisées pour alimenter des satellites, des capsules spatiales, des automobiles, des bateaux et des sous-marins (Figure\(\PageIndex{6}\)).
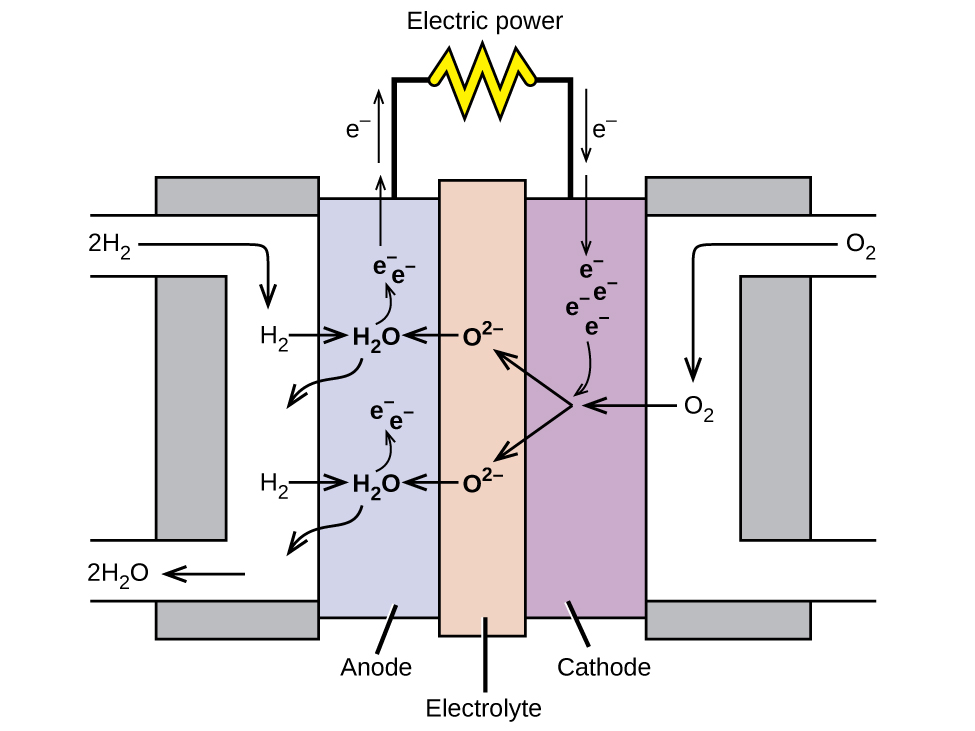
Dans une pile à combustible à hydrogène, les réactions sont
\ [\ begin {align*}
& \ textrm {anode :} \ ce {2H2 + 2O^2- ⟶ 2H2O + 4e-} \ \
& \ underline {\ textrm {cathode :} \ ce {O2 + 4e- ⟶ 2O^2-} \ hspace {55px}} \ \
& \ textrm {globalement :} \ ce {2H2 + O2 ⟶ 2H2X} O} \ end {align*} \ nonumber \]
La tension est d'environ 0,9 V. Le rendement des piles à combustible est généralement d'environ 40 % à 60 %, ce qui est supérieur à celui d'un moteur à combustion interne classique (25 % à 35 %) et, dans le cas de la pile à combustible à hydrogène, produit uniquement de l'eau comme gaz d'échappement. À l'heure actuelle, les piles à combustible sont assez chères et présentent des caractéristiques qui les font tomber en panne après un laps de temps relativement court.
Résumé
Les batteries sont des cellules galvaniques, ou une série de cellules, qui produisent un courant électrique. Lorsque des cellules sont combinées dans des batteries, le potentiel de la batterie est un multiple entier du potentiel d'une seule cellule. Il existe deux types de batteries de base : les batteries primaires et les batteries secondaires. Les batteries principales sont « à usage unique » et ne peuvent pas être rechargées. Les piles sèches et (la plupart) des piles alcalines sont des exemples de batteries primaires. Le second type est rechargeable et s'appelle batterie secondaire. Les batteries au nickel-cadmium (NiCd), au plomb et au lithium-ion sont des exemples de batteries secondaires. Les piles à combustible sont similaires aux batteries en ce sens qu'elles génèrent un courant électrique, mais nécessitent un ajout continu de combustible et d'oxydant. La pile à combustible à hydrogène utilise l'hydrogène et l'oxygène de l'air pour produire de l'eau et est généralement plus efficace que les moteurs à combustion interne.
Résumé
- batterie alcaline
- batterie principale utilisant un électrolyte alcalin (souvent de l'hydroxyde de potassium) ; conçue pour remplacer exactement la pile sèche, mais avec plus de stockage d'énergie et moins de fuites d'électrolyte que les piles sèches classiques
- batterie
- cellule galvanique ou série de cellules produisant un courant ; en théorie, toute cellule galvanique
- cellule sèche
- batterie principale, également appelée batterie zinc-carbone ; peut être utilisée dans n'importe quelle orientation car elle utilise une pâte comme électrolyte ; a tendance à laisser échapper de l'électrolyte lorsqu'elle est stockée
- pile à combustible
- dispositifs qui produisent un courant électrique tant que du carburant et du comburant sont ajoutés en continu ; plus efficaces que les moteurs à combustion interne
- batterie au plomb
- batterie secondaire composée de plusieurs cellules ; la batterie au plomb que l'on trouve dans les automobiles comporte six cellules et une tension de 12 V
- batterie au lithium-ion
- batterie secondaire très populaire ; utilise des ions lithium pour conduire le courant, est légère, rechargeable et produit un potentiel presque constant lorsqu'elle se décharge
- batterie au nickel-cadmium
- (batterie NiCd) batterie secondaire utilisant du cadmium, un métal lourd toxique ; plus lourde que les batteries au lithium-ion, mais présentant des caractéristiques de performance similaires
- batterie principale
- batterie non rechargeable à usage unique
- batterie secondaire
- batterie qui peut être rechargée


