15.2 : Acides et bases de Lewis
- Page ID
- 194018
- Expliquer le modèle de Lewis de chimie acido-basique
- Écrire des équations pour la formation d'adduits et d'ions complexes
- Effectuer des calculs d'équilibre impliquant des constantes de formation
En 1923, G. N. Lewis a proposé une définition généralisée du comportement acido-basique dans laquelle les acides et les bases sont identifiés par leur capacité à accepter ou à donner une paire d'électrons et à former une liaison covalente coordonnée.
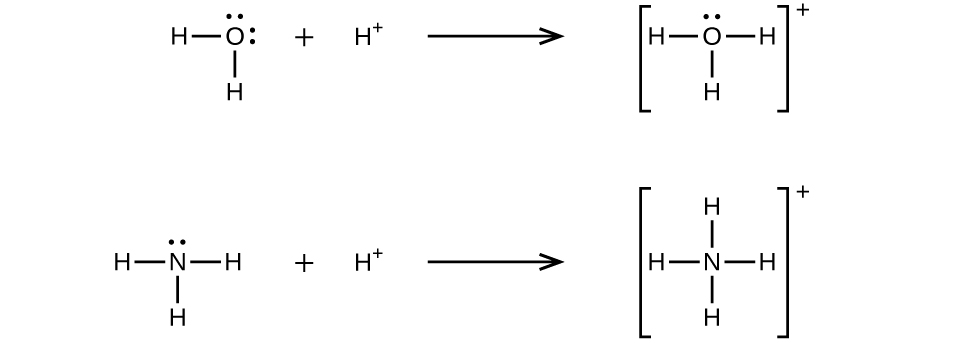
Une liaison covalente coordonnée (ou liaison dative) se produit lorsque l'un des atomes de la liaison fournit les deux électrons de liaison. Par exemple, une liaison covalente coordonnée se produit lorsqu'une molécule d'eau se combine à un ion hydrogène pour former un ion hydronium. Une liaison covalente coordonnée se produit également lorsqu'une molécule d'ammoniac se combine à un ion hydrogène pour former un ion ammonium. Ces deux équations sont présentées ici.
Définition : Acides et bases de Lewis
- Un acide de Lewis est toute espèce (molécule ou ion) capable d'accepter une paire d'électrons, et une base de Lewis est toute espèce (molécule ou ion) capable de donner une paire d'électrons.
Une réaction acide-base de Lewis se produit lorsqu'une base donne une paire d'électrons à un acide. Un produit d'addition acide-base de Lewis, un composé qui contient une liaison covalente coordonnée entre l'acide de Lewis et la base de Lewis, est formé. Les équations suivantes illustrent l'application générale du concept de Lewis.
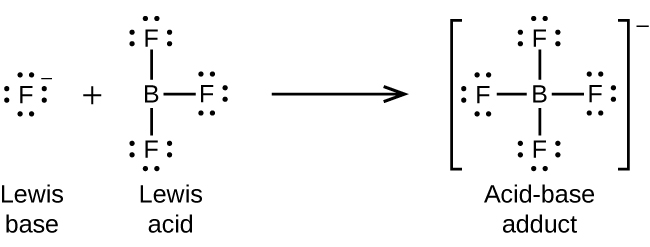
L'atome de bore du trifluorure de bore, BF 3, ne possède que six électrons dans sa couche de valence. Étant inférieur à l'octet préféré, le BF 3 est un très bon acide de Lewis qui réagit avec de nombreuses bases de Lewis ; un ion fluorure est la base de Lewis dans cette réaction, donnant l'une de ses paires isolées :
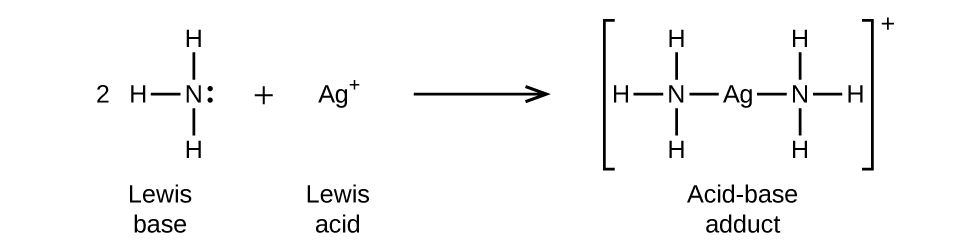
Dans la réaction suivante, chacune des deux molécules d'ammoniac, les bases de Lewis, donne une paire d'électrons à un ion argent, l'acide de Lewis :
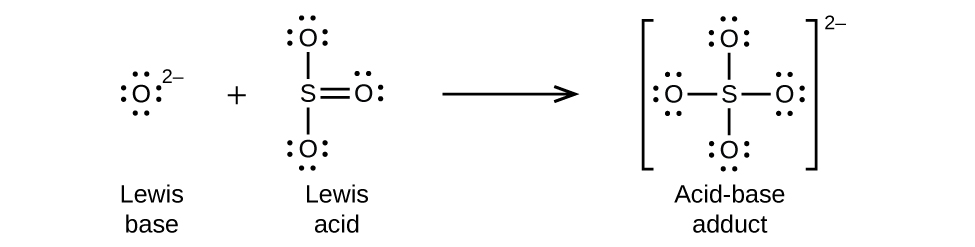
Les oxydes non métalliques agissent comme des acides de Lewis et réagissent avec les ions oxydes, les bases de Lewis, pour former des oxyanions :
De nombreuses réactions acide-base de Lewis sont des réactions de déplacement dans lesquelles une base de Lewis déplace une autre base de Lewis d'un adduit acide-base, ou dans lesquelles un acide de Lewis déplace un autre acide de Lewis :
La dernière réaction de déplacement montre comment la réaction d'un acide de Brønsted-Lowry avec une base s'inscrit dans le concept de Lewis. Un acide de Brønsted-Lowry tel que le HCl est un adduit acido-basique selon le concept de Lewis, et le transfert de protons se produit parce qu'un adduit acido-basique plus stable se forme. Ainsi, bien que les définitions des acides et des bases dans les deux théories soient très différentes, elles se recoupent considérablement.
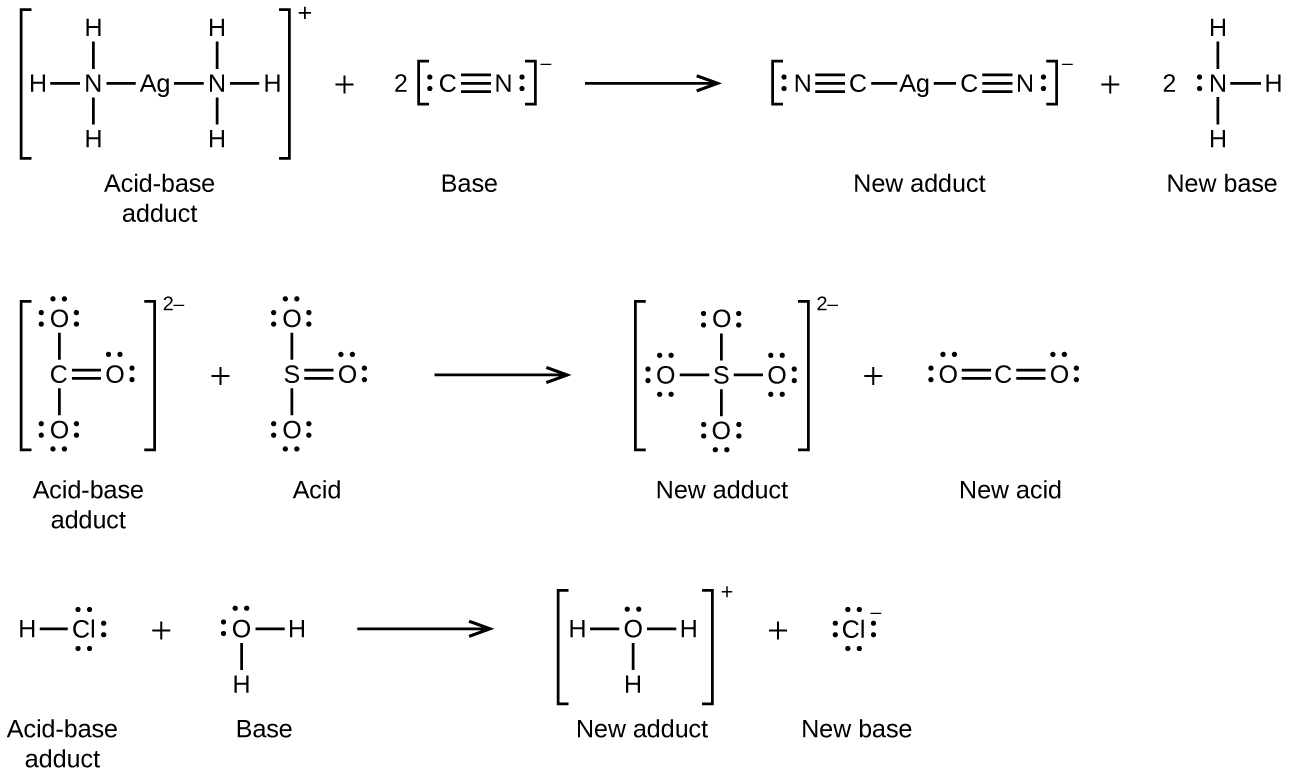
De nombreux solides ioniques légèrement solubles se dissolvent lorsque la concentration de l'ion métallique en solution diminue par la formation d'ions complexes (polyatomiques) lors d'une réaction acide-base de Lewis. Par exemple, le chlorure d'argent se dissout dans une solution d'ammoniac parce que l'ion argent réagit avec l'ammoniac pour former le complexe ion\(\ce{Ag(NH3)2+}\) n. La structure de Lewis de l'\(\ce{Ag(NH3)2+}\)ion est la suivante :
Les équations pour la dissolution de l'AgCl dans une solution de NH 3 sont les suivantes :
\[\ce{AgCl}(s)⟶\ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
\[\ce{Ag+}(aq)+\ce{2NH3}(aq)⟶\ce{Ag(NH3)2+}(aq) \nonumber \]
\[\textrm{Net: }\ce{AgCl}(s)+\ce{2NH3}(aq)⟶\ce{Ag(NH3)2+}(aq)+\ce{Cl-}(aq) \nonumber \]
L'hydroxyde d'aluminium se dissout dans une solution d'hydroxyde de sodium ou d'une autre base forte en raison de la formation de l'ion complexe\(\ce{Al(OH)4-}\). La structure de Lewis de l'\(\ce{Al(OH)4-}\)ion est la suivante :
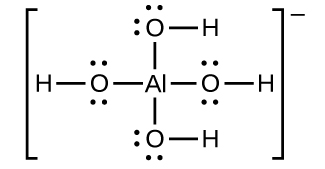
Les équations de la dissolution sont les suivantes :
\[\ce{Al(OH)3}(s)⟶\ce{Al^3+}(aq)+\ce{3OH-}(aq) \nonumber \]
\[\ce{Al^3+}(aq)+\ce{4OH-}(aq)⟶\ce{Al(OH)4-}(aq) \nonumber \]
\[\textrm{Net: }\ce{Al(OH)3}(s)+\ce{OH-}(aq)⟶\ce{Al(OH)4-}(aq) \nonumber \]
Le sulfure de mercure (II) se dissout dans une solution de sulfure de sodium car le HgS réagit avec l'ion S 2— :
\[\ce{HgS}(s)⟶\ce{Hg^2+}(aq)+\ce{S^2-}(aq) \nonumber \]
\[\ce{Hg^2+}(aq)+\ce{2S^2-}(aq)⟶\ce{HgS2^2-}(aq) \nonumber \]
\[\textrm{Net: }\ce{HgS}(s)+\ce{S^2-}(aq)⟶\ce{HgS2^2-}(aq) \nonumber \]
Un ion complexe est constitué d'un atome central, généralement un cation de métal de transition, entouré d'ions, ou de molécules appelées ligands. Ces ligands peuvent être des molécules neutres comme H 2 O ou NH 3, ou des ions tels que CN — ou OH —. Souvent, les ligands agissent comme des bases de Lewis, donnant une paire d'électrons à l'atome central. Les ligands s'agglutinent autour de l'atome central, créant un nouvel ion dont la charge est égale à la somme des charges et, le plus souvent, un ion métallique de transition. Cette disposition plus complexe est la raison pour laquelle l'ion résultant est appelé ion complexe. L'ion complexe formé lors de ces réactions ne peut pas être prédit ; il doit être déterminé expérimentalement. Les types de liaisons formées dans les ions complexes sont appelés liaisons covalentes coordonnées, car les électrons des ligands sont partagés avec l'atome central. De ce fait, les ions complexes sont parfois appelés complexes de coordination. Cela sera étudié plus en détail dans les prochains chapitres.
La constante d'équilibre pour la réaction des composants d'un ion complexe pour former l'ion complexe en solution est appelée constante de formation (K f) (parfois appelée constante de stabilité). Par exemple, l'ion complexe\(\ce{Cu(CN)2-}\) est présenté ici :
![]()
Il se forme par réaction :
\[\ce{Cu+}(aq)+\ce{2CN-}(aq)⇌\ce{Cu(CN)2-}(aq) \nonumber \]
À l'équilibre :
\[K_\ce{f}=Q=\ce{\dfrac{[Cu(CN)2- ]}{[Cu+][CN- ]^2}} \nonumber \]
L'inverse de la constante de formation est la constante de dissociation (K d), la constante d'équilibre pour la décomposition d'un ion complexe en ses composants en solution. Nous travaillerons sur les constantes de dissociation plus loin dans les exercices de cette section. Les tableaux E4 et Tableau\(\PageIndex{1}\) sont des tables de constantes de formation. En général, plus la constante de formation est élevée, plus le complexe est stable ; toutefois, comme dans le cas des valeurs de K sp, la stœchiométrie du composé doit être prise en compte.
| Substance | K f à 25 °C |
|---|---|
| \(\ce{[Cd(CN)4]^2-}\) | 3 × 10 18 |
| \(\ce{Ag(NH3)2+}\) | 1,7 × 10 7 |
| \(\ce{[AlF6]^3-}\) | 7 × 10 19 |
À titre d'exemple de dissolution par formation d'ions complexes, examinons ce qui se passe lorsque nous ajoutons de l'ammoniac aqueux à un mélange de chlorure d'argent et d'eau. Le chlorure d'argent se dissout légèrement dans l'eau, donnant une faible concentration d'Ag + ([Ag +] = 1,3 × 10 —5 M) :
\[\ce{AgCl}(s)⇌\ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
Cependant, si du NH 3 est présent dans l'eau, l'ion complexe peut se former selon l'équation suivante :\(\ce{Ag(NH3)2+}\)
\[\ce{Ag+}(aq)+\ce{2NH3}(aq)⇌\ce{Ag(NH3)2+}(aq) \nonumber \]
avec
\[K_\ce{f}=\ce{\dfrac{[Ag(NH3)2+]}{[Ag+][NH3]^2}}=1.7×10^7 \nonumber \]
La grande taille de cette constante de formation indique que la plupart des ions d'argent libres produits par la dissolution de AgCl se combinent avec le NH 3 pour se former\(\ce{Ag(NH3)2+}\). En conséquence, la concentration en ions argent, [Ag +], est réduite et le quotient de réaction pour la dissolution du chlorure d'argent, [Ag +] [Cl —], tombe en dessous du produit de solubilité de AgCl :
\[Q=\ce{[Ag+][Cl- ]}<K_\ce{sp} \nonumber \]
Plus de chlorure d'argent se dissout ensuite. Si la concentration en ammoniac est suffisamment élevée, tout le chlorure d'argent se dissout.
Calculez la concentration de l'ion argent dans une solution qui est initialement de 0,10 M par rapport à\(\ce{Ag(NH3)2+}\).
Une solution
Nous utilisons la méthode habituelle pour résoudre ce problème :
- Déterminez la direction du changement. L'ion complexe\(\ce{Ag(NH3)2+}\) est en équilibre avec ses composants, comme le montre l'équation suivante :\[\ce{Ag+}(aq)+\ce{2NH3}(aq)⇌\ce{Ag(NH3)2+}(aq) \nonumber \]
Nous écrivons l'équilibre comme une réaction de formation car le tableau E4 répertorie les constantes de formation pour les ions complexes. Avant l'équilibre, le quotient de réaction est supérieur à la constante d'équilibre (k_f = 1,7 \ fois 10^7 \), et\(Q=\dfrac{0.10}{0 \times 0} = \infty\) (il est infiniment grand), de sorte que la réaction se déplace vers la gauche pour atteindre l'équilibre.


