15.3 : Équilibres couplés
- Page ID
- 194014
- Décrire des exemples de systèmes impliquant deux (ou plus) équilibres chimiques simultanés
- Calculer les concentrations de réactifs et de produits pour plusieurs systèmes d'équilibre
- Comparez la dissolution et la formation d'électrolytes faibles
Parfois, une réaction d'équilibre ne décrit pas correctement le système étudié. Parfois, plusieurs types d'équilibre se produisent simultanément (par exemple, une réaction acide-base et une réaction de précipitation).
L'océan est un exemple unique de système comportant de multiples équilibres, ou de multiples états d'équilibres de solubilité fonctionnant simultanément. Le dioxyde de carbone présent dans l'air se dissout dans l'eau de mer pour former de l'acide carbonique (H 2 CO 3). L'acide carbonique s'ionise ensuite pour former des ions hydrogène et des ions bicarbonate\(\ce{(HCO3- )}\), qui peuvent ensuite s'ioniser en davantage d'ions hydrogène et d'ions carbonate\(\ce{(CO3^2- )}\) :
\[\ce{CO2}(g)⇌\ce{CO2}(aq) \nonumber \]
\[\ce{CO2}(aq)+\ce{H2O}⇌\ce{H2CO3}(aq) \nonumber \]
\[\ce{H2CO3}(aq)⇌\ce{H+}(aq)+\ce{HCO3-}(aq) \nonumber \]
\[\ce{HCO3-}(aq)⇌\ce{H+}(aq)+\ce{CO3^2-}(aq) \nonumber \]
L'excès d'ions H + rend l'eau de mer plus acide. L'augmentation de l'acidification des océans peut alors avoir des impacts négatifs sur les coraux qui construisent des récifs, car ils ne peuvent pas absorber le carbonate de calcium dont ils ont besoin pour se développer et entretenir leur squelette (Figure\(\PageIndex{1}\)). Cela perturbe à son tour le biosystème local qui dépend de la santé des récifs pour sa survie. Si un nombre suffisant de récifs locaux sont affectés de la même manière, les perturbations de la vie marine peuvent se faire sentir à l'échelle mondiale. Les océans du monde traversent actuellement une période d'acidification intense, qui aurait débuté au milieu du XIXe siècle, et qui s'accélère aujourd'hui à un rythme plus rapide que n'importe quel changement du pH océanique au cours des 20 derniers millions d'années.

Apprenez-en davantage sur l'acidification des océans et ses effets sur les autres créatures marines.
Les solides légèrement solubles dérivés d'acides faibles se dissolvent généralement dans les acides forts, sauf si leurs produits de solubilité sont extrêmement petits. Par exemple, nous pouvons dissoudre le CuCO 3, le FeS et le Ca 3 (PO 4) 2 dans du HCl car leurs anions basiques réagissent pour former des acides faibles (H 2 CO 3, H 2 S et\(\ce{H2PO4-}\)). La diminution de la concentration de l'anion qui en résulte entraîne un déplacement des concentrations d'équilibre vers la droite conformément au principe de Le Chatelier.

La dissolution de l'hydroxylapatite, Ca 5 (PO 4) 3 OH, dans l'acide est particulièrement importante pour nous. Les apatites sont une classe de minéraux à base de phosphate de calcium (Figure\(\PageIndex{2}\)) ; une forme biologique d'hydroxylapatite est le principal minéral de l'émail de nos dents. Un mélange d'hydroxylapatite et d'eau (ou de salive) contient un mélange équilibré d'ions Ca 5 (PO 4) 3 OH solides et d'ions Ca 2 +\(\ce{PO4^3-}\),, et OH — dissous :
\[\ce{Ca5(PO4)3OH}(s)⟶\ce{5Ca^2+}(aq)+\ce{3PO4^3-}(aq)+\ce{OH-}(aq) \nonumber \]
Lorsqu'ils sont exposés à l'acide, les ions phosphate réagissent avec les ions hydronium pour former des ions hydrogénophosphate et, finalement, de l'acide phosphorique :
\[\ce{PO4^3-}(aq)+\ce{H3O+}⇌\ce{H2PO4^2-}+\ce{H2O} \nonumber \]
\[\ce{PO4^2-}(aq)+\ce{H3O+}⇌\ce{H2PO4-}+\ce{H2O} \nonumber \]
\[\ce{H2PO4- + H3O+ ⇌ H3PO4 + H2O} \nonumber \]
L'ion hydroxyde réagit pour former de l'eau :
\[\ce{OH-}(aq)+\ce{H3O+}⇌\ce{2H2O} \nonumber \]
Ces réactions diminuent les concentrations en ions phosphate et hydroxyde, et l'hydroxylapatite supplémentaire se dissout dans une solution acide conformément au principe de Le Chatelier. Nos dents développent des caries lorsque les déchets acides produits par les bactéries qui s'y développent provoquent la dissolution de l'hydroxylapatite de l'émail. Les dentifrices au fluorure contiennent du fluorure de sodium, du NaF ou du fluorure d'étain [plus précisément appelé fluorure d'étain (II)], du SnF 2. Ils fonctionnent en remplaçant l'ion OH — de l'hydroxylapatite par l'ion F —, produisant de la fluorapatite, Ca 5 (PO 4) 3 F :
\[\ce{NaF + Ca5(PO4)3OH ⇌ Ca5(PO4)3F + Na+ + OH-} \nonumber \]
Le Ca 5 (PO 4) 3 F qui en résulte est légèrement moins soluble que le Ca 5 (PO 4) 3 OH, et F — est une base plus faible que l'OH —. Ces deux facteurs rendent la fluorapatite plus résistante aux attaques des acides que l'hydroxylapatite. Pour en savoir plus, consultez l'article La chimie dans la vie quotidienne sur le rôle du fluorure dans la prévention de la carie dentaire.
Comme nous l'avons vu précédemment, les ions fluorure aident à protéger nos dents en réagissant avec l'hydroxylapatite pour former de la fluorapatite, Ca 5 (PO 4) 3 F. Comme elle n'a pas d'ion hydroxyde, la fluorapatite est plus résistante aux attaques des acides de notre bouche et est donc moins soluble, protégeant ainsi nos dents. Les scientifiques ont découvert que l'eau naturellement fluorée pouvait être bénéfique pour les dents. Il est donc devenu courant d'ajouter du fluor à l'eau potable. Les dentifrices et les bains de bouche contiennent également des quantités de fluorure (Figure\(\PageIndex{3}\)).

Malheureusement, un excès de fluorure peut annuler ses avantages. Les sources naturelles d'eau potable dans diverses régions du monde présentent des concentrations variables de fluorure, et les endroits où cette concentration est élevée sont sujets à certains risques pour la santé lorsqu'il n'existe aucune autre source d'eau potable. L'effet secondaire le plus grave d'un excès de fluorure est la maladie des os, la fluorose squelettique. Lorsqu'un excès de fluorure est présent dans le corps, il peut provoquer une raideur des articulations et un épaississement des os. Cela peut avoir de graves répercussions sur la mobilité et affecter négativement la glande thyroïde. La fluorose squelettique est une maladie dont souffrent plus de 2,7 millions de personnes dans le monde. Alors que le fluorure peut protéger nos dents contre la carie, l'Agence de protection de l'environnement des États-Unis fixe un niveau maximum de 4 ppm (4 mg/L) de fluorure dans l'eau potable aux États-Unis. Les niveaux de fluorure dans l'eau ne sont pas réglementés dans tous les pays, de sorte que la fluorose est un problème dans les zones où les niveaux de fluorure dans les eaux souterraines sont élevés.
Lorsque les pluies acides attaquent le calcaire ou le marbre, qui sont des carbonates de calcium, une réaction similaire à l'attaque acide de l'hydroxylapatite se produit. L'ion hydronium issu des pluies acides se combine à l'ion carbonate des carbonates de calcium et forme l'ion hydrogénocarbonate, un acide faible :
\[\ce{H3O+}(aq)+\ce{CO3^2-}(aq)⟶\ce{HCO3-}(aq)+\ce{H2O}(l) \nonumber \]
L'hydrogénocarbonate de calcium, Ca (HCO 3) 2, est soluble, de sorte que les objets en calcaire et en marbre se dissolvent lentement sous l'effet des pluies acides.
Si du carbonate de calcium est ajouté à un acide concentré, l'ion hydronium réagit avec l'ion carbonate selon l'équation suivante :
\[\ce{2H3O+}(aq)+\ce{CO3^2-}(aq)⟶\ce{H2CO3}(aq)+\ce{2H2O}(l) \nonumber \]
(Les pluies acides ne sont généralement pas suffisamment acides pour provoquer cette réaction ; toutefois, les acides de laboratoire le sont.) La solution peut devenir saturée par l'acide carbonique à électrolyte faible, qui est instable, et du dioxyde de carbone peut se dégager :
\[\ce{H2CO3}(aq)⟶\ce{CO2}(g)+\ce{H2O}(l) \nonumber \]
Ces réactions diminuent la concentration en ions carbonate et du carbonate de calcium supplémentaire se dissout. En présence d'une quantité suffisante d'acide, la concentration en ions carbonate est réduite à un niveau si bas que le quotient de réaction pour la dissolution du carbonate de calcium reste inférieur au produit de solubilité du carbonate de calcium, même après dissolution complète du carbonate de calcium.
Calculer la concentration en ions ammonium requise pour empêcher la précipitation de Mg (OH) 2 dans une solution contenant [Mg 2 +] = 0,10 M et [NH 3] = 0,10 M.
Solution
Deux équilibres interviennent dans ce système :
- Réaction (1) :\(\ce{Mg(OH)2}(s)⇌\ce{Mg^2+}(aq)+\ce{2OH-}(aq); \hspace{20px} K_\ce{sp}=8.9×10^{−12}\)
- Réaction (2) :\(\ce{NH3}(aq)+\ce{H2O}(l)⇌\ce{NH4+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{sp}=1.8×10^{−5}\)
Pour empêcher la formation de Mg (OH) 2 solide, nous devons ajuster la concentration de OH — de sorte que le quotient de réaction pour l'équation (1), Q = [Mg 2 +] [OH —] 2, soit inférieur à K sp pour Mg (OH) 2 . (Pour simplifier le calcul, nous déterminons la concentration de OH — lorsque Q = K sp.) [OH —] peut être réduit par l'ajout de\(\ce{NH4+}\), ce qui déplace la réaction (2) vers la gauche et réduit [OH —].
- Nous déterminons le [OH —] auquel Q = K sp lorsque [Mg 2 +] = 0,10 M :\[Q=\ce{[Mg^2+][OH- ]^2}=(0.10)\ce{[OH- ]^2}=8.9×10^{−12} \nonumber \]
Le Mg (OH) 2 solide ne se forme pas dans cette solution lorsque [OH —] est inférieur à 9,4 × 10 —6 M.
- Nous calculons le\(\mathit{[NH_4^+]}\) besoin pour diminuer [OH —] à 9,4 × 10 —6 M lorsque [NH 3] = 0,10. \[K_\ce{b}=\ce{\dfrac{[NH4+][OH- ]}{[NH3]}}=\dfrac{\ce{[NH4+]}(9.4×10^{−6})}{0.10}=1.8×10^{−5} \nonumber \]\[\ce{[NH4+]}=0.19\:M \nonumber \]
Quand il\(\ce{[NH4+]}\) est égal à 0,19 M, [OH —] sera égal à 9,4 × 10 —6 M. Toute\(\ce{[NH4+]}\) valeur supérieure à 0,19 M réduira [OH —] en dessous de 9,4 × 10 —6 M et empêchera la formation de Mg (OH) 2.
Considérez les deux équilibres :
\[\ce{ZnS}(s)⇌\ce{Zn^2+}(aq)+\ce{S^2-}(aq) \hspace{20px} K_\ce{sp}=1×10^{−27} \nonumber \]
\[\ce{2H2O}(l)+\ce{H2S}(aq)⇌\ce{2H3O+}(aq)+\ce{S^2-}(aq) \hspace{20px} K=1.0×10^{−26} \nonumber \]
et calculer la concentration en ions hydronium requise pour empêcher la précipitation de ZnS dans une solution à 0,050 M dans Zn 2 + et saturée en H 2 S (0,10 M H 2 S).
- Réponse
-
\[\ce{[H3O+]}>0.2\:M \nonumber \]
([S 2—] est inférieur à 2 × 10 —26 M et aucune précipitation de ZnS ne se produit.)
Par conséquent, les calculs précis de la solubilité des solides à partir du produit de solubilité sont limités aux cas où la seule réaction significative se produisant lors de la dissolution du solide est la formation de ses ions.
Les halogénures d'argent non exposés sont retirés du film photographique lorsqu'ils réagissent avec le thiosulfate de sodium (Na 2 S 2 O 3, appelé hypo) pour former l'ion complexe\(\ce{Ag(S2O3)2^3-}\) (K f = 4,7 × 10 13). La réaction avec le bromure d'argent est :
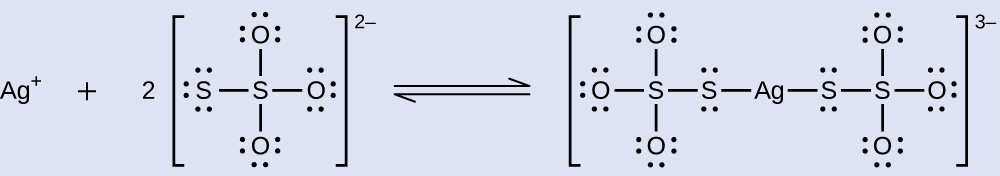
Quelle masse de Na 2 S 2 O 3 est nécessaire pour préparer 1,00 L d'une solution qui dissoudra 1,00 g d'AgBr par formation de\(\ce{Ag(S2O3)2^3-}\) ?
Une solution
Deux équilibres entrent en jeu lorsque l'AgBr se dissout dans une solution contenant l'\(\ce{S2O3^2-}\)ion :
- Réaction (1) :\(\ce{AgBr}(s)⇌\ce{Ag+}(aq)+\ce{Br-}(aq) \hspace{20px} K_\ce{sp}=5.0×10^{−13}\)
- Réaction (2) :\(\ce{Ag+}(aq)+\ce{S2O3^2-}(aq)⇌\ce{Ag(S2O3)2^3-}(aq) \hspace{20px} K_\ce{f}=4.7×10^{13}\)
Pour que 1,00 g d'AgBr se dissolve, le [Ag +] dans la solution qui en résulte doit être suffisamment faible pour que Q pour la réaction (1) soit inférieur à K sp pour cette réaction. Nous réduisons [Ag +] en ajoutant\(\ce{S2O3^2-}\) et provoquons ainsi le décalage de la réaction (2) vers la droite. Nous avons besoin des étapes suivantes pour déterminer la masse de Na 2 S 2 O 3 nécessaire pour fournir le nécessaire\(\ce{S2O3^2-}\).
- Nous calculons le [Br —] produit par la dissolution complète de 1,00 g d'AgBr (5,33 × 10 —3 mol AgBr) dans 1,00 L de solution :\[\ce{[Br- ]}=5.33×10^{−3}\:M \nonumber \]
- Nous utilisons [Br —] et K sp pour déterminer la concentration maximale possible d'Ag + qui peut être présente sans provoquer de reprécipitation d'AgBr :\[\ce{[Ag+]}=9.4×10^{−11}\:M \nonumber \]
- Nous déterminons la\(\mathit{[S_2O_3^{2-}]}\) quantité requise pour obtenir [Ag +] = 9,4 × 10 —11 M après la réaction de l'ion Ag + restant,\(\mathit{S_2O_3^{2-}}\) selon l'équation suivante :\[\ce{Ag+ + 2S2O3^2- ⇌ Ag(S2O3)2^3-} \hspace{20px} K_\ce{f}=4.7×10^{13} \nonumber \]
Parce que 5,33 × 10 —3 mol d'AgBr se dissout :
\ [(5,33 × 10^ {−3}) − (9,4 × 10 ^ {−11}) =5,33 × 10^ {−3} \ ce {\ :mol \ :Ag (S2O3) 2^3-} \ \ nonnumber]Ainsi, à l'équilibre :\(\ce{[Ag(S2O3)2^3- ]}\) = 5,33 × 10 —3 M, [Ag +] = 9,4 × 10 —11 M et Q = K f = 4,7 × 10 13 :
\[K_\ce{f}=\ce{\dfrac{[Ag(S2O3)2^3- ]}{[Ag+][S2O3^2- ]^2}}=4.7×10^{13} \nonumber \]\[\ce{[S2O3^2- ]}=1.1×10^{−3}\:M \nonumber \]Lorsque la\(\ce{[S2O3^2- ]}\) valeur est de 1,1 × 10 —3 M, [Ag +] est de 9,4 × 10 —11 M et tout l'AgBr reste dissous.
- Nous déterminons le nombre total de\(\mathit{S_2O_3^{2-}}\) moles à ajouter à la solution. Cela est égal à la quantité qui réagit avec l'Ag + pour se former,\(\ce{Ag(S2O3)2^3-}\) plus la quantité de matière libre\(\ce{S2O3^2-}\) en solution à l'équilibre. Pour former 5,33 × 10 —3 mol de,\(\ce{Ag(S2O3)2^3-}\) il faut 2 × (5,33 × 10 —3) mol de\(\ce{S2O3^2-}\). De plus, 1,1 × 10 —3 mol de substances n'ayant pas réagi\(\ce{S2O3^2-}\) sont présentes (étape 3). Ainsi, le montant total\(\ce{S2O3^2-}\) à ajouter est de :\[\mathrm{2×(5.33×10^{−3}mol\:S_2O_3^{2-}) + 1.1×10^{−3}\:mol\:S_2O_3^{2-} = 1.18×10^{−2}\: mol\:S_2O_3^{2-}} \nonumber \]
- Nous déterminons la masse de Na 2 S 2 O 3 requise pour obtenir 1,18 × 10 —2 mol\(\mathit{S_2O_3^{2-}}\) en utilisant la masse molaire de Na 2 S 2 O 3 :\[\mathrm{1.18×10^{−2}\:mol\:S_2O_3^{2-}×\dfrac{158.1\:g\:Na_2S_2O_3}{1\:mol\:Na_2S_2O_3}=1.9\:g\:Na_2S_2O_3} \nonumber \]
Ainsi, 1,00 L d'une solution préparée à partir de 1,9 g de Na 2 S 2 O 3 dissout 1,0 g d'AgBr.
L'AgCl (s), le chlorure d'argent, est bien connu pour sa très faible solubilité :\(\ce{Ag}(s)⇌\ce{Ag+}(aq)+\ce{Cl-}(aq)\) K sp = 1,6 × 10 —10. L'ajout d'ammoniac augmente significativement la solubilité de l'AgCl car un ion complexe se forme :\(\ce{Ag+}(aq)+\ce{2NH3}(aq)⇌\ce{Ag(NH3)2+}(aq)\), K f = 1,7 × 10 7. Quelle masse de NH 3 est nécessaire pour préparer 1,00 L de solution qui dissoudra 2,00 g d'AgCl par formation de\(\ce{Ag(NH3)2+}\) ?
- Réponse
-
1,00 L d'une solution préparée avec 4,81 g de NH 3 dissout 2,0 g d'AgCl.
Dissolution ou formation d'électrolytes faibles
Nous pouvons déterminer comment modifier la concentration des ions dans l'équilibre entre un solide légèrement soluble et une solution de ses ions en appliquant le principe de Le Chatelier. Par exemple, une façon de contrôler la concentration d'ion manganèse (II), Mn 2 +, dans une solution consiste à ajuster le pH de la solution et, par conséquent, à manipuler l'équilibre entre l'hydroxyde de manganèse (II) solide légèrement soluble, l'ion manganèse (II) et l'ion hydroxyde :
\[\ce{Mn(OH)2}(s) ⇌ \ce{Mn^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mn^2+][OH- ]^2} \nonumber \]
Cela peut être important pour une blanchisserie, car les vêtements lavés dans de l'eau dont la concentration en manganèse dépasse 0,1 mg par litre peuvent être tachés par le manganèse. Nous pouvons réduire la concentration de manganèse en augmentant la concentration en ions hydroxyde. Nous pourrions ajouter, par exemple, une petite quantité de NaOH ou une autre base telle que les silicates présents dans de nombreux détergents à lessive. Lorsque la concentration en ions OH — augmente, l'équilibre réagit en se déplaçant vers la gauche et en réduisant la concentration en ions Mn 2 + tout en augmentant la quantité de Mn (OH) 2 solide dans le mélange d'équilibre, comme le prédit le principe de Le Chatelier.
Quel est l'effet sur la quantité de Mg (OH) 2 solide qui se dissout et sur les concentrations de Mg 2 + et OH lorsque chacun des éléments suivants est ajouté à un mélange de Mg (OH) 2 solide dans de l'eau à l'équilibre ?
- MgCl 2
- KOH
- un acide
- NaNO 3
- Mg (OH) 2
Solution
L'équilibre entre le Mg (OH) 2 solide et une solution de Mg 2 + et de OH — est le suivant :
\[\ce{Mg(OH)2}(s) ⇌ \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
(a) La réaction se déplace vers la gauche pour soulager le stress produit par l'ion Mg 2 + supplémentaire, conformément au principe de Le Chatelier. En termes quantitatifs, le Mg 2 + ajouté fait que le quotient de réaction est supérieur au produit de solubilité (Q > K sp), et du Mg (OH) 2 se forme jusqu'à ce que le quotient de réaction soit à nouveau égal à K sp. Au nouvel équilibre, [OH —] est inférieur et [Mg 2 +] est supérieur à celui de la solution de Mg (OH) 2 dans de l'eau pure. Du Mg (OH) 2 plus solide est présent.
(b) La réaction se déplace vers la gauche pour soulager le stress de l'ion OH — supplémentaire. Du Mg (OH) 2 se forme jusqu'à ce que le quotient réactionnel soit de nouveau égal à K sp. Au nouvel équilibre, [OH —] est supérieur et [Mg 2 +] est inférieur à celui de la solution de Mg (OH) 2 dans de l'eau pure. Du Mg (OH) 2 plus solide est présent.
(c) La concentration de OH — diminue lorsque l'OH — réagit avec l'acide. La réaction se déplace vers la droite pour soulager le stress lié à la diminution de la quantité d'ions OH —. En termes quantitatifs, la diminution de la concentration d'OH — fait que le quotient de réaction est inférieur au produit de solubilité (Q < K sp), et le Mg (OH) 2 supplémentaire se dissout jusqu'à ce que le quotient de réaction soit de nouveau égal à K sp. Au nouvel équilibre, [OH —] est inférieur et [Mg 2 +] est supérieur à celui de la solution de Mg (OH) 2 dans de l'eau pure. Plus de Mg (OH) 2 est dissous.
(d) Le NaNO 3 ne contient aucune des espèces impliquées dans l'équilibre, il faut donc s'attendre à ce qu'il n'ait aucun effet appréciable sur les concentrations de Mg 2 + et de OH —. (Comme nous l'avons vu précédemment, les sels dissous modifient l'activité des ions d'un électrolyte. Cependant, l'effet du sel est généralement faible, et nous négligerons les légères erreurs qui peuvent en résulter.)
(e) L'ajout de Mg (OH) 2 solide n'a aucun effet sur la solubilité du Mg (OH) 2 ni sur la concentration de Mg 2 + et OH —. La concentration de Mg (OH) 2 n'apparaît pas dans l'équation du quotient de réaction :
\[Q=\ce{[Mg^2+][OH- ]^2} \nonumber \]
Ainsi, la modification de la quantité d'hydroxyde de magnésium solide dans le mélange n'a aucun effet sur la valeur de Q, et aucun décalage n'est nécessaire pour ramener Q à la valeur de la constante d'équilibre.
Quel est l'effet sur la quantité de NiCO 3 solide qui se dissout et les concentrations de Ni 2 + et\(\ce{CO3^2-}\) lorsque chacun des éléments suivants est ajouté à un mélange de NiCO 3 solide légèrement soluble et d'eau à l'équilibre ?
- Non (NO 32)
- KClO 4
- NiCo 3
- K 2 CO 3
- HNO 3 (réagit avec le carbonate en donnant\(\ce{HCO3-}\) du H 2 O et du CO 2)
Réponse
(a) la masse de NiCO 3 (s) augmente, [Ni 2 +] augmente,\(\ce{[CO3^2- ]}\) diminue ; (b) aucun effet appréciable ; (c) aucun effet sauf pour augmenter la quantité de NiCO 3 solide ; (d) la masse de NiCO 3 (s) augmente, [Ni 2 +] diminue,\(\ce{[CO3^2- ]}\) augmente ; (e) la masse de NiCO 3 (s) diminue, [Ni 2 +] augmente,\(\ce{[CO3^2- ]}\) diminue
Résumé
Plusieurs systèmes que nous rencontrons sont constitués de plusieurs équilibres, des systèmes dans lesquels deux ou plusieurs processus d'équilibre se produisent simultanément. Parmi les exemples courants, citons les pluies acides, la fluoration et la dissolution du dioxyde de carbone dans l'eau de mer. Lorsque nous examinons ces systèmes, nous devons considérer chaque équilibre séparément, puis combiner les constantes d'équilibre individuelles en un produit de solubilité ou une expression de quotient de réaction à l'aide des outils du premier chapitre sur l'équilibre. Le principe de Le Chatelier doit également être pris en compte, car chaque réaction d'un système à équilibres multiples se déplace vers des réactifs ou des produits en fonction de ce qui est ajouté à la réaction initiale et de la façon dont il affecte chaque réaction d'équilibre ultérieure.
Lexique
- équilibre multiple
- système caractérisé par plus d'un état d'équilibre entre un solide ionique légèrement soluble et une solution aqueuse d'ions agissant simultanément


