15.1 : Précipitation et dissolution
- Page ID
- 194015
- Écrire des équations chimiques et des expressions d'équilibre représentant les équilibres de solubilité
- Effectuer des calculs d'équilibre impliquant la solubilité, les expressions d'équilibre et les concentrations de solutés
La conservation des échantillons sanguins des laboratoires médicaux, l'extraction de l'eau de mer pour le magnésium, la formulation de médicaments en vente libre tels que le lait de magnésie et les antiacides, et le traitement de la présence d'eau calcaire dans l'alimentation en eau de votre maison ne sont que quelques-unes des nombreuses tâches qui impliquent le contrôle de l'équilibre entre un solide ionique légèrement soluble et une solution aqueuse de ses ions.
Dans certains cas, nous voulons empêcher la dissolution. La carie dentaire, par exemple, survient lorsque l'hydroxylapatite de calcium, dont la formule est Ca 5 (PO 4) 3 (OH), se dissout dans nos dents. Le processus de dissolution est facilité lorsque les bactéries présentes dans notre bouche se régalent des sucres contenus dans notre alimentation pour produire de l'acide lactique, qui réagit avec les ions hydroxydes de l'hydroxylapatite de calcium. Empêcher la dissolution empêche la pourriture. D'un autre côté, nous voulons parfois qu'une substance se dissolve. Nous voulons que le carbonate de calcium contenu dans un antiacide à croquer soit dissous, car les\(\ce{CO3^2-}\) ions produits au cours de ce processus aident à apaiser les maux d'estomac.
Dans cette section, nous allons découvrir comment contrôler la dissolution d'un solide ionique légèrement soluble en appliquant le principe de Le Chatelier. Nous apprendrons également comment utiliser la constante d'équilibre de la réaction pour déterminer la concentration d'ions présents dans une solution.
La constante du produit de solubilité
Le chlorure d'argent est ce que l'on appelle un solide ionique peu soluble (Figure\(\PageIndex{1}\)). Rappelons que les règles de solubilité décrites dans un chapitre précédent indiquent que les halogénures d'Ag + ne sont normalement pas solubles. Cependant, lorsque nous ajoutons un excès d'AgCl solide à l'eau, celui-ci se dissout légèrement et produit un mélange constitué d'une solution très diluée d'ions Ag + et Cl — en équilibre avec du chlorure d'argent non dissous :
\[\ce{AgCl}(s)\mathrm{\xrightleftharpoons[\:precipitation\:]{\:dissolution\:}}\ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
Cet équilibre, comme les autres équilibres, est dynamique ; une partie du AgCl solide continue de se dissoudre, mais en même temps, les ions Ag + et Cl — de la solution se combinent pour produire une quantité égale de solide. À l'équilibre, les processus opposés ont des taux égaux.
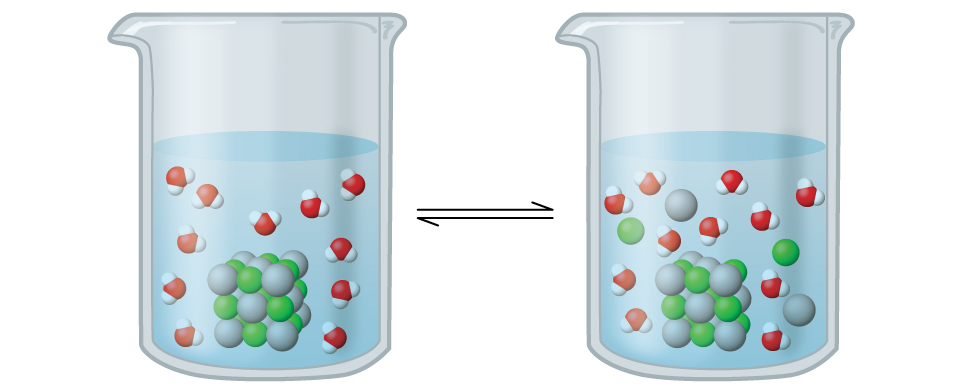
La constante d'équilibre entre un solide ionique légèrement soluble et une solution de ses ions est appelée produit de solubilité (K sp) du solide. Rappelons que dans le chapitre sur les solutions et les colloïdes, nous utilisons la concentration d'un ion comme approximation de son activité dans une solution diluée. Pour le chlorure d'argent, à l'équilibre :
\[\ce{AgCl}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
avec
\[K_\ce{sp}=[\ce{Ag+}(aq)][\ce{Cl-}(aq)] \nonumber \]
Lorsque l'on examine de telles réactions de dissolution, le solide est répertorié en tant que réactif, tandis que les ions sont répertoriés en tant que produits. La constante du produit de solubilité, comme toute expression de constante d'équilibre, s'écrit comme le produit des concentrations de chacun des ions, augmentées à la puissance de leurs coefficients stœchiométriques. Ici, la constante du produit de solubilité est égale à Ag + et Cl, lorsqu'une solution de chlorure d'argent est en équilibre avec du AgCl non dissous. Aucun dénominateur ne représente les réactifs dans cette expression d'équilibre puisque le réactif est un solide pur ; par conséquent, [AgCl] n'apparaît pas dans l'expression de K sp.
| Substance | K sp à 25 °C |
|---|---|
| CuCl | 1,2 × 10 —6 |
| CuBr | 6,27 × 10 —9 |
| AGI | 1,5 × 10 —16 |
| PBs | 7 × 10 —29 |
| Al (OH) 3 | 2 × 10 —32 |
| Fe (OH) 3 | 4 × 10 —38 |
Certains produits de solubilité courants sont répertoriés dans le tableau en\(\PageIndex{1}\) fonction de leurs valeurs K sp, tandis qu'une compilation plus complète des produits figure dans le tableau E3. Chacune de ces constantes d'équilibre est bien inférieure à 1 car les composés listés ne sont que légèrement solubles. Un faible K sp représente un système dans lequel l'équilibre se situe à gauche, de sorte que relativement peu d'ions hydratés seraient présents dans une solution saturée.
Écrivez l'équation ionique pour la dissolution et l'expression du produit de solubilité pour chacun des composés ioniques légèrement solubles suivants :
- AgI, iodure d'argent, un solide aux propriétés antiseptiques
- CaCO 3, carbonate de calcium, ingrédient actif de nombreux antiacides à croquer en vente libre
- Mg (OH) 2, hydroxyde de magnésium, ingrédient actif du lait de magnésie
- Mg (NH 4) PO 4, phosphate de magnésium et d'ammonium, substance essentiellement insoluble utilisée dans les tests de détection du magnésium
- Ca 5 (PO 4) 3 OH, l'apatite minérale, source de phosphate pour les engrais
(Conseil : pour déterminer comment diviser (d) et (e) en ions, reportez-vous à la liste des ions polyatomiques dans la section sur la nomenclature chimique.)
Solution
- \(\ce{AgI}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{I-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ag+][I- ]}\)
- \(\ce{CaCO3}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{CO3^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ca^2+][CO3^2- ]}\)
- \(\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mg^2+][OH- ]^2}\)
- \(\ce{Mg(NH4)PO4}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{NH4+}(aq)+\ce{PO4^3-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mg^2+][NH4+][PO4^3- ]}\)
- \(\ce{Ca5(PO4)3OH}(s) \rightleftharpoons \ce{5Ca^2+}(aq)+\ce{3PO4^3-}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ca^2+]^5[PO4^3- ]^3[OH- ]}\)
Écrivez l'équation ionique pour la dissolution et le produit de solubilité pour chacun des composés légèrement solubles suivants :
- Abso 4
- Âge 2 ISO 4
- Al (OH) 3
- Pb (OH) Cl
- Répondez à une
-
\(\ce{BaSO4}(s) \rightleftharpoons \ce{Ba^2+}(aq)+\ce{SO4^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ba^2+][SO4^2- ]}\)
- Réponse b
-
\(\ce{Ag2SO4}(s) \rightleftharpoons \ce{2Ag+}(aq)+\ce{SO4^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ag+]^2[SO4^2- ]}\)
- Réponse c
-
\(\ce{Al(OH)3}(s) \rightleftharpoons \ce{Al^2+}(aq)+\ce{3OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Al^3+][OH- ]^3}\)
- Réponse d
-
\(\ce{Pb(OH)Cl}(s) \rightleftharpoons \ce{Pb^2+}(aq)+\ce{OH-}(aq)+\ce{Cl-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Pb^2+][OH- ][Cl- ]}\)
Nous allons maintenant étendre la discussion sur K sp et montrer comment la constante du produit de solubilité est déterminée à partir de la solubilité de ses ions, ainsi que comment K sp peut être utilisé pour déterminer la solubilité molaire d'une substance.
K sp et solubilité
Rappelons que la définition de la solubilité est la concentration maximale possible d'un soluté dans une solution à une température et une pression données. Nous pouvons déterminer le produit de solubilité d'un solide légèrement soluble à partir de cette mesure de sa solubilité à une température et une pression données, à condition que la seule réaction significative qui se produit lorsque le solide se dissout soit sa dissociation en ions solvatés, c'est-à-dire que le seul équilibre impliqué soit :
\[\ce{M}_p\ce{X}_q(s) \rightleftharpoons p\mathrm{M^{m+}}(aq)+q\mathrm{X^{n−}}(aq) \nonumber \]
Dans ce cas, nous calculons le produit de solubilité en prenant la solubilité du solide exprimée en unités de moles par litre (mol/L), connue sous le nom de solubilité molaire.
Nous avons commencé le chapitre par une discussion informelle sur la formation de la fluorite minérale. La fluorite, CaF 2, est un solide légèrement soluble qui se dissout selon l'équation :
\[\ce{CaF2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2F-}(aq) \nonumber \]
La concentration de Ca 2 + dans une solution saturée de CaF 2 est de 2,1 × 10 —4 M ; par conséquent, celle de F — est de 4,2 × 10 —4 M, soit le double de la concentration de Ca 2 +. Quel est le produit de solubilité de la fluorite ?
Solution
Écrivez d'abord l'expression K sp, puis remplacez-la par des concentrations et résolvez pour K sp :
\[\ce{CaF2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2F-}(aq) \nonumber \]
Une solution saturée est une solution en équilibre avec le solide. Ainsi :
\[\begin{align*} K_\ce{sp} &=\ce{[Ca^2+][F^{-}]^2} \\[4pt] &=(2.1×10^{−4})(4.2×10^{−4})^2 \\[4pt] &=3.7×10^{−11} \end{align*} \nonumber \]
Comme pour les autres constantes d'équilibre, nous n'incluons pas les unités avec K sp.
Dans une solution saturée qui est en contact avec du Mg (OH) 2 solide, la concentration de Mg 2 + est de 3,7 × 10 —5 M. Quel est le produit de solubilité du Mg (OH) 2 ?
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
- Réponse
-
2,0 × 10-13
Le K sp du bromure de cuivre (I), CuBr, est de 6,3 × 10 —9. Calculez la solubilité molaire du bromure de cuivre.
Solution
La constante du produit de solubilité du bromure de cuivre (I) est\(6.3 \times 10^{–9}\).
La réaction est la suivante :
\[\ce{CuBr}(s) \rightleftharpoons \ce{Cu+}(aq)+\ce{Br-}(aq) \nonumber \]
Tout d'abord, écrivez l'expression de la constante d'équilibre du produit de solubilité :
\[K_\ce{sp}=\ce{[Cu+][Br- ]} \nonumber \]
Créez une table ICE (comme présenté dans le chapitre sur les concepts d'équilibre fondamentaux), en laissant la colonne CuBr vide car elle est solide et ne contribue pas au K sp :
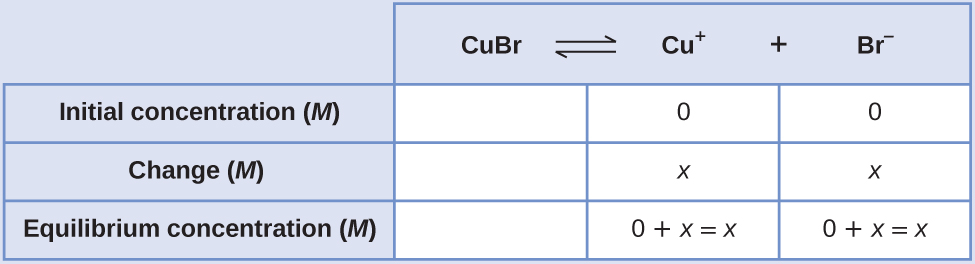
À l'équilibre :
\[\begin{align*} K_{sp} &=\ce{[Cu+][Br- ]} \\[4pt] 6.3×10^{−9} &=(x)(x)=x^2 \\[4pt] x &=\sqrt{(6.3×10^{−9})}=7.9×10^{−5} \end{align*} \nonumber \]Par conséquent, la solubilité molaire du CuBr est de 7,9 × 10 —5 M.
Le K sp de AgI est de 1,5 × 10 —16. Calculez la solubilité molaire de l'iodure d'argent.
- Réponse
-
1,2 × 10 —8 M
Détermination de la solubilité molaire à partir de K sp, partie II La valeur K sp de l'hydroxyde de calcium, Ca (OH) 2, est de 8,0 × 10 —6. Calculez la solubilité molaire de l'hydroxyde de calcium.
Solution
La constante du produit de solubilité de l'hydroxyde de calcium est de 1,3 × 10 —6.
La réaction est la suivante :
\[\ce{Ca(OH)2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
Tout d'abord, écrivez l'expression de la constante d'équilibre du produit de solubilité :
\[K_\ce{sp}=\ce{[Ca^2+][OH- ]^2} \nonumber \]
Créez une table ICE en laissant la colonne Ca (OH) 2 vide car elle est solide et ne contribue pas au K sp :
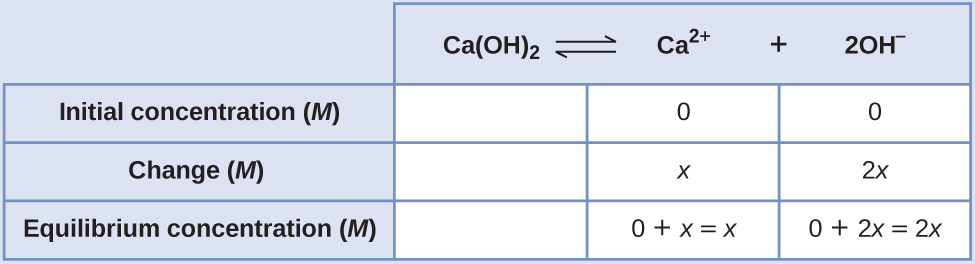
À l'équilibre :
\[ \begin{align*} K_\ce{sp} &=\ce{[Ca^2+][OH- ]^2} \\[4pt] 1.3×10^{−6} &=(x)(2x)^2=(x)(4x^2)=4x^3 \\[4pt] x &=\sqrt[3]{\dfrac{1.3×10^{-6}}{4}}=6.9×10^{-3} \end{align*} \nonumber \]
Par conséquent, la solubilité molaire du Ca (OH) 2 est de 6,9 × 10 —3 M.
Le K sp du PBi 2 est de 1,4 × 10 —8. Calculer la solubilité molaire de l'iodure de plomb (II).
- Réponse
-
1,5 × 10 —3 M
Notez que la solubilité n'est pas toujours donnée sous forme de valeur molaire. Lorsque la solubilité d'un composé est donnée dans une unité autre que les moles par litre, nous devons convertir la solubilité en moles par litre (c'est-à-dire la molarité) afin de l'utiliser dans l'expression de la constante du produit de solubilité. \(\PageIndex{5}\)L'exemple montre comment effectuer ces conversions d'unités avant de déterminer l'équilibre du produit de solubilité.
De nombreux pigments utilisés par les artistes dans les peintures à l'huile (Figure\(\PageIndex{2}\)) sont peu solubles dans l'eau. Par exemple, la solubilité du pigment jaune chrome de l'artiste, le pBCRo 4, est de 4,6 × 10 —6 g/L. Déterminez la constante d'équilibre du produit de solubilité pour le pBCRo 4.

Solution
On nous donne la solubilité du PbCRo 4 en grammes par litre. Si nous convertissons cette solubilité en moles par litre, nous pouvons trouver les concentrations d'équilibre de Pb 2 + puis\(\ce{CrO4^2-}\) de K sp :
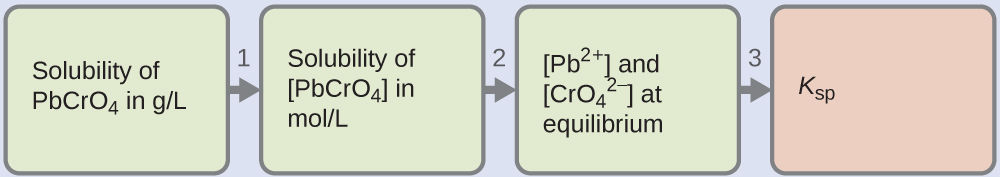
- Utilisez la masse molaire du PbCRo 4\(\mathrm{\left(\dfrac{323.2\:g}{1\:mol}\right)}\) pour convertir la solubilité du PbCRo 4 en grammes par litre en moles par litre :
\(\mathrm{[PbCrO_4]=\dfrac{4.6×10^{−6}\:g\: PbCrO_4}{1\:L}×\dfrac{1\:mol\: PbCrO_4}{323.2\:g\: PbCrO_4}}\)
\(\mathrm{=\dfrac{1.4×10^{−8}\:mol\: PbCrO_4}{1\:L}}\)
\(=1.4×10^{−8}\:M\)
- L'équation chimique de la dissolution indique qu'une mole de PbCRo 4 donne 1 mole de Pb 2 + (aq) et 1 mol de\(\ce{CrO_4^{2-}}(aq)\) :
\(\ce{PbCrO4}(s) \rightleftharpoons \ce{Pb^2+}(aq)+\ce{CrO4^2-}(aq)\)
Ainsi, [Pb 2 +] et [Pb 2 +]\(\ce{[CrO4^2- ]}\) sont égaux à la solubilité molaire du PbCRo 4 :
\(\ce{[Pb^2+]}=\ce{[CrO4^2- ]}=1.4×10^{−8}\:M\) - Résoudre. K sp = [Pb 2 +]\(\ce{[CrO4^2- ]}\) = (1,4 × 10 —8) (1,4 × 10 —8) = 2,0 × 10 —16
La solubilité du TLCl [chlorure de thallium (I)], un intermédiaire formé lorsque le thallium est isolé des minerais, est de 3,46 grammes par litre à 20 °C. Quel est son produit de solubilité ?
- Réponse
-
2,08 × 10 —4
Le calomel, Hg 2 Cl 2, est un composé composé de l'ion diatomique du mercure (I) et d'ions chlorure, Cl —.\(\ce{Hg2^2+}\) Bien que la plupart des composés du mercure soient aujourd'hui connus pour être toxiques, les médecins du XVIIIe siècle utilisaient le calomel comme médicament. Leurs patients ont rarement souffert d'empoisonnement au mercure à la suite des traitements, car le calomel est très insoluble :
\[\ce{Hg2Cl2}(s) \rightleftharpoons \ce{Hg2^2+}(aq)+\ce{2Cl-}(aq) \hspace{20px} K_\ce{sp}=1.1×10^{−18} \nonumber \]
Calculer la solubilité molaire du Hg 2 Cl 2.
Solution
La solubilité molaire du Hg 2 Cl 2 est égale à la concentration en\(\ce{Hg2^2+}\) ions car pour chaque mole de Hg 2 Cl 2 qui se dissout, 1 mol\(\ce{Hg2^2+}\) forme :
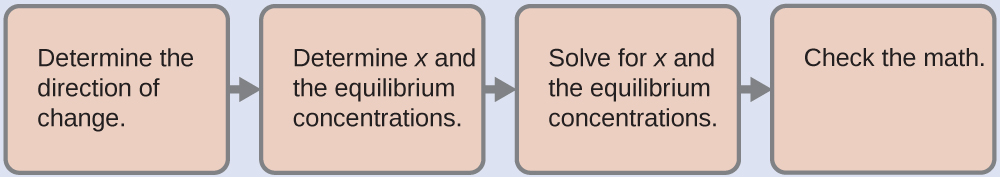
- Déterminez la direction du changement. Avant que tout Hg 2 Cl 2 ne soit dissous, Q est nul et la réaction se déplace vers la droite pour atteindre l'équilibre.
- Déterminez les concentrations x et d'équilibre. Les concentrations et les variations sont indiquées dans le tableau ICE suivant :
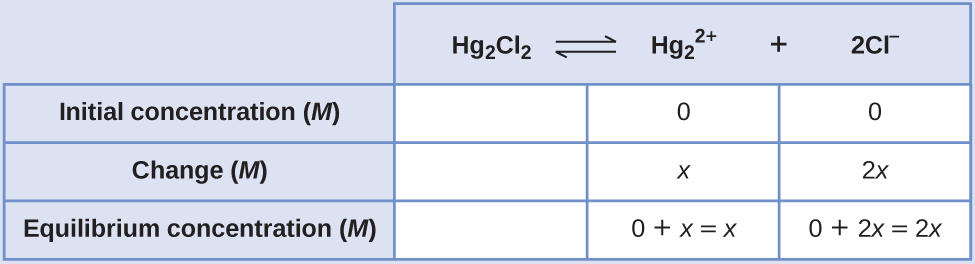
Notez que la variation de la concentration de Cl — (2 x) est deux fois plus importante que la variation de la concentration de\(\ce{Hg2^2+}\) (x) car 2 mol de Cl — se forment pour chaque mole de\(\ce{Hg2^2+}\) cette forme. Le Hg 2 Cl 2 étant un solide pur, il n'apparaît pas dans le calcul.
- Résolvez pour x et les concentrations d'équilibre. Nous substituons les concentrations d'équilibre dans l'expression de K sp et calculons la valeur de x :
\[\begin{align*} K_\ce{sp} &=\ce{[Hg2^2+][Cl- ]^2} \\[4pt] 1.1×10^{−18} &=(x)(2x)^2 \\[4pt] 4x^3 &=1.1×10^{−18} \\[4pt] x &=\sqrt[3]{\left(\dfrac{1.1×10^{-18}}{4}\right)}=6.5×10^{-7}\:M \end{align*} \nonumber \]
Donc, les concentrations sont
\[\begin{align*} \ce{[Hg2^2+]} &=6.5×10^{−7}\:M=6.5×10^{−7}\:M \\[4pt] \ce{[Cl- ]} &=2x=2(6.5×10^{−7})=1.3×10^{−6}\:M \end{align*} \nonumber \]
La solubilité molaire du Hg 2 Cl 2 est égale ou égale à\(\ce{[Hg2^2+]}\) 6,5 × 10 —7 M.
Vérifiez le travail.
À l'équilibre, Q = K sp :
\[Q=\ce{[Hg2^2+][Cl- ]^2}=(6.5×10^{−7})(1.3×10^{−6})^2=1.1×10^{−18} \nonumber \]
Les calculs vérifient.
Déterminer la solubilité molaire du MgF 2 à partir de son produit de solubilité : K sp = 6,4 × 10 —9.
- Réponse
-
1,2 × 10 —3 M
Les valeurs tabulées de K sp peuvent également être comparées aux quotients de réaction calculés à partir de données expérimentales pour déterminer si un solide précipitera lors d'une réaction dans des conditions spécifiques : Q est égal à K sp à l'équilibre ; si Q est inférieur à K sp, le solide se dissoudra jusqu'à ce que Q soit égal à K sp ; si Q est supérieur à K sp, la précipitation se produira à une température donnée jusqu'à ce que Q soit égal à K sp.
Différents types de techniques d'imagerie médicale sont utilisés pour faciliter le diagnostic de maladies de manière non invasive. L'une de ces techniques consiste à ingérer un composé de baryum avant de prendre une radiographie. Une suspension de sulfate de baryum, une poudre calcaire, est ingérée par le patient. Comme le K sp du sulfate de baryum est de 1,1 × 10 —10, très peu de celui-ci se dissout lorsqu'il recouvre la paroi du tractus intestinal du patient. Les zones du tube digestif recouvertes de baryum apparaissent ensuite en blanc sur une radiographie, ce qui permet d'obtenir plus de détails visuels qu'une radiographie traditionnelle (Figure\(\PageIndex{3}\)).
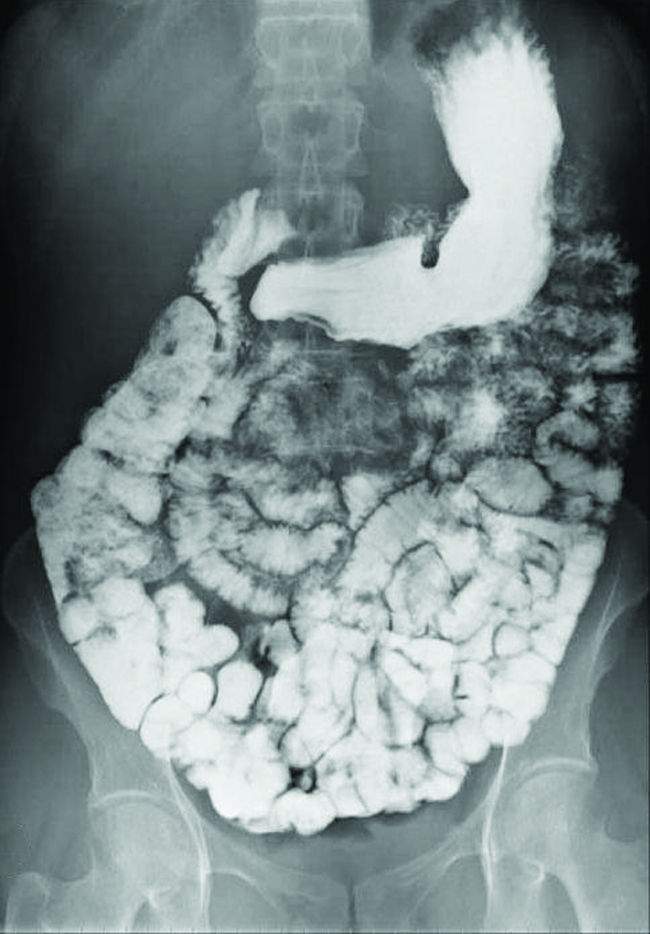
D'autres tests diagnostiques peuvent être effectués à l'aide de sulfate de baryum et de fluoroscopie. Lors de la fluoroscopie, on fait passer une radiographie continue à travers le corps afin que le médecin puisse suivre, sur un écran de télévision ou d'ordinateur, le mouvement du sulfate de baryum lorsqu'il traverse le tube digestif. L'imagerie médicale utilisant du sulfate de baryum peut être utilisée pour diagnostiquer le reflux acide, la maladie de Crohn et les ulcères, en plus d'autres affections.
Prédire les précipitations
L'équation qui décrit l'équilibre entre le carbonate de calcium solide et ses ions solvatés est la suivante :
\[\ce{CaCO3}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{CO3^2-}(aq) \nonumber \]
Nous pouvons établir cet équilibre soit en ajoutant du carbonate de calcium solide à l'eau, soit en mélangeant une solution contenant des ions calcium à une solution contenant des ions carbonate. Si nous ajoutons du carbonate de calcium à l'eau, le solide se dissoudra jusqu'à ce que les concentrations soient telles que la valeur du quotient de réaction\(\ce{(Q=[Ca^2+][CO3^2- ])}\) soit égale au produit de solubilité (K sp = 4,8 × 10 —9). Si nous mélangeons une solution de nitrate de calcium, qui contient des ions Ca 2 +, avec une solution de carbonate de sodium, qui contient\(\ce{CO3^2-}\) des ions, le solide ionique légèrement soluble CaCO 3 précipitera, à condition que les concentrations de Ca 2 + et \(\ce{CO3^2-}\)les ions sont tels que Q est supérieur à K sp pour le mélange. La réaction se déplace vers la gauche et les concentrations des ions sont réduites par la formation du solide jusqu'à ce que la valeur de Q soit égale à K sp. Il en résultera une solution saturée en équilibre avec le solide non dissous. Si les concentrations sont telles que Q est inférieur à K sp, alors la solution n'est pas saturée et aucun précipité ne se formera.
Nous pouvons comparer les valeurs numériques de Q avec K sp pour prédire si des précipitations se produiront, comme le\(\PageIndex{7}\) montre l'exemple. (Remarque : étant donné que toutes les formes de constantes d'équilibre dépendent de la température, nous supposerons un environnement à température ambiante dans ce chapitre à moins qu'une valeur de température différente ne soit explicitement spécifiée.)
La première étape de la préparation du magnésium métallique est la précipitation du Mg (OH) 2 présent dans l'eau de mer par addition de chaux, Ca (OH) 2, une source peu coûteuse d'ions OH — facilement disponible :
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=8.9×10^{−12} \nonumber \]
La concentration de Mg 2 + (aq) dans l'eau de mer est de 0,0537 M. Le Mg (OH) 2 précipitera-t-il lorsqu'on ajoute suffisamment de Ca (OH) 2 pour obtenir un [OH —] de 0,0010 M ?
Solution
Ce problème demande si la réaction :
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
se déplace vers la gauche et forme du Mg (OH) 2 solide lorsque [Mg 2 +] = 0,0537 M et [OH —] = 0,0010 M. La réaction se déplace vers la gauche si Q est supérieur à K sp. Le calcul du quotient de réaction dans ces conditions est présenté ici :
\[\mathrm{Q=[Mg^{2+}][OH^-]^2=(0.0537)(0.0010)^2=5.4×10^{−8}} \nonumber \]
Comme Q est supérieur à K sp (Q = 5,4 × 10 —8 est supérieur à K sp = 8,9 × 10 —12), on peut s'attendre à ce que la réaction se déplace vers la gauche et forme de l'hydroxyde de magnésium solide. Le Mg (OH) 2 (s) se forme jusqu'à ce que les concentrations en ions magnésium et en ions hydroxyde soient suffisamment réduites pour que la valeur de Q soit égale à K sp.
Utilisez les produits de solubilité du tableau E3 pour déterminer si le CaHPO 4 précipitera à partir d'une solution contenant [Ca 2 +] = 0,0001 M et\(\ce{[HPO4^2- ]}\) = 0,001 M.
- Réponse
-
Aucune précipitation de CaHPO 4 ; Q = 1 × 10 —7, ce qui est inférieur à K sp
Le chlorure d'argent précipite-t-il lorsque des volumes égaux d'une solution 2,0 × 10 —4 - M d'AgNO 3 et d'une solution 2,0 × 10 —4 - M de NaCl sont mélangés ?
(Remarque : La solution contient également du Na + et\(\ce{NO3-}\) des ions, mais si l'on se réfère aux règles de solubilité, on peut constater que le nitrate de sodium est très soluble et ne peut pas former de précipité.)
Solution
L'équation de l'équilibre entre le chlorure d'argent solide, l'ion argent et l'ion chlorure est la suivante :
Le produit de solubilité est de 1,8 × 10 —10 (Tableau E3).
L'AgCl précipite si le quotient de réaction calculé à partir des concentrations dans le mélange d'AgNO 3 et de NaCl est supérieur à K sp. Le volume double lorsque nous mélangeons des volumes égaux de solutions d'AgNO 3 et de NaCl, de sorte que chaque concentration est réduite de moitié par rapport à sa valeur initiale. Par conséquent, dès le mélange, [Ag +] et [Cl —] sont tous deux égaux à :
Le quotient de réaction, Q, est momentanément supérieur à K sp pour AgCl, de sorte qu'une solution sursaturée se forme :
Les solutions sursaturées étant instables, AgCl précipite à partir du mélange jusqu'à ce que la solution revienne à l'équilibre, avec Q égal à K sp.
Le KClO 4 précipitera-t-il lorsque 20 ml d'une solution 0,050- M de K + sont ajoutés à 80 ml d'une solution 0,50- M de\(\ce{ClO4-}\) ? (N'oubliez pas de calculer la nouvelle concentration de chaque ion après avoir mélangé les solutions avant de saisir l'expression du quotient de réaction.)
- Réponse
-
Non, Q = 4,0 × 10 —3, ce qui est inférieur à K sp = 1,07 × 10 —2
Dans les deux exemples précédents, nous avons vu que le Mg (OH) 2 ou l'AgCl précipitent lorsque Q est supérieur à K sp. En général, lorsqu'une solution d'un sel soluble de l'ion M m+ est mélangée à une solution d'un sel soluble de l'ion X n—, le solide, M p X q précipite si la valeur de Q pour le mélange de M m+ et X n— est supérieur à K sp pour M p X q. Ainsi, si nous connaissons la concentration de l'un des ions d'un solide ionique légèrement soluble et la valeur du produit de solubilité du solide, nous pouvons calculer la concentration que l'autre ion doit dépasser pour que la précipitation commence. Pour simplifier le calcul, nous supposerons que la précipitation commence lorsque le quotient de réaction devient égal à la constante du produit de solubilité.
Le sang ne coagule pas si les ions calcium sont retirés du plasma. Certains tubes de prélèvement sanguin contiennent des sels de l'ion oxalate\(\ce{C2O4^2-}\), à cette fin (Figure\(\PageIndex{4}\)). À des concentrations suffisamment élevées, les ions calcium et oxalate forment un solide, CaC 2 O 4 •H 2 O (qui contient également de l'eau liée au solide). La concentration de Ca 2 + dans un échantillon de sérum sanguin est de 2,2 × 10 —3 M. Quelle concentration d'\(\ce{C2O4^2-}\)ions doit être établie avant que CaC 2 O 4 •H 2 O ne commence à précipiter ?
Solution
L'expression d'équilibre est la suivante :
\[\ce{CaC2O4}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{C2O4^2-}(aq) \nonumber \]
Pour cette réaction (Tableau E3) :
\[K_\ce{sp}=\ce{[Ca^2+][C2O4^2- ]}=1.96×10^{−8} \nonumber \]
Le CaC 2 O 4 n'apparaît pas dans cette expression car il s'agit d'un solide. L'eau n'apparaît pas car c'est le solvant.
Le CaC 2 O 4 solide ne commence à se former que lorsque Q est égal à K sp. Comme nous connaissons K sp et [Ca 2 +], nous pouvons déterminer la\(\ce{C2O4^2-}\) concentration nécessaire pour produire la première trace de solide :
Une concentration de\(\ce{[C2O4^2- ]}\) = 8,9 × 10 —6 M est nécessaire pour amorcer la précipitation de CaC 2 O 4 dans ces conditions.
Si une solution contient 0,0020 mol de\(\ce{CrO4^2-}\) par litre, quelle concentration d'ion Ag + doit être atteinte en ajoutant de l'AgNO 3 solide avant que l'Ag 2 CrO 4 ne commence à précipiter ? Négligez toute augmentation de volume lors de l'ajout du nitrate d'argent solide.
- Réponse
-
4,5 × 10 —9 M
Il est parfois utile de connaître la concentration d'un ion qui reste en solution après précipitation. Nous pouvons également utiliser le produit de solubilité pour ce calcul : si nous connaissons la valeur de K sp et la concentration d'un ion en solution, nous pouvons calculer la concentration du second ion restant dans la solution. Le calcul est du même type que celui de l'exemple\(\PageIndex{8}\) : calcul de la concentration d'une espèce dans un mélange d'équilibre à partir des concentrations des autres espèces et de la constante d'équilibre. Cependant, les concentrations sont différentes ; nous calculons les concentrations une fois que les précipitations sont complètes, plutôt qu'au début des précipitations.
Les vêtements lavés dans de l'eau dont la concentration en manganèse [Mn 2 + (aq)] dépasse 0,1 mg/L (1,8 × 10 —6 M) peuvent être tachés par le manganèse lors de l'oxydation, mais la quantité de Mn 2 + dans l'eau peut être réduite en ajoutant un base. Si une personne qui fait la lessive souhaite ajouter un tampon pour maintenir le pH suffisamment élevé pour précipiter le manganèse sous forme d'hydroxyde, le Mn (OH) 2, quel est le pH requis pour maintenir [Mn 2 +] égal à 1,8 × 10 —6 M ?
Solution
La dissolution du Mn (OH) 2 est décrite par l'équation suivante :
\[\ce{Mn(OH)2}(s) \rightleftharpoons \ce{Mn^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=2×10^{−13} \nonumber \]
Nous devons calculer la concentration de OH — lorsque la concentration de Mn 2 + est de 1,8 × 10 —6 M. À partir de là, nous calculons le pH. À l'équilibre :
ou
\[ (1.8×10^{−6})\ce{[OH- ]^2}=2×10^{−13} \nonumber \]
donc
Nous calculons maintenant le pH à partir du PoH :
Si la personne qui fait la lessive ajoute une base, telle que le silicate de sodium (Na 4 SiO 4) contenu dans certains détergents, à l'eau de lavage jusqu'à ce que le pH soit élevé à 10,52, l'ion manganèse sera réduit à une concentration de 1,8 × 10 —6 M ; à cette concentration ou moins, l'ion ne tachera pas les vêtements.
La première étape de la préparation du magnésium métallique est la précipitation du Mg (OH) 2 à partir de l'eau de mer par addition de Ca (OH) 2. La concentration de Mg 2 + (aq) dans l'eau de mer est de 5,37 × 10 —2 M. Calculez le pH auquel [Mg 2 +] est abaissé à 1,0 × 10 —5 M par addition de Ca (OH) 2.
- Réponse
-
10,97
En raison de leur sensibilité à la lumière, les mélanges d'halogénures d'argent sont utilisés dans les fibres optiques pour les lasers médicaux, dans les lentilles de lunettes photochromiques (lentilles en verre qui s'assombrissent automatiquement lorsqu'elles sont exposées au soleil) et, avant l'avènement de la photographie numérique, dans les films photographiques. Même si AgCl (K sp = 1,6 × 10 —10), AgBr (K sp = 5,0 × 10 —13) et AgI (K sp = 1,5 × 10 —16) sont tous deux très insolubles, nous ne pouvons pas préparer un mélange solide homogène de ceux-ci en ajoutant de l'Ag + à une solution de Cl —, Br — et I — ; essentiellement, la totalité de l'AgI précipitera avant la formation des autres halogénures solides en raison de sa valeur plus faible pour K sp. Cependant, nous pouvons préparer un mélange homogène de solides en ajoutant lentement une solution de Cl —, Br — et I — à une solution d'Ag +.
Lorsque deux anions forment des composés légèrement solubles avec le même cation, ou lorsque deux cations forment des composés légèrement solubles avec le même anion, le composé le moins soluble (généralement le composé avec le plus petit K sp) précipite généralement en premier lorsque nous ajoutons un agent précipitant à un solution contenant les deux anions (ou les deux cations). Lorsque les valeurs K sp des deux composés diffèrent de deux ordres de grandeur ou plus (par exemple, 10 —2 contre 10 —4), presque tous les composés les moins solubles précipitent avant les composés les plus solubles. Il s'agit d'un exemple de précipitation sélective, dans laquelle un réactif est ajouté à une solution d'ions dissous, provoquant la précipitation de l'un des ions avant les autres.
Le rôle des précipitations dans le traitement des eaux usées
Les équilibres de solubilité sont des outils utiles pour le traitement des eaux usées effectué dans des installations pouvant traiter l'eau municipale de votre ville ou village (Figure\(\PageIndex{5}\)). Plus précisément, les précipitations sélectives sont utilisées pour éliminer les contaminants des eaux usées avant qu'elles ne soient rejetées dans les plans d'eau naturels. Par exemple, les ions phosphate\(\ce{(PO4^2- )}\) sont souvent présents dans l'eau rejetée par les installations de fabrication. Une abondance de phosphate provoque la croissance d'algues en excès, ce qui a un impact sur la quantité d'oxygène disponible pour la vie marine et rend l'eau impropre à la consommation humaine.

Une méthode courante pour éliminer les phosphates de l'eau consiste à ajouter de l'hydroxyde de calcium, connu sous le nom de chaux, Ca (OH) 2. La chaux est convertie en carbonate de calcium, une base solide, dans l'eau. Au fur et à mesure que l'eau devient plus basique, les ions calcium réagissent avec les ions phosphate pour produire de l'hydroxylapatite, le Ca 5 (PO4) 3 (OH), qui précipite hors de la solution :
\[\ce{5Ca^2+ + 3PO4^3- + OH- \rightleftharpoons Ca10(PO4)6⋅(OH)2}(s) \nonumber \]
Le précipité est ensuite éliminé par filtration et l'eau est ramenée à un pH neutre par addition de CO 2 lors d'un processus de recarbonatation. D'autres produits chimiques peuvent également être utilisés pour éliminer les phosphates par précipitation, notamment le chlorure de fer (III) et le sulfate d'aluminium.
Les précipitations sélectives peuvent également être utilisées dans les analyses qualitatives. Dans cette méthode, des réactifs sont ajoutés à un mélange chimique inconnu afin de provoquer une précipitation. Certains réactifs provoquent la précipitation d'ions spécifiques ; par conséquent, l'ajout du réactif peut être utilisé pour déterminer si l'ion est présent dans la solution.
Une solution contient 0,0010 mol de KI et 0,10 mol de KCl par litre. De l'AgNO 3 est ajouté progressivement à cette solution. Qui forme en premier, l'AgI solide ou l'AgCl solide ?
Solution
Les deux équilibres concernés sont les suivants :
Si la solution contenait des concentrations à peu près égales de Cl — et de I —, alors le sel d'argent contenant le plus petit K sp (AgI) précipiterait en premier. Les concentrations ne sont toutefois pas égales, nous devrions donc trouver le [Ag +] auquel AgCl commence à précipiter et le [Ag +] auquel AgI commence à précipiter. Le sel qui se forme au niveau de la couche inférieure [Ag +] précipite en premier.
Pour AgI : AgI précipite lorsque Q est égal à K sp pour AgI (1,5 × 10 —16). Quand [I —] = 0,0010 M :
AgI commence à précipiter lorsque [Ag +] est de 1,5 × 10 —13 M.
Pour AgCl : AgCl précipite lorsque Q est égal à K sp pour AgCl (1,6 × 10 —10). Lorsque [Cl —] = 0,10 M :
AgCl commence à précipiter lorsque [Ag +] est égal à 1,6 × 10 —9 M.
L'AgI commence à précipiter à une concentration inférieure à [Ag +] que l'AgCl, de sorte que l'AgI commence à précipiter en premier.
Si une solution de nitrate d'argent est ajoutée à une solution contenant 0,050 M à la fois en ions Cl — et Br —, à quel moment [Ag +] commencerait la précipitation et quelle serait la formule du précipité ?
- Réponse
-
[Ag +] = 1,0 × 10 —11 M ; AgBr précipite en premier
Effet ionique courant
Comme nous l'avons vu lorsque nous avons discuté des solutions tampons, la concentration en ions hydronium d'une solution aqueuse d'acide acétique diminue lorsque l'acétate de sodium à électrolyte fort, NaCH 3 CO 2, est ajouté. Nous pouvons expliquer cet effet en utilisant le principe de Le Chatelier. L'ajout d'ions acétate provoque un déplacement de l'équilibre vers la gauche, diminuant la concentration de\(\ce{H3O+}\) pour compenser l'augmentation de la concentration en ions acétate. Cela augmente la concentration de CH 3 CO 2 H :
\ [\ ce {CH3CO2H + H2O \ harpons droitegauches H3O+ + CH3CO2-} \)]
Comme l'acétate de sodium et l'acide acétique ont l'ion acétate en commun, l'influence sur l'équilibre est appelée effet ionique commun. L'effet ionique commun peut également avoir un effet direct sur les équilibres de solubilité. Supposons que nous examinions la réaction où l'iodure d'argent est dissous :
\[\ce{AgI}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{I-}(aq) \nonumber \]
Si nous devions ajouter de l'iodure de potassium (KI) à cette solution, nous ajouterions une substance qui partage un ion commun avec l'iodure d'argent. Le principe du Chatelier nous indique que lorsqu'un changement est apporté à un système en équilibre, la réaction change pour contrecarrer ce changement. Dans cet exemple, il y aurait un excès d'ions iodure, de sorte que la réaction se déplacerait vers la gauche, provoquant la précipitation d'une plus grande quantité d'iodure d'argent hors de la solution.
Calculer la solubilité molaire du sulfure de cadmium (CdS) dans une solution de 0,010- M de bromure de cadmium (CdBr 2). La valeur K sp des CD est de 1,0 × 10 —28.
Solution
La première chose à noter est que le sulfure de cadmium est dissous dans une solution contenant des ions cadmium. Nous devons utiliser une table ICE pour mettre en place ce problème et inclure la concentration de CdBr 2 en tant que contributeur aux ions cadmium :
\[\ce{CdS}(s) \rightleftharpoons \ce{Cd^2+}(aq)+\ce{S^2-}(aq) \nonumber \]
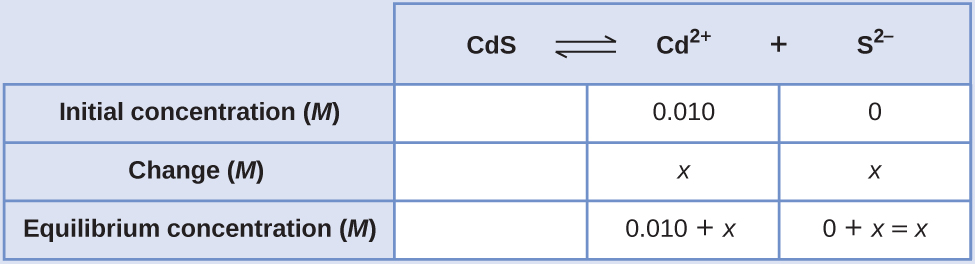
\( (0.010+x)(x)=1.0×10^{−28}\)\(x^2+0.010x−1.0×10^{−28}=0\)
Nous pouvons résoudre cette équation à l'aide de la formule quadratique, mais nous pouvons également faire une hypothèse pour simplifier ce calcul. Comme la valeur de K sp est si faible par rapport à la concentration de cadmium, nous pouvons supposer que le changement entre la concentration initiale et la concentration d'équilibre est négligeable, de sorte que 0,010 + x ~ 0,010. Pour en revenir à notre expression K sp, nous obtiendrions maintenant :
Par conséquent, la solubilité molaire des CdS dans cette solution est de 1,0 × 10 —26 M.
Calculer la solubilité molaire de l'hydroxyde d'aluminium, Al (OH) 3, dans une solution à 0,015- M de nitrate d'aluminium, Al (NO 3) 3. Le K sp de Al (OH) 3 est de 2 × 10 —32.
- Réponse
-
4 × 10 —11
Résumé
La constante d'équilibre d'un équilibre impliquant la précipitation ou la dissolution d'un solide ionique légèrement soluble est appelée produit de solubilité, K sp, du solide. Lorsque nous avons un équilibre hétérogène impliquant le solide légèrement soluble M p X q et ses ions M m+ et X n— :
\[\ce{M}_p\ce{X}_q(s) \rightleftharpoons p\mathrm{M^{m+}}(aq)+q\mathrm{X^{n−}}(aq) \nonumber \]
Nous écrivons l'expression du produit de solubilité comme suit :
\[K_\ce{sp}=\mathrm{[M^{m+}]}^p\mathrm{[X^{n−}]}^q \nonumber \]
Le produit de solubilité d'un électrolyte légèrement soluble peut être calculé à partir de sa solubilité ; inversement, sa solubilité peut être calculée à partir de son K sp, à condition que la seule réaction significative qui se produit lorsque le solide se dissout soit la formation de ses ions. Un électrolyte légèrement soluble commence à précipiter lorsque l'amplitude du quotient de réaction pour la réaction de dissolution dépasse l'amplitude du produit de solubilité. Les précipitations se poursuivent jusqu'à ce que le quotient réactionnel soit égal au produit de solubilité. Un réactif peut être ajouté à une solution d'ions pour permettre à un ion de précipiter sélectivement hors de la solution. L'effet ionique commun peut également jouer un rôle dans les réactions de précipitation. En présence d'un ion en commun avec l'un des ions de la solution, le principe de Le Chatelier s'applique et une plus grande quantité de précipité sort de la solution, ce qui réduit la solubilité molaire.
Lexique
- effet ionique commun
- effet sur l'équilibre lorsqu'une substance ayant un ion en commun avec l'espèce dissoute est ajoutée à la solution ; provoque une diminution de la solubilité d'une espèce ionique ou une diminution de l'ionisation d'un acide ou d'une base faible
- solubilité molaire
- solubilité d'un composé exprimée en unités de moles par litre (mol/L)
- précipitation sélective
- procédé dans lequel les ions sont séparés en utilisant des différences de solubilité avec un réactif précipitant donné
- produit de solubilité (K sp)
- constante d'équilibre pour la dissolution d'un électrolyte légèrement soluble


