14.4 : Hydrolyse des solutions salines
- Page ID
- 194097
- Prédire si une solution saline sera acide, basique ou neutre
- Calculer les concentrations des différentes espèces dans une solution saline
- Décrire le processus qui rend les solutions de certains ions métalliques acides
Comme nous l'avons vu dans la section sur les réactions chimiques, lorsqu'un acide et une base sont mélangés, ils subissent une réaction de neutralisation. Le mot « neutralisation » semble impliquer qu'une solution stoechiométrique équivalente d'un acide et d'une base serait neutre. C'est parfois vrai, mais les sels qui se forment lors de ces réactions peuvent avoir des propriétés acides ou basiques qui leur sont propres, comme nous allons le voir maintenant.
Neutralisation acido-basique
Une solution est neutre lorsqu'elle contient des concentrations égales d'ions hydronium et hydroxyde. Lorsque nous mélangeons des solutions d'un acide et d'une base, une réaction de neutralisation acide-base se produit. Cependant, même si nous mélangeons des quantités stœchiométriquement équivalentes, nous pouvons constater que la solution obtenue n'est pas neutre. Il peut contenir soit un excès d'ions hydronium, soit un excès d'ions hydroxyde, car la nature du sel formé détermine si la solution est acide, neutre ou basique. Les quatre situations suivantes illustrent comment des solutions présentant différentes valeurs de pH peuvent apparaître à la suite d'une réaction de neutralisation utilisant des quantités stœchiométriquement équivalentes :
- Un acide fort et une base forte, tels que HCl (aq) et NaOH (aq) réagiront pour former une solution neutre puisque les partenaires conjugués produits sont d'une force négligeable :\[\ce{HCl}(aq)+\ce{NaOH}(aq)⇌\ce{NaCl}(aq)+\ce{H2O}(l) \nonumber \]
- Un acide fort et une base faible produisent une solution faiblement acide, non pas à cause de l'acide fort impliqué, mais à cause de l'acide conjugué de la base faible.
- Un acide faible et une base forte donnent une solution faiblement basique. Une solution d'un acide faible réagit avec une solution d'une base forte pour former la base conjuguée de l'acide faible et l'acide conjugué de la base forte. L'acide conjugué de la base forte est un acide plus faible que l'eau et n'a aucun effet sur l'acidité de la solution obtenue. Cependant, la base conjuguée de l'acide faible est une base faible et s'ionise légèrement dans l'eau. Cela augmente la quantité d'ion hydroxyde dans la solution produite lors de la réaction et la rend légèrement basique.
- Un acide faible associé à une base faible peut donner une solution acide, basique ou neutre. Il s'agit de la plus complexe des quatre types de réactions. Lorsque l'acide conjugué et la base conjuguée ont des forces inégales, la solution peut être acide ou basique, selon les forces relatives des deux conjugués. Parfois, l'acide faible et la base faible auront la même force, de sorte que leur base conjuguée et leur acide respectifs auront la même force, et la solution sera neutre. Pour prédire si une combinaison particulière sera acide, basique ou neutre, les valeurs K tabulées des conjugués doivent être comparées.
Antiacides pour l'estomac
Notre estomac contient une solution d'environ 0,03 M de HCl, qui nous aide à digérer les aliments que nous mangeons. La sensation de brûlure associée aux brûlures d'estomac est due au fait que l'acide gastrique s'écoule par la valve musculaire située au sommet de l'estomac et pénètre dans les parties inférieures de l'œsophage. La paroi de l'œsophage n'est pas protégée des effets corrosifs de l'acide gastrique de la même manière que la paroi de l'estomac, et les résultats peuvent être très douloureux. Lorsque nous avons des brûlures d'estomac, il est préférable de réduire l'excès d'acide dans l'œsophage en prenant un antiacide. Comme vous l'avez peut-être deviné, les antiacides sont des bases. L'un des antiacides les plus courants est le carbonate de calcium, CaCO 3. La réaction,
\[CaCO_3(s)+2HCl(aq)⇌CaCl_2(aq)+H_2O(l)+CO_2(g) \nonumber \]
non seulement neutralise l'acide gastrique, mais produit également du CO 2 (g), ce qui peut provoquer une éructation satisfaisante.
Le lait de magnésie est une suspension d'hydroxyde de magnésium, une base peu soluble, Mg (OH) 2. Il agit en fonction de la réaction :
\[Mg(OH)_2(s)⇌Mg^{2+}(aq)+2OH^-(aq) \nonumber \]
Les ions hydroxyde générés dans cet équilibre réagissent ensuite avec les ions hydronium de l'acide gastrique, de sorte que :
\[H_3O^+ + OH^- ⇌ 2H_2O(l) \nonumber \]
Cette réaction ne produit pas de dioxyde de carbone, mais les antiacides contenant du magnésium peuvent avoir un effet laxatif. Plusieurs antiacides contiennent de l'hydroxyde d'aluminium, Al (OH) 3, comme ingrédient actif. L'hydroxyde d'aluminium a tendance à provoquer de la constipation, et certains antiacides utilisent de l'hydroxyde d'aluminium en association avec de l'hydroxyde de magnésium pour équilibrer les effets secondaires des deux substances.
Aspects culinaires de la chimie
La cuisine est essentiellement une chimie de synthèse qui peut être consommée sans danger. Il existe de nombreux exemples de chimie acido-basique dans le monde culinaire. Un exemple est l'utilisation de bicarbonate de soude ou de bicarbonate de sodium dans la cuisson. NaHCO 3 est une base. Lorsqu'elle réagit avec un acide tel que le jus de citron, le babeurre ou la crème sure dans une pâte, des bulles de dioxyde de carbone se forment à partir de la décomposition de l'acide carbonique résultant et la pâte « remonte ». La levure chimique est une combinaison de bicarbonate de sodium et d'un ou de plusieurs sels acides qui réagissent lorsque les deux produits chimiques entrent en contact avec l'eau contenue dans la pâte.
Beaucoup de gens aiment mettre du jus de citron ou du vinaigre, tous deux acides, sur du poisson cuit (Figure\(\PageIndex{1}\)). Il s'avère que les poissons contiennent des amines (bases) volatiles dans leur système, qui sont neutralisées par les acides pour produire des sels d'ammonium involatiles. Cela réduit l'odeur du poisson et ajoute également un goût « aigre » que nous semblons apprécier.
Le marinage est une méthode utilisée pour conserver les légumes dans un environnement acide produit naturellement. Le légume, tel qu'un concombre, est placé dans un bocal scellé immergé dans une solution de saumure. La solution de saumure favorise la croissance de bactéries bénéfiques et supprime la croissance de bactéries nocives. Les bactéries bénéfiques se nourrissent des amidons contenus dans le concombre et produisent de l'acide lactique sous forme de déchets au cours d'un processus appelé fermentation. L'acide lactique augmente finalement l'acidité de la saumure à un niveau qui tue toutes les bactéries nocives, qui nécessitent un environnement basique. Sans les bactéries nocives qui consomment les concombres, ils peuvent durer beaucoup plus longtemps que s'ils n'étaient pas protégés. Un sous-produit du processus de marinage modifie la saveur des légumes avec l'acide qui leur donne un goût amer.
Sels de bases faibles et d'acides forts
Lorsque nous neutralisons une base faible par un acide fort, le produit est un sel contenant l'acide conjugué de la base faible. Cet acide conjugué est un acide faible. Par exemple, le chlorure d'ammonium, NH 4 Cl, est un sel formé par la réaction de l'ammoniac basique faible avec l'acide fort HCl :
\[\ce{NH3}(aq)+\ce{HCl}(aq)⟶\ce{NH4Cl}(aq) \nonumber \]
Une solution de ce sel contient des ions ammonium et des ions chlorure. L'ion chlorure n'a aucun effet sur l'acidité de la solution puisque le HCl est un acide fort. Le chlorure est une base très faible qui n'accepte pas de proton dans une mesure mesurable. Cependant, l'ion ammonium, l'acide conjugué de l'ammoniac, réagit avec l'eau et augmente la concentration en ions hydronium :
\[\ce{NH4+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{NH3}(aq) \nonumber \]
L'équation d'équilibre de cette réaction est simplement la constante d'ionisation. K a, pour l'acide\(\ce{NH4+}\) :
\[\ce{\dfrac{[H3O+][NH3]}{[NH4+]}}=K_\ce{a} \nonumber \]
Nous ne trouverons pas de valeur de K a pour l'ion ammonium dans le tableau E1. Cependant, il n'est pas difficile de déterminer K a pour à\(\ce{NH4+}\) partir de la valeur de la constante d'ionisation de l'eau, K w, et K b, la constante d'ionisation de sa base conjuguée, NH 3, en utilisant la relation suivante :
\[K_\ce{w}=K_\ce{a}×K_\ce{b} \nonumber \]
Cette relation vaut pour toute base et son acide conjugué ou pour tout acide et sa base conjuguée.
L'aniline est une amine utilisée pour fabriquer des colorants. Il est isolé sous forme de chlorhydrate d'aniline\(\ce{[C6H5NH3+]Cl}\), un sel préparé par réaction de l'aniline, une base faible, et de l'acide chlorhydrique. Quel est le pH d'une solution de chlorhydrate d'aniline à 0,233 M ?
\[\ce{C6H5NH3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{C6H5NH2}(aq) \nonumber \]
Solution
La nouvelle étape de cet exemple consiste à déterminer K a pour l'\(\ce{C6H5NH3+}\)ion. L'\(\ce{C6H5NH3+}\)ion est l'acide conjugué d'une base faible. La valeur de K a pour cet acide n'est pas répertoriée dans le tableau E1, mais nous pouvons la déterminer à partir de la valeur de K b pour l'aniline, C 6 H 5 NH 2, qui est donnée par 4,6 × 10 −10 −10 :
\[\mathrm{\mathit{K}_a(for\:C_6H_5NH_3^+)×\mathit{K}_b(for\:C_6H_5NH_2)=\mathit{K}_w=1.0×10^{−14}} \nonumber \]
\[\mathrm{\mathit{K}_a(for\:C_6H_5NH_3^+)=\dfrac{\mathit{K}_w}{\mathit{K}_b(for\:C_6H_5NH_2)}=\dfrac{1.0×10^{−14}}{4.6×10^{−10}}=2.3×10^{−5}} \nonumber \]
Nous avons maintenant la constante d'ionisation et la concentration initiale de l'acide faible, les informations nécessaires pour déterminer la concentration d'équilibre de H 3 O + et le pH :
Avec ces étapes, nous trouvons [H 3 O +] = 2,3 × 10 −3 M et pH = 2,64
- Faites les calculs et montrez que la concentration en ions hydronium pour une solution à 0,233- M de\(\ce{C6H5NH3+}\) est de 2,3 × 10 −3 et que le pH est de 2,64.
- Quelle est la concentration en ions hydronium dans une solution à 0,100 M de nitrate d'ammonium, NH 4 NO 3, un sel composé des ions\(\ce{NH4+}\) et\(\ce{NO3-}\). Utilisez les données du tableau E1 pour déterminer K b pour l'ion ammonium. Quel est l'acide le plus fort\(\ce{C6H5NH3+}\) ou\(\ce{NH4+}\) ?
- Répondez à
-
\(K_a\ce{(for\:NH4+)}=5.6×10^{−10}\), [H 3 O +] = 7,5 × 10−6 M
- Réponse b
-
\(\ce{C6H5NH3+}\)est l'acide le plus fort (a) (b).
Sels d'acides faibles et de bases fortes
Lorsque nous neutralisons un acide faible avec une base forte, nous obtenons un sel qui contient la base conjuguée de l'acide faible. Cette base conjuguée est généralement une base faible. Par exemple, l'acétate de sodium, NaCH 3 CO 2, est un sel formé par la réaction de l'acide acétique faible avec l'hydroxyde de sodium à base forte :
\[\ce{CH3CO2H}(aq)+\ce{NaOH}(aq)⟶\ce{NaCH3CO2}(aq)+\ce{H2O}(aq) \nonumber \]
Une solution de ce sel contient des ions sodium et des ions acétate. L'ion sodium n'a aucun effet sur l'acidité de la solution. Cependant, l'ion acétate, la base conjuguée de l'acide acétique, réagit avec l'eau et augmente la concentration en ions hydroxyde :
\[\ce{CH3CO2-}(aq)+\ce{H2O}(l)⇌\ce{CH3CO2H}(aq)+\ce{OH-}(aq) \nonumber \]
L'équation d'équilibre de cette réaction est la constante d'ionisation, K b, pour la base\(\ce{CH3CO2-}\). La valeur de K b peut être calculée à partir de la valeur de la constante d'ionisation de l'eau, K w, et de K a, la constante d'ionisation de l'acide conjugué de l'anion à l'aide de l'équation :
\[_\ce{w}=K_\ce{a}×K_\ce{b} \nonumber \]
Pour l'ion acétate et son acide conjugué, nous avons :
\[\mathrm{\mathit{K}_b(for\:\ce{CH_3CO_2^-})=\dfrac{\mathit{K}_w}{\mathit{K}_a(for\:CH_3CO_2H)}=\dfrac{1.0×10^{−14}}{1.8×10^{−5}}=5.6×10^{−10}} \nonumber \]
Certains manuels ne signalent pas les valeurs de K b. Ils indiquent uniquement les constantes d'ionisation pour les acides. Si nous voulons déterminer une valeur K b à l'aide de l'un de ces manuels, nous devons rechercher la valeur de K a pour l'acide conjugué et la convertir en valeur K b.
Déterminer la concentration d'acide acétique dans une solution avec\(\ce{[CH3CO2- ]}=0.050\:M\) et [OH −] = 2,5 × 10 −6 M à l'équilibre. La réaction est la suivante :
\[\ce{CH3CO2-}(aq)+\ce{H2O}(l)⇌\ce{CH3CO2H}(aq)+\ce{OH-}(aq) \nonumber \]
Solution
On nous donne deux des trois concentrations d'équilibre et on nous demande de trouver la concentration manquante. Si nous pouvons trouver la constante d'équilibre de la réaction, le processus est simple.
L'ion acétate se comporte comme une base dans cette réaction ; les ions hydroxyde sont un produit. Nous déterminons K b comme suit :
\[\mathrm{\mathit{K}_b(for\:\ce{CH_3CO_2^-})=\dfrac{\mathit{K}_w}{\mathit{K}_a(for\:CH_3CO_2H)}=\dfrac{1.0×10^{−14}}{1.8×10^{−5}}=5.6×10^{−10}} \nonumber \]
Trouvez maintenant la concentration manquante :
\[K_\ce{b}=\ce{\dfrac{[CH3CO2H][OH- ]}{[CH3CO2- ]}}=5.6×10^{−10} \nonumber \]
\[=\dfrac{[\ce{CH3CO2H}](2.5×10^{−6})}{(0.050)}=5.6×10^{−10} \nonumber \]
En résolvant cette équation, nous obtenons [CH 3 CO 2 H] = 1,1 × 10 −5 M.
Quel est le pH d'une solution de CN − 0,083- M ? Utilisez 4,9 × 10 −10 comme K a pour HCN. Conseil : Nous devrons probablement convertir le PoH en pH ou trouver [H 3 O +] à l'aide de [OH −] dans les dernières étapes de ce problème.
- Réponse
-
11.16
Équilibre dans une solution d'un sel d'un acide faible et d'une base faible
Dans une solution d'un sel formé par la réaction d'un acide faible et d'une base faible, pour prédire le pH, il faut connaître à la fois le K a de l'acide faible et le K b de la base faible. Si K a > K b, la solution est acide, et si K b > K a, la solution est basique.
Déterminer si les solutions aqueuses des sels suivants sont acides, basiques ou neutres :
- KBr
- NahCo 3
- NH 4 Cl
- Non 2 HP 4
- NH 4 F
Solution
Examinez chacun des ions séparément en fonction de son effet sur le pH de la solution, comme indiqué ci-dessous :
- Le cation K+ et l'anion Br − sont tous deux spectateurs, puisqu'ils sont respectivement le cation d'une base forte (KOH) et l'anion d'un acide fort (HBr). La solution est neutre.
- Le cation Na + est un spectateur et n'affectera pas le pH de la solution ; l'\(\ce{HCO3-}\)anion est amphiprotique. Le K a de\(\ce{HCO3-}\) est de 4,7 × 10 −11, donc le K b de sa base conjuguée l'est\(\dfrac{1.0×10^{−14}}{4.7×10^{−11}}=2.1×10^{−4}\). Puisque K b >> K a, la solution est basique.
- L'\(\ce{NH4+}\)ion est acide et l'ion Cl − est un spectateur. La solution sera acide.
- L'ion Na + est un spectateur et n'affectera pas le pH de la solution, alors que l'\(\ce{HPO4^{2-}}\)ion est amphiprotique. Le K a de\(\ce{HPO_4^{2-}}\) est de 4,2 × 10 -13 et son K b est\(\dfrac{1.0×10^{−14}}{4.2×10^{−13}}=2.4×10^{−2}\). Parce que K b >> K a, la solution est basique.
- L'\(\ce{NH4+}\)ion est répertorié comme étant acide et l'ion F − est répertorié comme base, nous devons donc comparer directement le K a et le K b des deux ions. K a de\(\ce{NH4+}\) est de 5,6 × 10 −10, ce qui semble très faible, alors que le K b de F − est de 1,4 × 10 −11, donc la solution est acide, puisque K a > K b.
Déterminer si les solutions aqueuses des sels suivants sont acides, basiques ou neutres :
- K 2 CO 3
- CaCl 2
- KH 2 OU 4
- (NH 42) CO 3
- Laboratoire 3
- Répondez à
-
de base
- Réponse b
-
neutre
- Réponse c
-
acide
- Réponse d
-
de base
- Réponse e
-
acide
L'ionisation des ions métalliques hydratés
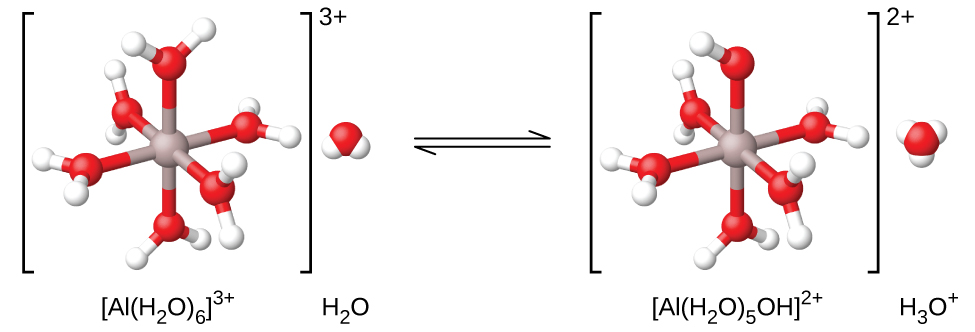
Si nous mesurons le pH des solutions de divers ions métalliques, nous constaterons que ces ions agissent comme des acides faibles lorsqu'ils sont en solution. L'ion aluminium en est un exemple. Lorsque le nitrate d'aluminium se dissout dans l'eau, l'ion aluminium réagit avec l'eau pour donner un ion aluminium hydraté\(\ce{Al(H2O)6^3+}\), dissous dans de l'eau en vrac. Cela signifie que l'ion aluminium a les interactions les plus fortes avec les six molécules d'eau les plus proches (ce que l'on appelle la première couche de solvatation), même s'il interagit également avec les autres molécules d'eau entourant cet\(\ce{Al(H2O)6^3+}\) amas :
\[\ce{Al(NO3)3}(s)+\ce{6H2O}(l)⟶\ce{Al(H2O)6^3+}(aq)+\ce{3NO3-}(aq) \nonumber \]
Nous voyons souvent la formule de cet ion simplement comme « Al 3 + (aq) », sans mentionner explicitement les six molécules d'eau les plus proches de l'ion aluminium et sans simplement décrire l'ion comme étant solvaté dans l'eau (hydraté). Ceci est similaire à la simplification de la formule de l'ion hydronium, H 3 O + à H +. Cependant, dans ce cas, l'ion aluminium hydraté est un acide faible (Figure\(\PageIndex{2}\)) et donne un proton à une molécule d'eau. Ainsi, l'hydratation devient importante et nous pouvons utiliser des formules qui montrent l'étendue de l'hydratation :
\[\ce{Al(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)5(OH)^2+}(aq) \hspace{20px} K_\ce{a}=1.4×10^{−5} \nonumber \]
Comme les autres acides polyprotiques, l'ion aluminium hydraté s'ionise par étapes, comme le montre :
\[\ce{Al(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)5(OH)^2+}(aq) \nonumber \]
\[\ce{Al(H2O)5(OH)^2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)4(OH)2+}(aq) \nonumber \]
\[\ce{Al(H2O)4(OH)2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)3(OH)3}(aq) \nonumber \]
Notez que certaines de ces espèces d'aluminium présentent un comportement amphiprotique, puisqu'elles agissent comme des acides lorsqu'elles apparaissent sur le côté gauche des expressions d'équilibre et comme des bases lorsqu'elles apparaissent sur le côté droit.
Cependant, l'ionisation d'un cation portant plus d'une charge n'est généralement pas importante au-delà de la première étape. D'autres exemples de la première étape de l'ionisation des ions métalliques hydratés sont les suivants :
\[\ce{Fe(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Fe(H2O)5(OH)^2+}(aq) \hspace{20px} K_\ce{a}=2.74 \nonumber \]
\[\ce{Cu(H2O)6^2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Cu(H2O)5(OH)+}(aq) \hspace{20px} K_\ce{a}=~6.3 \nonumber \]
\[\ce{Zn(H2O)4^2+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Zn(H2O)3(OH)+}(aq) \hspace{20px} K_\ce{a}=9.6 \nonumber \]
Calculez le pH d'une solution de chlorure d'aluminium à 0,10- M, qui se dissout complètement pour donner l'ion aluminium hydraté\(\ce{[Al(H2O)6]^3+}\) en solution.
Solution
Malgré l'aspect inhabituel de l'acide, il s'agit d'un problème typique d'ionisation acide.
- Déterminez la direction du changement. Les équations de la réaction et de K a sont les suivantes :
\(\ce{Al(H2O)6^3+}(aq)+\ce{H2O}(l)⇌\ce{H3O+}(aq)+\ce{Al(H2O)5(OH)^2+}(aq) \hspace{20px} K_\ce{a}=1.4×10^{−5}\)
La réaction se déplace vers la droite pour atteindre l'équilibre. - Déterminez les concentrations x et d'équilibre. Utilisez le tableau
:

Résolvez pour x et les concentrations d'équilibre. En substituant les expressions des concentrations d'équilibre dans l'équation de la constante d'ionisation, on obtient :
- \[K_\ce{a}=\ce{\dfrac{[H3O+][Al(H2O)5(OH)^2+]}{[Al(H2O)6^3+]}} \nonumber \]
\(=\dfrac{(x)(x)}{0.10−x}=1.4 \times 10^{−5}\)
Solving this equation gives:
\[x=1.2×10^{−3}\:M \nonumber \]
From this we find:
\[\ce{[H3O+]}=0+x=1.2×10^{−3}\:M \nonumber \]
\[\mathrm{pH=−log[H_3O^+]=2.92(an\: acidic\: solution)} \nonumber \]
Check the work. The arithmetic checks; when 1.2 × 10−3 M is substituted for x, the result = Ka.
What is \(\ce{[Al(H2O)5(OH)^2+]}\) in a 0.15-M solution of Al(NO3)3 that contains enough of the strong acid HNO3 to bring [H3O+] to 0.10 M?
- Answer
-
2.1 × 10−5 M
The constants for the different stages of ionization are not known for many metal ions, so we cannot calculate the extent of their ionization. However, practically all hydrated metal ions other than those of the alkali metals ionize to give acidic solutions. Ionization increases as the charge of the metal ion increases or as the size of the metal ion decreases.
Summary
The characteristic properties of aqueous solutions of Brønsted-Lowry acids are due to the presence of hydronium ions; those of aqueous solutions of Brønsted-Lowry bases are due to the presence of hydroxide ions. The neutralization that occurs when aqueous solutions of acids and bases are combined results from the reaction of the hydronium and hydroxide ions to form water. Some salts formed in neutralization reactions may make the product solutions slightly acidic or slightly basic. Solutions that contain salts or hydrated metal ions have a pH that is determined by the extent of the hydrolysis of the ions in the solution. The pH of the solutions may be calculated using familiar equilibrium techniques, or it may be qualitatively determined to be acidic, basic, or neutral depending on the relative Ka and Kb of the ions involved.


