12.2 : Facteurs influant sur les taux de
- Page ID
- 193964
- Décrire les effets de la nature chimique, de l'état physique, de la température, de la concentration et de la catalyse sur les vitesses de
Les vitesses auxquelles les réactifs sont consommés et les produits se forment au cours des réactions chimiques varient considérablement. Nous pouvons identifier cinq facteurs qui influent sur la vitesse des réactions chimiques : la nature chimique des substances réactives, l'état de subdivision (un gros morceau par rapport à de nombreuses petites particules) des réactifs, la température des réactifs, la concentration des réactifs et la présence d'un catalyseur.
La nature chimique des substances réactives
La vitesse d'une réaction dépend de la nature des substances participantes. Les réactions qui semblent similaires peuvent avoir des taux différents dans les mêmes conditions, selon l'identité des réactifs. Par exemple, lorsque de petits morceaux de fer et de sodium sont exposés à l'air, le sodium réagit complètement avec l'air pendant la nuit, alors que le fer est à peine affecté. Les métaux actifs, le calcium et le sodium, réagissent tous deux avec l'eau pour former de l'hydrogène gazeux et une base. Pourtant, le calcium réagit à une vitesse modérée, alors que le sodium réagit si rapidement que la réaction est presque explosive.
L'état de la subdivision des réactifs
À l'exception des substances à l'état gazeux ou en solution, les réactions se produisent à la limite, ou à l'interface, entre deux phases. La vitesse d'une réaction entre deux phases dépend donc dans une large mesure du contact de surface entre elles. Un solide finement divisé possède une plus grande surface disponible pour la réaction qu'un seul gros morceau de la même substance. Ainsi, un liquide réagira plus rapidement avec un solide finement divisé qu'avec un gros morceau du même solide. Par exemple, de gros morceaux de fer réagissent lentement avec les acides ; le fer finement divisé réagit beaucoup plus rapidement (Figure\(\PageIndex{1}\)). Les gros morceaux de bois couvent, les plus petits brûlent rapidement et la sciure brûle de manière explosive.

Vidéo\(\PageIndex{1}\) : La réaction du césium avec l'eau au ralenti et une discussion sur la façon dont l'état des réactifs et la taille des particules affectent les vitesses de réaction.
Température des réactifs
Les réactions chimiques se produisent généralement plus rapidement à des températures plus élevées. Les aliments peuvent se gâter rapidement lorsqu'ils sont laissés sur le comptoir de la cuisine. Cependant, la température plus basse à l'intérieur d'un réfrigérateur ralentit ce processus, de sorte que les mêmes aliments restent frais pendant des jours. Nous utilisons un brûleur ou une plaque chauffante en laboratoire pour augmenter la vitesse des réactions qui se déroulent lentement à des températures ordinaires. Dans de nombreux cas, une augmentation de la température de seulement 10 °C doublera approximativement la vitesse d'une réaction dans un système homogène.
Concentrations des réactifs
La vitesse de nombreuses réactions dépend des concentrations des réactifs. Les taux augmentent généralement lorsque la concentration d'un ou de plusieurs réactifs augmente. Par exemple, le carbonate de calcium (\(\mathrm{CaCO_3}\)) se détériore à la suite de sa réaction avec le dioxyde de soufre, un polluant. La vitesse de cette réaction dépend de la quantité de dioxyde de soufre dans l'air (Figure\(\PageIndex{2}\)). En tant qu'oxyde acide, le dioxyde de soufre se combine à la vapeur d'eau présente dans l'air pour produire de l'acide sulfureux dans la réaction suivante :
\[\ce{SO}_{2(g)}+\ce{H_2O}_{(g)}⟶\ce{H_2SO}_{3(aq)} \label{12.3.1} \]
Le carbonate de calcium réagit avec l'acide sulfureux comme suit :
\[\ce{CaCO}_{3(s)}+\ce{H_2SO}_{3(aq)}⟶\ce{CaSO}_{3(aq)}+\ce{CO}_{2(g)}+\ce{H_2O}_{(l)} \label{12.3.2} \]
Dans une atmosphère polluée où la concentration de dioxyde de soufre est élevée, le carbonate de calcium se détériore plus rapidement que dans un air moins pollué. De même, le phosphore brûle beaucoup plus rapidement dans une atmosphère d'oxygène pur que dans l'air, qui ne contient qu'environ 20 % d'oxygène.

Vidéo\(\PageIndex{2}\) : Le phosphore brûle rapidement dans l'air, mais il brûle encore plus rapidement si la concentration d'oxygène dans l'air est plus élevée.
La présence d'un catalyseur
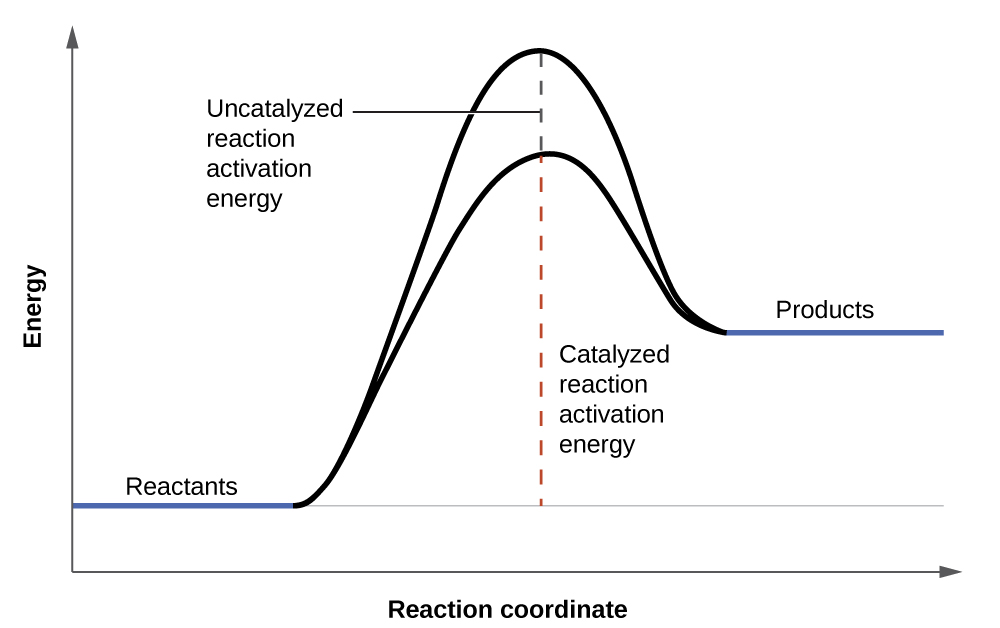
Les solutions de peroxyde d'hydrogène moussent lorsqu'elles sont versées sur une plaie ouverte parce que les substances présentes dans les tissus exposés agissent comme des catalyseurs, augmentant ainsi le taux de décomposition du peroxyde d'hydrogène. Cependant, en l'absence de ces catalyseurs (par exemple, dans le flacon de l'armoire à pharmacie), la décomposition complète peut prendre des mois. Un catalyseur est une substance qui augmente la vitesse d'une réaction chimique en diminuant l'énergie d'activation sans être elle-même consommée par la réaction. L'énergie d'activation est la quantité minimale d'énergie requise pour qu'une réaction chimique se déroule vers l'avant. Un catalyseur augmente la vitesse de réaction en fournissant une voie ou un mécanisme alternatif à suivre par la réaction (Figure\(\PageIndex{3}\)). La catalyse sera abordée plus en détail plus loin dans ce chapitre en ce qui concerne les mécanismes des réactions.
Les réactions chimiques se produisent lorsque des molécules entrent en collision les unes avec les autres et subissent une transformation chimique. Avant de réaliser physiquement une réaction en laboratoire, les scientifiques peuvent utiliser des simulations de modélisation moléculaire pour prédire comment les paramètres discutés précédemment influenceront la vitesse d'une réaction. Utilisez l'interface interactive PhET Reactions & Rates pour découvrir comment la température, la concentration et la nature des réactifs influent sur les taux de réaction.
Résumé
La vitesse d'une réaction chimique est influencée par plusieurs paramètres. Les réactions impliquant deux phases se déroulent plus rapidement lorsqu'il y a une plus grande surface de contact. Si la température ou la concentration du réactif augmente, la vitesse d'une réaction donnée augmente généralement également. Un catalyseur peut augmenter la vitesse d'une réaction en fournissant une voie alternative qui entraîne une diminution de l'énergie d'activation de la réaction.
Lexique
- catalyseur
- substance qui augmente la vitesse d'une réaction sans être elle-même consommée par la réaction


