10.E : Liquides et solides (exercices)
- Page ID
- 193923
10.1 : Forces intermoléculaires
Q10.1.1
En termes de propriétés générales, en quoi les liquides et les solides diffèrent-ils ? En quoi sont-ils similaires ?
ARTICLE 10.1.1
Les liquides et les solides sont similaires en ce sens qu'ils sont composés d'atomes, d'ions ou de molécules. Ils sont incompressibles et ont des densités similaires qui sont toutes deux beaucoup plus grandes que celles des gaz. Ils se distinguent par le fait que les liquides n'ont pas de forme fixe et que les solides sont rigides.
Q10.1.2
En termes de théorie moléculaire cinétique, en quoi les liquides sont-ils similaires aux solides ? En quoi les liquides sont-ils différents des solides ?
Q10.1.3
En termes de théorie moléculaire cinétique, en quoi les liquides sont-ils similaires aux gaz ? En quoi les liquides sont-ils différents des gaz ?
ARTICLE 10.1.3
Ils sont similaires en ce sens que les atomes ou les molécules sont libres de se déplacer d'une position à une autre. Elles se distinguent par le fait que les particules d'un liquide sont confinées à la forme du récipient dans lequel elles sont placées. En revanche, un gaz se dilate sans limite pour remplir l'espace dans lequel il est placé.
Q10.1.4
Expliquez pourquoi les liquides prennent la forme de n'importe quel contenant dans lequel ils sont versés, alors que les solides sont rigides et conservent leur forme.
Q10.1.5
Quelles sont les preuves que tous les atomes et molécules neutres exercent des forces d'attraction les uns sur les autres ?
ARTICLE 10.1.5
Tous les atomes et molécules se condenseront en un liquide ou un solide dans lequel les forces d'attraction dépassent l'énergie cinétique des molécules, à une température suffisamment basse.
Q10.1.6
Ouvrez la simulation des états de la matière PhET pour répondre aux questions suivantes :
- Sélectionnez l'onglet Solide, Liquide, Gaz. Explorez en sélectionnant différentes substances, en chauffant et en refroidissant les systèmes et en modifiant l'état. Quelles similitudes remarquez-vous entre les quatre substances pour chaque phase (solide, liquide, gazeuse) ? Quelles différences remarquez-vous ?
- Pour chaque substance, sélectionnez chacun des états et enregistrez les températures données. Comment les températures données pour chaque état sont-elles corrélées à la force de leurs attractions intermoléculaires ? Expliquez.
- Sélectionnez l'onglet Potentiel d'interaction et utilisez les atomes de néon par défaut. Déplacez l'atome de Ne vers la droite et observez comment l'énergie potentielle change. Sélectionnez le bouton Force totale et déplacez l'atome Ne comme précédemment. Quand la force totale exercée sur chaque atome est-elle suffisamment attirante et suffisamment importante pour être importante ? Sélectionnez ensuite le bouton Component Forces et déplacez l'atome Ne. Quand les forces d'attraction (Van der Waals) et de répulsion (superposition d'électrons) s'équilibrent-elles ? Quel est le lien entre cela et le graphe de l'énergie potentielle par rapport à la distance entre les atomes ? Expliquez.
Q10.1.7
Définissez les éléments suivants et donnez un exemple de chacun d'entre eux :
- force de dispersion
- attraction dipole-dipolaire
- liaison hydrogène
10.1.7
- Les forces de dispersion se produisent lorsqu'un atome développe un moment dipolaire temporaire lorsque ses électrons sont distribués de manière asymétrique autour du noyau. Cette structure est plus présente dans les gros atomes tels que l'argon ou le radon. Un deuxième atome peut alors être déformé par l'apparition du dipôle dans le premier atome. Les électrons du deuxième atome sont attirés vers l'extrémité positive du premier atome, ce qui crée un dipôle dans le deuxième atome. Il en résulte des dipôles temporaires qui fluctuent rapidement et qui s'attirent les uns les autres (exemple : Ar).
- Une attraction dipole-dipôle est une force qui résulte de l'attraction électrostatique de l'extrémité positive d'une molécule polaire pour l'extrémité négative d'une autre molécule polaire (exemple : les molécules ICI s'attirent entre elles par interaction dipôle-dipôle).
- Les liaisons hydrogène se forment chaque fois qu'un atome d'hydrogène est lié à l'un des atomes les plus électronégatifs, tel qu'un atome de fluor, d'oxygène, d'azote ou de chlore. L'attraction électrostatique entre l'atome d'hydrogène partiellement positif d'une molécule et l'atome partiellement négatif d'une autre molécule donne lieu à une forte interaction dipôle-dipôle appelée liaison hydrogène (exemple :\(\mathrm{HF⋯HF}\)).
Q10.1.8
Les types de forces intermoléculaires dans une substance sont identiques, qu'il s'agisse d'un solide, d'un liquide ou d'un gaz. Pourquoi alors une substance change-t-elle de phase, passant d'un gaz à un liquide ou à un solide ?
Q10.1.9
Pourquoi les points d'ébullition des gaz rares augmentent-ils dans l'ordre He < Ne < Ar < Kr < Xe ?
10.1.9
Les forces de Londres augmentent généralement à mesure que le nombre d'électrons augmente.
Q10.1.10
Le néon et le HF ont à peu près les mêmes masses moléculaires.
- Expliquez pourquoi les points d'ébullition du néon et de l'HF diffèrent.
- Comparez la variation des points d'ébullition de Ne, Ar, Kr et Xe avec la variation des points d'ébullition de HF, HCl, HBr et HI, et expliquez la différence entre les variations lorsque la masse atomique ou moléculaire augmente.
Q10.1.11
Disposez chacun des ensembles de composés suivants dans l'ordre d'augmentation de la température du point d'ébullition :
- HCl, H 2 O, SiH 4
- F 2, Cl 2, Br 2
- CH 4, C 2 H 6, C 3 H 8
- O 2, NON, N 2
10.1.11
(a) SiH 4 < HCl < H 2 O ; (b) F 2 < Cl 2 < Br 2 ; (c) CH 4 < C 2 H 6 < C 3 H 8 ; (d) N 2 < O 2 < NO
Q10.1.12
La masse moléculaire du butanol, C 4 H 9 OH, est de 74,14 ; celle de l'éthylène glycol, CH 2 (OH) CH 2 OH, est de 62,08, mais leurs points d'ébullition sont de 117,2 °C et 174 °C, respectivement. Expliquez la raison de la différence.
Q10.1.13
Sur la base des attractions intermoléculaires, expliquez les différences entre les points d'ébullition du n-butane (−1 °C) et du chloroéthane (12 °C), qui ont des masses molaires similaires.
10.1.13
Seules des interactions dipole-dipôle relativement faibles issues des liaisons C-H sont disponibles pour maintenir le n-butane à l'état liquide. Le chloroéthane présente toutefois des interactions dipolaires assez importantes en raison de la liaison Cl-C ; l'interaction est donc plus forte, ce qui entraîne un point d'ébullition plus élevé.
Q10.1.14
Sur la base des moments dipolaires et/ou de la liaison hydrogène, expliquez de manière qualitative les différences entre les points d'ébullition de l'acétone (56,2 °C) et du 1-propanol (97,4 °C), qui ont des masses molaires similaires.
Q10.1.15
Le point de fusion de H 2 O (s) est de 0 °C. Pensez-vous que le point de fusion de H 2 S (s) soit de −85 °C, 0 °C ou 185 °C ? Expliquez votre réponse.
10.1.15
−85 °C. L'eau possède des liaisons hydrogène plus fortes, de sorte qu'elle fond à une température plus élevée.
Q10.1.16
Le silane (SiH 4), la phosphine (PH 3) et le sulfure d'hydrogène (H 2 S) fondent à −185 °C, −133 °C et −85 °C, respectivement. Qu'est-ce que cela suggère sur le caractère polaire et les attraits intermoléculaires des trois composés ?
Q10.1.17
Expliquez pourquoi une liaison hydrogène entre deux molécules d'eau est plus faible qu'une liaison hydrogène entre deux molécules de fluorure d'hydrogène.
10.1.17
La liaison hydrogène entre deux molécules de fluorure d'hydrogène est plus forte que celle entre deux molécules d'eau parce que l'électronégativité de F est supérieure à celle de O. Par conséquent, la charge négative partielle sur F est supérieure à celle sur O. La liaison hydrogène entre le H partiellement positif et le plus gros F partiellement négatif sera plus fort que celui formé entre H et O.
Q10.1.18
Dans certaines conditions, les molécules d'acide acétique, le CH 3 COOH, forment des « dimères », des paires de molécules d'acide acétique maintenues ensemble par de fortes attractions intermoléculaires :

Dessinez un dimère d'acide acétique, en montrant comment deux molécules de CH 3 COOH sont maintenues ensemble et en indiquant le type d'IMF responsable.
Q10.1.19
Les protéines sont des chaînes d'acides aminés qui peuvent se former selon divers arrangements, dont une hélice. Quel type d'IMF est chargé de maintenir le brin protéique dans cette forme ? Sur l'image de la protéine, montrez les emplacements des IMF qui maintiennent la protéine ensemble :

10.1.19
La liaison H est le principal IMF qui maintient les brins d'ADN ensemble. La liaison en H se situe entre\(\mathrm{N−H}\) and \(\mathrm{C=O}\).
Q10.1.20
The density of liquid NH3 is 0.64 g/mL; the density of gaseous NH3 at STP is 0.0007 g/mL. Explain the difference between the densities of these two phases.
Q10.1.21
Identify the intermolecular forces present in the following solids:
- CH3CH2OH
- CH3CH2CH3
- CH3CH2Cl
S10.1.21
(a) hydrogen bonding and dispersion forces; (b) dispersion forces; (c) dipole-dipole attraction and dispersion forces
10.2: Properties of Liquids
Q10.2.1
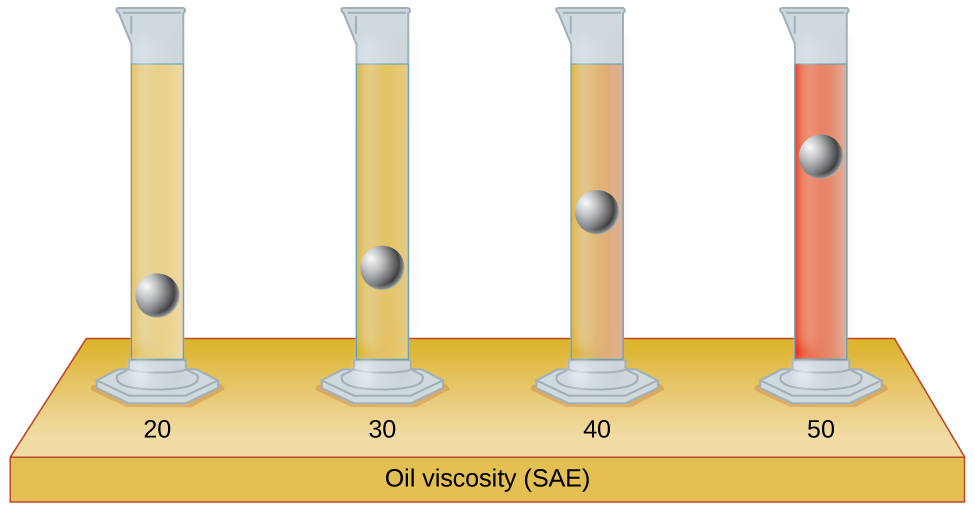
The test tubes shown here contain equal amounts of the specified motor oils. Identical metal spheres were dropped at the same time into each of the tubes, and a brief moment later, the spheres had fallen to the heights indicated in the illustration. Rank the motor oils in order of increasing viscosity, and explain your reasoning:
Q10.2.2
Bien que l'acier soit plus dense que l'eau, il est possible de faire flotter une aiguille en acier ou un trombone placé soigneusement dans le sens de la longueur à la surface de l'eau plate. Expliquez au niveau moléculaire comment cela est possible :

(crédit : Cory Zanker)
ARTICLE 10.2.2
Les molécules d'eau possèdent de fortes forces intermoléculaires de liaison hydrogène. Les molécules d'eau sont donc fortement attirées les unes vers les autres et présentent une tension superficielle relativement importante, formant une sorte de « peau » à sa surface. Cette peau peut supporter un insecte ou un trombone si elle est placée doucement sur l'eau.
Q10.2.3
Les valeurs de tension superficielle et de viscosité pour l'éther diéthylique, l'acétone, l'éthanol et l'éthylène glycol sont présentées ici.
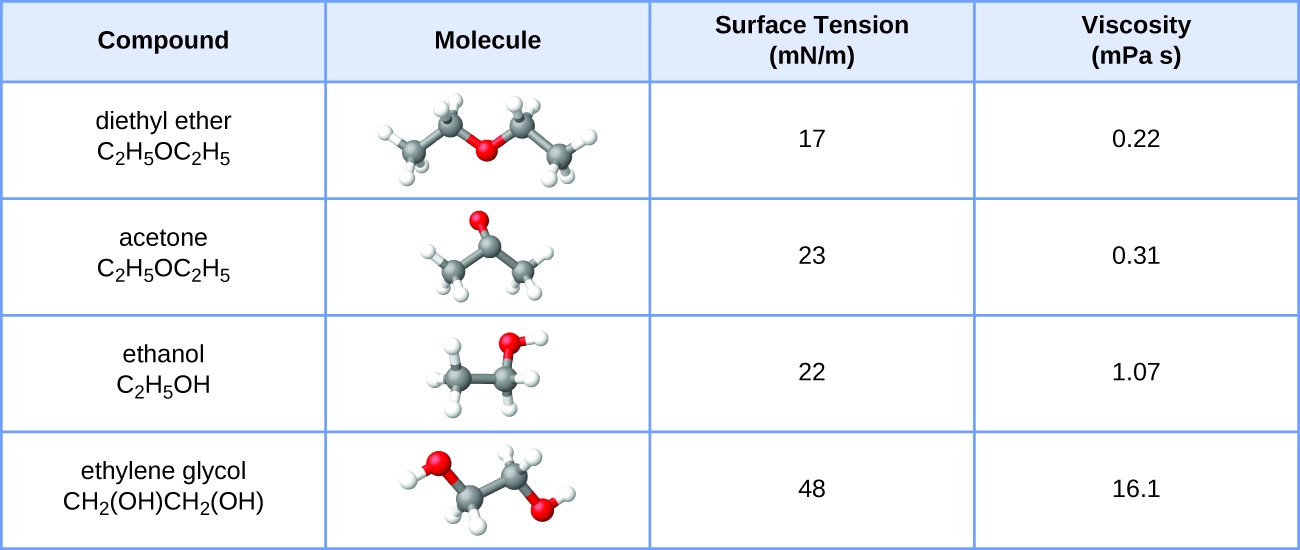
- Expliquez leurs différences de viscosité en termes de taille et de forme de leurs molécules et de leurs IMF.
- Expliquez leurs différences de tension superficielle en termes de taille et de forme de leurs molécules et de leurs IMF :
Q10.2.4
Vous avez peut-être entendu quelqu'un utiliser la figure de style « plus lentement que la mélasse en hiver » pour décrire un processus qui se produit lentement. Expliquez pourquoi il s'agit d'un langage approprié, en utilisant les concepts de taille et de forme moléculaires, d'interactions moléculaires et de l'effet des changements de température.
ARTICLE 10.2.4
La température a un effet sur les forces intermoléculaires : plus la température est élevée, plus les énergies cinétiques des molécules sont élevées et plus leurs forces intermoléculaires sont surmontées, de sorte que plus le liquide est fluide (moins visqueux) ; plus la température est basse, plus la valeur intermoléculaire est faible les forces sont surmontées, et donc moins le liquide est visqueux.
Q10.2.5
Il est souvent recommandé de laisser tourner le moteur de votre voiture au ralenti pour se réchauffer avant de prendre la route, en particulier lors des froides journées d'hiver. Bien que les avantages d'un fonctionnement prolongé au ralenti soient douteux, il est certainement vrai qu'un moteur chaud est plus économe en carburant qu'un moteur froid. Explique-en la raison.
Q10.2.6
La tension superficielle et la viscosité de l'eau à différentes températures sont indiquées dans ce tableau.
| Eau | Tension superficielle (mN/m) | Viscosité (MPa s) |
|---|---|---|
| 0 °C | 75,6 | 1,79 |
| 20 °C | 72,8 | 1,00 |
| 60 °C | 6,2 | 0,47 |
| 100 °C | 58,9 | 0,28 |
- À mesure que la température augmente, qu'advient-il de la tension superficielle de l'eau ? Expliquez pourquoi cela se produit, en termes d'interactions moléculaires et d'effet du changement de température.
- À mesure que la température augmente, qu'advient-il de la viscosité de l'eau ? Expliquez pourquoi cela se produit, en termes d'interactions moléculaires et d'effet du changement de température.
ARTICLE 10.2.6
(a) À mesure que l'eau atteint des températures plus élevées, l'énergie cinétique accrue de ses molécules est plus efficace pour surmonter la liaison hydrogène, et sa tension superficielle diminue donc. La tension superficielle et les forces intermoléculaires sont directement liées. (b) La même tendance de la viscosité est observée que celle de la tension superficielle, et pour la même raison.
Q10.2.7
À 25 °C, à quelle hauteur l'eau va-t-elle monter dans un tube capillaire en verre d'un diamètre intérieur de 0,63 mm ? Reportez-vous à l'exemple pour les informations requises.
Q10.2.8
L'eau monte dans un tube capillaire en verre jusqu'à une hauteur de 17 cm. Quel est le diamètre du tube capillaire ?
ARTICLE 10.2.8
9,5 × 10 −5 m
10.3 : Transitions de phase
Q10.3.1
De la chaleur est ajoutée à l'eau bouillante. Expliquez pourquoi la température de l'eau bouillante ne change pas. Qu'est-ce qui change ?
Q10.3.2
De la chaleur est ajoutée à la glace à 0 °C. Expliquez pourquoi la température de la glace ne change pas. Qu'est-ce qui change ?
10.3.2
La chaleur est absorbée par la glace, fournissant l'énergie nécessaire pour surmonter partiellement les forces d'attraction intermoléculaires dans le solide et provoquant une transition de phase vers l'eau liquide. La solution reste à 0 °C jusqu'à ce que toute la glace soit fondue. Seule la quantité d'eau présente sous forme de glace change jusqu'à ce que la glace disparaisse. Ensuite, la température de l'eau peut augmenter.
Q10.3.3
Quelle caractéristique caractérise l'équilibre dynamique entre un liquide et sa vapeur dans un récipient fermé ?
Q10.3.4
Identifiez deux observations courantes indiquant que certains liquides ont une pression de vapeur suffisante pour s'évaporer de manière visible.
10.3.4
Nous pouvons voir la quantité de liquide dans un récipient ouvert diminuer et nous pouvons sentir la vapeur de certains liquides.
Q10.3.5
Identifiez deux observations courantes indiquant que la pression de vapeur de certains solides, tels que la glace carbonique et les boules à mites, est suffisante pour se sublimer.
Q10.3.6
Quelle est la relation entre les forces intermoléculaires d'un liquide et sa pression de vapeur ?
10.3.7
La pression de vapeur d'un liquide diminue à mesure que la force de ses forces intermoléculaires augmente.
Q10.3.7
Quelle est la relation entre les forces intermoléculaires d'un solide et sa température de fusion ?
Q10.3.8
Pourquoi l'essence renversée s'évapore-t-elle plus rapidement par temps chaud que par temps froid ?
10.3.8
À mesure que la température augmente, l'énergie cinétique moyenne des molécules d'essence augmente, de sorte qu'une plus grande fraction des molécules possède suffisamment d'énergie pour s'échapper du liquide qu'à des températures plus basses.
Q10.3.9
Le tétrachlorure de carbone, CCl 4, était autrefois utilisé comme solvant de nettoyage à sec, mais il n'est plus utilisé car il est cancérigène. À 57,8 °C, la pression de vapeur du CCl 4 est de 54,0 kPa et son enthalpie de vaporisation est de 33,05 kJ/mol. Utilisez ces informations pour estimer le point d'ébullition normal du CCl 4.
Q10.3.10
Quand le point d'ébullition d'un liquide est-il égal à son point d'ébullition normal ?
10.3.10
Lorsque la pression du gaz au-dessus du liquide est exactement de 1 atm
Q10.3.11
En quoi l'ébullition d'un liquide diffère-t-elle de son évaporation ?
Q10.3.12
Utilisez les informations de la figure pour estimer le point d'ébullition de l'eau à Denver lorsque la pression atmosphérique est de 83,3 kPa.
10.3.12
environ 95 °C
Q10.3.13
Une seringue à une température de 20 °C est remplie d'éther liquide de telle sorte qu'il n'y ait pas de place pour la vapeur. Si la température est maintenue constante et que le piston est retiré pour créer un volume pouvant être occupé par de la vapeur, quelle serait la pression approximative de la vapeur produite ?
Q10.3.14
Expliquez les observations suivantes :
- Il faut plus de temps pour faire cuire un œuf à Ft. Davis, Texas (altitude, 5000 pieds au-dessus du niveau de la mer) qu'à Boston (au niveau de la mer).
- La transpiration est un mécanisme qui permet de refroidir le corps.
10.3.14
a) À 5 000 pieds, la pression atmosphérique est plus basse qu'au niveau de la mer et l'eau bouillira donc à une température plus basse. Cette température plus basse ralentira les changements physiques et chimiques liés à la cuisson de l'œuf, et il faudra plus de temps pour que l'œuf soit complètement cuit. (b) Tant que l'air environnant le corps contient moins de vapeur d'eau que le maximum que l'air peut contenir à cette température, la transpiration s'évapore, refroidissant ainsi le corps en éliminant la chaleur de vaporisation requise pour vaporiser l'eau.
Q10.3.15
L'enthalpie de vaporisation de l'eau est supérieure à son enthalpie de fusion. Expliquez pourquoi.
Q10.3.16
Expliquez pourquoi les enthalpies molaires de vaporisation des substances suivantes augmentent dans l'ordre suivant : CH 4 < C 2 H 6 < C 3 H 8, même si les trois substances subissent les mêmes forces de dispersion à l'état liquide.
10.3.16
Les forces de dispersion augmentent avec la masse ou la taille des molécules. À mesure que le nombre d'atomes composant les molécules de cette série homologue augmente, l'ampleur de l'attraction intermoléculaire par les forces de dispersion augmente également et, par conséquent, l'énergie requise pour surmonter ces forces et vaporiser les liquides.
Q10.3.17
Expliquez pourquoi les enthalpies de vaporisation des substances suivantes augmentent dans l'ordre suivant : CH 4 < NH 3 < H 2 O, même si les trois substances ont approximativement la même masse molaire.
Q10.3.18
L'enthalpie de vaporisation du CO 2 (l) est de 9,8 kJ/mol. Vous attendez-vous à ce que l'enthalpie de vaporisation du CS 2 (l) soit de 28 kJ/mol, 9,8 kJ/mol ou −8,4 kJ/mol ? Discutez de la plausibilité de chacune de ces réponses.
10.3.18
Le point d'ébullition du CS 2 est supérieur à celui du CO 2, en partie à cause du poids moléculaire plus élevé du CS 2 ; par conséquent, les forces d'attraction sont plus fortes dans le CS 2. On s'attendrait donc à ce que la chaleur de vaporisation soit supérieure à celle de 9,8 kJ/mol pour le CO 2. Une valeur de 28 kJ/mol semble raisonnable. Une valeur de −8,4 kJ/mol indiquerait une libération d'énergie lors de la vaporisation, ce qui est clairement invraisemblable.
Q10.3.19
La molécule de fluorure d'hydrogène, HF, est plus polaire qu'une molécule d'eau, H 2 O (par exemple, possède un moment dipolaire plus élevé), mais l'enthalpie molaire de vaporisation du fluorure d'hydrogène liquide est inférieure à celle de l'eau. Expliquez.
Q10.3.20
Le chlorure d'éthyle (point d'ébullition, 13 °C) est utilisé comme anesthésique local. Lorsque le liquide est pulvérisé sur la peau, il refroidit suffisamment la peau pour la geler et l'engourdir. Expliquer l'effet rafraîchissant du chlorure d'éthyle liquide.
10.3.20
L'énergie thermique (chaleur) nécessaire à l'évaporation du liquide est éliminée de la peau.
Q10.3.21
Lequel contient les composés correctement listés par ordre d'augmentation des points d'ébullition ?
- N 2 < CS 2 < H 2 O < KCl
- H 2 O < N 2 < CS 2 < KCl
- N 2 < KCl < CS 2 < H 2 O
- CS 2 < N 2 < KCl < H 2 O
- KCl < H 2 O < CS 2 < N 2
Q10.3.2
Quelle est la quantité de chaleur nécessaire pour convertir 422 g d'H 2 O liquide à 23,5 °C en vapeur à 150 °C ?
10.3.2
130 kJ
Q10.3.2
L'évaporation de la sueur nécessite de l'énergie et évacue ainsi l'excès de chaleur du corps. Une partie de l'eau que vous buvez peut éventuellement être transformée en sueur et s'évaporer. Si vous buvez une bouteille de 20 onces d'eau qui se trouvait au réfrigérateur à 3,8 °C, quelle quantité de chaleur est nécessaire pour convertir toute cette eau en sueur puis en vapeur ? (Remarque : la température de votre corps est de 36,6 °C. Pour résoudre ce problème, supposons que les propriétés thermiques de la sueur sont les mêmes que celles de l'eau.)
Q10.3.24
Le tétrachlorure de titane, TiCl 4, a un point de fusion de −23,2 °C et une fusion Δ H = 9,37 kJ/mol.
- Quelle quantité d'énergie est nécessaire pour faire fondre 263,1 g de TiCl 4 ?
- Pour le TiCl 4, lequel aura probablement la plus grande amplitude : fusion Δ H ou vaporisation Δ H ? Expliquez votre raisonnement.
10.3.24
(a) 13,0 kJ ; (b) Il est probable que la chaleur de vaporisation sera plus importante, car dans le cas de la vaporisation, les interactions intermoléculaires doivent être complètement surmontées, tandis que la fusion n'affaiblit ou ne détruit que certaines d'entre elles.
10.4 : Diagrammes de phase
Q10.4.1
À partir du diagramme de phase de l'eau, déterminez l'état de l'eau à :
- 35 °C et 85 kPa
- −15 °C et 40 kPa
- −15 °C et 0,1 kPa
- 75 °C et 3 kPa
- 40 °C et 0,1 kPa
- 60 °C et 50 kPa
Q10.4.2
Quels changements de phase se produiront lorsque l'eau est soumise à une pression variable à une température constante de 0,005 °C ? À 40 °C ? À −40 °C ?
10.4.2
À basse pression et à 0,005 °C, l'eau est un gaz. Lorsque la pression augmente jusqu'à 4,6 torr, l'eau devient solide ; à mesure que la pression augmente encore, elle devient liquide. À 40 °C, l'eau à basse pression est une vapeur ; à des pressions supérieures à environ 75 torr, elle se transforme en liquide. À −40 °C, l'eau passe de l'état gazeux à l'état solide lorsque la pression augmente au-delà de valeurs très basses.
Q10.4.3
Les autocuiseurs permettent aux aliments de cuire plus rapidement car la pression plus élevée à l'intérieur de l'autocuiseur augmente la température d'ébullition de l'eau. Un autocuiseur particulier possède une soupape de sécurité qui est réglée pour évacuer la vapeur si la pression dépasse 3,4 atm. Quelle est la température maximale approximative pouvant être atteinte à l'intérieur de cet autocuiseur ? Expliquez votre raisonnement.
Q10.4.4
À partir du diagramme de phase du dioxyde de carbone, déterminez l'état du CO 2 à :
- 20 °C et 1 000 kPa
- 10 °C et 2000 kPa
- 10 °C et 100 kPa
- −40 °C et 500 kPa
- −80 °C et 1500 kPa
- −80 °C et 10 kPa

Les axes de pression et de température sur ce diagramme de phase du dioxyde de carbone ne sont pas tracés à échelle constante afin d'illustrer plusieurs propriétés importantes.
10.4.4
(a) liquide ; (b) solide ; (c) gaz ; (d) gaz ; (e) gaz ; (f) gaz
Q10.4.5
Déterminez les changements de phase subis par le dioxyde de carbone lorsque la pression change si la température est maintenue à −50 °C ? Si la température est maintenue à −40 °C ? À 20 °C ?

Les axes de pression et de température sur ce diagramme de phase du dioxyde de carbone ne sont pas tracés à échelle constante afin d'illustrer plusieurs propriétés importantes.
Q10.4.6
Prenons l'exemple d'une bouteille contenant un mélange de dioxyde de carbone liquide en équilibre avec du dioxyde de carbone gazeux à une pression initiale de 65 atm et à une température de 20 °C. Dessinez un diagramme illustrant l'évolution de la pression de la bouteille au fil du temps lorsque du dioxyde de carbone gazeux est libéré à température constante.
10.4.6

Q10.4.7
La neige carbonique, le CO 2 (s), ne fond pas à la pression atmosphérique. Il se sublime à une température de −78 °C. Quelle est la pression la plus basse à laquelle le CO 2 (s) fondra pour donner du CO 2 (l) ? À quelle température cela se produira-t-il approximativement ? (Voir la figure pour le diagramme de phase.)
10.4.7
La glace carbonique, CO 2 (s), va fondre pour donner du CO 2 (l) à 5,11 atm à −56,6 °C, le point triple du dioxyde de carbone.
Q10.4.8
Si une tempête violente entraîne une perte d'électricité, il peut être nécessaire d'utiliser une corde à linge pour sécher le linge. Dans de nombreuses régions du pays, en plein hiver, les vêtements gèlent rapidement lorsqu'ils sont accrochés à la corde. S'il ne neige pas, sècheront-ils quand même ? Expliquez votre réponse.
10.4.8
Oui, la glace va se sublimer, même si cela peut prendre plusieurs jours. La glace a une faible pression de vapeur et certaines molécules de glace forment du gaz et s'échappent des cristaux de glace. Au fil du temps, de plus en plus de solides se transforment en gaz jusqu'à ce que les vêtements soient secs.
Q10.4.9
Est-il possible de liquéfier de l'azote à température ambiante (environ 25 °C) ? Est-il possible de liquéfier le dioxyde de soufre à température ambiante ? Expliquez vos réponses.
Q10.4.10
Le carbone élémentaire comprend une phase gazeuse, une phase liquide et trois phases solides différentes, comme le montre le diagramme des phases :
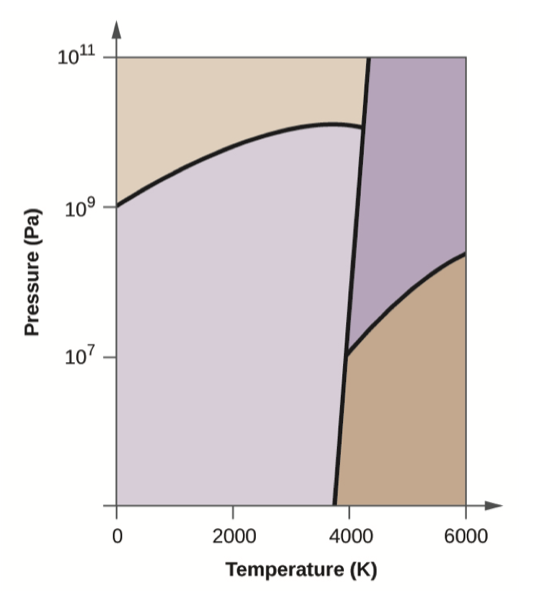
- Sur le diagramme de phase, étiquetez les régions de gaz et de liquide.
- Le graphite est la phase la plus stable du carbone dans des conditions normales. Sur le diagramme de phase, étiquetez la phase graphite.
- Si, dans des conditions normales, le graphite est chauffé à 2500 K alors que la pression est augmentée à 10 10 Pa, il est converti en diamant. Marquez la phase diamantée.
- Encerclez chaque point triple sur le diagramme de phase.
- Dans quelle phase le carbone existe-t-il à 5000 K et 10 8 Pa ?
- Si la température d'un échantillon de carbone augmente de 3 000 K à 5 000 K à une pression constante de 10 6 Pa, quelle transition de phase se produit, le cas échéant ?
10.5 : L'état solide de la matière
Q10.5.1
Quels types de liquides forment généralement des solides amorphes ?
10.5.1
Les solides amorphes n'ont pas de structure interne ordonnée. Les matières liquides qui contiennent de grosses molécules encombrantes qui ne peuvent pas se déplacer facilement dans des positions ordonnées forment généralement de tels solides.
Q10.5.2
À très basse température, l'oxygène, O 2, gèle et forme un solide cristallin. Qu'est-ce qui décrit le mieux ces cristaux ?
- ionique
- réseau covalent
- métallique
- amorphe
- cristaux moléculaires
10.5.3
(e) cristaux moléculaires
Q10.5.4
En refroidissant, l'huile d'olive se solidifie lentement et forme un solide sur une plage de températures. Qu'est-ce qui décrit le mieux le solide ?
- ionique
- réseau covalent
- métallique
- amorphe
- cristaux moléculaires
10.5.4
(d) amorphe
Q10.5.5
Expliquez pourquoi la glace, qui est un solide cristallin, a une température de fusion de 0 °C, alors que le beurre, qui est un solide amorphe, se ramollit à différentes températures.
10.5.6
La glace a une structure cristalline stabilisée par liaison hydrogène. Ces forces intermoléculaires ont une force comparable et nécessitent donc la même quantité d'énergie pour être surmontées. Par conséquent, la glace fond à une seule température et non dans une plage de températures. Les différentes molécules très grosses qui composent le beurre sont soumises à des attraits variés de Van der Waals, à des forces diverses qui sont surmontées à différentes températures, de sorte que le processus de fusion se déroule sur une large plage de températures.
Q10.5.7
Identifier le type de solide cristallin (métallique, réseau covalent, ionique ou moléculaire) formé par chacune des substances suivantes :
- SiO 2
- KCl
- Cu
- CO 2
- C (diamant)
- Abso 4
- NH 3
- NH 4 F
- C 2 H 5 OHM
10.5.7
(a) SiO 2, réseau covalent ; (b) KCl, ionique ; (c) Cu, métallique ; (d) CO, moléculaire ; (e) C (diamant), réseau covalent ; (f) BaSO 4, ionique ; (g) NH 3, moléculaire ; (h) NH 4 F, ionique ; (i) C 2 H 5 OH, moléculaire
Q10.5.8
Identifier le type de solide cristallin (métallique, réseau covalent, ionique ou moléculaire) formé par chacune des substances suivantes :
- CaCl 2
- SiC
- N° 2
- Fe
- C (graphite)
- CH 3 CH 2 CH 2 CH 3
- HCl
- NH 4 N° 3
- K 3 PO 4
10.5.8
(a) CaCl 2, ionique ; (b) SiC, réseau covalent ; (c) N 2, moléculaire ; (d) Fe, métallique ; (e) C (graphite), réseau covalent ; (f) CH 3 CH 2 CH 2 CH 3, moléculaire ; (g) HCl, moléculaire ; (h) NH 4 NO 3, ionique ; (i) K 3 PO 4, ionique
Q10.5.9
Classifiez chaque substance du tableau en tant que solide métallique, ionique, moléculaire ou en réseau covalent :
| Substance | Apparence | Point de fusion | Conductivité électrique | Solubilité dans l'eau |
|---|---|---|---|---|
| X | brillant, malléable | 1500 °C | haute | insoluble |
| Y | doux, jaune | 113 °C | aucune | insoluble |
| Z | dur, blanc | 800 °C | uniquement en cas de fusion ou de dissolution | soluble |
10.5.9
X = métallique ; Y = réseau covalent ; Z = ionique
Q10.5.10
Classifiez chaque substance du tableau en tant que solide métallique, ionique, moléculaire ou en réseau covalent :
| Substance | Apparence | Point de fusion | Conductivité électrique | Solubilité dans l'eau |
|---|---|---|---|---|
| X | fragile, blanc | 800 °C | uniquement en cas de fusion ou de dissolution | soluble |
| Y | brillant, malléable | 1100 °C | haute | insoluble |
| Z | dur, incolore | 35,50 °C | aucune | insoluble |
10.5.10
X = ionique ; Y = métallique ; Z = réseau covalent
Q10.5.11
Identifier les substances suivantes en tant que solides ioniques, métalliques, à réseaux covalents ou moléculaires :
La substance A est malléable, ductile, conduit bien l'électricité et a un point de fusion de 1135 °C. La substance B est fragile, ne conduit pas l'électricité sous forme solide mais le fait lorsqu'elle est fondue, et a un point de fusion de 2 072 °C. La substance C est très dure, ne conduit pas l'électricité et a un point de fusion de 3 440 °C. La substance D est molle, ne conduit pas l'électricité et a un point de fusion de 185 °C.
10.5.11
A = métallique ; B = ionique ; C = réseau covalent ; D = moléculaire
Q10.5.12
La substance A est brillante, conduit bien l'électricité et fond à 975 °C. La substance A est probablement a (n) :
- solide ionique
- solide métallique
- solide moléculaire
- solide en réseau covalent
10.5.12
(b) solide métallique
Q10.5.13
La substance B est dure, ne conduit pas l'électricité et fond à 1200 °C. La substance B est probablement a (n) :
- solide ionique
- solide métallique
- solide moléculaire
- solide en réseau covalent
10.5.13
(d) solide en réseau covalent
10.6 : Structures en treillis
Q10.6.1
Décrivez la structure cristalline du fer, qui cristallise avec deux atomes métalliques équivalents dans une cellule unitaire cubique.
10.6.1
La structure de cette forme de fer à basse température (en dessous de 910 °C) est cubique et centrée sur le corps. Il y a un huitième atome à chacun des huit coins du cube et un atome au centre du cube.
Q10.6.2
Décrivez la structure cristalline du Pt, qui cristallise avec quatre atomes métalliques équivalents dans une cellule unitaire cubique.
Q10.6.3
Quel est le numéro de coordination d'un atome de chrome dans la structure cubique du chrome centrée sur le corps ?
10.6.3
huit
Q10.6.4
Quel est le numéro de coordination d'un atome d'aluminium dans la structure cubique à faces centrées de l'aluminium ?
Q10.6.5
Le cobalt cristallise dans une structure hexagonale la plus compacte. Quel est le numéro de coordination d'un atome de cobalt ?
10.6.5
12
Q10.6.6
Le nickel métallique cristallise dans une structure cubique la plus compacte. Quel est le numéro de coordination d'un atome de nickel ?
Q10.6.7
Le tungstène cristallise dans une cellule cubique centrée sur le corps avec une longueur d'arête de 3,165 Å.
- Quel est le rayon atomique du tungstène dans cette structure ?
- Calculez la densité du tungstène.
10.6.7
(a) 1,370 Å ; (b) 19,26 g/cm
Q10.6.8
Le platine (rayon atomique = 1,38 Å) cristallise dans une structure cubique serrée. Calculez la longueur de l'arête de la cellule unitaire cubique à face centrée et la densité du platine.
Q10.6.9
Le baryum cristallise dans une cellule cubique centrée sur le corps avec une longueur d'arête de 5,025 Å
- Quel est le rayon atomique du baryum dans cette structure ?
- Calculez la densité du baryum.
10.6.9
(a) 2,176 Å ; (b) 3,595 g/cm 3
Q10.6.10
L'aluminium (rayon atomique = 1,43 Å) cristallise dans une structure cubique serrée. Calculez la longueur de l'arête de la cellule unitaire cubique à face centrée et la densité de l'aluminium.
Q10.6.11
La densité de l'aluminium est de 2,7 g/cm 3 ; celle du silicium est de 2,3 g/cm 3. Expliquez pourquoi le Si a la densité la plus faible, même s'il contient des atomes plus lourds.
10.6.11
La structure cristalline du Si montre qu'il est moins serré (numéro de coordination 4) dans le solide que Al (numéro de coordination 12).
Q10.6.12
L'espace libre dans un métal peut être trouvé en soustrayant le volume des atomes d'une cellule unitaire du volume de la cellule. Calculez le pourcentage d'espace libre dans chacun des trois réseaux cubiques si tous les atomes de chacun sont de taille égale et touchent leurs voisins les plus proches. Laquelle de ces structures représente l'emballage le plus efficace ? C'est-à-dire quels packs offrent le moins d'espace inutilisé ?
Q10.6.13
Le sulfure de cadmium, parfois utilisé comme pigment jaune par les artistes, cristallise avec le cadmium et occupe la moitié des trous tétraédriques du réseau d'ions sulfure le plus proche. Quelle est la formule du sulfure de cadmium ? Expliquez votre réponse.
10.6.13
Dans la matrice la plus compacte, deux trous tétraédriques existent pour chaque anion. Si seulement la moitié des trous tétraédriques sont occupés, les nombres d'anions et de cations sont égaux. La formule du sulfure de cadmium est CdS.
Q10.6.14
Un composé de cadmium, d'étain et de phosphore est utilisé dans la fabrication de certains semi-conducteurs. Il cristallise avec du cadmium occupant un quart des trous tétraédriques et de l'étain occupant un quart des trous tétraédriques dans un réseau compact d'ions phosphure le plus proche. Quelle est la formule du composé ? Expliquez votre réponse.
Q10.6.15
Quelle est la formule de l'oxyde magnétique de cobalt, utilisé dans les bandes d'enregistrement, qui cristallise lorsque des atomes de cobalt occupent un huitième des trous tétraédriques et la moitié des trous octaédriques d'un réseau serré d'ions oxydes ?
10.6.15
Co 3 O 4
Q10.6.16
Un composé contenant du zinc, de l'aluminium et du soufre cristallise avec le réseau d'ions sulfure le plus compact. Des ions zinc se trouvent dans un huitième des trous tétraédriques et des ions aluminium dans la moitié des trous octaédriques. Quelle est la formule empirique du composé ?
Q10.6.17
Un composé de thallium et d'iode cristallise dans un réseau cubique simple d'ions iodure avec des ions thallium dans tous les trous cubiques. Quelle est la formule de cet iodure ? Expliquez votre réponse.
10.6.17
Dans un réseau cubique simple, un seul trou cubique peut être occupé par un cation pour chaque anion du réseau. Le rapport entre le thallium et l'iodure doit être de 1:1 ; par conséquent, la formule du thallium est TLi.
Q10.6.18
Lequel des éléments suivants réagit avec le soufre pour former un solide dans lequel les atomes de soufre forment le réseau le plus serré avec tous les trous octaédriques occupés : Li, Na, Be, Ca ou Al ?
Q10.6.19
Quel est le pourcentage en masse de titane dans le rutile, un minéral qui contient du titane et de l'oxygène, si la structure peut être décrite comme un réseau compact d'ions oxydes avec des ions titane dans la moitié des trous octaédriques ? Quel est l'indice d'oxydation du titane ?
10.6.19
59,95 % ; L'indice d'oxydation du titane est de +4.
Q10.6.20
Expliquez pourquoi les chlorures de métaux alcalins NaCl et CsCl, chimiquement similaires, ont des structures différentes, alors que les chlorures de métaux alcalins chimiquement différents ont la même structure.
Q10.6.21
Au fur et à mesure que les minéraux se formaient à partir du magma fondu, différents ions occupaient les mêmes cités dans les cristaux. Le lithium est souvent présent avec le magnésium dans les minéraux malgré la différence de charge de leurs ions. Suggérez une explication.
10.6.21
Les deux ions sont de taille proche : Mg, 0,65 ; Li, 0,60. Cette similitude permet aux deux de s'échanger assez facilement. La différence de charge est généralement compensée par le remplacement du Si 4+ par de l'Al 3+.
Q10.6.2
L'iodure de rubidium cristallise dans une cellule unitaire cubique qui contient des ions iodure aux coins et un ion rubidium au centre. Quelle est la formule du composé ?
Q10.6.23
L'un des différents oxydes de manganèse cristallise dans une cellule unitaire cubique qui contient des ions manganèse aux coins et au centre. Les ions oxydes sont situés au centre de chaque bord de la cellule unitaire. Quelle est la formule du composé ?
10.6.23
Homme 2 ou 3
Q10.6.24
Le NaH cristallise avec la même structure cristalline que le NaCl. La longueur du bord de la cellule unitaire cubique de NaH est de 4,880 Å.
- Calculez le rayon ionique de H -. (Le rayon ionique de Li + est de 0,0,95 Å.)
- Calculez la densité de NaH.
Q10.6.25
L'iodure de thallium (I) cristallise avec la même structure que le CsCl. La longueur du bord de la cellule unitaire de TLi est de 4,20 Å. Calculez le rayon ionique de TI +. (Le rayon ionique de I − est de 2,16 Å.)
10.6.25
1,48 Å
Q10.6.26
Une cellule unitaire cubique contient des ions manganèse aux angles et des ions fluorure au centre de chaque bord.
- Quelle est la formule empirique de ce composé ? Expliquez votre réponse.
- Quel est le numéro de coordination de l'ion Mn 3+ ?
- Calculez la longueur du bord de la cellule unitaire si le rayon d'un ion Mn 3+ est de 0,65 A.
- Calculez la densité du composé.
Q10.6.27
Quel est l'espacement entre les plans cristallins qui diffractent les rayons X d'une longueur d'onde de 1,541 nm sous un angle θ de 15,55° (réflexion du premier ordre) ?
10.6.27
2,874 Å
Q10.6.28
Un diffractomètre utilisant des rayons X d'une longueur d'onde de 0,2287 nm a produit un pic de diffraction du premier ordre pour un angle cristallin θ = 16,21°. Déterminez l'espacement entre les plans de diffraction dans ce cristal.
Q10.6.29
Un métal dont l'espacement entre les plans est égal à 0,4164 nm diffracte des rayons X d'une longueur d'onde de 0,2879 nm. Quel est l'angle de diffraction pour le pic de diffraction du premier ordre ?
10.6.29
20,2°
Q10.6.30
L'or cristallise dans une cellule cubique centrée sur la face. La réflexion du second ordre (n = 2) des rayons X pour les plans qui constituent le haut et le bas des cellules unitaires se situe à θ = 22,20°. La longueur d'onde des rayons X est de 1,54 Å. Quelle est la densité de l'or métallique ?
Q10.6.31
Lorsqu'un électron d'un atome de molybdène excité tombe de la couche L à la couche K, un rayon X est émis. Ces rayons X sont diffractés à un angle de 7,75° par des plans séparés de 2,64 Å. Quelle est la différence d'énergie entre la couche K et la couche L dans le molybdène en supposant une diffraction du premier ordre ?
10.6.31
1,74 × 10 4 éV


