10.5 : L'état solide de la matière
- Page ID
- 193916
- Définir et décrire la liaison et les propriétés des solides cristallins ioniques, moléculaires, métalliques et covalents
- Décrire les principaux types de solides cristallins : solides ioniques, solides métalliques, solides de réseaux covalents et solides moléculaires
- Expliquer comment des défauts cristallins peuvent se produire dans un solide
Lorsque la plupart des liquides sont refroidis, ils finissent par geler et former des solides cristallins, des solides dans lesquels les atomes, les ions ou les molécules sont disposés selon un schéma répétitif défini. Il est également possible qu'un liquide gèle avant que ses molécules ne s'organisent de manière ordonnée. Les matériaux qui en résultent sont appelés solides amorphes ou solides non cristallins (ou, parfois, verres). Les particules de ces solides n'ont pas de structure interne ordonnée et sont disposées de manière aléatoire (Figure\(\PageIndex{1}\)).
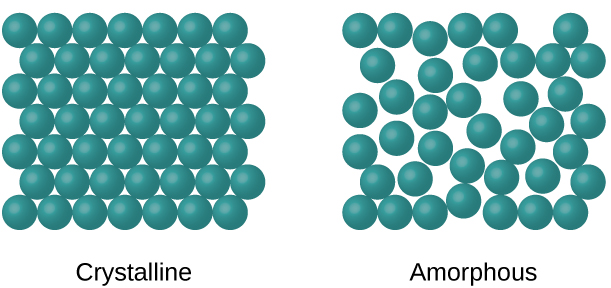
Les métaux et les composés ioniques forment généralement des solides cristallins ordonnés. Les substances constituées de grosses molécules ou d'un mélange de molécules dont les mouvements sont plus restreints forment souvent des solides amorphes. Par exemple, les cires pour bougies sont des solides amorphes composés de grosses molécules d'hydrocarbures. Certaines substances, comme l'oxyde de bore (Figure\(\PageIndex{2}\)), peuvent former des solides cristallins ou amorphes, selon les conditions dans lesquelles elles sont produites. De plus, les solides amorphes peuvent subir une transition vers l'état cristallin dans des conditions appropriées.
Les solides cristallins sont généralement classés en fonction de la nature des forces qui maintiennent leurs particules ensemble. Ces forces sont principalement responsables des propriétés physiques des solides en vrac. Les sections suivantes fournissent des descriptions des principaux types de solides cristallins : ioniques, métalliques, réseaux covalents et moléculaires.
Solides ioniques
Les solides ioniques, tels que le chlorure de sodium et l'oxyde de nickel, sont composés d'ions positifs et négatifs maintenus ensemble par des attractions électrostatiques, qui peuvent être assez fortes (Figure\(\PageIndex{3}\)). De nombreux cristaux ioniques ont également des points de fusion élevés. Cela est dû aux très fortes attractions entre les ions : dans les composés ioniques, les attractions entre les charges complètes sont (beaucoup) plus importantes que celles entre les charges partielles dans les composés moléculaires polaires. Cela sera examiné plus en détail dans une discussion ultérieure sur les énergies des réseaux. Bien qu'ils soient durs, ils ont tendance à être fragiles et se brisent au lieu de se plier. Les solides ioniques ne sont pas conducteurs d'électricité, mais ils le font lorsqu'ils sont fondus ou dissous, car leurs ions sont libres de se déplacer. De nombreux composés simples formés par la réaction d'un élément métallique avec un élément non métallique sont ioniques.

Solides métalliques
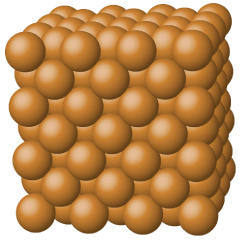
Les solides métalliques tels que les cristaux de cuivre, d'aluminium et de fer sont formés par des atomes métalliques Figure\(\PageIndex{4}\). La structure des cristaux métalliques est souvent décrite comme une distribution uniforme des noyaux atomiques au sein d'une « mer » d'électrons délocalisés. Les atomes d'un tel solide métallique sont maintenus ensemble par une force unique appelée liaison métallique qui donne naissance à de nombreuses propriétés globales utiles et variées. Tous présentent une conductivité thermique et électrique, un lustre métallique et une malléabilité élevés. Beaucoup sont très durs et très forts. En raison de leur malléabilité (capacité à se déformer sous pression ou par martelage), ils ne se brisent pas et constituent donc des matériaux de construction utiles. Les points de fusion des métaux varient considérablement. Le mercure est liquide à température ambiante et les métaux alcalins fondent à moins de 200 °C. Plusieurs métaux post-transition ont également des points de fusion bas, tandis que les métaux de transition fondent à des températures supérieures à 1 000 °C. Ces différences reflètent les différences de résistance des liaisons métalliques entre les métaux.
Solides de réseau covalents
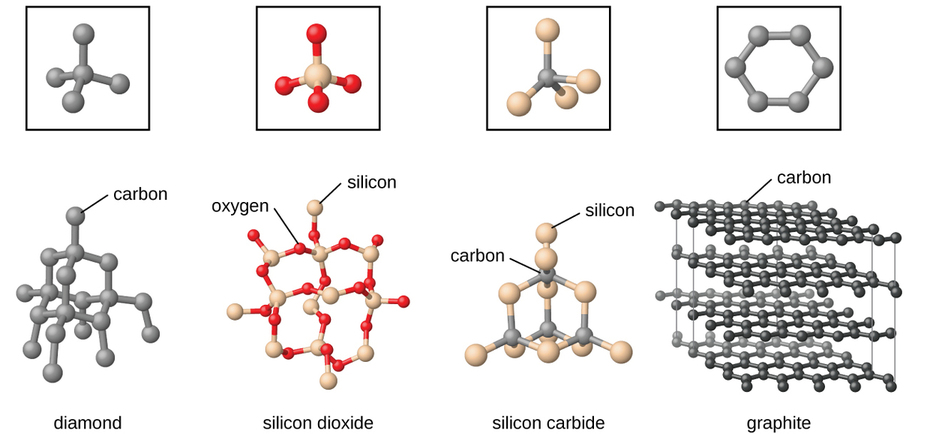
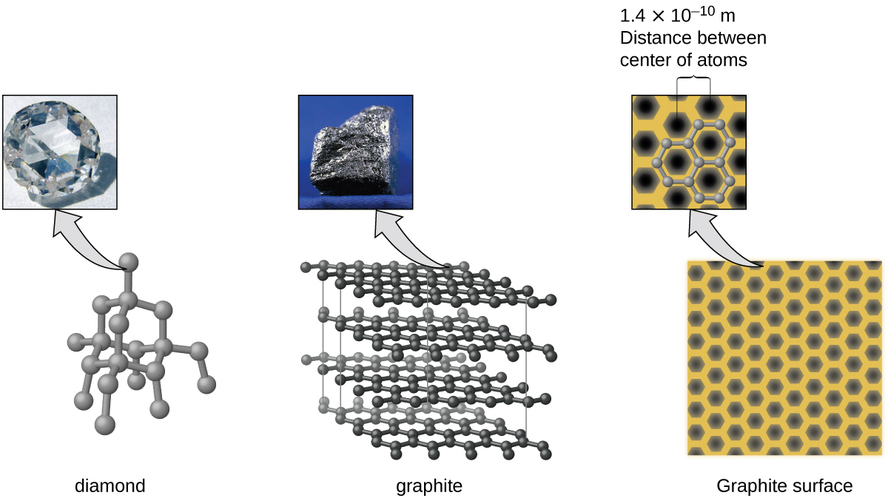
Les solides du réseau covalent comprennent des cristaux de diamant, de silicium, d'autres éléments non métalliques et certains composés covalents tels que le dioxyde de silicium (sable) et le carbure de silicium (carborundum, l'abrasif du papier abrasif). De nombreux minéraux possèdent des réseaux de liaisons covalentes. Les atomes de ces solides sont maintenus ensemble par un réseau de liaisons covalentes, comme le montre la figure\(\PageIndex{5}\). Pour rompre ou faire fondre un solide en réseau covalent, les liaisons covalentes doivent être rompues. Les liaisons covalentes étant relativement fortes, les solides des réseaux covalents se caractérisent généralement par leur dureté, leur résistance et leurs points de fusion élevés. Par exemple, le diamant est l'une des substances les plus dures connues et fond au-dessus de 3500 °C.
Solides moléculaires
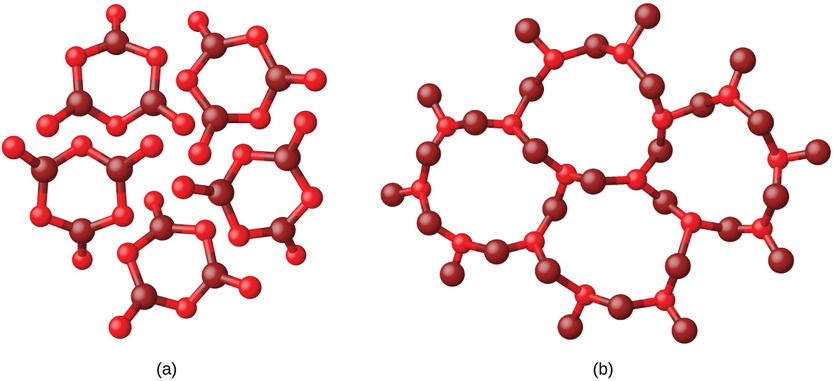
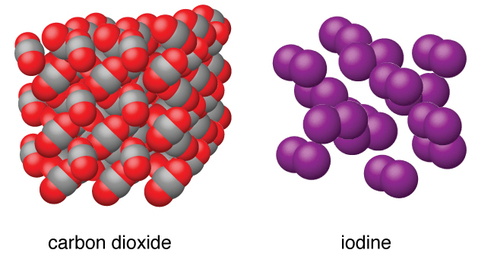
Les solides moléculaires, tels que la glace, le saccharose (sucre de table) et l'iode, comme le montre la figure\(\PageIndex{6}\), sont composés de molécules neutres. Les intensités des forces d'attraction entre les unités présentes dans les différents cristaux varient considérablement, comme l'indiquent les points de fusion des cristaux. Les petites molécules symétriques (molécules non polaires), telles que H 2, N 2, O 2 et F 2, ont de faibles forces d'attraction et forment des solides moléculaires ayant des points de fusion très bas (inférieurs à −200 °C). Les substances constituées de molécules non polaires plus grosses ont des forces d'attraction plus importantes et fondent à des températures plus élevées. Les solides moléculaires composés de molécules présentant des moments dipolaires permanents (molécules polaires) fondent à des températures encore plus élevées. Les exemples incluent la glace (point de fusion, 0 °C) et le sucre de table (point de fusion, 185 °C).
Propriétés des solides
Un solide cristallin, comme ceux listés dans le tableau,\(\PageIndex{1}\) a une température de fusion précise car chaque atome ou molécule du même type est maintenu en place avec les mêmes forces ou énergie. Ainsi, les attractions entre les unités qui composent le cristal ont toutes la même force et nécessitent toutes la même quantité d'énergie pour être brisées. Le ramollissement progressif d'un matériau amorphe diffère radicalement de la fusion distincte d'un solide cristallin. Cela résulte de la non-équivalence structurale des molécules dans le solide amorphe. Certaines forces sont plus faibles que d'autres, et lorsqu'un matériau amorphe est chauffé, les attractions intermoléculaires les plus faibles se brisent en premier. Au fur et à mesure que la température augmente, les attractions les plus fortes se cassent. Ainsi, les matériaux amorphes se ramollissent sur une plage de températures.
| Type de solide | Type de particules | Type d'attractions | Propriétés | Exemples |
|---|---|---|---|---|
| ionique | ions | liaisons ioniques | dur, fragile, conduit l'électricité sous forme liquide mais non sous forme solide, point de fusion élevé à très élevé | NaCl, Al 2 O 3 |
| métallique | atomes d'éléments électropositifs | liaisons métalliques | brillant, malléable, ductile, conduit bien la chaleur et l'électricité, dureté et température de fusion variables | Cu, Fe, Ti, Pb, U |
| réseau covalent | atomes d'éléments électronégatifs | liaisons covalentes | très dur, non conducteur, point de fusion très élevé | C (diamant), SiO 2, SiC |
| moléculaire | molécules (ou atomes) | FMI | dureté variable, fragilité variable, non conducteur, points de fusion bas | H 2 O, CO 2, I 2, C 12, H 22 O 11 |
Le carbone est un élément essentiel de notre monde. Les propriétés uniques des atomes de carbone permettent l'existence de formes de vie à base de carbone telles que nous. Le carbone forme une grande variété de substances que nous utilisons quotidiennement, y compris celles présentées sur la Figure\(\PageIndex{7}\). Vous connaissez peut-être le diamant et le graphite, les deux allotropes les plus courants du carbone. (Les allotropes sont différentes formes structurales d'un même élément.) Le diamant est l'une des substances les plus résistantes connues, tandis que le graphite est suffisamment doux pour être utilisé comme mine de crayon. Ces propriétés très différentes proviennent des différents arrangements des atomes de carbone dans les différents allotropes.
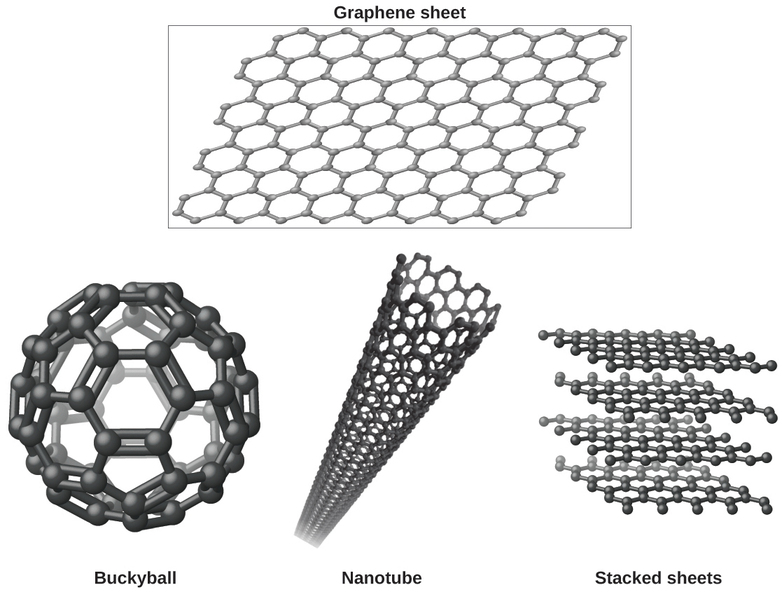
Vous connaissez peut-être moins une forme de carbone récemment découverte : le graphène. Le graphène a été isolé pour la première fois en 2004 en utilisant du ruban adhésif pour décoller des couches de plus en plus fines du graphite. Il s'agit essentiellement d'une feuille unique (d'un atome d'épaisseur) de graphite. Le graphène, illustré sur la figure\(\PageIndex{8}\), est non seulement solide et léger, mais il est également un excellent conducteur d'électricité et de chaleur. Ces propriétés peuvent s'avérer très utiles dans un large éventail d'applications, telles que des puces et des circuits informatiques considérablement améliorés, de meilleures batteries et cellules solaires, ainsi que des matériaux structurels plus solides et plus légers. Le prix Nobel de physique 2010 a été décerné à André Geim et Konstantin Novoselov pour leurs travaux novateurs sur le graphène.
défauts cristallins
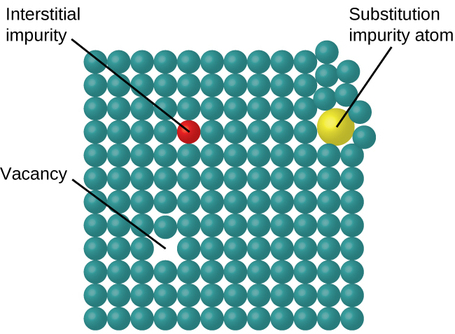
Dans un solide cristallin, les atomes, les ions ou les molécules sont disposés selon un schéma répétitif défini, mais des défauts occasionnels peuvent apparaître dans le motif. Plusieurs types de défauts sont connus, comme illustré sur la figure\(\PageIndex{9}\). Les lacunes sont des défauts qui se produisent lorsque des positions qui devraient contenir des atomes ou des ions sont vacantes. Plus rarement, certains atomes ou ions d'un cristal peuvent occuper des positions, appelées sites interstitiels, situées entre les positions normales des atomes. D'autres distorsions se produisent dans les cristaux impurs, par exemple lorsque les cations, les anions ou les molécules de l'impureté sont trop gros pour entrer dans les positions normales sans déformer la structure. Des traces d'impuretés sont parfois ajoutées à un cristal (processus connu sous le nom de dopage) afin de créer des défauts dans la structure qui entraînent des modifications souhaitables de ses propriétés. Par exemple, les cristaux de silicium sont dopés avec des quantités variables d'éléments différents pour obtenir des propriétés électriques adaptées à leur utilisation dans la fabrication de semi-conducteurs et de puces informatiques.
Résumé
Certaines substances forment des solides cristallins composés de particules ayant une structure très organisée ; d'autres forment des solides amorphes (non cristallins) dont la structure interne n'est pas ordonnée. Les principaux types de solides cristallins sont les solides ioniques, les solides métalliques, les solides de réseaux covalents et les solides moléculaires. Les propriétés des différents types de solides cristallins sont dues au type de particules qui les composent, à la disposition des particules et à la force des attraits qui les unissent. Comme leurs particules présentent des attraits identiques, les solides cristallins ont des températures de fusion distinctes ; les particules des solides amorphes subissent toute une gamme d'interactions, de sorte qu'elles se ramollissent progressivement et fondent sur une gamme de températures. Certains solides cristallins présentent des défauts dans le schéma répétitif défini de leurs particules. Ces défauts (qui incluent les lacunes, les atomes ou les ions ne se trouvant pas dans les positions normales et les impuretés) modifient des propriétés physiques telles que la conductivité électrique, qui est exploitée dans les cristaux de silicium utilisés pour fabriquer les puces informatiques.
Lexique
- solide amorphe
- (également solide non cristallin) solide dans lequel les particules n'ont pas de structure interne ordonnée
- solide en réseau covalent
- solide dont les particules sont maintenues ensemble par des liaisons covalentes
- solide cristallin
- solide dans lequel les particules sont disposées selon un motif répétitif défini
- sites interstitiels
- espaces entre les positions régulières des particules dans n'importe quel réseau d'atomes ou d'ions
- solide ionique
- solide composé d'ions positifs et négatifs maintenus ensemble par de fortes attractions électrostatiques
- solide métallique
- solide composé d'atomes métalliques
- solide moléculaire
- solide composé de molécules neutres maintenues ensemble par des forces d'attraction intermoléculaires
- vacance
- défaut qui se produit lorsqu'une position qui devrait contenir un atome ou un ion est vacante


