10.4 : Diagrammes de phase
- Page ID
- 193915
- Expliquer la construction et l'utilisation d'un diagramme de phase type
- Utiliser des diagrammes de phase pour identifier les phases stables à des températures et des pressions données et pour décrire les transitions de phase résultant des modifications de ces propriétés
- Décrire la phase fluide supercritique de la matière
Dans le module précédent, la variation de la pression de vapeur d'équilibre d'un liquide en fonction de la température a été décrite. Compte tenu de la définition du point d'ébullition, les diagrammes de la pression de vapeur par rapport à la température indiquent comment le point d'ébullition du liquide varie en fonction de la pression. L'utilisation de courbes de chauffage et de refroidissement pour déterminer le point de fusion (ou de congélation) d'une substance a également été décrite. La réalisation de telles mesures sur une large gamme de pressions permet d'obtenir des données qui peuvent être présentées graphiquement sous forme de diagramme de phase. Un diagramme de phase combine des courbes de pression en fonction de la température pour les équilibres de transition de phase liquide-gaz, solide-liquide et solide-gaz d'une substance. Ces diagrammes indiquent les états physiques qui existent dans des conditions spécifiques de pression et de température, et fournissent également la dépendance à la pression des températures de transition de phase (points de fusion, points de sublimation, points d'ébullition). Un diagramme de phase typique pour une substance pure est illustré à la figure\(\PageIndex{1}\).
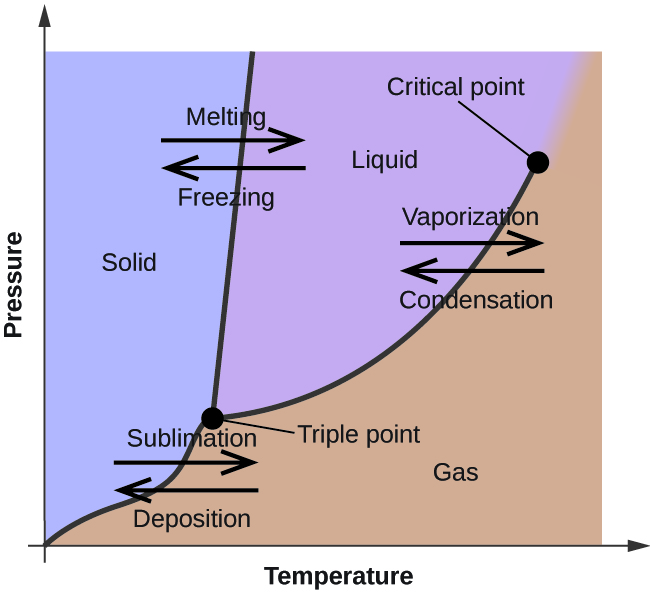
Pour illustrer l'utilité de ces parcelles, considérez le diagramme de phase pour l'eau illustré à la figure\(\PageIndex{2}\).

Nous pouvons utiliser le diagramme de phase pour identifier l'état physique d'un échantillon d'eau dans des conditions de pression et de température spécifiées. Par exemple, une pression de 50 kPa et une température de −10 °C correspondent à la région du diagramme étiquetée « glace ». Dans ces conditions, l'eau n'existe que sous forme solide (glace). Une pression de 50 kPa et une température de 50 °C correspondent à la région « de l'eau » ; ici, l'eau n'existe que sous forme liquide. À 25 kPa et à 200 °C, l'eau n'existe qu'à l'état gazeux. Notez que sur le diagramme de phase de H 2 O, les axes de pression et de température ne sont pas tracés à une échelle constante afin de permettre l'illustration de plusieurs caractéristiques importantes décrites ici.
La courbe BC de la figure\(\PageIndex{2}\) est le diagramme de la pression de vapeur en fonction de la température tel que décrit dans le module précédent de ce chapitre. Cette courbe « liquide-vapeur » sépare les régions liquide et gazeuse du diagramme de phase et fournit le point d'ébullition de l'eau à n'importe quelle pression. Par exemple, à 1 atm, le point d'ébullition est de 100 °C. Notez que la courbe liquide-vapeur se termine à une température de 374 °C et à une pression de 218 atm, ce qui indique que l'eau ne peut pas exister sous forme liquide au-dessus de cette température, quelle que soit la pression. Les propriétés physiques de l'eau dans ces conditions sont intermédiaires entre celles de ses phases liquide et gazeuse. Cet état unique de la matière est appelé fluide supercritique, un sujet qui sera décrit dans la section suivante de ce module.
La courbe solide-vapeur, étiquetée AB sur la figure\(\PageIndex{2}\), indique les températures et les pressions auxquelles la glace et la vapeur d'eau sont en équilibre. Ces paires de données température-pression correspondent aux points de sublimation, ou de dépôt, de l'eau. Si nous pouvions zoomer sur la conduite de gaz solide de la figure\(\PageIndex{2}\), nous verrions que la glace a une pression de vapeur d'environ 0,20 kPa à −10 °C. Ainsi, si nous plaçons un échantillon congelé sous vide à une pression inférieure à 0,20 kPa, la glace se sublimera. C'est la base du processus de « lyophilisation » souvent utilisé pour conserver les aliments, comme la crème glacée illustrée à la figure\(\PageIndex{3}\).

La courbe solide-liquide étiquetée BD montre les températures et les pressions auxquelles la glace et l'eau liquide sont en équilibre, représentant les points de fusion/congélation de l'eau. Notez que cette courbe présente une légère pente négative (fortement exagérée pour des raisons de clarté), ce qui indique que le point de fusion de l'eau diminue légèrement lorsque la pression augmente. L'eau est une substance inhabituelle à cet égard, car la plupart des substances présentent une augmentation du point de fusion avec l'augmentation de la pression. Ce comportement est en partie responsable du mouvement des glaciers, comme celui illustré sur la figure\(\PageIndex{4}\). Le fond d'un glacier subit une pression énorme due à son poids qui peut faire fondre une partie de la glace, formant ainsi une couche d'eau liquide sur laquelle le glacier peut glisser plus facilement.

Le point d'intersection des trois courbes est marqué B sur la figure\(\PageIndex{2}\). À la pression et à la température représentées par ce point, les trois phases de l'eau coexistent en équilibre. Cette paire de données température-pression est appelée point triple. À des pressions inférieures au point triple, l'eau ne peut pas exister sous forme liquide, quelle que soit la température.
À l'aide du diagramme de phase de l'eau présenté à la Figure 10.4.2, déterminez l'état de l'eau aux températures et pressions suivantes :
- −10 °C et 50 kPa
- 25 °C et 90 kPa
- 50 °C et 40 kPa
- 80 °C et 5 kPa
- −10 °C et 0,3 kPa
- 50 °C et 0,3 kPa
Solution
À l'aide du diagramme de phase de l'eau, nous pouvons déterminer que l'état de l'eau à chaque température et pression donnée est le suivant : (a) solide ; (b) liquide ; (c) liquide ; (d) gaz ; (e) solide ; (f) gaz.
Quels changements de phase l'eau peut-elle subir lorsque la température change si la pression est maintenue à 0,3 kPa ? Si la pression est maintenue à 50 kPa ?
- Réponse
-
À 0,3 kPa : s⟶ g à −58 °C. À 50 kPa : s⟶ l à 0 °C, l ⟶ g à 78 °C
Prenons le diagramme de phase du dioxyde de carbone illustré à la figure\(\PageIndex{5}\) comme autre exemple. La courbe solide-liquide présente une pente positive, ce qui indique que le point de fusion du CO 2 augmente avec la pression, comme c'est le cas pour la plupart des substances (l'eau étant une exception notable, comme décrit précédemment). Notez que le point triple est bien supérieur à 1 atm, ce qui indique que le dioxyde de carbone ne peut pas exister sous forme liquide dans des conditions de pression ambiante. Au lieu de cela, le refroidissement du dioxyde de carbone gazeux à 1 atm entraîne son dépôt à l'état solide. De même, le dioxyde de carbone solide ne fond pas à une pression de 1 atm mais se sublime pour produire du CO 2 gazeux. Enfin, notez que le point critique pour le dioxyde de carbone est observé à une température et une pression relativement modestes par rapport à l'eau.
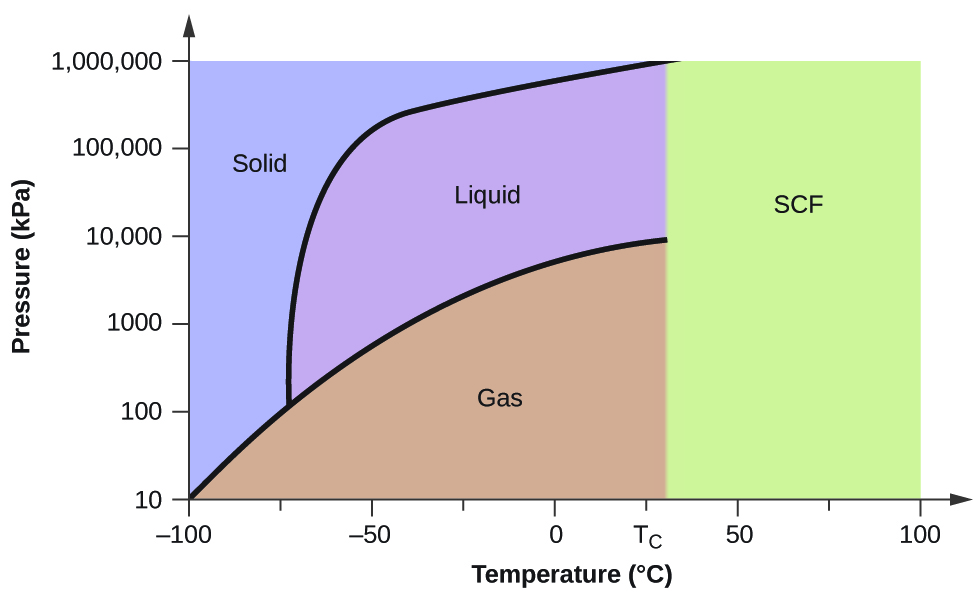
À l'aide du diagramme de phase du dioxyde de carbone illustré à la Figure 10.4.5, déterminez l'état du CO 2 aux températures et pressions suivantes :
- −30 °C et 2000 kPa
- −60 °C et 1 000 kPa
- −60 °C et 100 kPa
- 20 °C et 1500 kPa
- 0 °C et 100 kPa
- 20 °C et 100 kPa
Solution
À l'aide du diagramme de phase du dioxyde de carbone fourni, nous pouvons déterminer que l'état du CO 2 à chaque température et pression indiquées est le suivant : (a) liquide ; (b) solide ; (c) gaz ; (d) liquide ; (e) gaz ; (f) gaz ; (f) gaz.
Déterminez les changements de phase que subit le dioxyde de carbone lorsque sa température varie, maintenant ainsi sa pression constante à 1500 kPa ? À 500 kPa ? À quelles températures approximatives ces changements de phase se produisent-ils ?
- Réponse
-
à 150 kPa : s⟶ l à −45 °C, l⟶ g à −10 °C ; à 500 kPa : s⟶ g à −58 °C
Fluides supercritiques
Si nous plaçons un échantillon d'eau dans un récipient hermétique à 25 °C, que nous retirons l'air et que nous laissons l'équilibre vaporisation-condensation s'établir, nous nous retrouvons avec un mélange d'eau liquide et de vapeur d'eau à une pression de 0,03 atm. Une frontière distincte entre le liquide le plus dense et le gaz le moins dense est clairement observée. Lorsque nous augmentons la température, la pression de la vapeur d'eau augmente, comme le décrit la courbe liquide-gaz dans le diagramme de phase de l'eau (Figure\(\PageIndex{2}\)), et un équilibre biphasique entre les phases liquide et gazeuse persiste. À une température de 374 °C, la pression de vapeur a atteint 218 atm, et toute nouvelle augmentation de température entraîne la disparition de la limite entre les phases liquide et vapeur. Toute l'eau contenue dans le récipient est maintenant présente dans une phase unique dont les propriétés physiques sont intermédiaires entre celles des états gazeux et liquides. Cette phase de la matière est appelée fluide supercritique, et la température et la pression au-dessus desquelles cette phase existe constituent le point critique (Figure\(\PageIndex{5}\)). Au-delà de sa température critique, un gaz ne peut pas être liquéfié, quelle que soit la pression appliquée. La pression requise pour liquéfier un gaz à sa température critique est appelée pression critique. Les températures critiques et les pressions critiques de certaines substances courantes sont indiquées dans le tableau\(\PageIndex{1}\).
| Substance | Température critique (K) | Pression critique (atm) |
|---|---|---|
| hydrogène | 33,2 | 12,8 |
| nitrogène | 126,0 | 33,5 |
| oxygène | 154,3 | 49,7 |
| dioxyde de carbone | 304,2 | 73,0 |
| ammoniac | 405,5 | 111,5 |
| dioxyde de soufre | 430,3 | 77,7 |
| eau | 647,1 | 217,7 |
Comme un gaz, un fluide supercritique se dilate et remplit un récipient, mais sa densité est beaucoup plus élevée que les densités de gaz habituelles, étant généralement proche de celles des liquides. Comme les liquides, ces fluides sont capables de dissoudre des solutés non volatils. Ils ne présentent pratiquement aucune tension superficielle et de très faibles viscosités, ce qui leur permet de pénétrer plus efficacement de très petites ouvertures dans un mélange solide et d'éliminer les composants solubles. Ces propriétés font des fluides supercritiques des solvants extrêmement utiles pour une large gamme d'applications. Par exemple, le dioxyde de carbone supercritique est devenu un solvant très populaire dans l'industrie alimentaire. Il est utilisé pour décaféiner le café, éliminer les graisses des croustilles et extraire les composés aromatiques et parfumés des huiles d'agrumes. Il est non toxique, relativement peu coûteux et n'est pas considéré comme un polluant. Après utilisation, le CO 2 peut être facilement récupéré en réduisant la pression et en collectant le gaz résultant.
Si nous secouons un extincteur au dioxyde de carbone par temps frais (18 °C), nous pouvons entendre du CO 2 liquide se balader à l'intérieur du cylindre. Cependant, la même bouteille ne semble pas contenir de liquide par une chaude journée d'été (35 °C). Expliquez ces observations.
Solution
Par temps frais, la température du CO 2 est inférieure à la température critique du CO 2, 304 K ou 31 °C (tableau\(\PageIndex{1}\)), de sorte que du CO 2 liquide est présent dans la bouteille. Par temps chaud, la température du CO 2 est supérieure à sa température critique de 31 °C. Au-delà de cette température, aucune pression ne peut liquéfier le CO 2, de sorte qu'il n'y a pas de CO 2 liquide dans l'extincteur.
L'ammoniac peut être liquéfié par compression à température ambiante ; l'oxygène ne peut pas être liquéfié dans ces conditions. Pourquoi les deux gaz ont-ils un comportement différent ?
- Réponse
-
La température critique de l'ammoniac est de 405,5 K, ce qui est supérieur à la température ambiante. La température critique de l'oxygène est inférieure à la température ambiante ; l'oxygène ne peut donc pas être liquéfié à température ambiante.
Café décaféiné à l'aide de CO 2 supercritique
Le café est la deuxième matière première la plus échangée au monde, après le pétrole. Partout dans le monde, les gens adorent l'arôme et le goût du café. Beaucoup d'entre nous dépendent également d'un composant du café, la caféine, pour nous aider à démarrer le matin ou à rester vigilants l'après-midi. Mais tard dans la journée, l'effet stimulant du café peut vous empêcher de dormir. Vous pouvez donc choisir de boire du café décaféiné le soir.
Depuis le début des années 1900, de nombreuses méthodes ont été utilisées pour décaféiner le café. Toutes présentent des avantages et des inconvénients et dépendent toutes des propriétés physiques et chimiques de la caféine. Comme la caféine est une molécule quelque peu polaire, elle se dissout bien dans l'eau, un liquide polaire. Cependant, étant donné que la plupart des plus de 400 autres composés qui contribuent au goût et à l'arôme du café se dissolvent également dans l'H 2 O, les procédés de décaféination à l'eau chaude peuvent également éliminer certains de ces composés, altérant ainsi l'odeur et le goût du café décaféiné. Le dichlorométhane (CH 2 Cl 2) et l'acétate d'éthyle (CH 3 CO 2 C 2 H 5) ont une polarité similaire à celle de la caféine et sont donc des solvants très efficaces pour l'extraction de la caféine, mais tous deux éliminent également certains composants aromatiques et aromatiques, ainsi que leur utilisation nécessite de longs temps d'extraction et de nettoyage. Ces deux solvants étant toxiques, des préoccupations sanitaires ont été soulevées concernant l'effet du solvant résiduel restant dans le café décaféiné.
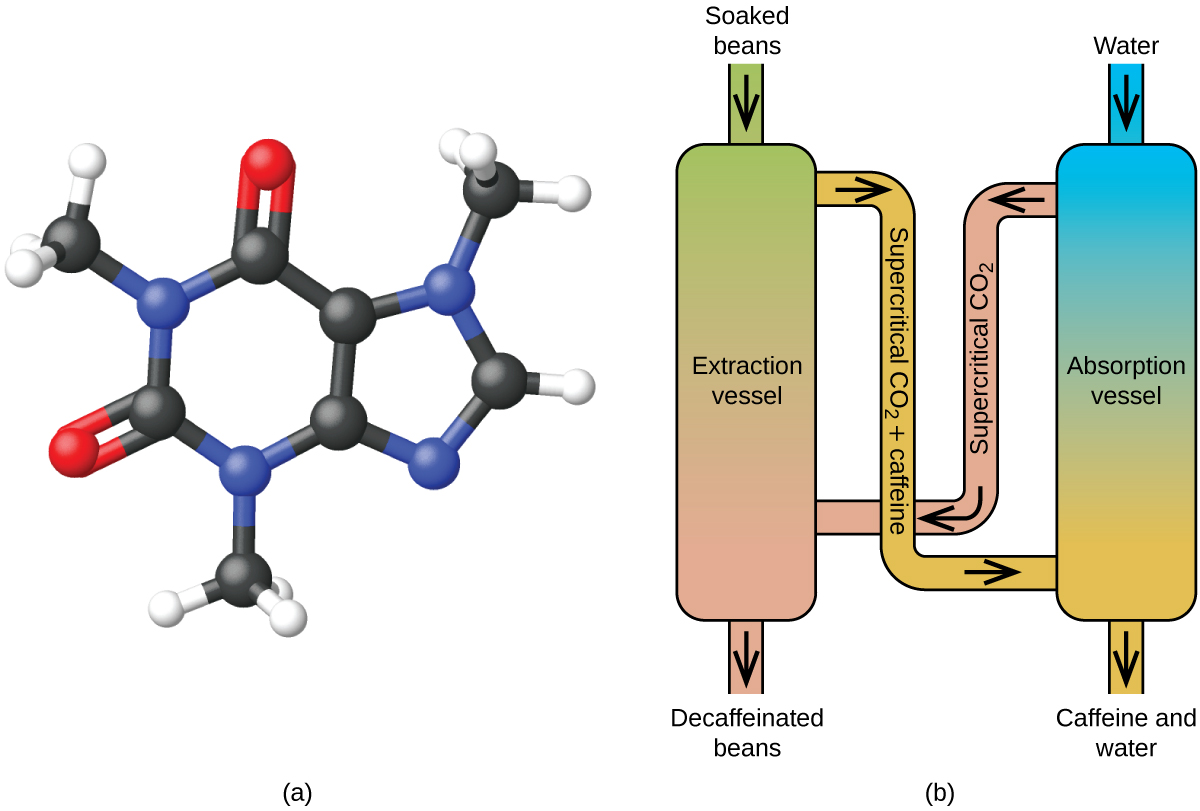
L'extraction de fluides supercritiques à l'aide de dioxyde de carbone est désormais largement utilisée comme méthode de décaféination plus efficace et plus respectueuse de l'environnement (Figure\(\PageIndex{7}\)). À des températures supérieures à 304,2 K et à des pressions supérieures à 7376 kPa, le CO 2 est un fluide supercritique qui possède des propriétés à la fois gazeuses et liquides. Comme un gaz, il pénètre profondément dans les grains de café ; comme un liquide, il dissout efficacement certaines substances. L'extraction supercritique au dioxyde de carbone des grains de café cuits à la vapeur élimine 97 à 99 % de la caféine, laissant ainsi intacts les composés aromatiques et aromatiques du café. Le CO 2 étant un gaz dans des conditions standard, son élimination des grains de café extraits est facile, tout comme la récupération de la caféine à partir de l'extrait. La caféine récupérée à partir des grains de café par ce procédé est un produit précieux qui peut être utilisé ultérieurement comme additif à d'autres aliments ou médicaments.
Résumé
Les conditions de température et de pression auxquelles une substance existe à l'état solide, liquide et gazeux sont résumées dans un diagramme de phase pour cette substance. Les diagrammes de phase sont des tracés combinés de trois courbes d'équilibre pression-température : solide-liquide, liquide-gaz et solide-gaz. Ces courbes représentent les relations entre les températures et les pressions de transition de phase. Le point d'intersection des trois courbes représente le point triple de la substance, à savoir la température et la pression auxquelles les trois phases sont en équilibre. À des pressions inférieures au point triple, une substance ne peut pas exister à l'état liquide, quelle que soit sa température. L'extrémité de la courbe liquide-gaz représente le point critique de la substance, à savoir la pression et la température au-dessus desquelles une phase liquide ne peut pas exister.
Lexique
- point critique
- température et pression au-dessus desquelles un gaz ne peut pas être condensé en liquide
- diagramme de phase
- graphique pression/température résumant les conditions dans lesquelles les phases d'une substance peuvent exister
- fluide supercritique
- substance à une température et à une pression supérieures à son point critique ; présente des propriétés intermédiaires entre celles des états gazeux et liquides
- point triple
- température et pression auxquelles les phases vapeur, liquide et solide d'une substance sont en équilibre


