10.1 : Forces intermoléculaires
- Page ID
- 193927
- Décrire les types de forces intermoléculaires possibles entre des atomes ou des molécules dans des phases condensées (forces de dispersion, attractions dipôle-dipôle et liaisons hydrogène)
- Identifier les types de forces intermoléculaires subies par des molécules spécifiques en fonction de leurs structures
- Expliquer la relation entre les forces intermoléculaires présentes dans une substance et les températures associées aux changements de son état physique
Comme pour les substances gazeuses, la théorie moléculaire cinétique peut être utilisée pour expliquer le comportement des solides et des liquides. Dans la description qui suit, le terme particule sera utilisé pour désigner un atome, une molécule ou un ion. Notez que nous utiliserons l'expression populaire « attraction intermoléculaire » pour désigner les forces d'attraction entre les particules d'une substance, que ces particules soient des molécules, des atomes ou des ions.
Considérez ces deux aspects des environnements au niveau moléculaire dans les matières solides, liquides et gazeuses :
- Les particules d'un solide sont étroitement entassées et souvent disposées selon un schéma régulier ; dans un liquide, elles sont proches les unes des autres sans arrangement régulier ; dans un gaz, elles sont éloignées les unes des autres sans arrangement régulier.
- Les particules d'un solide vibrent autour de positions fixes et ne se déplacent généralement pas les unes par rapport aux autres ; dans un liquide, elles se croisent mais restent en contact essentiellement constant ; dans un gaz, elles se déplacent indépendamment les unes des autres sauf lorsqu'elles entrent en collision.
Les différences de propriétés d'un solide, d'un liquide ou d'un gaz reflètent l'intensité des forces d'attraction entre les atomes, les molécules ou les ions qui composent chaque phase. La phase dans laquelle une substance existe dépend de l'étendue relative de ses forces intermoléculaires (IMF) et des énergies cinétiques (KE) de ses molécules. Les IMF sont les différentes forces d'attraction qui peuvent exister entre les atomes et les molécules d'une substance en raison de phénomènes électrostatiques, comme cela sera détaillé dans ce module. Ces forces servent à maintenir les particules proches les unes des autres, tandis que le KE des particules fournit l'énergie nécessaire pour surmonter les forces d'attraction et ainsi augmenter la distance entre les particules. La figure\(\PageIndex{1}\) montre comment des changements d'état physique peuvent être induits par la modification de la température, donc de la KE moyenne, d'une substance donnée.
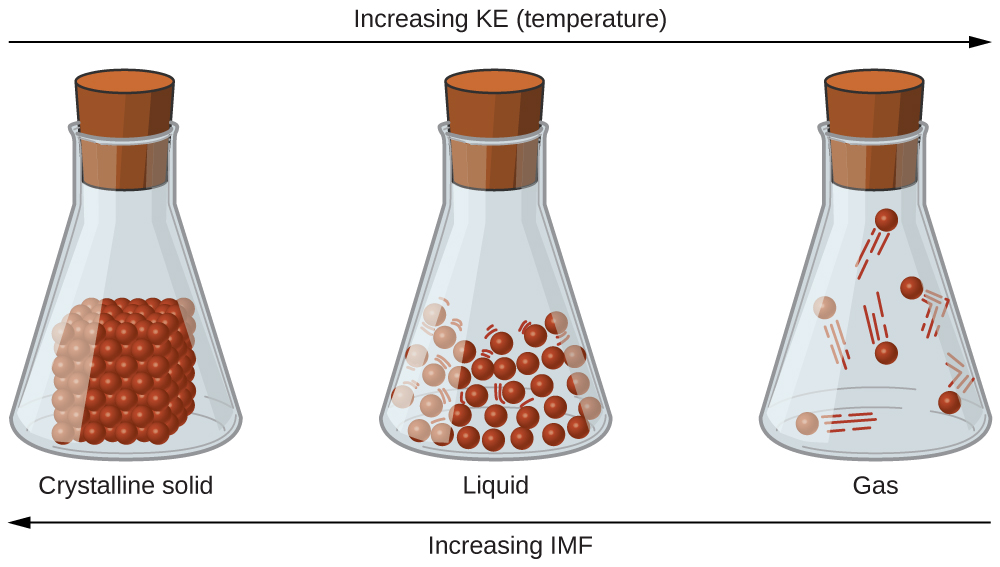
À titre d'exemple des processus décrits dans cette figure, considérez un échantillon d'eau. Lorsque l'eau gazeuse est suffisamment refroidie, les attractions entre les molécules d'H 2 O seront capables de les maintenir ensemble lorsqu'elles entrent en contact les unes avec les autres ; le gaz se condense pour former de l'H 2 O. Par exemple, de l'eau liquide se forme à l'extérieur d'un verre froid sous forme d'eau la vapeur dans l'air est refroidie par le verre froid, comme le montre la figure\(\PageIndex{2}\).

On peut également liquéfier de nombreux gaz en les comprimant, si la température n'est pas trop élevée. L'augmentation de la pression rapproche les molécules d'un gaz, de sorte que les attractions entre les molécules deviennent fortes par rapport à leur KE. Par conséquent, ils forment des liquides. Le butane, C 4 H 10, est le carburant utilisé dans les briquets jetables et est un gaz à température et pression standard. À l'intérieur du compartiment à carburant du briquet, le butane est comprimé à une pression qui entraîne sa condensation jusqu'à l'état liquide, comme le montre la figure\(\PageIndex{3}\).

Enfin, si la température d'un liquide devient suffisamment basse ou si la pression sur le liquide devient suffisamment élevée, les molécules du liquide n'ont plus assez de KE pour surmonter l'IMF qui les sépare, et un solide se forme. Une discussion plus approfondie de ces changements d'état et d'autres changements d'état, ou transitions de phase, est fournie dans un module ultérieur de ce chapitre.
Forces entre les molécules
Dans des conditions appropriées, les attractions entre toutes les molécules de gaz les amèneront à former des liquides ou des solides. Cela est dû à des forces intermoléculaires, et non à des forces intra-moléculaires. Les forces intra-moléculaires sont celles qui, au sein de la molécule, maintiennent l'unité de la molécule, par exemple, les liaisons entre les atomes. Les forces intermoléculaires sont les attraits entre les molécules, qui déterminent de nombreuses propriétés physiques d'une substance. La figure\(\PageIndex{4}\) illustre ces différentes forces moléculaires. Les forces de ces forces d'attraction varient considérablement, bien que les IMF entre les petites molécules soient généralement faibles par rapport aux forces intramoléculaires qui lient les atomes entre eux au sein d'une molécule. Par exemple, pour surmonter les IMF d'une mole de HCl liquide et le convertir en HCl gazeux, il suffit d'environ 17 kilojoules. Cependant, pour rompre les liaisons covalentes entre les atomes d'hydrogène et de chlore d'une mole de HCl, il faut environ 25 fois plus d'énergie, soit 430 kilojoules.
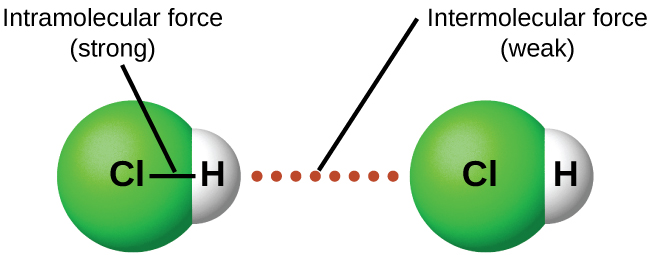
Toutes les forces d'attraction entre les atomes neutres et les molécules sont connues sous le nom de forces de Van der Waals, bien qu'elles soient généralement appelées attraction intermoléculaire de manière plus informelle. Nous examinerons les différents types de fichiers IMF dans les trois prochaines sections de ce module.
Forces de dispersion
L'une des trois forces de Van der Waals est présente dans toutes les phases condensées, quelle que soit la nature des atomes ou des molécules composant la substance. Cette force d'attraction est appelée force de dispersion de Londres en l'honneur du physicien américain d'origine allemande Fritz London qui, en 1928, l'a expliquée pour la première fois. Cette force est souvent appelée simplement force de dispersion. Comme les électrons d'un atome ou d'une molécule sont en mouvement constant (ou que la position de l'électron est soumise à une variabilité mécanique quantique), à tout moment, un atome ou une molécule peut développer un dipôle temporaire et instantané si ses électrons sont distribués de manière asymétrique. La présence de ce dipôle peut, à son tour, déformer les électrons d'un atome ou d'une molécule voisin, produisant ainsi un dipôle induit. Ces deux dipôles temporaires qui fluctuent rapidement se traduisent donc par une attraction électrostatique relativement faible entre les espèces, une force dite de dispersion comme celle illustrée à la figure\(\PageIndex{5}\).
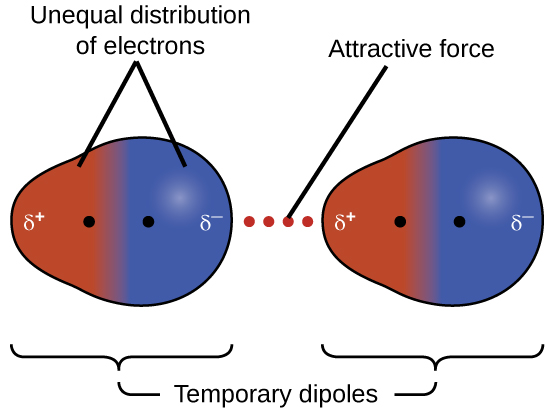
Les forces de dispersion qui se développent entre les atomes de différentes molécules peuvent attirer les deux molécules l'une vers l'autre. Les forces sont cependant relativement faibles et ne deviennent significatives que lorsque les molécules sont très proches. Les atomes et les molécules plus gros et plus lourds présentent des forces de dispersion plus fortes que les atomes et les molécules plus petits et plus légers. Le F 2 et le Cl 2 sont des gaz à température ambiante (reflétant des forces d'attraction plus faibles) ; le Br 2 est un liquide et l'I 2 est un solide (reflétant des forces d'attraction plus fortes). Les tendances des points de fusion et d'ébullition observés pour les halogènes démontrent clairement cet effet, comme le montre le tableau\(\PageIndex{1}\).
| halogène | Masse molaire | Rayon atomique | Point de fusion | Point d'ébullition |
|---|---|---|---|---|
| fluor, F 2 | 38 g/mol | 72 heures | 53 KG | 85 KG |
| chlore, Cl 2 | 71 g/mol | 21 h | 172 KG | 238 KG |
| brome, Br 2 | 160 g/mol | 14 h 14 | 266 KG | 332 KG |
| iode, I 2 | 254 g/mol | 13 h 33 | 387 KG | 457 KG |
| Bastatine, Art 2 | 420 g/mol | 15 h 50 | 575 KG | 610 KG |
L'augmentation des points de fusion et d'ébullition avec l'augmentation de la taille atomique/moléculaire peut être rationalisée en examinant comment la force des forces de dispersion est affectée par la structure électronique des atomes ou des molécules de la substance. Dans un atome plus gros, les électrons de valence sont, en moyenne, plus éloignés des noyaux que dans un atome plus petit. Ainsi, ils sont moins serrés et peuvent plus facilement former les dipôles temporaires qui produisent l'attraction. La mesure de la facilité ou de la difficulté pour une autre charge électrostatique (par exemple, un ion proche ou une molécule polaire) de déformer la distribution de charge d'une molécule (son nuage d'électrons) est connue sous le nom de polarisabilité. Une molécule qui possède un nuage de charge facilement déformé est dite très polarisable et aura de grandes forces de dispersion ; une molécule dont le nuage de charge est difficile à déformer n'est pas très polarisable et aura de faibles forces de dispersion.
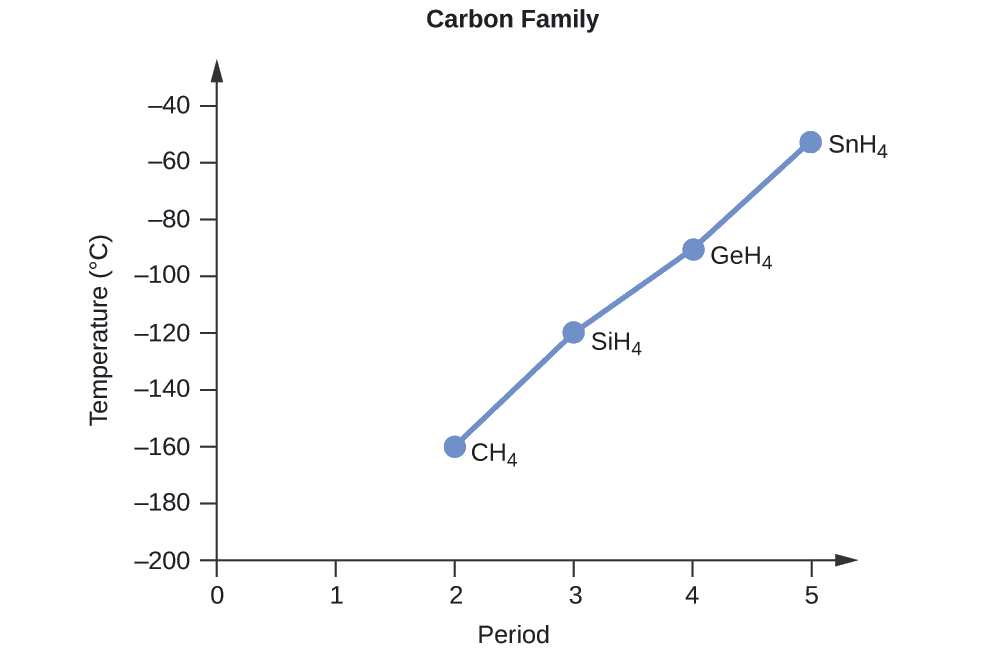
Classez les composés suivants d'un élément du groupe 14 et d'hydrogène du point d'ébullition le plus bas au point d'ébullition le plus élevé : CH 4, SiH 4, GeH 4 et SnH 4. Expliquez votre raisonnement.
Solution
En appliquant les compétences acquises dans le chapitre sur les liaisons chimiques et la géométrie moléculaire, tous ces composés devraient être non polaires, de sorte qu'ils ne peuvent subir que des forces de dispersion : plus la molécule est petite, moins elle est polarisable et plus les forces de dispersion sont faibles ; plus la molécule est grande, plus la forces de dispersion. Les masses molaires du CH 4, du SiH 4, du GeH 4 et du SnH 4 sont d'environ 16 g/mol, 32 g/mol, 77 g/mol et 123 g/mol, respectivement. Par conséquent, le CH 4 devrait avoir le point d'ébullition le plus bas et le SnH 4 le point d'ébullition le plus élevé. L'ordre du point d'ébullition le plus bas au point d'ébullition le plus élevé devrait être
CH 4 < SiH 4 < GeH 4 < SnH 4
Un graphique des points d'ébullition réels de ces composés par rapport à la période des éléments du groupe 14 montre que cette prédiction est correcte :
Triez les hydrocarbures suivants du point d'ébullition le plus bas au point d'ébullition le plus élevé : C 2 H 6, C 3 H 8 et C 4 H 10.
- Réponse
-
Tous ces composés sont non polaires et n'ont que des forces de dispersion de Londres : plus la molécule est grosse, plus les forces de dispersion sont importantes et plus le point d'ébullition est élevé. L'ordre du point d'ébullition le plus bas au plus haut est donc
C 2 H 6 < C 3 H 8 < C 4 H 10.
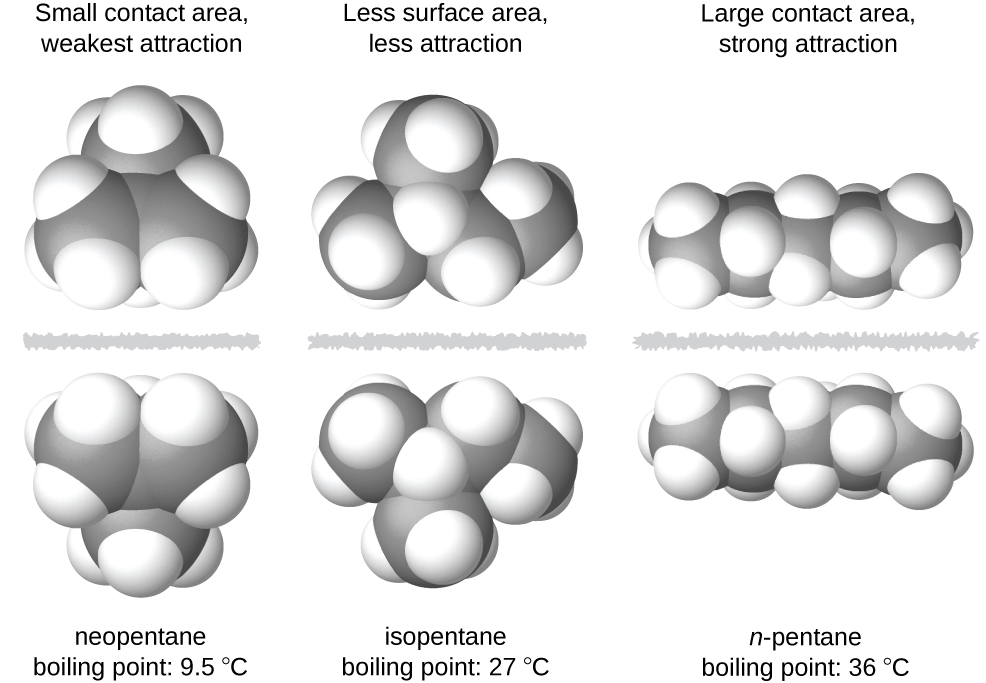
La forme des molécules influe également sur l'amplitude des forces de dispersion entre elles. Par exemple, les points d'ébullition des isomères n-pentane, isopentane et néopentane (illustrés sur la figure\(\PageIndex{6}\)) sont respectivement de 36 °C, 27 °C et 9,5 °C. Même si ces composés sont composés de molécules ayant la même formule chimique, C 5 H 12, la différence des points d'ébullition suggère que les forces de dispersion dans la phase liquide sont différentes, étant les plus élevées pour le n-pentane et les plus faibles pour le néopentane. La forme allongée du n-pentane fournit une plus grande surface disponible pour le contact entre les molécules, ce qui se traduit par des forces de dispersion proportionnellement plus fortes. La forme plus compacte de l'isopentane offre une plus petite surface disponible pour le contact intermoléculaire et, par conséquent, des forces de dispersion plus faibles. Les molécules de néopentane sont les plus compactes des trois, offrant la plus faible surface disponible pour le contact intermoléculaire et, par conséquent, les forces de dispersion les plus faibles. Ce comportement est analogue aux connexions qui peuvent se former entre les bandes de fixations de marque VELCRO : plus la surface de contact de la bande est grande, plus la connexion est solide.
Les geckos ont une incroyable capacité à adhérer à la plupart des surfaces. Ils peuvent courir rapidement sur des murs lisses et sur des plafonds dépourvus de prise pour les orteils, et ils le font sans avoir de ventouses ou de substance collante sur leurs orteils. Et si un gecko peut facilement lever ses pieds lorsqu'il marche sur une surface, si vous essayez de le saisir, il adhère à la surface. Comment les geckos (ainsi que les araignées et certains autres insectes) sont-ils capables de le faire ? Bien que ce phénomène soit étudié depuis des centaines d'années, les scientifiques n'ont découvert que récemment les détails du processus qui permet aux pieds des geckos de se comporter ainsi.

Les orteils des geckos sont recouverts de centaines de milliers de petits poils appelés soies, qui se ramifient à tour de rôle en centaines de minuscules pointes plates et triangulaires appelées spatules. Le grand nombre de spatules sur ses soies fournit à un gecko, illustré sur la figure\(\PageIndex{7}\), une grande surface totale pouvant adhérer à une surface. En 2000, Kellar Autumn, qui dirige une équipe de recherche multi-institutionnelle sur les gecko, a découvert que les geckos adhéraient aussi bien au dioxyde de silicium polaire qu'à l'arséniure de gallium non polaire. Cela a prouvé que les geckos adhèrent aux surfaces en raison des forces de dispersion, c'est-à-dire de faibles attractions intermoléculaires résultant de distributions de charge temporaires et synchronisées entre des molécules adjacentes. Bien que les forces de dispersion soient très faibles, l'attraction totale sur des millions de spatules est suffisamment importante pour supporter plusieurs fois le poids du gecko.
En 2014, deux scientifiques ont développé un modèle pour expliquer comment les geckos peuvent rapidement passer de « collants » à « non collants ». Alex Greaney et Congcong Hu de l'Oregon State University ont décrit comment les geckos peuvent y parvenir en modifiant l'angle entre leurs spatules et la surface. Les pieds des geckos, qui ne sont normalement pas collants, deviennent collants lorsqu'une faible force de cisaillement est appliquée. En recourbant et en déroulant leurs orteils, les geckos peuvent alterner entre coller et décoller d'une surface, et ainsi se déplacer facilement sur celle-ci. D'autres recherches pourraient éventuellement mener au développement de meilleurs adhésifs et d'autres applications.
Regardez cette vidéo pour en savoir plus sur les recherches de Kellar Autumn qui ont déterminé que les forces de Van der Waals sont responsables de la capacité d'un gecko à s'accrocher et à grimper.
Activités à Dipole-Dipole
Souvenez-vous du chapitre sur les liaisons chimiques et la géométrie moléculaire que les molécules polaires ont une charge positive partielle d'un côté et une charge partiellement négative de l'autre côté de la molécule, une séparation de charge appelée dipôle. Prenons l'exemple d'une molécule polaire telle que le chlorure d'hydrogène, le HCl. Dans la molécule de HCl, l'atome de Cl le plus électronégatif porte la charge négative partielle, tandis que l'atome H le moins électronégatif porte la charge positive partielle. Une force d'attraction entre les molécules de HCl résulte de l'attraction entre l'extrémité positive d'une molécule de HCl et l'extrémité négative d'une autre. Cette force d'attraction est appelée attraction dipôle-dipôle, c'est-à-dire la force électrostatique entre l'extrémité partiellement positive d'une molécule polaire et l'extrémité partiellement négative d'une autre, comme illustré sur la figure\(\PageIndex{8}\).
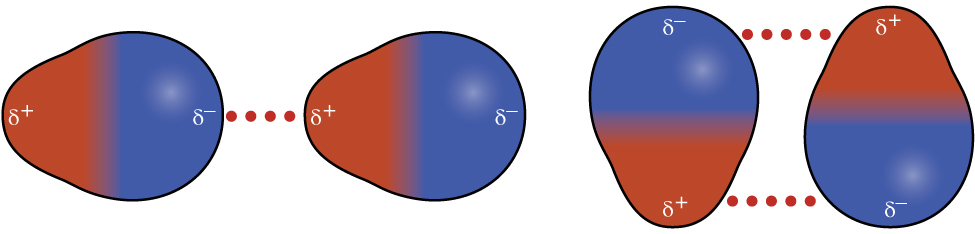
L'effet d'une attraction dipole-dipolaire est évident lorsque nous comparons les propriétés des molécules de HCl à celles des molécules de F 2 non polaires. Le HCl et le F 2 sont constitués du même nombre d'atomes et ont approximativement la même masse moléculaire. À une température de 150 K, les molécules des deux substances auraient la même valeur moyenne de KE. Cependant, les attractions dipoles-dipolaires entre les molécules de HCl sont suffisantes pour les amener à « se coller » pour former un liquide, alors que les forces de dispersion relativement plus faibles entre les molécules non polaires de F 2 ne le sont pas, de sorte que cette substance est gazeuse à cette température. Le point d'ébullition normal plus élevé du HCl (188 K) par rapport au F 2 (85 K) reflète la plus grande force des attractions dipoles-dipolaires entre les molécules de HCl, par rapport aux attractions entre les molécules de F 2 non polaires. Nous utiliserons souvent des valeurs telles que les points d'ébullition ou de congélation, ou les enthalpies de vaporisation ou de fusion, comme indicateurs de la force relative des IMF d'attraction présents dans différentes substances.
Prédisez lequel aura le point d'ébullition le plus élevé : N 2 ou CO. Expliquez votre raisonnement.
Solution
Le CO et le N 2 sont tous deux des molécules diatomiques d'une masse d'environ 28 amu, de sorte qu'ils subissent des forces de dispersion similaires à celles de Londres. Comme le CO est une molécule polaire, il présente des attraits dipolaires et dipolaires. Comme le N 2 n'est pas polaire, ses molécules ne peuvent pas présenter d'attractions dipolaires et dipolaires. Les attractions dipole-dipolaire entre les molécules de CO sont comparativement plus fortes que les forces de dispersion entre les molécules de N 2 non polaires, de sorte que le CO devrait avoir le point d'ébullition le plus élevé.
Une méthode courante de préparation de l'oxygène est la décomposition
Prédisez lequel aura le point d'ébullition le plus élevé :\(\ce{ICl}\) ou\(\ce{Br2}\). Expliquez votre raisonnement.
- Réponse
-
ICl. L'ICl et le Br 2 ont des masses similaires (~160 amu) et subissent donc des forces de dispersion similaires à Londres. L'ICl est polaire et présente donc également des attractions dipoles-dipolaires ; Br 2 est non polaire et ne le fait pas. Les attractions dipôle-dipôle relativement plus fortes nécessitent plus d'énergie pour être surmontées, de sorte que l'ICl aura le point d'ébullition le plus élevé.
Liaison hydrogène
Le fluorure de nitrosyle (ONF, masse moléculaire 49 amu) est un gaz à température ambiante. L'eau (H 2 O, masse moléculaire 18 amu) est un liquide, même si sa masse moléculaire est plus faible. Nous ne pouvons clairement pas attribuer cette différence entre les deux composés aux forces de dispersion. Les deux molécules ont à peu près la même forme et l'ONF est la molécule la plus lourde et la plus grosse. Il devrait donc subir des forces de dispersion plus importantes. De plus, nous ne pouvons pas attribuer cette différence de points d'ébullition à des différences dans les moments dipolaires des molécules. Les deux molécules sont polaires et présentent des moments dipolaires comparables. La grande différence entre les points d'ébullition est due à une attraction dipole-dipôle particulièrement forte qui peut se produire lorsqu'une molécule contient un atome d'hydrogène lié à un atome de fluor, d'oxygène ou d'azote (les trois éléments les plus électronégatifs). La très grande différence d'électronégativité entre l'atome H (2.1) et l'atome auquel il est lié (4,0 pour un atome F, 3,5 pour un atome O ou 3,0 pour un atome N), combinée à la très petite taille d'un atome H et aux tailles relativement petites des atomes F, O ou N, conduit à une des charges avec ces atomes. Les molécules contenant des fractions F-H, O-H ou N-H sont très fortement attirées par des fractions similaires présentes dans les molécules voisines, un type d'attraction dipole-dipôle particulièrement puissant appelé liaison hydrogène. Des exemples de liaisons hydrogène incluent HF HF, H 2 OHOH et H 3 NHNH 2, dans lesquels les liaisons hydrogène sont désignées par des points. La figure\(\PageIndex{9}\) illustre la liaison hydrogène entre les molécules d'eau.
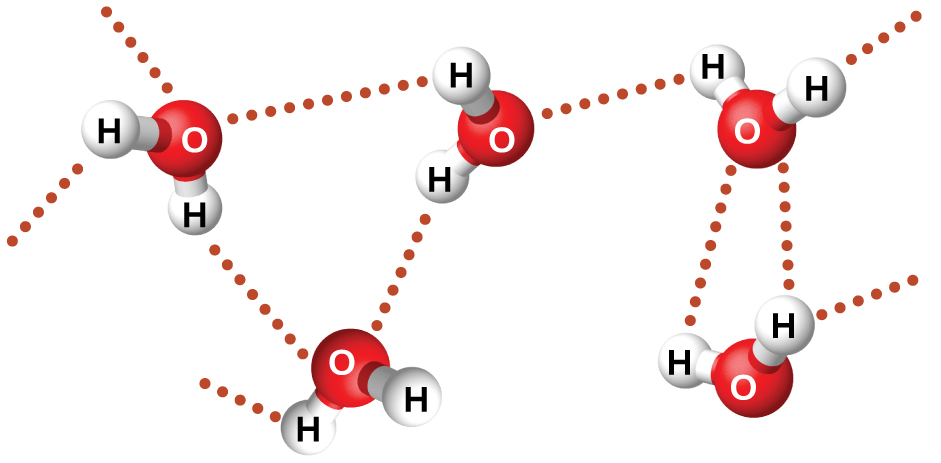
Malgré l'utilisation du mot « liaison », gardez à l'esprit que les liaisons hydrogène sont des forces d'attraction intermoléculaires, et non des forces d'attraction intramoléculaires (liaisons covalentes). Les liaisons hydrogène sont beaucoup plus faibles que les liaisons covalentes, seulement 5 à 10 % plus fortes, mais elles sont généralement beaucoup plus fortes que les autres attractions dipôles-dipôles et forces de dispersion.
Les liaisons hydrogène ont un effet prononcé sur les propriétés des phases condensées (liquides et solides). Par exemple, considérez les tendances des points d'ébullition pour les hydrures binaires du groupe 15 (NH 3, PH 3, AsH 3 et SbH 3), les hydrures du groupe 16 (H 2 O, H 2 S, H 2 Se et H 2 Te) et les hydrures du groupe 17 (HF, HCl, HBr, et BONJOUR). Les points d'ébullition des trois hydrures les plus lourds pour chaque groupe sont tracés sur la figure\(\PageIndex{10}\). Au fur et à mesure que nous descendons dans l'un de ces groupes, les polarités des molécules diminuent légèrement, tandis que la taille des molécules augmente considérablement. L'effet de forces de dispersion de plus en plus fortes domine celui des attractions dipoles-dipôles de plus en plus faibles, et les points d'ébullition augmentent régulièrement. Pour les hydrures des groupes 15, 16 et 17, les points d'ébullition de chaque classe de composés augmentent avec l'augmentation de la masse moléculaire des éléments au cours des périodes 3, 4 et 5.
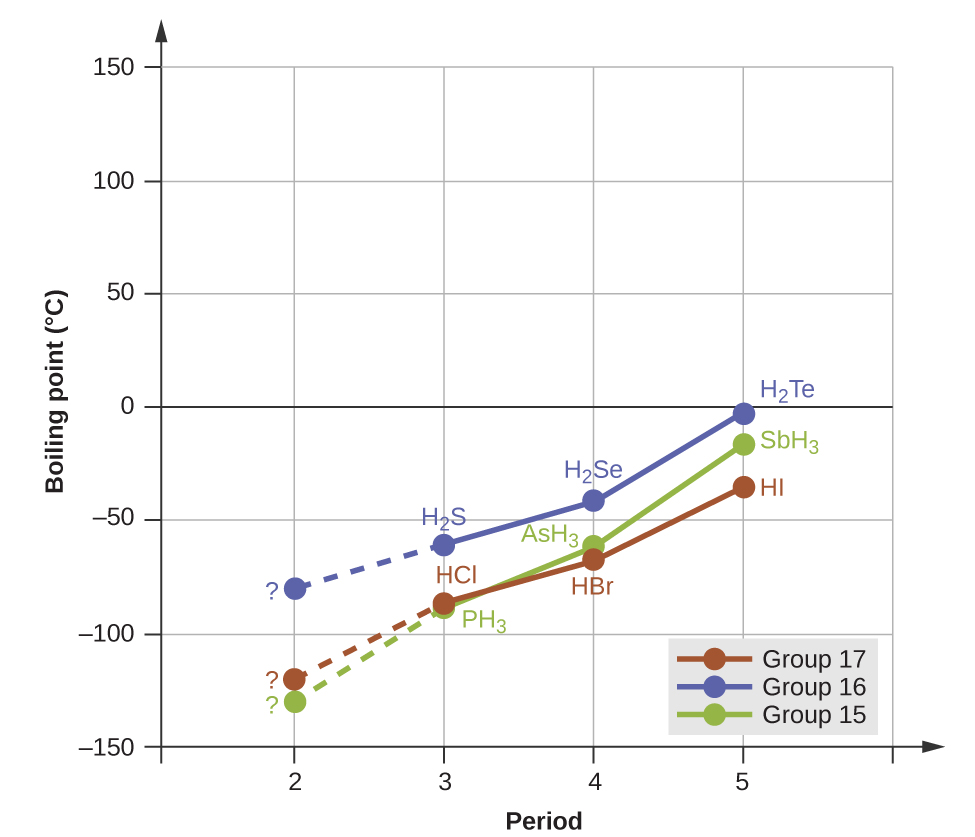
Si nous utilisons cette tendance pour prédire les points d'ébullition de l'hydrure le plus léger de chaque groupe, nous pouvons nous attendre à ce que NH 3 bouillonne à environ −120 °C, H 2 O à environ −80 °C et HF à environ −110 °C. Cependant, lorsque nous mesurons les points d'ébullition de ces composés, nous constatons qu'ils sont considérablement plus élevé que ce que les tendances prédisent, comme le montre la figure\(\PageIndex{10}\). Le contraste saisissant entre nos prédictions naïves et la réalité fournit des preuves convaincantes de la force de la liaison hydrogène.
Considérez les composés diméthyléther (CH 3 OCH 3), éthanol (CH 3 CH 2 OH) et propane (CH 3 CH 2 CH 3). Leurs points d'ébullition, qui ne sont pas nécessairement dans l'ordre, sont de −42,1 °C, −24,8 °C et 78,4 °C. Faites correspondre chaque composé à son point d'ébullition. Expliquez votre raisonnement.
Solution
Les formes prédites par le VSEPR du CH 3 OCH 3, du CH 3 CH 2 OH et du CH 3 CH 2 CH 3 sont similaires, de même que leurs masses molaires (46 g/mol, 46 g/mol et 44 g/mol, respectivement), de sorte qu'ils présenteront des forces de dispersion similaires. Le CH 3 CH 2 CH 3 étant non polaire, il ne peut présenter que des forces de dispersion. Comme le CH 3 OCH 3 est polaire, il bénéficiera également d'attractions dipoles-dipolaires. Enfin, le CH 3 CH 2 OH possède un groupe −OH, et il subira donc l'attraction dipole-dipôle particulièrement forte connue sous le nom de liaison hydrogène. Ainsi, l'ordre en termes de force des IMF, et donc de points d'ébullition, est CH 3 CH 2 CH 3 < CH 3 OCH 3 < CH 3 CH 2 OH. Le point d'ébullition du propane est de −42,1 °C, le point d'ébullition du diméthyléther est de −24,8 °C et le point d'ébullition de l'éthanol est de 78,5 °C.
L'éthane (CH 3 CH 3) a un point de fusion de −183 °C et un point d'ébullition de −89 °C. Prédire les points de fusion et d'ébullition de la méthylamine (CH 3 NH 2). Expliquez votre raisonnement.
- Réponse
-
Les points de fusion et d'ébullition de la méthylamine devraient être nettement supérieurs à ceux de l'éthane. Le CH 3 CH 3 et le CH 3 NH 2 sont de taille et de masse similaires, mais la méthylamine possède un groupe −NH et peut donc présenter une liaison hydrogène. Cela augmente considérablement ses IMF, et donc ses points de fusion et d'ébullition. Il est difficile de prévoir les valeurs, mais les valeurs connues sont un point de fusion de −93 °C et un point d'ébullition de −6 °C.
Liaison hydrogène et ADN
L'acide désoxyribonucléique (ADN) est présent dans tous les organismes vivants et contient les informations génétiques qui déterminent les caractéristiques de l'organisme, fournissent le plan de fabrication des protéines nécessaires à la vie et servent de modèle pour transmettre ces informations à la progéniture de l'organisme. Une molécule d'ADN est constituée de deux chaînes (anti) parallèles de nucléotides répétés, qui forment sa structure double hélicoïdale bien connue, comme le montre la figure\(\PageIndex{10}\).
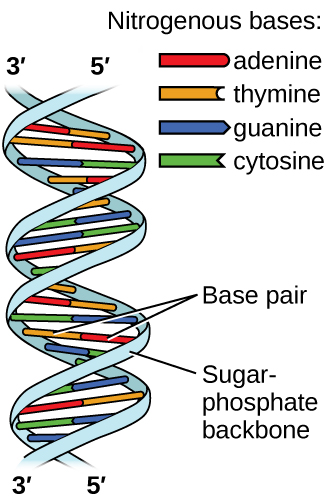
Chaque nucléotide contient un sucre (désoxyribose) lié à un groupe phosphate d'un côté et l'une des quatre bases azotées de l'autre. Deux des bases, la cytosine (C) et la thymine (T), sont des structures à anneau unique appelées pyrimidines. Les deux autres, l'adénine (A) et la guanine (G), sont des structures à double anneau appelées purines. Ces bases forment des paires de bases complémentaires composées d'une purine et d'une pyrimidine, l'adénine étant associée à la thymine et la cytosine à la guanine. Chaque paire de bases est maintenue ensemble par liaison hydrogène. A et T partagent deux liaisons hydrogène, C et G en partagent trois, et les deux paires ont une forme et une structure similaires Figure\(\PageIndex{12}\)
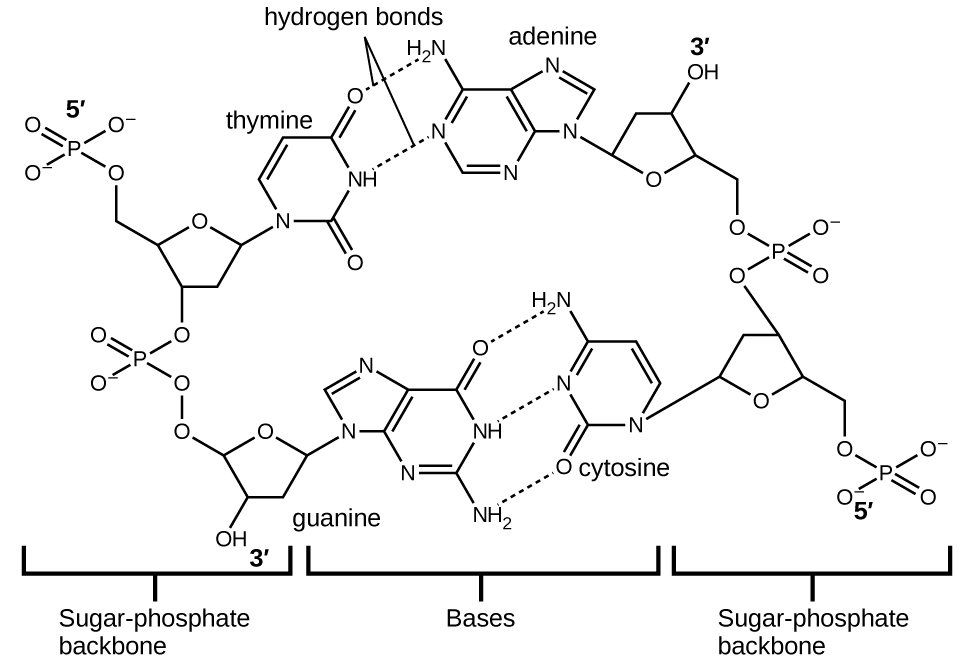
L'effet cumulé de millions de liaisons hydrogène maintient efficacement les deux brins d'ADN ensemble. Il est important de noter que les deux brins d'ADN peuvent relativement facilement « se décompresser » au milieu, car les liaisons hydrogène sont relativement faibles par rapport aux liaisons covalentes qui maintiennent les atomes des molécules d'ADN individuelles ensemble. Cela permet aux deux volets de fonctionner comme un modèle de réplication.
Résumé
Les propriétés physiques de la matière condensée (liquides et solides) peuvent être expliquées en termes de théorie moléculaire cinétique. Dans un liquide, les forces d'attraction intermoléculaires maintiennent les molécules en contact, bien qu'elles aient encore suffisamment d'énergie cinétique pour se déplacer les unes au-dessus des autres. Les forces d'attraction intermoléculaires, appelées collectivement forces de Van der Waals, sont responsables du comportement des liquides et des solides et sont de nature électrostatique. Les attractions dipoles-dipolaires résultent de l'attraction électrostatique de l'extrémité négative partielle d'une molécule dipolaire pour l'extrémité partiellement positive d'une autre. Le dipôle temporaire qui résulte du mouvement des électrons dans un atome peut induire un dipôle dans un atome adjacent et donner naissance à la force de dispersion de Londres. Les forces de Londres augmentent avec l'augmentation de la taille moléculaire. Les liaisons hydrogène sont un type spécial d'attraction dipole-dipôle qui se produit lorsque l'hydrogène est lié à l'un des trois éléments les plus électronégatifs : F, O ou N.
Lexique
- attraction dipôle-dipolaire
- attraction intermoléculaire entre deux dipôles permanents
- force de dispersion
- (également, force de dispersion de Londres) attraction entre deux dipôles temporaires fluctuant rapidement ; significative uniquement lorsque les particules sont très proches les unes des autres
- liaison hydrogène
- se produit lorsque des dipôles exceptionnellement forts s'attirent ; liaison qui se produit lorsque l'hydrogène est lié à l'un des trois éléments les plus électronégatifs : F, O ou N
- dipôle induit
- dipôle temporaire formé lorsque les électrons d'un atome ou d'une molécule sont déformés par le dipôle instantané d'un atome ou d'une molécule voisine
- dipôle instantané
- dipôle temporaire qui se produit pendant un bref instant lorsque les électrons d'un atome ou d'une molécule sont distribués de manière asymétrique
- force intermoléculaire
- force d'attraction non covalente entre les atomes, les molécules et/ou les ions
- polarisabilité
- mesure de la capacité d'une charge à déformer la distribution de charge d'une molécule (nuage d'électrons)
- Van der Waals Force
- la force d'attraction ou de répulsion entre les molécules, y compris les forces dipolaires-dipolaires, les forces dipolaires induites par les dipôles et les forces de dispersion de London ; n'inclut pas les forces dues à la liaison covalente ou ionique, ni à l'attraction entre les ions et les molécules


