10.2 : Propriétés des liquides
- Page ID
- 193924
- Distinguer les forces adhésives des forces de cohésion
- Définissez la viscosité, la tension superficielle et l'élévation capillaire
- Décrire les rôles des forces d'attraction intermoléculaires dans chacune de ces propriétés/phénomènes
Lorsque vous versez un verre d'eau ou que vous remplissez une voiture d'essence, vous constatez que l'eau et l'essence s'écoulent librement. Mais lorsque vous versez du sirop sur des crêpes ou que vous ajoutez de l'huile au moteur d'une voiture, vous constatez que le sirop et l'huile moteur ne s'écoulent pas aussi facilement. La viscosité d'un liquide est une mesure de sa résistance à l'écoulement. L'eau, l'essence et les autres liquides qui s'écoulent librement ont une faible viscosité. Le miel, le sirop, l'huile moteur et les autres liquides qui ne s'écoulent pas librement, comme ceux illustrés sur la figure\(\PageIndex{1}\), ont des viscosités plus élevées. Nous pouvons mesurer la viscosité en mesurant la vitesse à laquelle une bille métallique tombe à travers un liquide (la bille tombe plus lentement dans un liquide plus visqueux) ou en mesurant la vitesse à laquelle un liquide s'écoule dans un tube étroit (les liquides plus visqueux s'écoulent plus lentement).

Les IMF entre les molécules d'un liquide, la taille et la forme des molécules et la température déterminent la facilité avec laquelle un liquide s'écoule. Comme le\(\PageIndex{1}\) montre le tableau, plus les molécules d'un liquide sont complexes sur le plan structurel et plus les IMF entre elles sont forts, plus elles ont de la difficulté à se déplacer les unes sur les autres et plus la viscosité du liquide est grande. À mesure que la température augmente, les molécules se déplacent plus rapidement et leurs énergies cinétiques sont mieux à même de surmonter les forces qui les maintiennent ensemble ; ainsi, la viscosité du liquide diminue.
| Substance | Formule | Viscosité (mPa·s) |
|---|---|---|
| eau | H 2 O | 0,890 |
| mercure | Hg | 1,526 |
| éthanol | C 2 H 5 OHM | 1,074 |
| octane | C 8 H 18 | 0,508 |
| éthylène glycol | CH 2 (OH) CH2 (OH) | 16.1 |
| miel | variable | ~2 000 à 10 000 |
| huile moteur | variable | ~50-500 |
Les différents IMF entre des molécules identiques d'une substance sont des exemples de forces de cohésion. Les molécules d'un liquide sont entourées d'autres molécules et sont attirées de manière égale dans toutes les directions par les forces de cohésion présentes dans le liquide. Cependant, les molécules présentes à la surface d'un liquide ne sont attirées que par environ la moitié du nombre de molécules. En raison de l'attraction moléculaire déséquilibrée des molécules de surface, les liquides se contractent pour former une forme qui minimise le nombre de molécules à la surface, c'est-à-dire la forme ayant la surface minimale. Une petite goutte de liquide a tendance à prendre une forme sphérique, comme le montre la figure\(\PageIndex{2}\), car dans une sphère, le rapport entre la surface et le volume est minimal. Les gouttes plus grosses sont plus fortement affectées par la gravité, la résistance à l'air, les interactions de surface, etc., et sont donc moins sphériques.
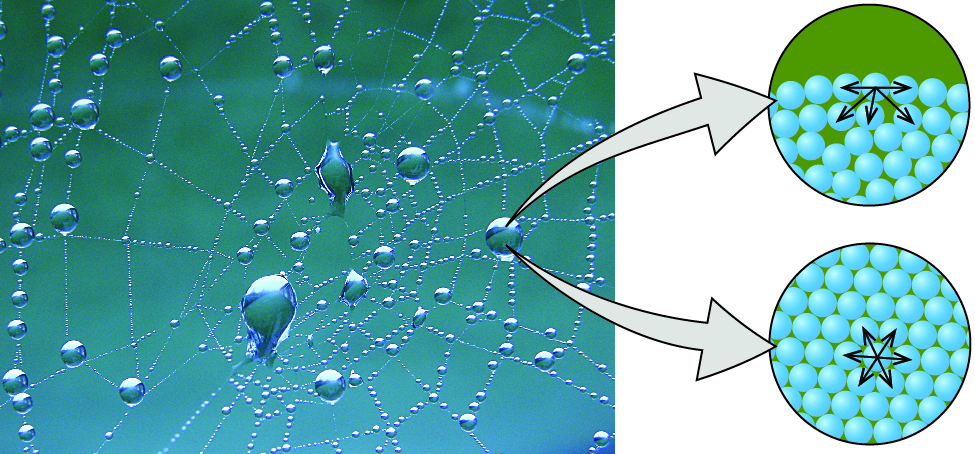
La tension superficielle est définie comme l'énergie requise pour augmenter la surface d'un liquide ou la force requise pour augmenter la longueur de la surface d'un liquide d'une quantité donnée. Cette propriété résulte des forces de cohésion entre les molécules à la surface d'un liquide, et elle fait en sorte que la surface d'un liquide se comporte comme une membrane en caoutchouc étirée. Les tensions de surface de plusieurs liquides sont présentées dans le tableau\(\PageIndex{2}\).
| Substance | Formule | Tension superficielle (mN/m) |
|---|---|---|
| eau | H 2 O | 71,99 |
| mercure | Hg | 458,48 |
| éthanol | C 2 H 5 OHM | 21,97 |
| octane | C 8 H 18 | 21.14 |
| éthylène glycol | CH 2 (OH) CH2 (OH) | 47,99 |
Parmi les liquides courants, l'eau présente une tension superficielle nettement élevée en raison de la forte liaison hydrogène entre ses molécules. En raison de cette tension superficielle élevée, la surface de l'eau représente une « peau relativement résistante » qui peut résister à une force considérable sans se casser. Une aiguille en acier placée avec soin sur l'eau va flotter. Certains insectes, comme celui illustré sur la figure\(\PageIndex{3}\), même s'ils sont plus denses que l'eau, se déplacent à sa surface parce qu'ils sont soutenus par la tension superficielle.

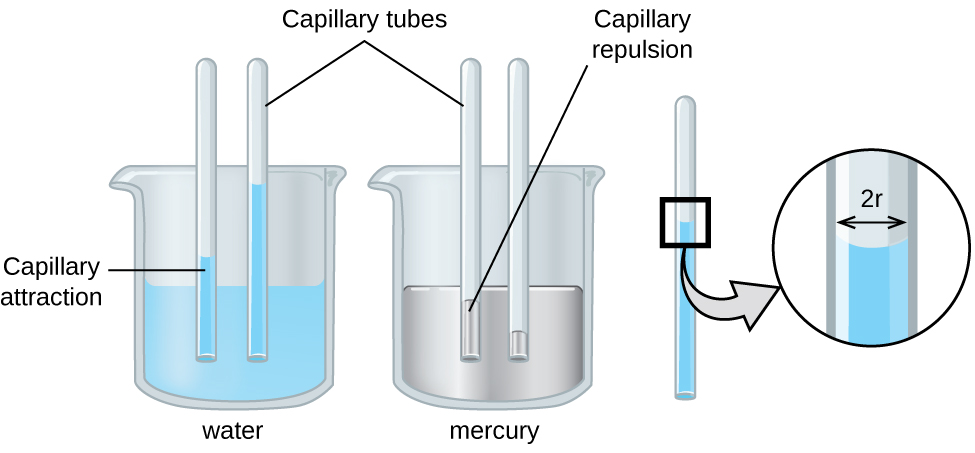
Les IMF d'attraction entre deux molécules différentes sont appelés forces adhésives. Réfléchissez à ce qui se passe lorsque l'eau entre en contact avec une surface. Si les forces d'adhérence entre les molécules d'eau et les molécules de surface sont faibles par rapport aux forces de cohésion entre les molécules d'eau, l'eau ne « mouille » pas la surface. Par exemple, l'eau ne mouille pas les surfaces cirées ou de nombreux plastiques tels que le polyéthylène. L'eau forme des gouttes sur ces surfaces parce que les forces de cohésion à l'intérieur des gouttes sont supérieures aux forces d'adhérence entre l'eau et le plastique. L'eau se répand sur le verre parce que la force d'adhérence entre l'eau et le verre est supérieure aux forces de cohésion présentes dans l'eau. Lorsque l'eau est confinée dans un tube de verre, son ménisque (surface) a une forme concave car l'eau mouille le verre et remonte le long du tube. D'autre part, les forces de cohésion entre les atomes de mercure sont bien supérieures aux forces d'adhérence entre le mercure et le verre. Le mercure ne mouille donc pas le verre et forme un ménisque convexe lorsqu'il est confiné dans un tube, car les forces de cohésion du mercure ont tendance à l'entraîner dans une goutte (Figure\(\PageIndex{4}\)).

Si vous placez une extrémité d'une serviette en papier dans du vin renversé, comme le montre la figure\(\PageIndex{5}\), le liquide évacue l'essuie-tout. Un processus similaire se produit dans une serviette en tissu lorsque vous l'utilisez pour sécher après une douche. Ce sont des exemples d'action capillaire, lorsqu'un liquide s'écoule à l'intérieur d'un matériau poreux en raison de l'attraction des molécules liquides vers la surface du matériau et par d'autres molécules liquides. Les forces d'adhérence entre le liquide et le matériau poreux, combinées aux forces de cohésion à l'intérieur du liquide, peuvent être suffisamment fortes pour déplacer le liquide vers le haut contre la gravité.
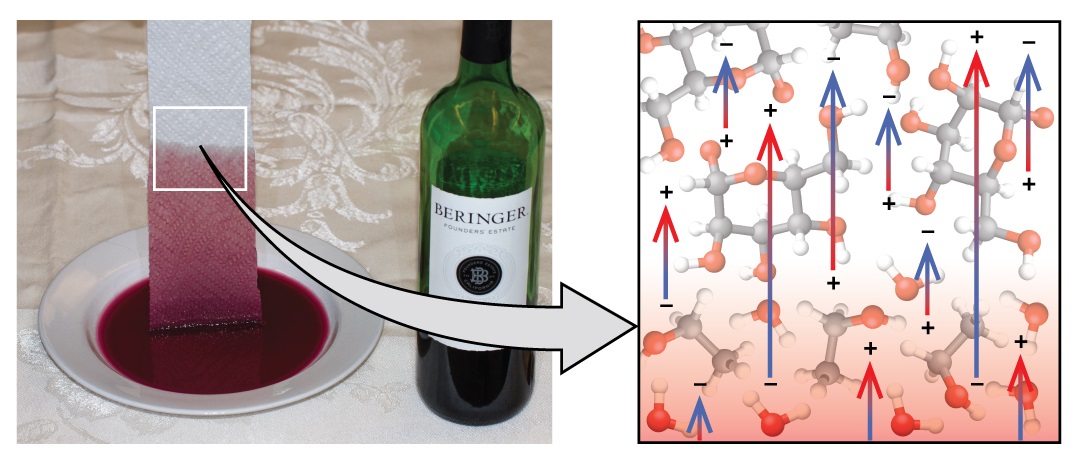
Les serviettes absorbent les liquides comme l'eau, car les fibres d'une serviette sont constituées de molécules qui sont attirées par les molécules d'eau. La plupart des serviettes en tissu sont en coton et les serviettes en papier sont généralement fabriquées à partir de pâte à papier. Les deux sont constitués de longues molécules de cellulose qui contiennent de nombreux groupes −OH. Les molécules d'eau sont attirées par ces groupes −OH et forment des liaisons hydrogène avec eux, ce qui attire les molécules de H 2 O vers le haut des molécules de cellulose. Les molécules d'eau sont également attirées les unes vers les autres, de sorte que de grandes quantités d'eau sont aspirées par les fibres de cellulose.
L'action capillaire peut également se produire lorsqu'une extrémité d'un tube de petit diamètre est immergée dans un liquide, comme illustré à la figure\(\PageIndex{6}\). Si les molécules liquides sont fortement attirées par les molécules du tube, le liquide remonte à l'intérieur du tube jusqu'à ce que le poids du liquide et les forces d'adhérence soient équilibrés. Plus le diamètre du tube est petit, plus le liquide grimpe haut. C'est en partie grâce à l'action capillaire qui se produit dans les cellules végétales appelées xylème que l'eau et les nutriments dissous sont acheminés du sol vers les racines jusqu'à la plante. L'action capillaire est à la base de la chromatographie sur couche mince, une technique de laboratoire couramment utilisée pour séparer de petites quantités de mélanges. Vous dépendez d'un apport constant de larmes pour garder vos yeux lubrifiés et de l'action capillaire pour évacuer le liquide lacrymal.
La hauteur à laquelle un liquide montera dans un tube capillaire est déterminée par plusieurs facteurs, comme le montre l'équation suivante :
\[h=\dfrac{2T\cosθ}{rρg} \label{10.2.1} \]
où
- h est la hauteur du liquide à l'intérieur du tube capillaire par rapport à la surface du liquide à l'extérieur du tube,
- T est la tension superficielle du liquide,
- θ est l'angle de contact entre le liquide et le tube,
- r est le rayon du tube, ρ est la densité du liquide, et
- g est l'accélération due à la gravité, 9,8 m/s 2.
Lorsque le tube est constitué d'un matériau auquel les molécules liquides sont fortement attirées, elles s'étalent complètement sur la surface, ce qui correspond à un angle de contact de 0°. C'est le cas de l'eau remontant dans un tube de verre.
À 25 °C, à quelle hauteur l'eau va-t-elle monter dans un tube capillaire en verre d'un diamètre intérieur de 0,25 mm ?
Pour l'eau, T = 71,99 mN/m et ρ = 1,0 g/cm 3.
Solution
Le liquide s'élèvera à une hauteur h donnée par l'équation\(\ref{10.2.1}\) :
\[h=\dfrac{2T\cosθ}{rρg} \nonumber \]
Le Newton est défini comme un kg m/s 2, de sorte que la tension de surface fournie est équivalente à 0,07199 kg/s 2. La densité fournie doit être convertie en unités qui s'annuleront de manière appropriée : ρ = 1000 kg/m 3. Le diamètre du tube en mètres est de 0,00025 m, donc le rayon est de 0,000125 m. Pour un tube de verre immergé dans l'eau, l'angle de contact est θ = 0°, donc cos θ = 1. Enfin, l'accélération due à la gravité sur la terre est g = 9,8 m/s 2. En substituant ces valeurs dans l'équation et en annulant les unités, on obtient :
\[h=\mathrm{\dfrac{2(0.07199\:kg/s^2)}{(0.000125\:m)(1000\:kg/m^3)(9.8\:m/s^2)}=0.12\:m=12\: cm} \nonumber \]
L'eau monte dans un tube capillaire en verre jusqu'à une hauteur de 8,4 cm. Quel est le diamètre du tube capillaire ?
- Réponse
-
diamètre = 0,36 mm
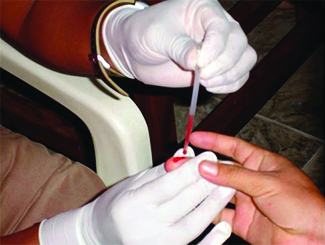
De nombreux tests médicaux nécessitent de prélever une petite quantité de sang, par exemple pour déterminer la quantité de glucose chez une personne diabétique ou le taux d'hématocrite chez un athlète. Cette procédure peut être facilement réalisée grâce à l'action capillaire, à la capacité d'un liquide à s'écouler dans un petit tube contre la gravité, comme le montre la figure\(\PageIndex{7}\). Lorsque votre doigt est piqué, une goutte de sang se forme et se maintient en place en raison de la tension superficielle, c'est-à-dire des attraits intermoléculaires déséquilibrés à la surface de la goutte. Ensuite, lorsque l'extrémité ouverte d'un tube de verre de diamètre étroit touche la goutte de sang, les forces d'adhérence entre les molécules présentes dans le sang et celles situées à la surface du verre aspirent le sang vers le haut du tube. La distance parcourue par le sang dans le tube dépend du diamètre du tube (et du type de liquide). Un petit tube possède une surface relativement grande pour un volume de sang donné, ce qui se traduit par des forces d'attraction (relatives) plus importantes, ce qui permet d'aspirer le sang plus haut dans le tube. Le liquide lui-même est maintenu ensemble par ses propres forces de cohésion. Lorsque le poids du liquide dans le tube génère une force descendante égale à la force ascendante associée à l'action capillaire, le liquide cesse de monter.
Concepts clés et résumé
Les forces intermoléculaires entre les molécules à l'état liquide varient en fonction de leur identité chimique et entraînent des variations correspondantes de diverses propriétés physiques. Les forces de cohésion entre des molécules similaires sont responsables de la viscosité (résistance à l'écoulement) et de la tension superficielle (élasticité de la surface d'un liquide). Les forces d'adhérence entre les molécules d'un liquide et les différentes molécules composant une surface en contact avec le liquide sont responsables de phénomènes tels que le mouillage de la surface et l'élévation capillaire.
Équations clés
- \(h=\dfrac{2T\cosθ}{rρg}\)
Lexique
- force d'adhérence
- force d'attraction entre des molécules d'identités chimiques différentes
- action capillaire
- écoulement de liquide au sein d'un matériau poreux dû à l'attraction des molécules liquides vers la surface du matériau et vers d'autres molécules liquides
- force de cohésion
- force d'attraction entre des molécules identiques
- tension superficielle
- énergie requise pour augmenter la surface, ou la longueur, d'une surface liquide d'une quantité donnée
- viscosité
- mesure de la résistance à l'écoulement d'un liquide


