7.6 : Structure moléculaire et polarité
- Page ID
- 193984
- Prédire les structures de petites molécules en utilisant la théorie de la répulsion des paires d'électrons de la couche de valence (VSEPR)
- Expliquer les concepts de liaisons covalentes polaires et de polarité moléculaire
- Évaluez la polarité d'une molécule en fonction de sa liaison et de sa structure
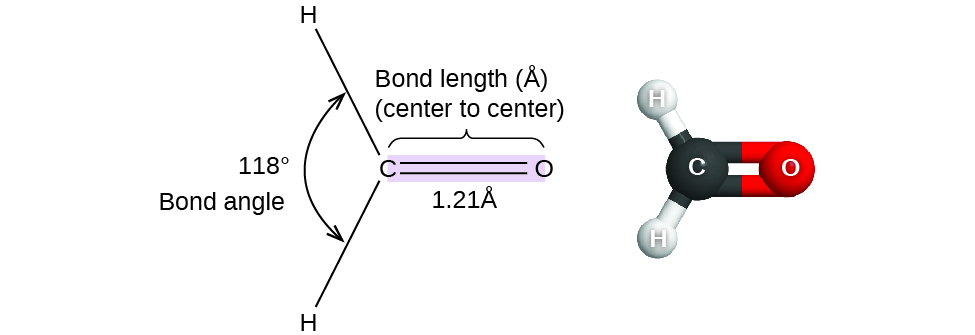
Jusqu'à présent, nous avons utilisé des structures de Lewis bidimensionnelles pour représenter des molécules. Cependant, la structure moléculaire est en fait tridimensionnelle, et il est important de pouvoir décrire les liaisons moléculaires en termes de distances, d'angles et de dispositions relatives dans l'espace (Figure\(\PageIndex{1}\)). Un angle de liaison est l'angle entre deux liaisons qui incluent un atome commun, généralement mesuré en degrés. Une distance de liaison (ou longueur de liaison) est la distance entre les noyaux de deux atomes liés le long de la ligne droite joignant les noyaux. Les distances de liaison sont mesurées en Ångstroms (1 Å = 10 —10 m) ou en picomètres (1 pm = 10 —12 m, 100pm = 1 Å).
Théorie VSEPR
La théorie de la répulsion des paires d'électrons de la couche de valence (théorie VSEPR) nous permet de prédire la structure moléculaire, y compris les angles de liaison approximatifs autour d'un atome central, d'une molécule à partir d'un examen du nombre de liaisons et de paires d'électrons isolés dans sa structure de Lewis. Le modèle VSEPR suppose que les paires d'électrons de la couche de valence d'un atome central adopteront un arrangement qui minimise les répulsions entre ces paires d'électrons en maximisant la distance qui les sépare. Les électrons de la couche de valence d'un atome central forment soit des paires d'électrons liantes, situées principalement entre des atomes liés, soit des paires isolées. La répulsion électrostatique de ces électrons est réduite lorsque les différentes régions à haute densité d'électrons prennent des positions aussi éloignées que possible les unes des autres.
La théorie de la VSEPR prédit la disposition des paires d'électrons autour de chaque atome central et, généralement, la disposition correcte des atomes dans une molécule. Il faut comprendre, cependant, que la théorie ne prend en compte que les répulsions par paires d'électrons. D'autres interactions, telles que les répulsions nucléaires et l'attraction des électrons nucléaires, sont également impliquées dans l'arrangement final que les atomes adoptent dans une structure moléculaire particulière.
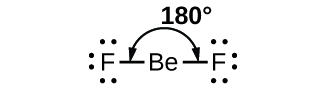
À titre d'exemple simple de la théorie VSEPR, prédisons la structure d'une molécule gazeuse de BeF 2. La structure de Lewis du BeF 2 (Figure\(\PageIndex{2}\)) ne montre que deux paires d'électrons autour de l'atome de béryllium central. Avec deux liaisons et aucune paire d'électrons isolée sur l'atome central, les liaisons sont aussi éloignées que possible et la répulsion électrostatique entre ces régions à haute densité d'électrons est réduite au minimum lorsqu'elles se trouvent de part et d'autre de l'atome central. L'angle de liaison est de 180° (Figure\(\PageIndex{2}\)).
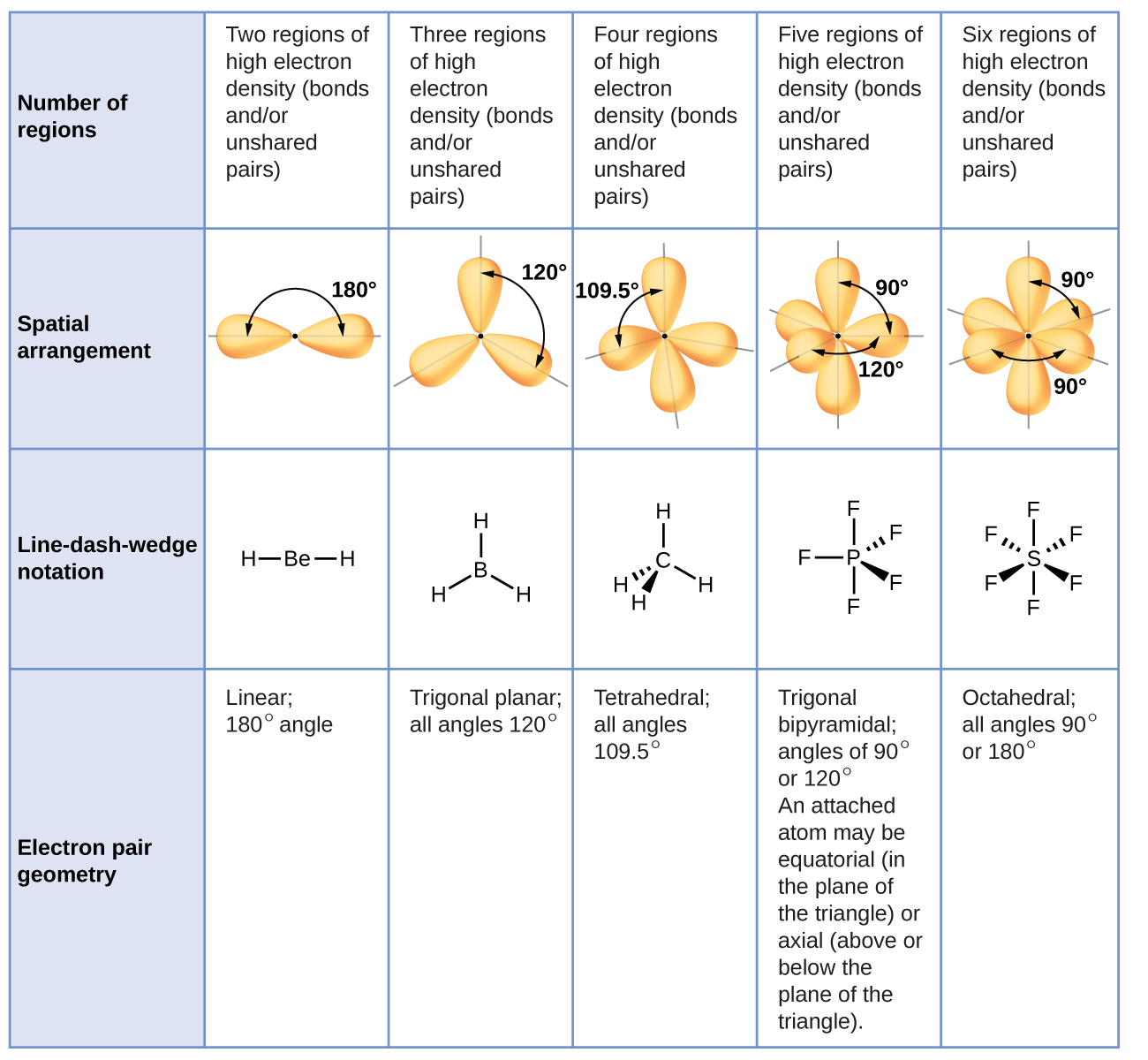
La figure\(\PageIndex{3}\) illustre cette géométrie et d'autres géométries de paires d'électrons qui minimisent les répulsions dans les régions à haute densité d'électrons (liaisons et/ou paires isolées). Deux régions de densité électronique autour d'un atome central d'une molécule forment une géométrie linéaire ; trois régions forment une géométrie plane trigonale ; quatre régions forment une géométrie tétraédrique ; cinq régions forment une géométrie bipyramidale trigonale ; et six régions forment une géométrie octaédrique.
Géométrie des paires d'électrons versus structure moléculaire
Il est important de noter que la géométrie des paires d'électrons autour d'un atome central n'est pas la même chose que sa structure moléculaire. Les géométries des paires d'électrons illustrées sur la figure\(\PageIndex{3}\) décrivent toutes les régions où se trouvent les électrons, les liaisons ainsi que les paires isolées. La structure moléculaire décrit l'emplacement des atomes, pas celui des électrons.
Nous distinguons ces deux situations en nommant la géométrie qui inclut toutes les paires d'électrons la géométrie des paires d'électrons. La structure qui inclut uniquement le placement des atomes dans la molécule est appelée structure moléculaire. Les géométries des paires d'électrons seront les mêmes que les structures moléculaires lorsqu'il n'y a pas de paires d'électrons isolées autour de l'atome central, mais elles seront différentes lorsqu'il y a des paires seules présentes sur l'atome central.
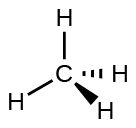
Par exemple, la molécule de méthane, le CH 4, qui est le principal composant du gaz naturel, possède quatre paires d'électrons liées autour de l'atome de carbone central ; la géométrie de la paire d'électrons est tétraédrique, tout comme la structure moléculaire (Figure\(\PageIndex{4}\)). D'autre part, la molécule d'ammoniac, NH 3, possède également quatre paires d'électrons associées à l'atome d'azote, et possède donc une géométrie de paire d'électrons tétraédrique. L'une de ces régions, cependant, est une paire isolée, qui n'est pas incluse dans la structure moléculaire, et cette paire isolée influence la forme de la molécule (Figure\(\PageIndex{5}\)).
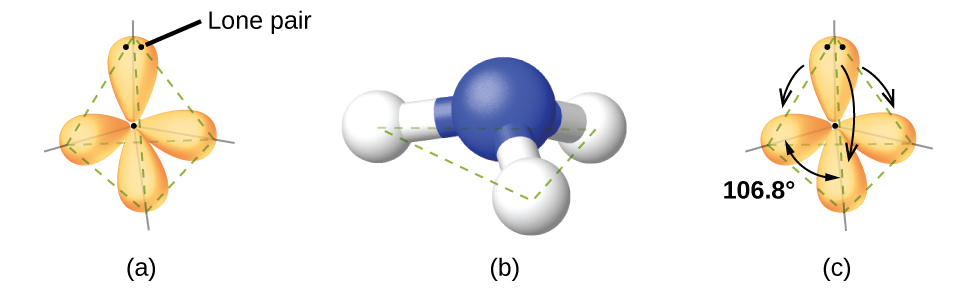
De petites distorsions par rapport aux angles idéaux de la figure\(\PageIndex{5}\) peuvent résulter de différences de répulsion entre les différentes régions de densité électronique. La théorie VSEPR prédit ces distorsions en établissant un ordre de répulsions et un ordre de l'espace occupé par différents types de paires d'électrons. L'ordre des répulsions des paires d'électrons, de la plus grande à la plus faible répulsion, est le suivant :
une paire > une paire de liaison par paire > une paire de liaison par paire
Cet ordre de répulsions détermine l'espace occupé par différentes régions d'électrons. Une seule paire d'électrons occupe une plus grande région de l'espace que les électrons d'une triple liaison ; à leur tour, les électrons d'une triple liaison occupent plus d'espace que ceux d'une double liaison, etc. L'ordre des tailles, du plus grand au plus petit, est le suivant :
paire isolée > triple liaison > double liaison > liaison simple
Prenons l'exemple du formaldéhyde, H 2 CO, qui est utilisé comme agent de conservation pour les échantillons biologiques et anatomiques. Cette molécule possède des régions à haute densité d'électrons constituées de deux liaisons simples et d'une double liaison. La géométrie de base est plane trigonale avec des angles de liaison de 120°, mais nous voyons que la double liaison provoque des angles légèrement plus grands (121°) et que l'angle entre les liaisons simples est légèrement plus petit (118°).
Dans la molécule d'ammoniac, les trois atomes d'hydrogène attachés à l'azote central ne sont pas disposés selon une structure moléculaire plane trigonale plate, mais plutôt selon une pyramide trigonale tridimensionnelle (Figure\(\PageIndex{6}\)) avec l'atome d'azote au sommet et les trois atomes d'hydrogène formant la base. Les angles de liaison idéaux dans une pyramide trigonale sont basés sur la géométrie de la paire d'électrons tétraédriques. Encore une fois, il y a de légers écarts par rapport à l'idéal car les paires isolées occupent de plus grandes régions de l'espace que les électrons de liaison. Les angles de liaison H—N—H dans NH 3 sont légèrement inférieurs à l'angle de 109,5° dans un tétraèdre ordinaire (Figure\(\PageIndex{6}\)) car la répulsion de la paire de liaisons par paires est supérieure à la répulsion de la paire de liaisons par paires. Les structures moléculaires idéales sont prédites sur la base des géométries des paires d'électrons pour diverses combinaisons de paires isolées et de paires de liaisons.
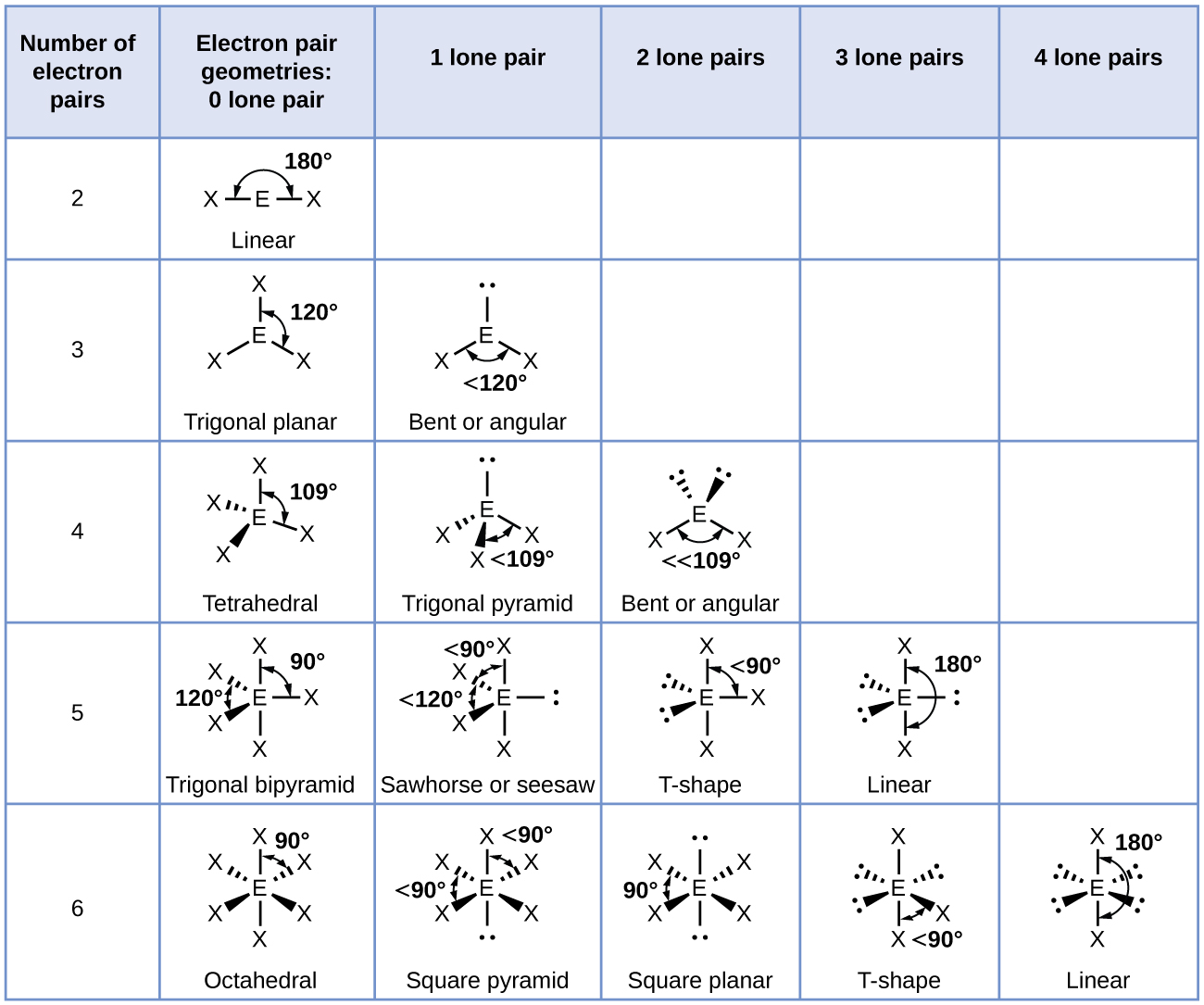
Selon la théorie du VSEPR, les emplacements des atomes terminaux (Xs sur la figure\(\PageIndex{7}\)) sont équivalents dans les géométries de paires d'électrons linéaires, trigonales planaires et tétraédriques (les trois premières rangées du tableau). Peu importe quel X est remplacé par une paire isolée, car les molécules peuvent être pivotées pour convertir des positions. Pour les géométries de paires d'électrons bipyramidales trigonales, cependant, il existe deux positions X distinctes (Figure\(\PageIndex{7}\) a) : une position axiale (si nous maintenons un modèle d'une bipyramide trigonale par les deux positions axiales, nous avons un axe autour duquel nous pouvons faire pivoter le modèle) et une position équatoriale (trois positions forment un équateur au milieu de la molécule). La position axiale est entourée par des angles de liaison de 90°, tandis que la position équatoriale offre plus d'espace disponible en raison des angles de liaison de 120°. Dans une géométrie à paires d'électrons bipyramidales trigonales, les paires seules occupent toujours des positions équatoriales, car ces positions plus spacieuses peuvent plus facilement accueillir les paires seules plus grandes.
Théoriquement, nous pouvons proposer trois arrangements possibles pour les trois liaisons et deux paires isolées pour la molécule ClF 3 (Figure\(\PageIndex{7}\)). La structure stable est celle qui place les paires isolées dans des emplacements équatoriaux, donnant ainsi une structure moléculaire en forme de T.
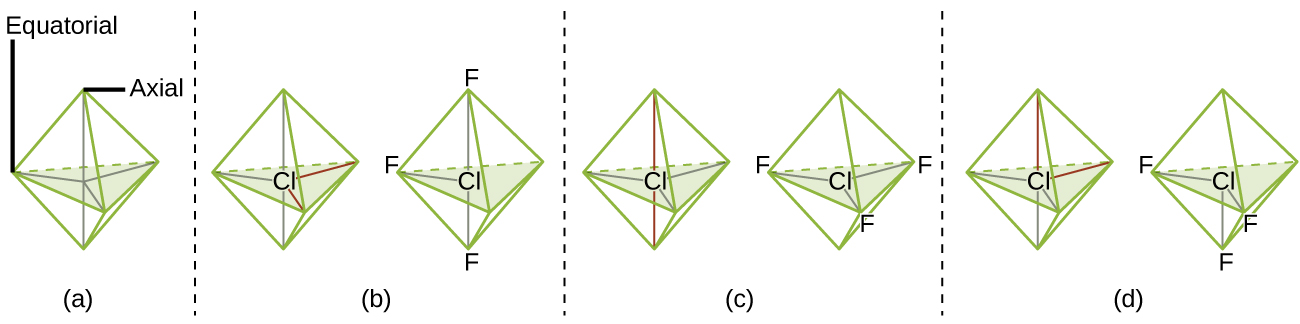
Lorsqu'un atome central possède deux paires d'électrons solitaires et quatre régions de liaison, nous avons une géométrie de paire d'électrons octaédrique. Les deux paires isolées se trouvent de part et d'autre de l'octaèdre (espacées de 180°), ce qui donne une structure moléculaire plane carrée qui minimise les répulsions entre une paire et une paire.
La procédure suivante utilise la théorie VSEPR pour déterminer les géométries des paires d'électrons et les structures moléculaires :
- Écrivez la structure de Lewis de la molécule ou de l'ion polyatomique.
- Comptez le nombre de régions de densité électronique (paires isolées et liaisons) autour de l'atome central. Une liaison simple, double ou triple compte comme une région de densité électronique.
- Identifiez la géométrie de la paire d'électrons en fonction du nombre de régions de densité électronique : linéaire, trigonale planaire, tétraédrique, trigonale bipyramidale ou octaédrique (Figure\(\PageIndex{7}\), première colonne).
- Utilisez le nombre de paires isolées pour déterminer la structure moléculaire (Figure\(\PageIndex{7}\)). Si plusieurs arrangements de paires solitaires et de liaisons chimiques sont possibles, choisissez celui qui minimisera les répulsions, en vous rappelant que les paires seules occupent plus d'espace que les liaisons multiples, qui occupent plus d'espace que les liaisons simples. Dans les arrangements bipyramidaux trigonaux, la répulsion est minimisée lorsque chaque paire isolée se trouve en position équatoriale. Dans un arrangement octaédrique à deux paires isolées, la répulsion est minimisée lorsque les paires isolées se trouvent de part et d'autre de l'atome central.
Les exemples suivants illustrent l'utilisation de la théorie VSEPR pour prédire la structure moléculaire de molécules ou d'ions dépourvus de paires d'électrons isolées. Dans ce cas, la structure moléculaire est identique à la géométrie de la paire d'électrons.
Prédisez la géométrie et la structure moléculaire de la paire d'électrons pour chacun des éléments suivants :
- dioxyde de carbone, CO 2, une molécule produite par la combustion de combustibles fossiles
- trichlorure de bore, BCl 3, un produit chimique industriel important
Solution
(a) Nous écrivons la structure de Lewis du CO 2 comme suit :

Cela nous montre deux régions à haute densité d'électrons autour de l'atome de carbone : chaque double liaison compte pour une région et il n'y a pas de paires isolées sur l'atome de carbone. À l'aide de la théorie VSEPR, nous prédisons que les deux régions de densité électronique se situent de part et d'autre de l'atome central avec un angle de liaison de 180°. La géométrie et la structure moléculaire de la paire d'électrons sont identiques, et les molécules de CO 2 sont linéaires.
(b) Nous écrivons la structure de Lewis du BCl 3 comme suit :
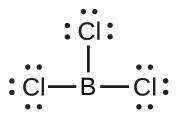
Nous voyons donc que le BCl 3 contient trois liaisons et qu'il n'y a pas de paires d'électrons isolées sur le bore. La disposition de trois régions à haute densité d'électrons donne une géométrie de paire d'électrons plane trigonale. Les liaisons B—Cl se situent dans un plan séparé par des angles de 120°. Le BCl 3 possède également une structure moléculaire plane trigonale.
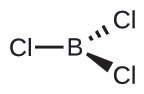
La géométrie de la paire d'électrons et la structure moléculaire du BCl 3 sont toutes deux planes trigonales. Notez que la géométrie du VSEPR indique les angles de liaison corrects (120°), contrairement à la structure de Lewis illustrée ci-dessus.
Le carbonate est un ion polyatomique courant présent dans divers matériaux, des coquilles d'œufs aux antiacides.\(\ce{CO3^2-}\) Quelles sont la géométrie de la paire d'électrons et la structure moléculaire de cet ion polyatomique ?
- Réponse
-
La géométrie de la paire d'électrons est plane trigonale et la structure moléculaire est plane trigonale. En raison de la résonance, les trois liaisons C—O sont identiques. Qu'il s'agisse d'une liaison simple, double ou d'une moyenne des deux, chaque liaison compte comme une région de densité électronique.
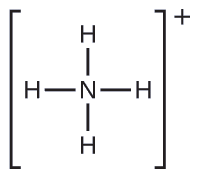
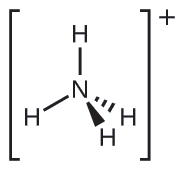
Deux des 50 principaux produits chimiques produits aux États-Unis, le nitrate d'ammonium et le sulfate d'ammonium, tous deux utilisés comme engrais, contiennent de l'ion ammonium. Prédisez la géométrie de la paire d'électrons et la structure moléculaire du\(\ce{NH4+}\) cation.
Solution
Nous écrivons la structure de Lewis de la\(\ce{NH4+}\) manière suivante :
Identifiez une molécule ayant une structure moléculaire bipyramidale trigonale.
- Réponse
-
Toute molécule comportant cinq paires d'électrons autour des atomes centraux, y compris aucune paire isolée, sera bipyramidale trigonale. \(\ce{PF5}\)est un exemple courant
Les exemples suivants illustrent l'effet de paires isolées d'électrons sur la structure moléculaire.
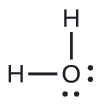
Prédisez la géométrie des paires d'électrons et la structure moléculaire d'une molécule d'eau.
Solution
La structure de Lewis de H 2 O indique qu'il existe quatre régions de haute densité électronique autour de l'atome d'oxygène : deux paires isolées et deux liaisons chimiques :
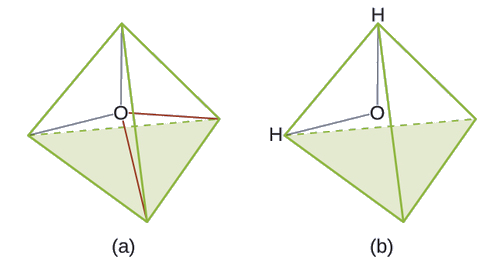
L'ion hydronium, H 3 O +, se forme lorsque les acides sont dissous dans l'eau. Prédisez la géométrie de la paire d'électrons et la structure moléculaire de ce cation.
- Réponse
-
géométrie de la paire d'électrons : tétraédrique ; structure moléculaire : pyramide trigonale
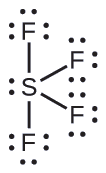
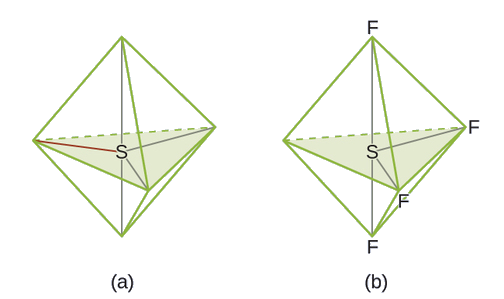
Prédiction de la géométrie et de la structure moléculaire des paires d'électrons : Le SF 4 est extrêmement utile pour la préparation de composés contenant du fluor utilisés comme herbicides (c'est-à-dire que le SF 4 est utilisé comme agent fluorant). Prédisez la géométrie de la paire d'électrons et la structure moléculaire d'une molécule de SF 4.
Solution
La structure de Lewis de SF 4 indique cinq régions de densité électronique autour de l'atome de soufre : une paire isolée et quatre paires de liaison :
Prédisez la géométrie de la paire d'électrons et la structure moléculaire des molécules de XeF 2.
- Réponse
-
La géométrie de la paire d'électrons est bipyramidale trigonale. La structure moléculaire est linéaire.
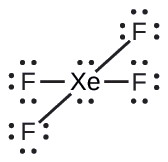
De tous les gaz rares, le xénon est le plus réactif, réagissant fréquemment avec des éléments tels que l'oxygène et le fluor. Prédisez la géométrie de la paire d'électrons et la structure moléculaire de la molécule XeF 4.
Solution
La structure de Lewis de XeF 4 indique six régions de haute densité électronique autour de l'atome de xénon : deux paires isolées et quatre liaisons :
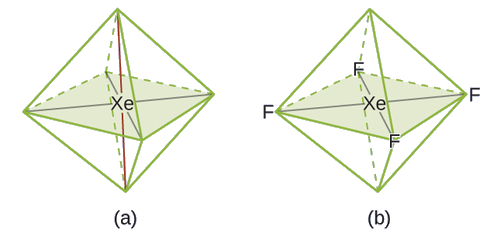
Dans une certaine molécule, l'atome central possède trois paires isolées et deux liaisons. Quelles seront la géométrie et la structure moléculaire de la paire d'électrons ?
- Réponse
-
géométrie de la paire d'électrons : bipyramidale trigonale ; structure moléculaire : linéaire
Structure moléculaire pour les molécules multicentriques
Lorsqu'une molécule ou un ion polyatomique ne possède qu'un seul atome central, la structure moléculaire décrit complètement la forme de la molécule. Les molécules plus grosses n'ont pas un seul atome central, mais sont reliées par une chaîne d'atomes intérieurs qui possèdent chacun une géométrie « locale ». La façon dont ces structures locales sont orientées les unes par rapport aux autres influence également la forme moléculaire, mais de telles considérations dépassent largement le cadre de cette discussion introductive. Pour nos besoins, nous nous concentrerons uniquement sur la détermination des structures locales.
La structure de Lewis pour l'acide aminé le plus simple, la glycine, H 2 NCH 2 CO 2 H, est présentée ici. Prédisez la géométrie locale de l'atome d'azote, des deux atomes de carbone et de l'atome d'oxygène auquel est attaché un atome d'hydrogène :
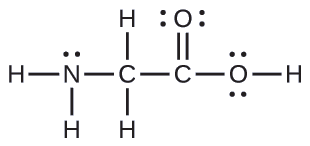
Solution
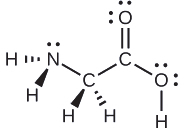
Considérez chaque atome central indépendamment. Les géométries des paires d'électrons :
- azote — quatre régions de densité électronique ; tétraédrique
- carbone (C H 2) — quatre régions de densité électronique ; tétraédrique
- carbone (C O 2) : trois régions de densité électronique ; plan trigonal
- oxygène (O H) : quatre régions de densité électronique ; tétraédrique
Les structures locales :
- azote : trois liaisons, une seule paire ; pyramide trigonale
- carbone (C H 2) : quatre liaisons, aucune paire isolée ; tétraédrique
- carbone (C O 2) : trois liaisons (une double liaison compte pour une liaison), aucune paire isolée ; plan trigonal
- oxygène (O H) —deux liaisons, deux paires isolées ; plié (109°)
Un autre acide aminé est l'alanine, dont la structure de Lewis est illustrée ici. Prédisez la géométrie de la paire d'électrons et la structure locale de l'atome d'azote, des trois atomes de carbone et de l'atome d'oxygène auquel l'hydrogène est attaché :
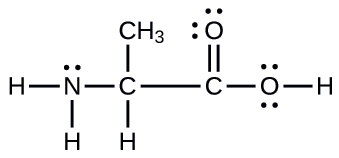
- Réponse
-
géométries de paires d'électrons : azote — tétraèdre ; carbone (C H) —tétraèdre ; carbone (C H 3) —tétraèdre ; carbone (C O 2) —plan trigonal ; oxygène (O H) —tétraédrique ; structures locales : azote—pyramide trigonale ; carbone (C H) — tétraédrique ; carbone (C H 3) —tétraédrique ; carbone (C O 2) —plan trigonal ; oxygène (O H) —courbé (109°)
L'utilisation de ce simulateur de forme moléculaire nous permet de contrôler si les angles de liaison et/ou les paires isolées sont affichés en cochant ou en décochant les cases sous « Options » sur la droite. Nous pouvons également utiliser les cases à cocher « Nom » en bas à gauche pour afficher ou masquer la géométrie de la paire d'électrons (appelée « géométrie des électrons » dans le simulateur) et/ou la structure moléculaire (appelée « forme moléculaire » dans le simulateur).
Construisez la molécule HCN dans le simulateur en vous basant sur la structure de Lewis suivante :
Cliquez sur chaque type de liaison ou sur chaque paire isolée à droite pour ajouter ce groupe à l'atome central. Une fois que vous avez obtenu la molécule complète, faites-la pivoter pour examiner la structure moléculaire prédite. De quelle structure moléculaire s'agit-il ?
Solution
La structure moléculaire est linéaire.
Construisez une molécule plus complexe dans le simulateur. Identifiez la géométrie du groupe d'électrons, la structure moléculaire et les angles de liaison. Essayez ensuite de trouver une formule chimique qui corresponde à la structure que vous avez dessinée.
- Réponse
-
Les réponses peuvent varier. Par exemple, un atome comportant quatre liaisons simples, une double liaison et une paire isolée possède une géométrie de groupe d'électrons octaédrique et une structure moléculaire pyramidale carrée. XeOF 4 est une molécule qui adopte cette structure.
Polarité moléculaire et moment dipolaire
Comme indiqué précédemment, les liaisons covalentes polaires relient deux atomes ayant des électronégativités différentes, laissant un atome avec une charge partiellement positive (δ+) et l'autre une charge partiellement négative (δ—), lorsque les électrons sont attirés vers l'atome le plus électronégatif. Cette séparation de charge donne naissance à un moment dipolaire de liaison. L'amplitude d'un moment dipolaire de liaison est représentée par la lettre grecque mu (µ) et est donnée par
\[μ=Qr \label{7.6.X} \]
où
- \(Q\)est l'amplitude des charges partielles (déterminée par la différence d'électronégativité) et
- \(r\)est la distance entre les charges :
Ce moment de liaison peut être représenté sous la forme d'un vecteur, une quantité ayant à la fois une direction et une amplitude (Figure\(\PageIndex{12}\)). Les vecteurs dipolaires sont représentés par des flèches pointant le long de la liaison de l'atome le moins électronégatif vers l'atome le plus électronégatif. Un petit signe plus est dessiné sur l'extrémité la moins électronégative pour indiquer l'extrémité partiellement positive de la liaison. La longueur de la flèche est proportionnelle à l'amplitude de la différence d'électronégativité entre les deux atomes.
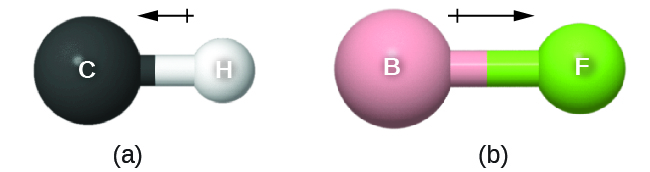
Une molécule entière peut également présenter une séparation de charge, en fonction de sa structure moléculaire et de la polarité de chacune de ses liaisons. Si une telle séparation de charges existe, la molécule est dite polaire (ou dipôle) ; sinon, la molécule est dite non polaire. Le moment dipolaire mesure l'étendue de la séparation de charge nette dans l'ensemble de la molécule. Nous déterminons le moment dipolaire en ajoutant les moments de liaison dans un espace tridimensionnel, en tenant compte de la structure moléculaire.
Pour les molécules diatomiques, il n'y a qu'une seule liaison, de sorte que le moment dipolaire de la liaison détermine la polarité moléculaire. Les molécules diatomiques homonucléaires telles que Br 2 et N 2 ne présentent aucune différence d'électronégativité, de sorte que leur moment dipolaire est nul. Pour les molécules hétéronucléaires telles que le CO, il existe un petit moment dipolaire. Pour le HF, le moment dipolaire est plus important parce qu'il y a une plus grande différence d'électronégativité.
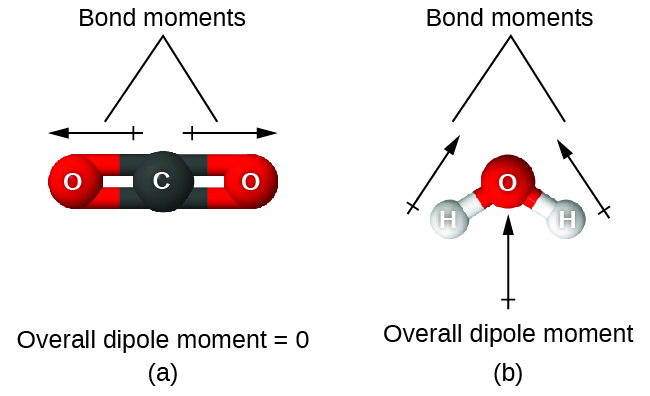
Lorsqu'une molécule contient plus d'une liaison, la géométrie doit être prise en compte. Si les liaisons d'une molécule sont disposées de telle sorte que leurs moments de liaison s'annulent (la somme des vecteurs est égale à zéro), alors la molécule est non polaire. C'est la situation pour le CO 2 (Figure\(\PageIndex{13A}\)). Chacune des liaisons est polaire, mais la molécule dans son ensemble n'est pas polaire. À partir de la structure de Lewis et en utilisant la théorie VSEPR, nous déterminons que la molécule de CO 2 est linéaire avec des liaisons polaires C=O sur les côtés opposés de l'atome de carbone. Les moments de liaison s'annulent parce qu'ils pointent dans des directions opposées. Dans le cas de la molécule d'eau (Figure\(\PageIndex{13B}\)), la structure de Lewis montre à nouveau qu'il existe deux liaisons avec un atome central, et la différence d'électronégativité montre à nouveau que chacune de ces liaisons a un moment de liaison non nul. Dans ce cas, cependant, la structure moléculaire est courbée à cause des paires isolées sur O, et les deux moments de liaison ne s'annulent pas. Par conséquent, l'eau a un moment dipolaire net et est une molécule polaire (dipôle).
La molécule OCS a une structure similaire à celle du CO 2, mais un atome de soufre a remplacé l'un des atomes d'oxygène. Pour déterminer si cette molécule est polaire, nous dessinons la structure moléculaire. La théorie du VSEPR prédit une molécule linéaire :
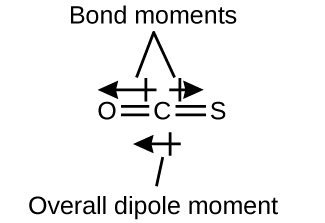
La liaison C—O est considérablement polaire. Bien que C et S aient des valeurs d'électronégativité très similaires, S est légèrement plus électronégatif que C, de sorte que la liaison C-S est légèrement polaire. Comme l'oxygène est plus électronégatif que le soufre, l'extrémité oxygène de la molécule est l'extrémité négative.
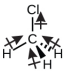
Le chlorométhane, CH 3 Cl, est un autre exemple de molécule polaire. Bien que les liaisons polaires C—Cl et C—H soient disposées selon une géométrie tétraédrique, les liaisons C—Cl ont un moment de liaison plus important que la liaison C—H, et les moments de liaison ne s'annulent pas complètement. Tous les dipôles ont une composante ascendante dans l'orientation indiquée, car le carbone est plus électronégatif que l'hydrogène et moins électronégatif que le chlore :
Lorsque nous examinons les molécules hautement symétriques BF 3 (trigonale planaire), CH 4 (tétraédrique), PF 5 (trigonale bipyramidale) et SF 6 (octaédrique), dans lesquelles toutes les liaisons polaires sont identiques, les molécules sont non polaires. Les liaisons de ces molécules sont disposées de telle sorte que leurs dipôles s'annulent. Cependant, ce n'est pas parce qu'une molécule contient des liaisons identiques que les dipôles s'annuleront toujours. De nombreuses molécules qui ont des liaisons identiques et des paires isolées sur les atomes centraux ont des dipôles de liaison qui ne s'annulent pas. Les exemples incluent H 2 S et NH 3. Un atome d'hydrogène se trouve à l'extrémité positive et un atome d'azote ou de soufre à l'extrémité négative des liaisons polaires de ces molécules :
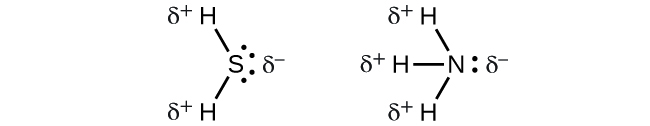
En résumé, pour être polaire, une molécule doit :
- Contiennent au moins une liaison covalente polaire.
- Avoir une structure moléculaire telle que la somme des vecteurs de chaque moment dipolaire de liaison ne s'annule pas.
Propriétés des molécules polaires
Les molécules polaires ont tendance à s'aligner lorsqu'elles sont placées dans un champ électrique, l'extrémité positive de la molécule étant orientée vers la plaque négative et l'extrémité négative vers la plaque positive (Figure\(\PageIndex{14}\)). Nous pouvons utiliser un objet chargé électriquement pour attirer des molécules polaires, mais les molécules non polaires ne le sont pas. De plus, les solvants polaires dissolvent mieux les substances polaires, et les solvants non polaires sont meilleurs pour dissoudre les substances non polaires.
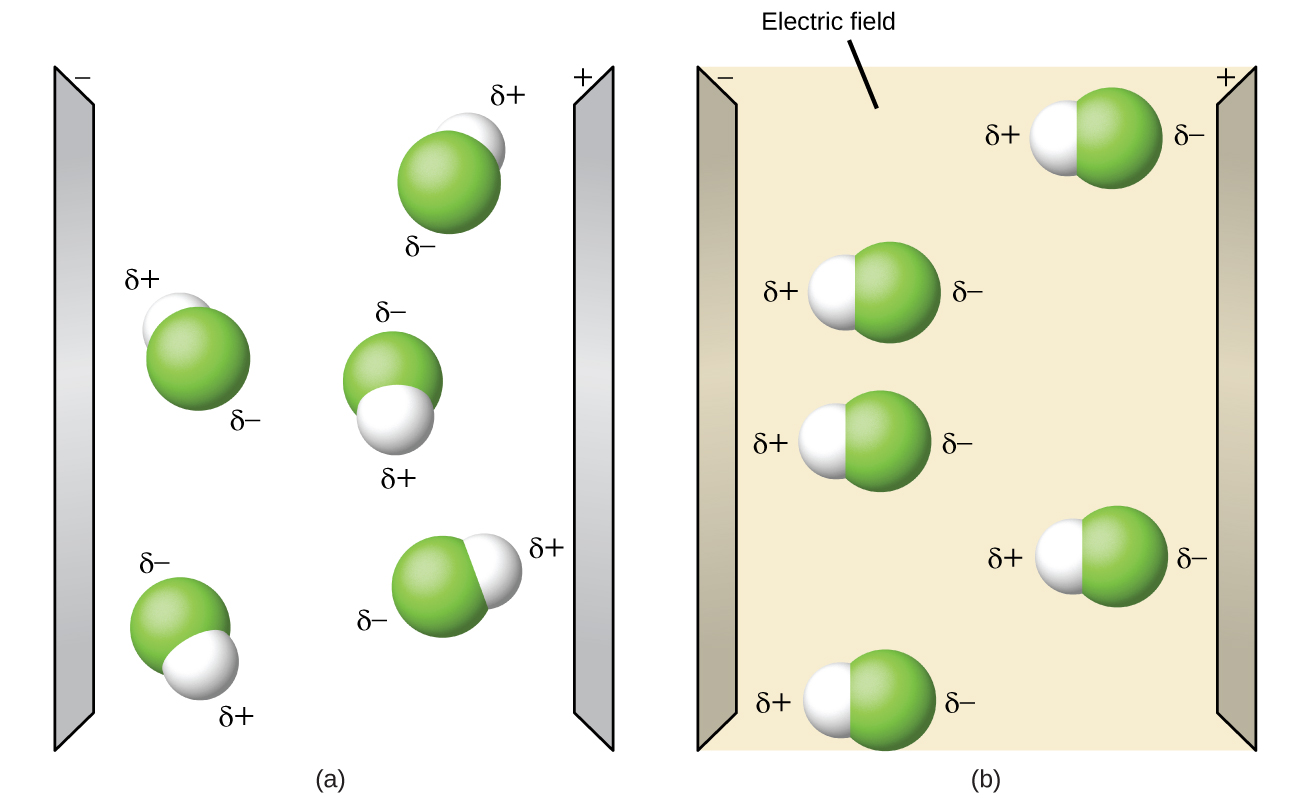
Ouvrez la simulation de polarité des molécules et sélectionnez l'onglet « Trois atomes » en haut. Cela devrait afficher une molécule ABC avec trois ajusteurs d'électronégativité. Vous pouvez afficher ou masquer les moments de liaison, les dipôles moléculaires et les charges partielles sur la droite. L'activation du champ électrique indiquera si la molécule se déplace lorsqu'elle est exposée à un champ, comme sur la Figure\(\PageIndex{14}\).
Utilisez les contrôles d'électronégativité pour déterminer à quoi ressemblera le dipôle moléculaire pour la molécule courbée de départ si :
- A et C sont très électronégatifs et B se situe au milieu de la gamme.
- A est très électronégatif, mais B et C ne le sont pas.
Solution
- Le moment dipolaire moléculaire se situe immédiatement entre A et C.
- Le moment dipolaire moléculaire pointe le long de la liaison A—B, vers A.
Déterminez les charges partielles qui donneront les plus grands dipôles de liaison possibles.
- Réponse
-
Les moments obligataires les plus importants se produiront avec les charges partielles les plus importantes. Les deux solutions ci-dessus montrent à quel point les électrons sont partagés de manière inégale dans la liaison. Les moments de liaison seront maximisés lorsque la différence d'électronégativité sera maximale. Les commandes pour A et C doivent être réglées sur une extrémité, et B doit être réglée sur l'extrême opposé. Bien que l'amplitude du moment de liaison ne changera pas selon que B est le plus électronégatif ou le moins électronégatif, la direction du moment de liaison changera.
Résumé
La théorie de la VSEPR prédit l'arrangement tridimensionnel des atomes dans une molécule. Il indique que les électrons de valence adopteront une géométrie de paire d'électrons qui minimise les répulsions entre les zones à haute densité d'électrons (liaisons et/ou paires isolées). La structure moléculaire, qui fait uniquement référence au placement des atomes dans une molécule et non des électrons, est équivalente à la géométrie des paires d'électrons uniquement lorsqu'il n'y a pas de paires d'électrons isolées autour de l'atome central. Un moment dipolaire mesure une séparation de charge. Pour une liaison, le moment dipolaire de la liaison est déterminé par la différence d'électronégativité entre les deux atomes. Pour une molécule, le moment dipolaire global est déterminé à la fois par les moments de liaison individuels et par la façon dont ces dipôles sont disposés dans la structure moléculaire. Les molécules polaires (celles qui ont un moment dipolaire appréciable) interagissent avec les champs électriques, alors que les molécules non polaires ne le font pas.
Lexique
- position axiale
- localisation dans une géométrie bipyramidale trigonale dans laquelle se trouve un autre atome à un angle de 180° et les positions équatoriales à un angle de 90°
- angle de liaison
- angle entre deux liaisons covalentes qui partagent un atome commun
- distance de liaison
- (également, longueur de liaison) distance entre les noyaux de deux atomes liés
- moment dipolaire de liaison
- séparation des charges dans une liaison qui dépend de la différence d'électronégativité et de la distance de liaison représentée par des charges partielles ou un vecteur
- moment dipolaire
- propriété d'une molécule qui décrit la séparation des charges déterminée par la somme des moments de liaison individuels sur la base de la structure moléculaire
- géométrie des paires d'électrons
- arrangement autour d'un atome central de toutes les régions de densité électronique (liaisons, paires isolées ou électrons non appariés)
- position équatoriale
- l'une des trois positions d'une géométrie bipyramidale trigonale avec des angles de 120° entre elles ; les positions axiales sont situées à un angle de 90°
- linéaire
- forme dans laquelle deux groupes extérieurs sont placés sur les côtés opposés d'un atome central
- structure moléculaire
- structure qui inclut uniquement le placement des atomes dans la molécule
- octaédrique
- forme dans laquelle six groupes extérieurs sont placés autour d'un atome central de telle sorte qu'une forme tridimensionnelle est générée avec quatre groupes formant un carré et les deux autres formant le sommet de deux pyramides, l'une au-dessus et l'autre au-dessous du plan carré
- molécule polaire
- molécule (également dipolaire) avec un moment dipolaire global
- tétraédrique
- forme dans laquelle quatre groupes extérieurs sont placés autour d'un atome central de telle sorte qu'une forme tridimensionnelle est générée avec quatre coins et des angles de 109,5° entre chaque paire et l'atome central
- bipyramidal trigonal
- forme dans laquelle cinq groupes extérieurs sont placés autour d'un atome central de telle sorte que trois forment un triangle plat avec des angles de 120° entre chaque paire et l'atome central, et les deux autres forment le sommet de deux pyramides, l'une au-dessus et l'autre au-dessous du plan triangulaire
- plan trigonal
- forme dans laquelle trois groupes extérieurs sont placés dans un triangle plat autour d'un atome central avec des angles de 120° entre chaque paire et l'atome central
- théorie de la répulsion par paire d'électrons à couche de valence (VSEPR)
- théorie utilisée pour prédire les angles de liaison dans une molécule en positionnant les régions à haute densité d'électrons aussi éloignées que possible afin de minimiser la répulsion électrostatique
- vecteur
- quantité ayant une amplitude et une direction


