7.5 : Forces des liaisons ioniques et covalentes
- Page ID
- 193985
- Décrire l'énergie de la formation et de la rupture de liaisons covalentes et ioniques
- Utiliser le cycle de Born-Haber pour calculer les énergies des réseaux pour les composés ioniques
- Utiliser les énergies moyennes des liaisons covalentes pour estimer les enthalpies de réaction
La force d'une liaison décrit la force avec laquelle chaque atome est joint à un autre atome, et donc la quantité d'énergie nécessaire pour rompre la liaison entre les deux atomes. Dans cette section, vous découvrirez la force de liaison des liaisons covalentes, puis vous la comparerez à la force des liaisons ioniques, qui est liée à l'énergie du réseau d'un composé.
Force de liaison : liaisons covalentes
Les molécules stables existent parce que les liaisons covalentes maintiennent les atomes ensemble. Nous mesurons la force d'une liaison covalente par l'énergie requise pour la rompre, c'est-à-dire l'énergie nécessaire pour séparer les atomes liés. La séparation d'une paire d'atomes liés nécessite de l'énergie ; plus une liaison est forte, plus l'énergie requise pour la rompre est importante. L'énergie requise pour rompre une liaison covalente spécifique dans une mole de molécules gazeuses est appelée énergie de liaison ou énergie de dissociation de la liaison. L'énergie de liaison d'une molécule diatomique est définie comme le changement d'enthalpie standard pour la réaction endothermique :\(D_{X–Y}\)
\[XY_{(g)}⟶X_{(g)}+Y_{(g)}\;\;\; D_{X−Y}=ΔH° \label{7.6.1} \]
Par exemple, l'énergie de liaison de la liaison H—H covalente pure est de 436 kJ par mole de liaisons H—H rompues :\(\Delta_{H–H}\)
\[H_{2(g)}⟶2H_{(g)} \;\;\; D_{H−H}=ΔH°=436kJ \label{EQ2} \]
Pour rompre une liaison, il faut toujours ajouter de l'énergie à la molécule. En conséquence, l'établissement d'un lien libère toujours de l'énergie.
Les molécules à trois atomes ou plus possèdent deux liaisons ou plus. La somme de toutes les énergies de liaison d'une telle molécule est égale au changement d'enthalpie standard pour la réaction endothermique qui rompt toutes les liaisons de la molécule. Par exemple, la somme des quatre énergies des liaisons C—H dans le CH 4, 1660 kJ, est égale au changement d'enthalpie standard de la réaction :
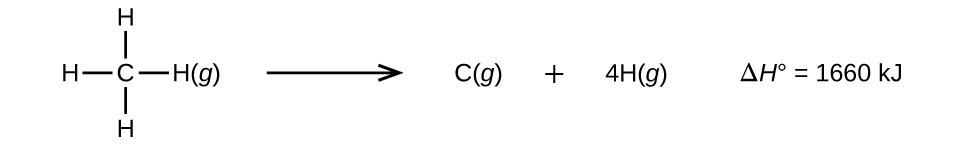
L'énergie moyenne des liaisons C—H,\(D_{C–H}\), est de 1660/4 = 415 kJ/mol parce qu'il y a quatre moles de liaisons C—H rompues par mole de réaction. Bien que les quatre liaisons C—H soient équivalentes dans la molécule d'origine, elles ne nécessitent pas toutes la même énergie pour se rompre ; une fois que la première liaison est rompue (ce qui nécessite 439 kJ/mol), les liaisons restantes sont plus faciles à rompre. La valeur de 415 kJ/mol est la moyenne, et non la valeur exacte requise pour rompre une liaison.
La force d'une liaison entre deux atomes augmente à mesure que le nombre de paires d'électrons dans la liaison augmente. Généralement, à mesure que la force de liaison augmente, la longueur de la liaison diminue. Ainsi, nous trouvons que les liaisons triples sont plus fortes et plus courtes que les doubles liaisons entre les deux mêmes atomes ; de même, les doubles liaisons sont plus fortes et plus courtes que les liaisons simples entre les deux mêmes atomes. Les énergies de liaison moyennes pour certaines liaisons communes apparaissent dans le tableau\(\PageIndex{2}\), et une comparaison des longueurs et des forces de liaison pour certaines liaisons communes apparaît dans le tableau\(\PageIndex{2}\). Lorsqu'un atome se lie à divers atomes d'un groupe, la force de liaison diminue généralement à mesure que nous descendons dans le groupe. Par exemple, C—F est de 439 kJ/mol, C—Cl est de 330 kJ/mol et C—Br est de 275 kJ/mol.
| Bond | Énergie obligataire | Bond | Énergie obligataire | Bond | Énergie obligataire | ||
|---|---|---|---|---|---|---|---|
| H—H | 436 | C—S | 260 | F—Cl | 255 | ||
| H—C | 415 | C-Cl | 330 | F—Br | 235 | ||
| H—N | 390 | C-Br | 275 | Si-Si | 230 | ||
| H—O | 464 | C-I | 240 | Si-P | 215 | ||
| H—F | 569 | N—N | 160 | Si-S | 225 | ||
| H—Si | 395 | \(\mathrm{N=N}\) | 418 | Si-Cl | 359 | ||
| H—P | 320 | \(\mathrm{N≡N}\) | 946 | Si-Br | 290 | ||
| H—S | 340 | N—NON | 200 | Si-I | 215 | ||
| H—Cl | 432 | N—F | 270 | P—P | 215 | ||
| H—Br | 370 | N—P | 210 | P—S | 230 | ||
| H—I | 295 | N—Cl | 200 | P-Cl | 330 | ||
| C-C | 345 | N-Br | 245 | P-Br | 270 | ||
| \(\mathrm{C=C}\) | 611 | O—O | 140 | P-I | 215 | ||
| \(\mathrm{C≡C}\) | 837 | \(\mathrm{O=O}\) | 498 | —S | 215 | ||
| C-N | 290 | O—F | 160 | S—Cl | 250 | ||
| \(\mathrm{C=N}\) | 615 | O—Si | 370 | S—Bar | 215 | ||
| \(\mathrm{C≡N}\) | 891 | O—P | 350 | Cl—Cl | 243 | ||
| C—O | 350 | O—Cl | 205 | Cl—Br | 220 | ||
| \(\mathrm{C=O}\) | 741 | O—I | 200 | Cl—I | 210 | ||
| \(\mathrm{C≡O}\) | 1080 | F—F | 160 | Br—Br | 190 | ||
| C-F | 439 | F—Si | 540 | Br—I | 180 | ||
| C-Si | 360 | F—P | 489 | I—I | 150 | ||
| C-P | 265 | F—S | 285 |
| Bond | Longueur de liaison (Å) | Énergie de liaison (kJ/mol) |
|---|---|---|
| C-C | 1,54 | 345 |
| \(\mathrm{C=C}\) | 1,34 | 611 |
| \(\mathrm{C≡C}\) | 1,20 | 837 |
| C-N | 1,43 | 290 |
| \(\mathrm{C=N}\) | 1,38 | 615 |
| \(\mathrm{C≡N}\) | 1,16 | 891 |
| C—O | 1,43 | 350 |
| \(\mathrm{C=O}\) | 1,23 | 741 |
| \(\mathrm{C≡O}\) | 1,13 | 1080 |
Nous pouvons utiliser les énergies des liaisons pour calculer les changements d'enthalpie approximatifs pour les réactions où les enthalpies de formation ne sont pas disponibles. Des calculs de ce type nous indiqueront également si une réaction est exothermique ou endothermique.
- Une réaction exothermique (Δ H négatif, produit de la chaleur) se produit lorsque les liaisons des produits sont plus fortes que celles des réactifs.
- Une réaction endothermique (Δ H positif, absorption de chaleur) se produit lorsque les liaisons des produits sont plus faibles que celles des réactifs.
Le changement d'enthalpie, Δ H, pour une réaction chimique est approximativement égal à la somme de l'énergie requise pour rompre toutes les liaisons dans les réactifs (énergie « entrée », signe positif) plus l'énergie libérée lorsque toutes les liaisons se forment dans les produits (énergie « sortie », signe négatif). Cela peut être exprimé mathématiquement de la manière suivante :
\[\Delta H=\sum D_{\text{bonds broken}}− \sum D_{\text{bonds formed}} \label{EQ3} \]
Dans cette expression, le symbole\(\Sigma\) signifie « la somme de » et D représente l'énergie de liaison en kilojoules par mole, qui est toujours un nombre positif. L'énergie de liaison est obtenue à partir d'un tableau et dépend du fait que la liaison en question est une liaison simple, double ou triple. Ainsi, pour calculer les enthalpies de cette manière, il est important de tenir compte de la liaison dans tous les réactifs et produits. Comme les valeurs D sont généralement des moyennes pour un type de liaison dans de nombreuses molécules différentes, ce calcul fournit une estimation approximative, et non une valeur exacte, de l'enthalpie de la réaction.
Envisagez la réaction suivante :
\[\ce{H_{2(g)} + Cl_{2(g)}⟶2HCl_{(g)}} \label{EQ4} \]
ou
\[\ce{H–H_{(g)} + Cl–Cl_{(g)}⟶2H–Cl_{(g)}} \label{\EQ5} \]
Pour former deux moles de HCl, il faut rompre une mole de liaisons H—H et une mole de liaisons Cl—Cl. L'énergie requise pour rompre ces liaisons est la somme de l'énergie de liaison de la liaison H—H (436 kJ/mol) et de la liaison Cl—Cl (243 kJ/mol). Au cours de la réaction, deux moles de liaisons H—Cl se forment (énergie de liaison = 432 kJ/mol), libérant 2 × 432 kJ ; soit 864 kJ. Comme les liaisons des produits sont plus fortes que celles des réactifs, la réaction libère plus d'énergie qu'elle n'en consomme :
\ [\ begin {align*}
ΔH&= \ sum \ mathrm {D_ {liaisons \ : rompues}} − \ sum \ mathrm {D_ {liaisons \ : formées}} \ \ [4pt]
&= \ mathrm {[D_ {H−H} +D_ {Cl−Cl}] −2D_ {H−Cl}} \ \ [4pt]
&= \ mathrm {[436+243] −2 (432) =−185 \ :kJ}
\ end {align*} \ nonnumber \]
Cet excès d'énergie est libéré sous forme de chaleur, de sorte que la réaction est exothermique. Le tableau T2 donne une valeur pour l'enthalpie molaire standard de formation de HCl (g)\(ΔH^\circ_\ce f\), de -92,307 kJ/mol. Le double de cette valeur est —184,6 kJ, ce qui correspond bien à la réponse obtenue précédemment pour la formation de deux moles de HCl.
Le méthanol, CH 3 OH, peut être un excellent carburant de remplacement. La réaction à haute température de la vapeur et du carbone produit un mélange de gaz monoxyde de carbone, CO et hydrogène, H 2, à partir duquel le méthanol peut être produit. À l'aide des énergies de liaison indiquées dans le tableau\(\PageIndex{2}\), calculez le changement d'enthalpie approximatif, Δ H, pour la réaction ici :
\[CO_{(g)}+2H2_{(g)}⟶CH_3OH_{(g)} \nonumber \]
Solution
Tout d'abord, nous devons écrire les structures de Lewis des réactifs et des produits :
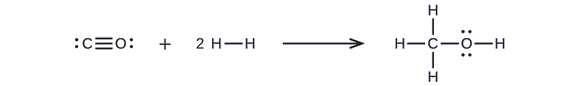
À partir de là, nous voyons que le Δ H de cette réaction implique l'énergie requise pour rompre une triple liaison C—O et deux liaisons simples H—H, ainsi que l'énergie produite par la formation de trois liaisons simples C—H, d'une liaison simple C—O et d'une liaison simple O—H. Nous pouvons l'exprimer comme suit (via l'équation \ ref {EQ3}) :
\ [\ begin {align*}
ΔH&= \ sum D_ {liaisons \ : rompues} − \ somme D_ {liaisons \ : formées} \ \
ΔH&= \ mathrm {[D_ {CO} +2 (D_ {H−H})] − [3 (D_ {C−H}) +D_ {C−O} +D_ {O−H}]}
\ fin {align*} \ nonnumber \]
En utilisant les valeurs d'énergie de liaison du tableau\(\PageIndex{2}\), nous obtenons :
\ [\ begin {align*}
ΔH&= [1080+2 (436)] − [3 (415) +350+464] \ \
&= \ ce {−107 \ :kJ}
\ end {align*} \ nonnumber \]
Nous pouvons comparer cette valeur à la valeur calculée sur la base\(ΔH^\circ_\ce f\) des données de l'annexe G :
\ [\ begin {align*}
ΔH&= [ΔH^ \ circ_ {\ ce f} \ ce {CH3OH} (g)] − [ΔH^ \ circ_ {\ ce f} \ ce {CO} (g) +2 × ΔH^ \ circ_ {\ ce f} \ ce {H2}] \ \
&= [−201,0] − [−110,0] − [−110,0] 52+2×0] \ \
&= \ mathrm {−90,5 \ :kJ}
\ end {align*} \ nonnumber \]
Notez qu'il existe un écart assez important entre les valeurs calculées à l'aide des deux méthodes différentes. Cela se produit parce que les valeurs D sont la moyenne de différentes forces de liaison ; par conséquent, elles ne donnent souvent qu'un accord approximatif avec d'autres données.
L'alcool éthylique, CH 3 CH 2 OH, a été l'un des premiers produits chimiques organiques délibérément synthétisés par l'homme. Il a de nombreuses utilisations dans l'industrie et c'est l'alcool contenu dans les boissons alcoolisées. Il peut être obtenu par fermentation du sucre ou synthétisé par hydratation de l'éthylène dans la réaction suivante :

À l'aide des énergies de liaison indiquées dans le tableau\(\PageIndex{2}\), calculez un changement d'enthalpie approximatif, Δ H, pour cette réaction.
- Réponse
-
—35 kJ
Force de liaison ionique et énergie du réseau
Un composé ionique est stable en raison de l'attraction électrostatique entre ses ions positifs et négatifs. L'énergie du réseau d'un composé est une mesure de la force de cette attraction. L'énergie du réseau (\(ΔH_{lattice}\)) d'un composé ionique est définie comme l'énergie requise pour séparer une mole du solide en ions gazeux qui le composent. Pour le solide ionique MX, l'énergie du réseau est le changement d'enthalpie du processus :
\[MX_{(s)}⟶Mn^+_{(g)}+X^{n−}_{(g)} \;\;\;\;\; ΔH_{lattice} \label{EQ6} \]
Notez que nous utilisons la convention selon laquelle le solide ionique est séparé en ions, de sorte que les énergies de notre réseau seront endothermiques (valeurs positives). Certains textes utilisent la convention équivalente mais opposée, définissant l'énergie du réseau comme l'énergie libérée lorsque des ions distincts se combinent pour former un réseau et donnent des valeurs négatives (exothermiques). Ainsi, si vous recherchez les énergies du réseau dans une autre référence, assurez-vous de vérifier quelle définition est utilisée. Dans les deux cas, une plus grande amplitude de l'énergie du réseau indique un composé ionique plus stable. Pour le chlorure de sodium, réseau Δ H = 769 kJ. Il faut donc 769 kJ pour séparer une mole de NaCl solide en ions Na + et Cl — gazeux. Lorsqu'une mole d'ions Na + et Cl — gazeux forme du NaCl solide, 769 kJ de chaleur sont libérés.
L'énergie\(ΔH_{lattice}\) du réseau d'un cristal ionique peut être exprimée par l'équation suivante (dérivée de la loi de Coulomb, régissant les forces entre les charges électriques) :
\[ΔH_{lattice}=\dfrac{C(Z^+)(Z^−)}{R_o} \label{EQ7} \]
dans lequel
- \(\ce{C}\)est une constante qui dépend du type de structure cristalline ;
- \(Z^+\)et\(Z^–\) sont les charges sur les ions ; et
- \(R_o\)est la distance interionique (la somme des rayons des ions positifs et négatifs).
Ainsi, l'énergie du réseau d'un cristal ionique augmente rapidement à mesure que les charges des ions augmentent et que la taille des ions diminue. Lorsque tous les autres paramètres sont maintenus constants, le fait de doubler la charge du cation et de l'anion quadruple l'énergie du réseau. Par exemple, l'énergie du réseau du LiF (Z + et Z — = 1) est de 1023 kJ/mol, tandis que celle du MgO (Z + et Z — = 2) est de 3 900 kJ/mol (R o est presque le même, environ 200pm pour les deux composés).
Les différentes distances interatomiques produisent différentes énergies de réseau. Par exemple, nous pouvons comparer l'énergie du réseau du MgF 2 (2957 kJ/mol) à celle du MgI 2 (2327 kJ/mol) pour observer l'effet sur l'énergie du réseau de la plus petite taille ionique du F — par rapport à I —.
Le rubis précieux est de l'oxyde d'aluminium, Al 2 O 3, contenant des traces de Cr 3 +. Le composé Al 2 Se 3 est utilisé dans la fabrication de certains dispositifs à semi-conducteurs. Lequel possède la plus grande énergie de réseau, Al 2 O 3 ou Al 2 Se 3 ?
Solution
Dans ces deux composés ioniques, les charges Z + et Z — sont les mêmes, de sorte que la différence d'énergie du réseau dépendra principalement de R o. L'ion O 2— est plus petit que l'ion Se 2 —. Ainsi, Al 2 O 3 aurait une distance interionique plus courte que Al 2 Se 3, et Al 2 O 3 aurait la plus grande énergie de réseau.
L'oxyde de zinc, ZnO, est un écran solaire très efficace. Comment l'énergie du réseau du ZnO se comparerait-elle à celle du NaCl ?
- Réponse
-
Le ZnO aurait la plus grande énergie de réseau parce que les valeurs Z du cation et de l'anion dans le ZnO sont plus élevées et que la distance interionique du ZnO est inférieure à celle du NaCl.
Le cycle Born-Haber
Il n'est pas possible de mesurer directement les énergies des réseaux. Cependant, l'énergie du réseau peut être calculée à l'aide de l'équation donnée dans la section précédente ou à l'aide d'un cycle thermochimique. Le cycle de Born-Haber est une application de la loi de Hess qui décompose la formation d'un solide ionique en une série d'étapes individuelles :
- \(ΔH^\circ_\ce f\), l'enthalpie standard de formation du composé
- IE, l'énergie d'ionisation du métal
- EA, l'affinité électronique du non-métal
- \(ΔH^\circ_s\), l'enthalpie de sublimation du métal
- D, l'énergie de dissociation des liaisons du matériau non métallique
- réseau ΔH, énergie du réseau du composé
La\(\PageIndex{1}\) figure montre le cycle de Born-Haber pour la formation du fluorure de césium solide.
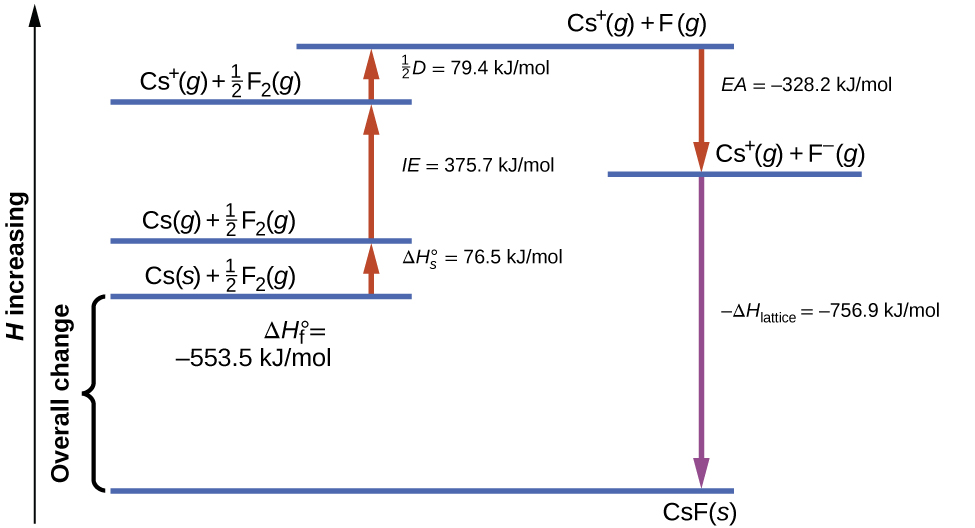
Nous commençons par les éléments dans leurs états les plus courants, Cs (s) et F 2 (g). Le\(ΔH^\circ_\ce s\) représente la conversion du césium solide en gaz, puis l'énergie d'ionisation convertit les atomes de césium gazeux en cations. À l'étape suivante, nous prenons en compte l'énergie requise pour rompre la liaison F—F afin de produire des atomes de fluor. La conversion d'une mole d'atomes de fluor en ions fluorure est un processus exothermique. Cette étape dégage de l'énergie (affinité électronique) et apparaît comme décroissante le long de l'axe y. Nous avons maintenant une mole de cations Cs et une mole d'anions F. Ces ions se combinent pour produire du fluorure de césium solide. Le changement d'enthalpie à cette étape est négatif de l'énergie du réseau, il s'agit donc également d'une quantité exothermique. L'énergie totale impliquée dans cette conversion est égale à l'enthalpie de formation,, du composé à partir de ses éléments\(ΔH^\circ_\ce f\), déterminée expérimentalement. Dans ce cas, le changement global est exothermique.
La loi de Hess peut également être utilisée pour montrer la relation entre les enthalpies des étapes individuelles et l'enthalpie de formation. Le tableau le\(\PageIndex{3}\) montre pour le fluorure de césium, CsF.
| Enthalpie de sublimation de Cs (s) | \(\ce{Cs}(s)⟶\ce{Cs}(g)\hspace{20px}ΔH=ΔH^\circ_s=\mathrm{77\:kJ/mol}\) |
|---|---|
| La moitié de l'énergie de liaison du F 2 | \(\dfrac{1}{2}\ce{F2}(g)⟶\ce{F}(g)\hspace{20px}ΔH=\dfrac{1}{2}D=\mathrm{79\:kJ/mol}\) |
| Énergie d'ionisation du Cs (g) | \(\ce{Cs}(g)⟶\ce{Cs+}(g)+\ce{e-}\hspace{20px}ΔH=IE=\ce{376\:kJ/mol}\) |
| Négatif de l'affinité électronique de F | \(\ce{F}(g)+\ce{e-}⟶\ce{F-}(g)\hspace{20px}ΔH=−EA=\ce{-328\:kJ/mol}\) |
| Négatif de l'énergie du réseau du CsF (s) | \(\ce{Cs+}(g)+\ce{F-}(g)⟶\ce{CsF}(s)\hspace{20px}ΔH=−ΔH_\ce{lattice}=\:?\) |
| Enthalpie de formation de CsF (s), ajouter les étapes 1 à 5 |
\(ΔH=ΔH^\circ_f=ΔH^\circ_s+\dfrac{1}{2}D+IE+(−EA)+(−ΔH_\ce{lattice})\) \(\ce{Cs}(s)+\dfrac{1}{2}\ce{F2}(g)⟶\ce{CsF}(s)=\ce{-554\:kJ/mol}\) |
Ainsi, l'énergie du réseau peut être calculée à partir d'autres valeurs. Pour le chlorure de césium, en utilisant ces données, l'énergie du réseau est la suivante :
\[ΔH_\ce{lattice}=\mathrm{(411+109+122+496+368)\:kJ=770\:kJ} \nonumber \]
Le cycle de Born-Haber peut également être utilisé pour calculer n'importe laquelle des autres grandeurs de l'équation de l'énergie du réseau, à condition que le reste soit connu. Par exemple, si l'enthalpie pertinente de sublimation\(ΔH^\circ_s\), l'énergie d'ionisation (IE), l'enthalpie de dissociation des liaisons (D), l'énergie du réseau Δ H, et l'enthalpie standard de formation\(ΔH^\circ_\ce f\) sont connues, le cycle de Born-Haber peut être utilisé pour déterminer l'électron affinité d'un atome.
Les énergies de réseau calculées pour les composés ioniques sont généralement beaucoup plus grandes que les énergies de dissociation des liaisons mesurées pour les liaisons covalentes. Alors que les énergies des réseaux se situent généralement entre 600 et 4 000 kJ/mol (certaines encore plus), les énergies de dissociation des liaisons covalentes se situent généralement entre 150 et 400 kJ/mol pour les liaisons simples. Gardez toutefois à l'esprit qu'il ne s'agit pas de valeurs directement comparables. Pour les composés ioniques, les énergies du réseau sont associées à de nombreuses interactions, car les cations et les anions se regroupent dans un réseau étendu. Pour les liaisons covalentes, l'énergie de dissociation des liaisons est associée à l'interaction de deux atomes seulement.
Résumé
La force d'une liaison covalente est mesurée par son énergie de dissociation, c'est-à-dire la quantité d'énergie requise pour rompre cette liaison particulière dans une mole de molécules. Les liaisons multiples sont plus fortes que les liaisons simples entre les mêmes atomes. L'enthalpie d'une réaction peut être estimée sur la base de l'apport énergétique requis pour rompre les liaisons et de l'énergie libérée lors de la formation de nouvelles liaisons. Pour les liaisons ioniques, l'énergie du réseau est l'énergie requise pour séparer une mole d'un composé en ions en phase gazeuse. L'énergie du réseau augmente pour les ions ayant des charges plus élevées et des distances plus courtes entre les ions. Les énergies des réseaux sont souvent calculées à l'aide du cycle de Born-Haber, un cycle thermochimique comprenant toutes les étapes énergétiques impliquées dans la conversion des éléments en un composé ionique.
Équations clés
- Énergie de liaison pour une molécule diatomique :\(\ce{XY}(g)⟶\ce{X}(g)+\ce{Y}(g)\hspace{20px}\ce{D_{X–Y}}=ΔH°\)
- Changement d'enthalpie : Δ H = liaisons D rompues — liaisons D formées
- Énergie du réseau pour un MX solide :\(\ce{MX}(s)⟶\ce M^{n+}(g)+\ce X^{n−}(g)\hspace{20px}ΔH_\ce{lattice}\)
- Énergie du réseau pour un cristal ionique :\(ΔH_\ce{lattice}=\mathrm{\dfrac{C(Z^+)(Z^-)}{R_o}}\)
Notes
- Cette question est tirée de l'examen de placement avancé en chimie et est utilisée avec l'autorisation du Service des tests éducatifs.
Lexique
- énergie des liaisons
- (également, énergie de dissociation de la liaison) énergie requise pour rompre une liaison covalente dans une substance gazeuse
- Cycle Born-Haber
- cycle thermochimique reliant les différentes étapes énergétiques impliquées dans la formation d'un solide ionique à partir des éléments concernés
- énergie du réseau (réseau Δ H)
- énergie requise pour séparer une mole d'un solide ionique en ions gazeux qui le composent


