7.E : Liaison chimique et géométrie moléculaire (exercices)
- Page ID
- 193996
7.1 : Liaison ionique
Q7.1.1
Un cation gagne-t-il des protons pour former une charge positive ou perd-il des électrons ?
7.1.1
Les protons du noyau ne changent pas lors de réactions chimiques normales. Seuls les électrons extérieurs se déplacent. Des charges positives se forment lorsque des électrons sont perdus.
Q7.1.2
Le sulfate de fer (III) [Fe 2 (SO 4) 3] est composé de Fe 3+ et\(\ce{SO4^2-}\) d'ions. Expliquez pourquoi un échantillon de sulfate de fer (III) n'est pas chargé.
Q7.1.3
Lequel des atomes suivants devrait former des ions négatifs dans les composés ioniques binaires et lequel devrait former des ions positifs : P, I, Mg, Cl, In, Cs, O, Pb, Co ?
7.1.3
P, I, Cl et O formeraient des anions car ce ne sont pas des métaux. Le Mg, l'In, le Cs, le Pb et le Co formeraient des cations car ce sont des métaux.
Q7.1.4
Lequel des atomes suivants devrait former des ions négatifs dans les composés ioniques binaires et lequel devrait former des ions positifs : Br, Ca, Na, N, F, Al, Sn, S, Cd ?
Q7.1.5
Prédisez la charge des ions monatomiques formés à partir des atomes suivants dans des composés ioniques binaires :
- P
- Mg
- Al
- O
- Cl
- CS
7.1.5
P 3— ; Mg 2+ ; Al 3+ ; O 2— ; Cl — ; Cs +
Q7.1.6
Prédisez la charge des ions monatomiques formés à partir des atomes suivants dans des composés ioniques binaires :
- JE
- Sr
- K
- N
- S
- Dans
7.1.6
- I -
- Sr. 2+
- K +
- N 3-
- S 2-
- Dans 3+
Q7.1.7
Écrivez la configuration électronique pour chacun des ions suivants :
- Comme 3—
- Je —
- Être plus de deux
- Cd 2+
- OU 2—
- Ga 3+
- Li +
- (h) N 3—
- (i) Sn 2+
- (j) Co 2+
- (k) Fe 2+
- (l) En tant que 3+
7.1.7
[Ar] 4 s 2 3 d 10 4 p 6 ; [Kr] 4 d 10 5 s 2 5 p 6 1 s 2 [Kr] 4 d 10 ; [Il] 2 s 2 p 6 ; [Ar] 3 d 10 ; 1 s 2 (h) [He] 2 s 2 2 2 p 6 (i) [Kr] 4 d 10 5 s 2 (j) [Ar] 3 d 7 (k) [Ar] 3 d 6, (l) [Ar] 3 d 10 4 x 2
Q7.1.8
Écrivez la configuration électronique des ions monoatomiques formés à partir des éléments suivants (qui constituent la plus grande concentration d'ions monatomiques dans l'eau de mer) :
- Cl
- Na
- Mg
- Californie
- K
- Bar
- Sr
- (h) F
Q7.1.9
Écrivez la configuration électronique complète pour chacun des atomes suivants et pour l'ion monatomique présent dans les composés ioniques binaires contenant l'élément :
- Al
- Bar
- Sr
- Li
- Comme
- S
7.1.9
1 s 2 2 s 2 2 p 6 3 s 2 3 p 1 ; Al 3+ : 1 s 2 2 s 2 2 p 6 ; 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 5 ; 1 s 2 2 x 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 ; 1 s 2 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 5 s 2 ;
Sr 2+ : 1 s 2 2 2 2 p 6 3 s 2 3 p 6 3 p 6 3 d 10 4 s 2 4 p 6 ; 1 s 2 2 1 ;
Li + : 1 s 2 ; 1 s 2 2 2 2 p 6 3 s 2 3 p 6 3 p 6 3 d 10 4 s 2 4 p 3 ; 1 s 2 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6 ; 1 s 2 2 2 s 2 2 p 6 3 s 2 3 p 4 ; 1 s 2 2 2 2 2 p 6 3 s 2 3 p 6
Q7.1.10
À partir des étiquettes de plusieurs produits commerciaux, dressez une liste de six composés ioniques contenus dans les produits. Pour chaque composé, écrivez la formule. (Il se peut que vous deviez rechercher certaines formules dans une référence appropriée.)
7.3 : Liaison covalente
Pourquoi est-il incorrect de parler d'une molécule de NaCl solide ?
Le NaCl est constitué d'ions discrets disposés dans un réseau cristallin, et non de molécules liées par covalence.
Quelles informations pouvez-vous utiliser pour prédire si une liaison entre deux atomes est covalente ou ionique ?
Prédisez lesquels des composés suivants sont ioniques et lesquels sont covalents, en fonction de l'emplacement de leurs atomes constitutifs dans le tableau périodique :
- Cl 2 CO
- Non
- NCl 3
- CoBR 2
- K 2 S
- CO
- CAF 2
- (h) Bonjour
- (i) CaO
- (j) IbR
- k) CO 2
ionique : (b), (d), (e), (g) et (i) ; covalent : (a), (c), (f), (h), (j) et (k)
Expliquez la différence entre une liaison covalente non polaire, une liaison covalente polaire et une liaison ionique.
À partir de sa position dans le tableau périodique, déterminez quel atome de chaque paire est le plus électronégatif :
- Br ou Cl
- N ou O
- S ou O
- P ou S
- Si ou N
- Ba ou P
- N ou K
Cl ; O ; O ; S ; N ; P ; N
À partir de sa position dans le tableau périodique, déterminez quel atome de chaque paire est le plus électronégatif :
- N ou P
- N ou Ge
- S ou F
- Cl ou S
- H ou C
- Voir pour PC
- C ou Si
À partir de leur position dans le tableau périodique, organisez les atomes dans chacune des séries suivantes par ordre d'électronégativité croissante :
- C, F, H, N, O
- Br, Cl, F, H, I
- F, H, O, P, S
- Al, H, Na, O, P
- Ba, H, N, O, Comme
H, C, N, O, F ; H, I, Br, Cl, F ; H, P, S, O, F ; Na, Al, H, P, O ; Ba, H, As, N, O
À partir de leur position dans le tableau périodique, organisez les atomes dans chacune des séries suivantes par ordre d'électronégativité croissante :
- As, H, N, P, Sb
- Cl, H, P, S, Si
- Br, Cl, Ge, H, Sr
- Ca, H, K, N, Si
- Cl, Cs, Ge, H, Sr
Quels atomes peuvent se lier au soufre de manière à produire une charge partielle positive sur l'atome de soufre ?
N, O, F et Cl
Quel est le lien le plus polaire ?
- C-C
- C—H
- N—H
- O—H
- Se-H
Identifiez la liaison la plus polaire dans chacune des paires de liaisons suivantes :
- HF ou HCl
- NO ou CO
- SH ou OH
- PCl ou SCl
- CH ou NH
- SO ou PO
- CN ou NN
HF ; CO ; OH ; PCl ; NH ; PO ; CN
Parmi les molécules ou ions suivants, lesquels contiennent des liaisons polaires ?
- DE 3
- S 8
- \(\ce{O2^2-}\)
- \(\ce{NO3-}\)
- CO 2
- H 2 S
- \(\ce{BH4-}\)
7.4 : Symboles et structures de Lewis
Q7.4.1
Écrivez les symboles de Lewis pour chacun des ions suivants :
- Comme 3—
- Je —
- Soyez plus que 2
- OU 2—
- Ga 3+
- Li +
- N° 3—
7.4.1
huit électrons :
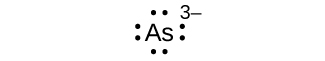
huit électrons :

pas d'électrons
Soyez plus ou moins ;
huit électrons :
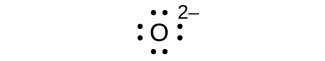
pas d'électrons
Gaz 3+ ;
pas d'électrons
Li + ;
huit électrons :
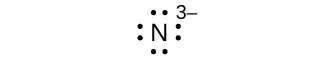
Q7.4.2
De nombreux ions monatomiques se trouvent dans l'eau de mer, y compris les ions formés à partir de la liste d'éléments suivante. Écrivez les symboles de Lewis pour les ions monatomiques formés à partir des éléments suivants :
- Cl
- Na
- Mg
- Californie
- K
- Bar
- Sr
- F
Q7.4.3
Écrivez les symboles de Lewis des ions dans chacun des composés ioniques suivants et les symboles de Lewis de l'atome à partir duquel ils sont formés :
- MGs
- Tous les 2 ou 3
- GAcL 3
- K 2 O
- Couvercle 3 N
- KF
(a)
 ;
;
(b)
 ;
;
(c)
 ;
;
(d)
 ;
;
(e)
 ;
;
(f)

Dans les structures de Lewis répertoriées ici, M et X représentent divers éléments de la troisième période du tableau périodique. Écrivez la formule de chaque composé en utilisant les symboles chimiques de chaque élément :
(a)

(b)

(c)

(d)

Écrivez la structure de Lewis de la molécule diatomique P 2, une forme instable de phosphore présente dans les vapeurs de phosphore à haute température.

Écrivez les structures de Lewis pour les éléments suivants :
- H 2
- HBr
- PCl 3
- SF 2
- H 2 CCH 2
- HNNH
- H 2 CNH
- (h) NON —
- (i) N 2
- (j) CO
- (k) CN —
Écrivez les structures de Lewis pour les éléments suivants :
- O 2
- H 2 CO
- SaF 3
- CLnO
- SiCl 4
- H 3 OU +
- \(\ce{NH4+}\)
- (h) \(\ce{BF4-}\)
- (i) HCCH
- (j) ClCN
- (k) \(\ce{C2^2+}\)
(a)

In this case, the Lewis structure is inadequate to depict the fact that experimental studies have shown two unpaired electrons in each oxygen molecule.
(b)
 ;
;
(c)
 ;
;
(d)
 ;
;
(e)
 ;
;
(f)
 ;
;
(g)
 ;
;
(h)
 ;
;
(i)
 ;
;
(j)
 ;
;
(k)

Écrivez les structures de Lewis pour les éléments suivants :
- ClF 3
- PCl 5
- B.F. 3
- \(\ce{PF6-}\)
Write Lewis structures for the following:
- SeF6
- XeF4
- \(\ce{SeCl3+}\)
- Cl2BBCl2 (contains a B–B bond)
SeF6:
 ;
;
XeF4:
 ;
;
\(\ce{SeCl3+}\):
 ;
;
Cl 2 BBCl 2 :

Ecrivez des structures de Lewis pour :
- \(\ce{PO4^3-}\)
- \(\ce{ICl4-}\)
- \(\ce{SO3^2-}\)
- HONO
Correct the following statement: “The bonds in solid PbCl2 are ionic; the bond in a HCl molecule is covalent. Thus, all of the valence electrons in PbCl2 are located on the Cl– ions, and all of the valence electrons in a HCl molecule are shared between the H and Cl atoms.”
Two valence electrons per Pb atom are transferred to Cl atoms; the resulting Pb2+ ion has a 6s2 valence shell configuration. Two of the valence electrons in the HCl molecule are shared, and the other six are located on the Cl atom as lone pairs of electrons.
Write Lewis structures for the following molecules or ions:
- SbH3
- XeF2
- Se8 (a cyclic molecule with a ring of eight Se atoms)
Methanol, H3COH, is used as the fuel in some race cars. Ethanol, C2H5OH, is used extensively as motor fuel in Brazil. Both methanol and ethanol produce CO2 and H2O when they burn. Write the chemical equations for these combustion reactions using Lewis structures instead of chemical formulas.

Many planets in our solar system contain organic chemicals including methane (CH4) and traces of ethylene (C2H4), ethane (C2H6), propyne (H3CCCH), and diacetylene (HCCCCH). Write the Lewis structures for each of these molecules.
Carbon tetrachloride was formerly used in fire extinguishers for electrical fires. It is no longer used for this purpose because of the formation of the toxic gas phosgene, Cl2CO. Write the Lewis structures for carbon tetrachloride and phosgene.

Identifiez les atomes qui correspondent à chacune des configurations électroniques suivantes. Ensuite, écrivez le symbole de Lewis pour l'ion commun formé à partir de chaque atome :
- 1 x 2 2 x 2 x 2 x 5
- 1 x 2 2 x 2 p 6 3 x 2
- 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 x 10
- 1 s 2 2 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 4 p 4
- 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 1
La disposition des atomes dans plusieurs molécules biologiquement importantes est donnée ici. Complétez les structures de Lewis de ces molécules en ajoutant de multiples liaisons et des paires isolées. N'ajoutez plus d'atomes.
l'acide aminé sérine :

urée :

acide pyruvique :

uracile :

acide carbonique :

(a)
 ;
;
(b)
 ;
;
(c)
 ;
;
(d)
 ;
;
(e)

Un composé ayant une masse molaire d'environ 28 g/mol contient 85,7 % de carbone et 14,3 % d'hydrogène en masse. Écrivez la structure de Lewis pour une molécule du composé.
Un composé ayant une masse molaire d'environ 42 g/mol contient 85,7 % de carbone et 14,3 % d'hydrogène en masse. Écrivez la structure de Lewis pour une molécule du composé.

Deux arrangements d'atomes sont possibles pour un composé ayant une masse molaire d'environ 45 g/mol qui contient 52,2 % de C, 13,1 % de H et 34,7 % d'O en masse. Écrivez les structures de Lewis pour les deux molécules.
En quoi les liaisons simples, doubles et triples sont-elles similaires ? En quoi diffèrent-ils ?
Chaque liaison comprend un partage d'électrons entre les atomes. Deux électrons sont partagés dans une seule liaison, quatre électrons sont partagés dans une double liaison et six électrons sont partagés dans une triple liaison.
7.5 : Charges formelles et résonance
Écrivez des formes de résonance qui décrivent la distribution des électrons dans chacune de ces molécules ou ions.
- dioxyde de sélénium, OSeO
- ion nitrate,\(\ce{NO3-}\)
- nitric acid, HNO3 (N is bonded to an OH group and two O atoms)
- benzene, C6H6:

l'ion formiate :

Écrivez des formes de résonance qui décrivent la distribution des électrons dans chacune de ces molécules ou ions.
- dioxyde de soufre, SO 2
- ion carbonate,\(\ce{CO3^2-}\)
- hydrogen carbonate ion, \(\ce{HCO3-}\) (C is bonded to an OH group and two O atoms)
- pyridine:

l'ion allyle :

(a)
 ;
;
(b)
 ;
;
(c)
 ;
;
(d)
 ;
;
(e)

Écrivez les formes de résonance de l'ozone, O 3, le composant de la haute atmosphère qui protège la Terre des rayons ultraviolets.
Le nitrite de sodium, utilisé pour conserver le bacon et d'autres viandes, est un composé ionique. Ecrivez les formes de résonance de l'ion nitrite,\(\ce{NO2-}\).

En termes de liaisons présentes, expliquez pourquoi l'acide acétique, CH 3 CO 2 H, contient deux types distincts de liaisons carbone-oxygène, alors que l'ion acétate, formé par la perte d'un ion hydrogène de l'acide acétique, ne contient qu'un seul type de liaison carbone-oxygène. Les structures squelettiques de ces espèces sont présentées :

Écrivez les structures de Lewis pour ce qui suit et incluez les structures de résonance le cas échéant. Indiquez lequel possède la liaison carbone-oxygène la plus forte.
- CO 2
- CO
(a)

(b)

Le CO possède la liaison carbone-oxygène la plus forte car il existe une triple liaison reliant le C et l'O. Le CO 2 possède des liaisons doubles.
Les dentifrices contenant de l'hydrogénocarbonate de sodium (bicarbonate de sodium) et du peroxyde d'hydrogène sont largement utilisés. Écrivez les structures de Lewis pour l'ion carbonate d'hydrogène et la molécule de peroxyde d'hydrogène, avec des formes de résonance le cas échéant.
Déterminez la charge formelle de chaque élément comme suit :
- HCl
- CF 4
- PCl 3
- PF 5
H : 0, Cl : 0 ; C : 0, F : 0 ; P : 0, Cl 0 ; P : 0, F : 0
Déterminez la charge formelle de chaque élément comme suit :
- H 3 OU +
- \(\ce{SO4^2-}\)
- NH3
- \(\ce{O2^2-}\)
- H2O2
Calculate the formal charge of chlorine in the molecules Cl2, BeCl2, and ClF5.
Cl in Cl2: 0; Cl in BeCl2: 0; Cl in ClF5: 0
Calculate the formal charge of each element in the following compounds and ions:
- F2CO
- NO–
- \(\ce{BF4-}\)
- \(\ce{SnCl3-}\)
- H2CCH2
- ClF3
- SeF6
- (h) \(\ce{PO4^3-}\)
Draw all possible resonance structures for each of these compounds. Determine the formal charge on each atom in each of the resonance structures:
- O3
- SO2
- \(\ce{NO2-}\)
- \(\ce{NO3-}\)
 ;
;
(b)
 ;
;
(c)
![[Two Lewis structures are shown, with brackets surrounding each with a superscripted negative sign and a double ended arrow in between. The left structure shows a nitrogen atom with one lone pair of electrons single bonded to an oxygen atom with three lone pairs of electrons and double bonded to an oxygen atom with two lone pairs of electrons. The symbols and numbers below this structure read “open parenthesis, 0, close parenthesis, open parenthesis, 0, close parenthesis, open parenthesis, negative 1, close parenthesis. The right structure appears as a mirror image of the left and the symbols and numbers below this structure read “open parenthesis, negative 1, close parenthesis, open parenthesis, 0, close parenthesis, open parenthesis, 0, close parenthesis.]](http://cnx.org/resources/1fdade826754e56f88dd8009bac80fa91af0bebc/CNX_Chem_07_04_Exercis12c_img.jpg) ;
;
(d)
![[Trois structures de Lewis sont illustrées, avec des crochets entourant chacune d'elles par un signe négatif en exposant et une flèche à double extrémité entre les deux. La structure de gauche montre un atome d'azote lié individuellement à deux atomes d'oxygène, chacun contenant trois paires d'électrons et lié deux fois à un atome d'oxygène contenant deux paires d'électrons solitaires. Les atomes d'oxygène liés à une seule liaison sont marqués, depuis le haut de la structure et dans le sens des aiguilles d'une montre, « parenthèse ouverte, négative 1, parenthèse fermée, parenthèse ouverte, positive 1, parenthèse fermée ». Les symboles et les chiffres situés sous cette structure se lisent comme suit : « parenthèses ouvertes, 0, parenthèses fermées, parenthèses ouvertes, moins 1, parenthèses fermées ». La structure centrale montre un atome d'azote lié individuellement à deux atomes d'oxygène, chacun contenant trois paires isolées d'électrons, dont l'une est étiquetée « parenthèse ouverte, positive 1, parenthèse fermée » et double liée à un atome d'oxygène avec deux paires isolées d'électrons étiquetées « parenthèse ouverte, 0, parenthèse fermée ». Les symboles et les chiffres situés sous cette structure se lisent comme suit : « parenthèses ouvertes, négatif 1, parenthèses fermées, parenthèses ouvertes, négatif 1, parenthèses fermées ». La structure de droite montre un atome d'azote lié individuellement à deux atomes d'oxygène, chacun contenant trois paires d'électrons et lié deux fois à un atome d'oxygène contenant deux paires d'électrons solitaires. L'un des atomes d'oxygène à liaison simple est marqué « parenthèse ouverte, négatif 1, parenthèse fermée » tandis que l'oxygène à double liaison est marqué « parenthèse ouverte, positif 1, parenthèse fermée ». Les symboles et les chiffres situés sous cette structure se lisent comme suit : « parenthèses ouvertes, moins 1, parenthèses fermées » et « parenthèses ouvertes, 0, parenthèses fermées ».]](http://cnx.org/resources/263fd2cd3c8d574474c489b5bb2f41b94cd81ae5/CNX_Chem_07_04_Exercis12d_img.jpg)
Sur la base de considérations formelles de charge, laquelle des options suivantes serait probablement la bonne disposition des atomes dans le chlorure de nitrosyle : ClNO ou ClON ?
Sur la base de considérations formelles relatives à la charge, laquelle des substances suivantes serait probablement la bonne disposition des atomes dans l'acide hypochloreux : HOCl ou OClH ?
HOCL
Sur la base de considérations formelles de charge, laquelle des options suivantes serait probablement la bonne disposition des atomes dans le dioxyde de soufre : OSO ou SOO ?
Dessinez la structure de l'hydroxylamine, H 3 NO, et attribuez des charges formelles ; recherchez la structure. La structure réelle est-elle conforme aux charges formelles ?
La structure qui donne des frais formels nuls est conforme à la structure réelle :

L'iode forme une série de fluorures (listés ici). Écrivez les structures de Lewis pour chacun des quatre composés et déterminez la charge formelle de l'atome d'iode dans chaque molécule :
- SI
- SI 3
- SI 5
- SI 7
Écrivez la structure de Lewis et la formule chimique du composé dont la masse molaire est d'environ 70 g/mol et qui contient 19,7 % d'azote et 80,3 % de fluor en masse, et déterminez la charge formelle des atomes de ce composé.
NF 3 ;

Parmi les structures suivantes, laquelle attendons-nous pour l'acide nitreux ? Déterminez les accusations formelles :

L'acide sulfurique est le produit chimique industriel produit en plus grande quantité dans le monde. Environ 90 milliards de livres sont produites chaque année rien qu'aux États-Unis. Écrivez la structure de Lewis de l'acide sulfurique, H 2 SO 4, qui possède deux atomes d'oxygène et deux groupes OH liés au soufre.

7.6 : Forces des liaisons ioniques et covalentes
Quelle liaison de chacune des paires de liaisons suivantes est la plus forte ?
- C—C ou\(\mathrm{C=C}\)
- C–N or \(\mathrm{C≡N}\)
- \(\mathrm{C≡O}\) or \(\mathrm{C=O}\)
- H–F or H–Cl
- C–H or O–H
- C–N or C–O
Using the bond energies in Table, determine the approximate enthalpy change for each of the following reactions:
- \(\ce{H2}(g)+\ce{Br2}(g)⟶\ce{2HBr}(g)\)
- \(\ce{CH4}(g)+\ce{I2}(g)⟶\ce{CH3I}(g)+\ce{HI}(g)\)
- (c) \(\ce{C2H4}(g)+\ce{3O2}(g)⟶\ce{2CO2}(g)+\ce{2H2O}(g)\)
- −114 kJ;
- 30 kJ;
- (c) −1055 kJ
Using the bond energies in Table, determine the approximate enthalpy change for each of the following reactions:
- \(\ce{Cl2}(g)+\ce{3F2}(g)⟶\ce{2ClF3}(g)\)
- \(\mathrm{H_2C=CH_2}(g)+\ce{H2}(g)⟶\ce{H3CCH3}(g)\)
- (c) \(\ce{2C2H6}(g)+\ce{7O2}(g)⟶\ce{4CO2}(g)+\ce{6H2O}(g)\)
When a molecule can form two different structures, the structure with the stronger bonds is usually the more stable form. Use bond energies to predict the correct structure of the hydroxylamine molecule:

The greater bond energy is in the figure on the left. It is the more stable form.
How does the bond energy of HCldiffer from the standard enthalpy of formation of HCl(g)?
Using the standard enthalpy of formation data in Appendix G, show how the standard enthalpy of formation of HCl(g) can be used to determine the bond energy.
\(\ce{HCl}(g)⟶\dfrac{1}{2}\ce{H2}(g)+\dfrac{1}{2}\ce{Cl2}(g)\hspace{20px}ΔH^\circ_1=−ΔH^\circ_{\ce f[\ce{HCl}(g)]}\\
\dfrac{1}{2}\ce{H2}(g)⟶\ce{H}(g)\hspace{105px}ΔH^\circ_2=ΔH^\circ_{\ce f[\ce H(g)]}\\
\underline{\dfrac{1}{2}\ce{Cl2}(g)⟶\ce{Cl}(g)\hspace{99px}ΔH^\circ_3=ΔH^\circ_{\ce f[\ce{Cl}(g)]}}\\
\ce{HCl}(g)⟶\ce{H}(g)+\ce{Cl}(g)\hspace{58px}ΔH^\circ_{298}=ΔH^\circ_1+ΔH^\circ_2+ΔH^\circ_3\)
\(\begin{align}
D_\ce{HCl}=ΔH^\circ_{298}&=ΔH^\circ_{\ce f[\ce{HCl}(g)]}+ΔH^\circ_{\ce f[\ce H(g)]}+ΔH^\circ_{\ce f[\ce{Cl}(g)]}\\
&=\mathrm{−(−92.307\:kJ)+217.97\:kJ+121.3\:kJ}\\
&=\mathrm{431.6\:kJ}
\end{align}\)
Using the standard enthalpy of formation data in Appendix G, calculate the bond energy of the carbon-sulfur double bond in CS2.
Using the standard enthalpy of formation data in Appendix G, determine which bond is stronger: the S–F bond in SF4(g) or in SF6(g)?
The S–F bond in SF4 is stronger.
Using the standard enthalpy of formation data in Appendix G, determine which bond is stronger: the P–Cl bond in PCl3(g) or in PCl5(g)?
Complete the following Lewis structure by adding bonds (not atoms), and then indicate the longest bond:


The C–C single bonds are longest.
Use the bond energy to calculate an approximate value of ΔH for the following reaction. Which is the more stable form of FNO2?

Use principles of atomic structure to answer each of the following:1
- The radius of the Ca atom is 197 pm; the radius of the Ca2+ ion is 99 pm. Account for the difference.
- The lattice energy of CaO(s) is –3460 kJ/mol; the lattice energy of K2O is –2240 kJ/mol. Account for the difference.
- (c) Given these ionization values, explain the difference between Ca and K with regard to their first and second ionization energies.
| Element | First Ionization Energy (kJ/mol) | Second Ionization Energy (kJ/mol) |
|---|---|---|
| K | 419 | 3050 |
| Ca | 590 | 1140 |
The first ionization energy of Mg is 738 kJ/mol and that of Al is 578 kJ/mol. Account for this difference.
When two electrons are removed from the valence shell, the Ca radius loses the outermost energy level and reverts to the lower n = 3 level, which is much smaller in radius. The +2 charge on calcium pulls the oxygen much closer compared with K, thereby increasing the lattice energy relative to a less charged ion. (c) Removal of the 4s electron in Ca requires more energy than removal of the 4s electron in K because of the stronger attraction of the nucleus and the extra energy required to break the pairing of the electrons. The second ionization energy for K requires that an electron be removed from a lower energy level, where the attraction is much stronger from the nucleus for the electron. In addition, energy is required to unpair two electrons in a full orbital. For Ca, the second ionization potential requires removing only a lone electron in the exposed outer energy level. In Al, the removed electron is relatively unprotected and unpaired in a p orbital. The higher energy for Mg mainly reflects the unpairing of the 2s electron.
The lattice energy of LiF is 1023 kJ/mol, and the Li–F distance is 200.8 pm. NaF crystallizes in the same structure as LiF but with a Na–F distance of 231 pm. Which of the following values most closely approximates the lattice energy of NaF: 510, 890, 1023, 1175, or 4090 kJ/mol? Explain your choice.
For which of the following substances is the least energy required to convert one mole of the solid into separate ions?
- MgO
- SrO
- (c) KF
- CsF
- MgF2
(d)
The reaction of a metal, M, with a halogen, X2, proceeds by an exothermic reaction as indicated by this equation: \(\ce{M}(s)+\ce{X2}(g)⟶\ce{MX2}(s)\). For each of the following, indicate which option will make the reaction more exothermic. Explain your answers.
- a large radius vs. a small radius for M+2
- a high ionization energy vs. a low ionization energy for M
- (c) an increasing bond energy for the halogen
- a decreasing electron affinity for the halogen
- an increasing size of the anion formed by the halogen
The lattice energy of LiF is 1023 kJ/mol, and the Li–F distance is 201 pm. MgO crystallizes in the same structure as LiF but with a Mg–O distance of 205 pm. Which of the following values most closely approximates the lattice energy of MgO: 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol, or 4008 kJ/mol? Explain your choice.
4008 kJ/mol; both ions in MgO have twice the charge of the ions in LiF; the bond length is very similar and both have the same structure; a quadrupling of the energy is expected based on the equation for lattice energy
Which compound in each of the following pairs has the larger lattice energy? Note: Mg2+ and Li+ have similar radii; O2– and F– have similar radii. Explain your choices.
- MgO or MgSe
- LiF or MgO
- (c) Li2O or LiCl
- Li2Se or MgO
Which compound in each of the following pairs has the larger lattice energy? Note: Ba2+ and
K+ have similar radii; S2– and Cl– have similar radii. Explain your choices.
- K2O or Na2O
- K2S or BaS
- (c) KCl or BaS
- BaS or BaCl2
Na2O; Na+ has a smaller radius than K+; BaS; Ba has a larger charge than K; (c) BaS; Ba and S have larger charges; BaS; S has a larger charge
Which of the following compounds requires the most energy to convert one mole of the solid into separate ions?
- MgO
- SrO
- (c) KF
- CsF
- MgF2
Which of the following compounds requires the most energy to convert one mole of the solid into separate ions?
- K2S
- K2O
- (c) CaS
- Cs2S
- CaO
(e)
The lattice energy of KF is 794 kJ/mol, and the interionic distance is 269 pm. The Na–F
distance in NaF, which has the same structure as KF, is 231 pm. Which of the following values is the closest approximation of the lattice energy of NaF: 682 kJ/mol, 794 kJ/mol, 924 kJ/mol, 1588 kJ/mol, or 3175 kJ/mol? Explain your answer.
7.7: Molecular Structure and Polarity
Explain why the HOH molecule is bent, whereas the HBeH molecule is linear.
The placement of the two sets of unpaired electrons in water forces the bonds to assume a tetrahedral arrangement, and the resulting HOH molecule is bent. The HBeH molecule (in which Be has only two electrons to bond with the two electrons from the hydrogens) must have the electron pairs as far from one another as possible and is therefore linear.
What feature of a Lewis structure can be used to tell if a molecule’s (or ion’s) electron-pair geometry and molecular structure will be identical?
Explain the difference between electron-pair geometry and molecular structure.
Space must be provided for each pair of electrons whether they are in a bond or are present as lone pairs. Electron-pair geometry considers the placement of all electrons. Molecular structure considers only the bonding-pair geometry.
Why is the H–N–H angle in NH3 smaller than the H–C–H bond angle in CH4? Why is the H–N–H angle in \(\ce{NH4+}\) identical to the H–C–H bond angle in CH4?
Explain how a molecule that contains polar bonds can be nonpolar.
As long as the polar bonds are compensated (for example. two identical atoms are found directly across the central atom from one another), the molecule can be nonpolar.
As a general rule, MXn molecules (where M represents a central atom and X represents terminal atoms; n = 2 – 5) are polar if there is one or more lone pairs of electrons on M. NH3 (M = N, X = H, n = 3) is an example. There are two molecular structures with lone pairs that are exceptions to this rule. What are they?
Predict the electron pair geometry and the molecular structure of each of the following molecules or ions:
- SF6
- PCl5
- (c) BeH2
- \(\ce{CH3+}\)
- Both the electron geometry and the molecular structure are octahedral.
- Both the electron geometry and the molecular structure are trigonal bipyramid.
- (c) Both the electron geometry and the molecular structure are linear.
- Both the electron geometry and the molecular structure are trigonal planar.
Identify the electron pair geometry and the molecular structure of each of the following molecules or ions:
- \(\ce{IF6+}\)
- CF4
- (c) BF3
- \(\ce{SiF5-}\)
- BeCl2
What are the electron-pair geometry and the molecular structure of each of the following molecules or ions?
- ClF5
- \(\ce{ClO2-}\)
- (c) \(\ce{TeCl4^2-}\)
- PCl3
- SeF4
- \(\ce{PH2-}\)
electron-pair geometry: octahedral, molecular structure: square pyramidal; electron-pair geometry: tetrahedral, molecular structure: bent; (c) electron-pair geometry: octahedral, molecular structure: square planar; electron-pair geometry: tetrahedral, molecular structure: trigonal pyramidal; electron-pair geometry: trigonal bypyramidal, molecular structure: seesaw; electron-pair geometry: tetrahedral, molecular structure: bent (109°)
Predict the electron pair geometry and the molecular structure of each of the following ions:
- H3O+
- \(\ce{PCl4-}\)
- (c) \(\ce{SnCl3-}\)
- \(\ce{BrCl4-}\)
- ICl3
- XeF4
- (g) SF2
Identify the electron pair geometry and the molecular structure of each of the following molecules:
- ClNO (N is the central atom)
- CS2
- (c) Cl2CO (C is the central atom)
- Cl2SO (S is the central atom)
- SO2F2 (S is the central atom)
- XeO2F2 (Xe is the central atom)
- (g) \(\ce{ClOF2+}\) (Cl is the central atom)
electron-pair geometry: trigonal planar, molecular structure: bent (120°); electron-pair geometry: linear, molecular structure: linear; (c) electron-pair geometry: trigonal planar, molecular structure: trigonal planar; electron-pair geometry: tetrahedral, molecular structure: trigonal pyramidal; electron-pair geometry: tetrahedral, molecular structure: tetrahedral; electron-pair geometry: trigonal bipyramidal, molecular structure: seesaw; (g) electron-pair geometry: tetrahedral, molecular structure: trigonal pyramidal
Predict the electron pair geometry and the molecular structure of each of the following:
- IOF5 (I is the central atom)
- POCl3 (P is the central atom)
- (c) Cl2SeO (Se is the central atom)
- ClSO+ (S is the central atom)
- F2SO (S is the central atom)
- \(\ce{NO2-}\)
- (g) \(\ce{SiO4^4-}\)
Which of the following molecules and ions contain polar bonds? Which of these molecules and ions have dipole moments?
- ClF5
- \(\ce{ClO2-}\)
- (c) \(\ce{TeCl4^2-}\)
- PCl3
- SeF4
- \(\ce{PH2-}\)
- (g) XeF2
All of these molecules and ions contain polar bonds. Only ClF5, \(\ce{ClO2-}\), PCl3, SeF4, and \(\ce{PH2-}\) have dipole moments.
Which of the molecules and ions in Exercise contain polar bonds? Which of these molecules and ions have dipole moments?
- H3O+
- \(\ce{PCl4-}\)
- (c) \(\ce{SnCl3-}\)
- \(\ce{BrCl4-}\)
- ICl3
- XeF4
- (g) SF2
Which of the following molecules have dipole moments?
- CS2
- SeS2
- (c) CCl2F2
- PCl3 (P is the central atom)
- ClNO (N is the central atom)
SeS2, CCl2F2, PCl3, and ClNO all have dipole moments.
Identify the molecules with a dipole moment:
- SF4
- CF4
- (c) Cl2CCBr2
- CH3Cl
- H2CO
The molecule XF3 has a dipole moment. Is X boron or phosphorus?
P
The molecule XCl2 has a dipole moment. Is X beryllium or sulfur?
Is the Cl2BBCl2 molecule polar or nonpolar?
nonpolar
There are three possible structures for PCl2F3 with phosphorus as the central atom. Draw them and discuss how measurements of dipole moments could help distinguish among them.
Describe the molecular structure around the indicated atom or atoms:
- the sulfur atom in sulfuric acid, H2SO4 [(HO)2SO2]
- the chlorine atom in chloric acid, HClO3 [HOClO2]
- (c) the oxygen atom in hydrogen peroxide, HOOH
- the nitrogen atom in nitric acid, HNO3 [HONO2]
- the oxygen atom in the OH group in nitric acid, HNO3 [HONO2]
- the central oxygen atom in the ozone molecule, O3
- (g) each of the carbon atoms in propyne, CH3CCH
- (h) the carbon atom in Freon, CCl2F2
- (i) each of the carbon atoms in allene, H2CCCH2
tetrahedral; trigonal pyramidal; (c) bent (109°); trigonal planar; bent (109°); bent (109°); (g) CH3CCH tetrahedral, CH3CCH linear; (h) tetrahedral; (i) H2CCCH2 linear; H2CCCH2 trigonal planar
Draw the Lewis structures and predict the shape of each compound or ion:
- CO2
- \(\ce{NO2-}\)
- (c) SO3
- \(\ce{SO3^2-}\)
A molecule with the formula AB2, in which A and B represent different atoms, could have one of three different shapes. Sketch and name the three different shapes that this molecule might have. Give an example of a molecule or ion for each shape.

Une molécule de formule AB 3, dans laquelle A et B représentent des atomes différents, peut avoir l'une des trois formes différentes. Esquissez et nommez les trois formes différentes que cette molécule pourrait avoir. Donnez un exemple de molécule ou d'ion ayant chacune des formes.
Dessinez les structures de points électroniques de Lewis pour ces molécules, y compris les structures de résonance, le cas échéant :
- \(\ce{CS3^2-}\)
- CS 2
- (c) CS
prédisez les formes moléculaires pour\(\ce{CS3^2-}\) et CS 2 et expliquez comment vous en êtes arrivé à vos prédictions
(a)
 ;
;
(b)
 ;
;
(c)
 ;
;
\(\ce{CS3^2-}\) includes three regions of electron density (all are bonds with no lone pairs); the shape is trigonal planar; CS2 has only two regions of electron density (all bonds with no lone pairs); the shape is linear
What is the molecular structure of the stable form of FNO2? (N is the central atom.)
A compound with a molar mass of about 42 g/mol contains 85.7% carbon and 14.3% hydrogen. What is its molecular structure?
The Lewis structure is made from three units, but the atoms must be rearranged:

Utilisez la simulation pour effectuer les exercices suivants pour une molécule à deux atomes :
- Ajustez la valeur d'électronégativité de sorte que le dipôle de liaison pointe vers B. Déterminez ensuite quelles doivent être les valeurs d'électronégativité pour faire basculer le dipôle de sorte qu'il pointe vers A.
- Avec une charge positive partielle sur A, allumez le champ électrique et décrivez ce qui se passe.
- (c) Avec une faible charge partiellement négative sur A, allumez le champ électrique et décrivez ce qui se passe.
- Réinitialisez tout, puis avec une charge négative partielle importante sur A, allumez le champ électrique et décrivez ce qui se passe.
Utilisez la simulation pour effectuer les exercices suivants pour une molécule réelle. Il se peut que vous deviez faire pivoter les molécules en trois dimensions pour voir certains dipôles.
- Esquissez les dipôles de liaison et le dipôle moléculaire (le cas échéant) pour O 3. Expliquez vos observations.
- Regardez les dipôles de liaison pour le NH 3. Utilisez ces dipôles pour prédire si N ou H est plus électronégatif.
- (c) Prédire s'il doit y avoir un dipôle moléculaire pour le NH 3 et, dans l'affirmative, dans quelle direction il pointera. Cochez la case du dipôle moléculaire pour vérifier votre hypothèse.
Le dipôle moléculaire pointe à l'opposé des atomes d'hydrogène.
Utilisez le simulateur Molecule Shape pour créer une molécule. En commençant par l'atome central, cliquez sur la double liaison pour ajouter une double liaison. Ajoutez ensuite une liaison simple et une paire isolée. Faites pivoter la molécule pour observer la géométrie complète. Nommez la géométrie et la structure moléculaire du groupe d'électrons et prédisez l'angle de liaison. Cliquez ensuite sur les cases à cocher en bas et à droite du simulateur pour vérifier vos réponses.
Utilisez le simulateur Molecule Shape pour explorer de vraies molécules. Dans l'onglet Molécules réelles, sélectionnez H 2 O. Basculez entre les modes « réel » et « modèle ». Expliquez la différence observée.
Les structures sont très similaires. En mode modèle, chaque groupe d'électrons occupe la même quantité d'espace, de sorte que l'angle de liaison est indiqué comme 109,5°. En mode « réel », les paires isolées sont plus grandes, ce qui entraîne la compression des hydrogènes. Cela conduit à un angle plus petit de 104,5°.
Utilisez le simulateur Molecule Shape pour explorer de vraies molécules. Dans l'onglet Real Molecules, sélectionnez le mode « modèle » et S 2 O. Quel est l'angle de liaison du modèle ? Expliquez si l'angle de liaison « réel » doit être plus grand ou plus petit que l'angle idéal du modèle.


